INTRODUCCIÓN
Colombia presenta una alta diversidad biológica, amenazada por la intensa presión antrópica, ocasionada por la deforestación, la fragmentación y los cambios en el uso de la tierra, causados, principalmente, por actividades ganaderas y agrícolas (Murcia et al. 2013; Chazdon, 2014), alterando la funcionalidad de los bosques primarios y provocando cambios en la estructura, la composición y la función de las comunidades animales y vegetales (Arriaga-Weiss et al. 2008; Chazdon, 2014).
Las áreas que se recuperan de la perturbación, donde se ha practicado principalmente la agricultura de subsistencia de roza y quema, y zonas de pastura para la ganadería, generan un aumento de los bosques secundarios (Guariguata & Ostertag, 2001; Shahabuddin & Kumar, 2006), provocando cambios en la cantidad y la calidad del hábitat, disponible para las aves (Arriaga-Weiss et al. 2008) y en la composición taxonómica y funcional dentro de sus ensamblajes (e.g. Gray et al. 2007; Bregman et al. 2014). Estas dinámicas juegan un papel importante en la fluctuación de la diversidad de especies, ya que diferentes organismos utilizan bosques en diferentes etapas sucesionales, como hábitat (Chazdon, 2014; Letcher et al. 2015; Norden et al. 2015) y estos bosques perturbados, gradualmente, aumentan la riqueza y la composición de especies, con el avance de la sucesión (Guariguata & Ostertag, 2001; Chazdon, 2014).
El tiempo de regeneración secundaria del bosque, de edades tempranas a maduras, puede influir en la organización de grupos taxonómicos y funcionales del ensamblaje de aves, debido a cambios en la estructura y la composición de la vegetación (Arriaga-Weiss et al. 2008; Bregman et al. 2014; Santamaría-Rivero et al. 2016), lo que puede, por ejemplo, afectar la disponibilidad de recursos alimenticios, como flores y frutos. A pesar del conocimiento de que especies y grupos funcionales de aves responden de manera distinta a cambios en el área, la estructura de la vegetación y la matriz circundante, poco se conoce sobre los cambios en la composición y la estructura taxonómica y funcional de sus ensamblajes con relación a la estructura de la vegetación, en diferentes estadios sucesionales (Leyequién et al. 2014; Casas et al. 2016; Santamaría-Rivero et al. 2016).
Este estudio tiene por objetivo relacionar la diversidad taxonómica y funcional de los ensamblajes de aves con la estructura de la vegetación en cuatro estadios sucesionales en un área de bosque en regeneración natural. Dado que la diversidad taxonómica suele presentar sus valores máximos cuando las perturbaciones ocurren a frecuencias e intensidades medias, de acuerdo a la hipótesis de las perturbaciones intermedias (Connell, 1978) y a que aspectos, como la proporción de gremios tróficos en las aves, se suelen ver influenciados por la edad y la estructura de la vegetación, se plantean las siguientes hipótesis: (i) la diversidad taxonómica de aves será mayor en estadios intermedios y no responderá positivamente al incremento de la estructura de la vegetación en estadios de mayor regeneración natural, (ii) la diversidad funcional presentará mayor cantidad de especies con preferencia de hábitat de interior de bosque y de gremios nectarívos y frugívoros en estadios más avanzados de sucesión.
MATERIALES Y MÉTODOS
Localización y descripción del área de estudio. La Reserva Natural Hacienda San Pedro tiene carácter privado, con una extensión total de 300 ha y predominio de áreas con bosque secundario en regeneración natural. Se encuentra ubicada en la cuenca media del río Magdalena, junto al río Nus (6° 27’35,0’’ N y 74° 47’15,0’’ W), en el Municipio Maceo, Departamento de Antioquia, Colombia. Tiene una temperatura media de 23,8°C, una humedad relativa del 87% y una precipitación media anual de 2.757mm, para la estación meteorológica Caracolí (2308053 - Red Hidrometeorológica de Empresas Públicas de Medellín -EE.PP.M-). Se encuentra en zona de Bosque Húmedo Premontano (bh-P) y Bosque Húmedo Tropical (bh-T), en un rango altitudinal de 800 a 1.100m s.n.m.
Se definieron cuatro estadios sucesionales de crecimiento del bosque secundario: SS1: sucesión en edad de 0-5 años, con área de 30ha, presencia de pastos, escasa vegetación arbórea y donde predominó la actividad ganadera; SS2: sucesión en edad de 10-13 años con vegetación arbórea, con área de 50ha, con presencia de helechos y dominio de especies heliófilas de rápido crecimiento, con suelo anteriormente usado en actividades agrícolas; SS3: sucesión con edad de 18-20 años, con área de 40ha, con algunos árboles de altura mayor a 30m y un dosel más cubierto, con presencia de epífitas y especies tolerantes a la sombra y con suelo antes usado en actividades ganaderas; SS4: sucesión avanzada con edad mayor a 50 años, con área de 180ha, con grandes árboles y dosel cubierto, con pocos claros y presencia de epifitas y bromelias y con presencia de bosque anteriormente sometido a tala selectiva.
Caracterización de la vegetación. Se establecieron 2 parcelas de 20x50m, en cada sucesión de bosque. Cada parcela, se dividió en 10 subparcelas de 10 x 10m, de las cuales, se seleccionaron al azar dos, para la toma de datos de composición de especies arbóreas que se realizó in situ, con la guía de Gentry (1993). En los ocho cuadrantes de 10x10 seleccionados, se midió el diámetro a la altura del pecho (DAP), con una cinta diamétrica y la altura a todos los árboles, con DAP >10cm, con clinómetro a partir de una distancia conocida. Se determinaron las variables estructurales: altura promedio en metros (Alt), altura máxima en metros (Alt máx), área basal en m2 (G), número árboles por hectárea (N árboles/ha), número de especies (N spp.) y número de especies por m2 (N spp/m2).
Muestreo de aves. Se realizaron cinco muestreos entre junio de 2016 y febrero de 2017. Se establecieron por estadio, cuatro puntos de conteo de radio fijo de 15 m, separados 200 m uno de otro, en los que, durante cuatro días consecutivos para cada muestreo, se tomaron cuatro veces al día, por 20 minutos, los registros visuales de las especies observadas y sus abundancias, con el uso de binoculares, entre las 6:00 a 10:00 horas y entre las 14:00 a 18:00 horas, para un esfuerzo de muestreo total de 21,3 horas/estadio/muestreo. Se identificaron las especies de aves en campo, con las guías de Hilty & Brown (1986) y Restall et al. (2007), y la lista de especies se ordenó taxonómicamente, de acuerdo con Remsen et al. (2018). Se catalogaron en siete gremios tróficos: frugívoro (FR), insectívoro (IN), granívoro (GR), nectarívoro (NE), omnívoro (OM), carnívoro (CA), carroñeras (CR), siguiendo la información presentada en las fichas de especies, por Hilty & Brown (1986) y Restall et al. (2007).
La preferencia de hábitat para cada especie fue determinada con las observaciones realizadas dentro de cuatro categorías en especies (1), de áreas abiertas; (2), de bordes; (3), de interior de bosque y (4), acuáticas. La especificidad de hábitat, se evaluó de acuerdo con Martínez-Bravo et al. (2013), teniendo en cuenta el grado de dependencia con respecto a su hábitat: alta, para especies restringidas a un solo tipo de hábitat; media, para especies detectadas en al menos dos tipos de hábitat y baja, para especies detectadas en todos los tipos de hábitat. Las especies endémicas, se establecieron de acuerdo con Chaparro-Herrera et al. (2013) y las categorías de residencia, según Naranjo et al. (2012).
Análisis de datos. Se evaluó la riqueza de especies, a través del estimador Chao1, se calcularon los índices de diversidad Shannon-Weaver, dominancia de Simpson (1-D) y equidad de Pielou y sus valores fueron comparados mediante pruebas de t de Hutchinson. La similitud entre grupos taxonómicos y entre gremios tróficos, se estimó mediante el índice de similitud de Bray Curtis y se graficó un dendrograma, con el algoritmo de aglomeración de grupos pareados o ligamiento promedio por la media aritmética (UPGMA). Para determinar diferencias en la abundancia de órdenes taxonómicos y los gremios tróficos, se compararon los valores medios del porcentaje de abundancia relativa en cada uno de los estadios, mediante análisis de varianza unidireccionales (ANOVA), validando que los datos cumplieran con los supuestos de normalidad (prueba de Shapiro-Wilk) y homocedasticidad (prueba de Levene) y comparaciones (post hoc), que fueron evaluadas mediante la prueba de Tukey. Cuando los datos no cumplieron con estos supuestos, se utilizó la prueba no paramétrica de Kruskall-Wallis y las comparaciones pareadas con la prueba Mann-Whitney, utilizando el programa estadístico PAST (Hammer et al. 2001).
Para resumir las variables que caracterizan la estructura de vegetación en cada estadio, se realizó un análisis de componentes principales (ACP). Para evaluar la respuesta de las especies de aves y gremios tróficos a los cambios en los parámetros estructurales de la vegetación, se efectuó un análisis de correspondencia canónica (ACC) sobre los datos de abundancia de las especies que presentaron una frecuencia mayor al 5% y una abundancia superior a 1% (Gauch, 1982), con 1000 permutaciones. Estos análisis, se ejecutaron con el programa R Studio 2.15.2. (RStudio, 2015).
RESULTADOS Y DISCUSIÓN
Caracterización de la vegetación. El estadio sucesional SS1 presentó el menor número de especies vegetales, las cuales, corresponden principalmente a las familias Fabaceae y Annonaceae, la menor área basal y el menor número de árboles por hectárea (Tabla 1). El estadio SS2 presentó valores bajos en el número de especies, destacando las familias Melastomatacea y Annonaceae, un bajo valor de área basal, pero un alto número de árboles por hectárea. Los estadios SS3 y SS4 mostraron valores mayores de número de especies, altura media y altura máxima (Tabla 1). El estadio SS3 presentó especies principalmente de las familias Hypericaceae y Melastomatacea y el SS4 predominio de las familias Rubiaceae, Euphorbiaceae y Arecaceae, y mayor área basal (Tabla 1)
Tabla 1 Valores de las variables estructurales de vegetación e Índices de diversidad de aves observadas para los cuatro estadios de sucesión secundaria, en la Reserva Natural Hacienda San Pedro, Departamento de Antioquia, Colombia.
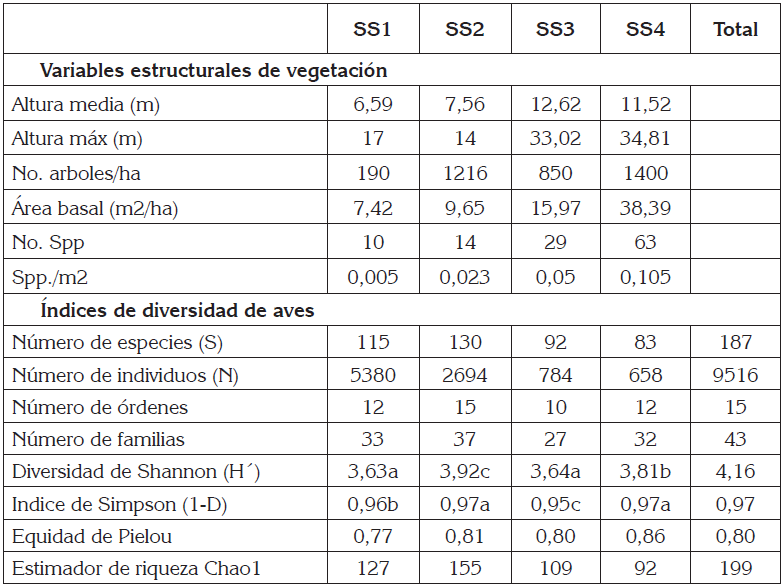
SS1: Sucesión secundaria edad 0-5 años. SS2: Sucesión secundaria con edad entre 10-13 años. SS3: Sucesión secundaria edad 18-20 años. SS4 Sucesión secundaria mayor 50 años. Letras diferentes en la misma fila indican diferencias significativas (p<0,05).
Diversidad taxonómica de aves. Se registraron 9.516 individuos de 187 especies, pertenecientes a 42 familias y 15 órdenes. Las familias con mayor número de especies fueron Thraupidae (n=30) y Tyrannidae (n=28). Se determinó que 155 especies fueron residentes y 32 migratorias. Los estadios SS2 y SS1 presentaron el mayor número de especies con 130 y 115, respectivamente (Tabla 1). Las 187 especies registradas representan un 94% del valor del estimador de Chao 1 (Tabla 1). Igualmente, se estableció la presencia de tres especies endémicas Ortalis columbiana, Habia gutturalis y Capito hypoleucus; seis especies categorizadas en riesgo de extinción en las listas rojas de la UICN; Odontophorus gujanensis, Habia gutturalis y Tinamus major, en categoría Casi Amenazada (NT); Ramphastos vitellinus y Patagioenas subvinacea, en categoría Vulnerable (Vu) y la especie Capito hypoleucus, en categoría En Peligro (EN).
El número de individuos fue mayor para SS1, donde se registraron 5.380 (56,5%), seguido del estadio SS2, con 2.694 individuos (28,3%); SS3, con 784 (8,2%) y SS4, 658 (6,9%). El índice de Shannon-Weaver mostró valores mayores en los estadios SS2 y SS4, entre los que se encontraron diferencias (p< 0,05) (Tabla 1). La dominancia reveló valores bajos para los cuatro estadios sucesionales (rango: 0,032 - 0,054); para el índice de Simpson, se encontraron diferencias entre los estadios (p<0,05), a excepción de SS2 y SS4, que presentaron el mayor valor (0,97) y el índice de equidad de Pielou osciló entre 0,86 (SS4) y 0,77 (SS1) (Tabla 1).
El estadio SS2 presentó el mayor número de órdenes (15), de familias (37), de riqueza de especies (130) y del índice de diversidad de Shannon (3,92) (Tabla 1), lo cual, puede ser explicado mediante la “hipótesis de las perturbaciones intermedias” de Connell (1978), quien propone que muy poca perturbación conduce a una baja diversidad, a través de la exclusión competitiva y demasiadas perturbaciones eliminan las especies incapaces de una recolonización rápida (Wilkinson, 1999). Igualmente, la mayor riqueza y abundancia de aves en los estadios SS1 y SS2 puede estar asociada a una mayor detectabilidad de las aves, considerando la relativa homogeneidad de su fisionomía con menores valores de las variables estructurales de vegetación, a diferencia de los estadios en sucesión más avanzada en los que la densidad arbórea y la heterogeneidad de la estructura de la vegetación dificulta la detección de las aves. La menor diversidad de especies y de abundancia en los estadios SS3 y SS4 puede estar asociada a que el bosque maduro es un área pequeña en tamaño, rodeada de un paisaje altamente deforestado y con poca conectividad. Este patrón en la riqueza de especies es contrario a lo reportado por Casas et al. (2016) y Santamaría-Rivero et al. (2016), quienes encontraron que los bosques secundarios más antiguos soportan mayor riqueza de especies. Esto, se puede deber a que las zonas evaluadas por estos autores corresponden a áreas de estudio de mayor extensión y los sitios de muestreo se ubicaron dentro de un mosaico de bosques sucesionales con mayor conectividad y cerca de grandes áreas de bosques conservados. Asimismo, Leyequién et al. (2014) no encontraron diferencias en la riqueza de especies y la diversidad de gremios tróficos de aves, lo que atribuyen al bajo nivel de deforestación y de fragmentación del sitio estudiado por ellos.
De acuerdo con el índice de similitud Bray-Curtis, la composición taxonómica por órdenes entre los estadios sucesionales mostró dos agrupaciones. La primera, conformada por las sucesiones SS1 y SS2, con una similitud del 51,7% y, la segunda, por las sucesiones SS3 y SS4, con 58,6%. La similitud entre las dos agrupaciones fue del 10,0% (Figura 1A). El orden Passeriformes presentó la mayor abundancia en los cuatro estadios sin diferencias entre ellos (Tabla 2), siendo Thraupis episcopus y Stelgidopteryx ruficollis las especies más abundantes en los estadios iniciales y Manacus manacus, en los más avanzados. Pelecaniformes y Accipitriformes mostraron mayor abundancia en SS1 y SS2, con diferencias de los estadios SS3 y SS4 (Tukey, P< 0,001 y P< 0,001, respectivamente) (Tabla 2); el orden Cuculiformes fue más abundante en el estadio SS1, diferente del estadio SS4 (Tukey P=0,03); el orden Columbiformes fue más abundante en el estadio SS1 (Tukey, P=0,009) y el orden Gruiformes solo se observó en el estadio SS2 (Tabla 2).
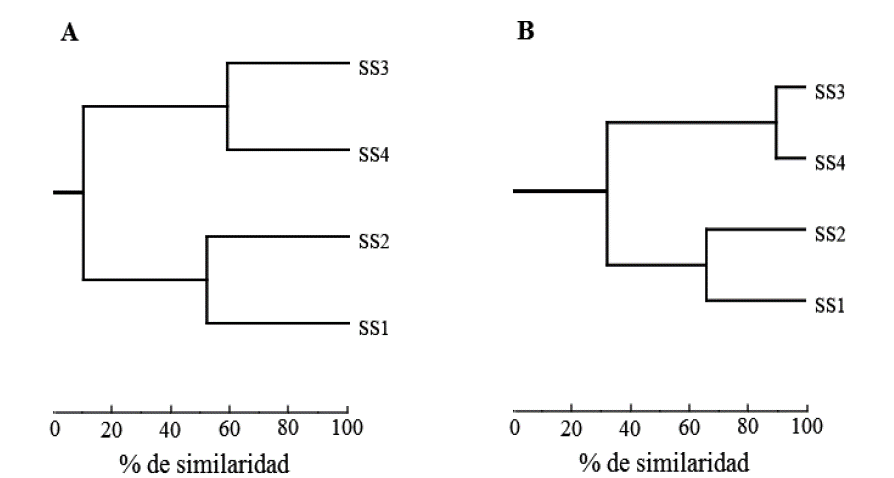
Figura 1 Dendrograma de similitud, de acuerdo con los valores de Bray Curtis, para grupos taxonómicos (A) y gremios tróficos (B), entre los cuatro estadios de sucesión secundaria, en la Reserva Natural Hacienda San Pedro, Antioquia, Colombia. Sucesión en edad 0-5 años (SS1), Sucesión en edad 10-13 años (SS2), Sucesión en edad 18-20 años (SS3), Sucesión mayor a 50 años (SS4).
Tabla 2 Valores medios (+/-DE) del porcentaje de abundancia de órdenes, especificidad y preferencia de hábitat para aves observadas en los cuatro estadios sucesionales, en la Reserva Natural Hacienda San Pedro, Departamento de Antioquia, Colombia.
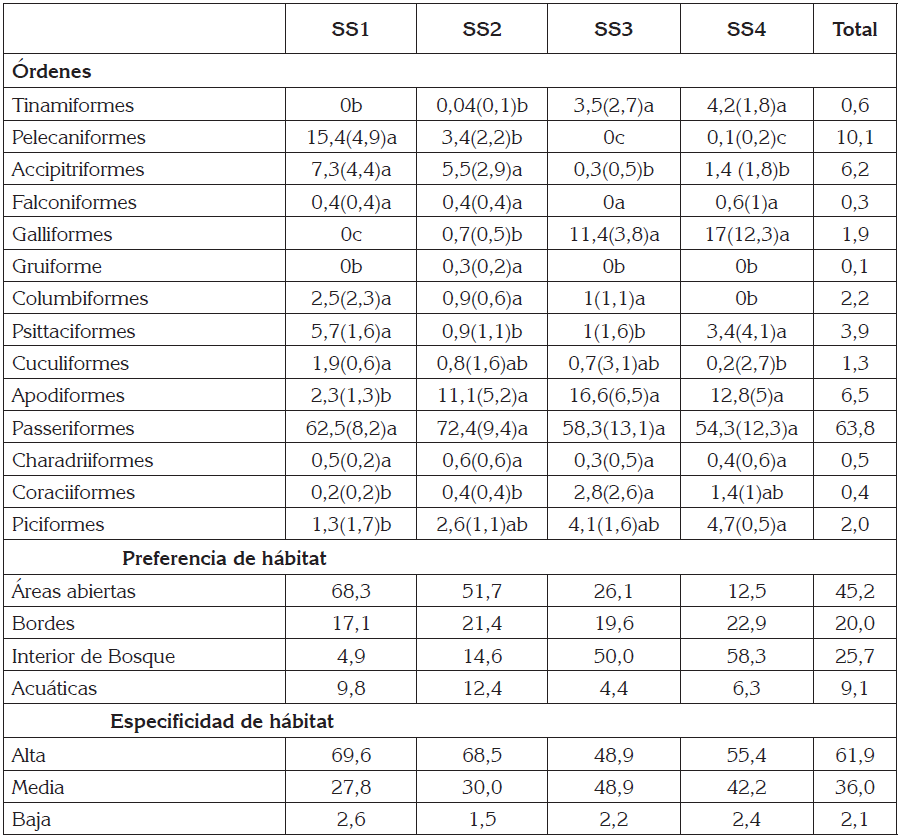
SS1: Sucesión secundaria edad 0-5 años. SS2: Sucesión secundaria con edad entre 10-13 años. SS3: Sucesión secundaria edad 18-20 años. SS4 Sucesión secundaria mayor 50 años. Desviación estándar (DE). Letras diferentes en la misma fila indican diferencias significativas (p<0,05).
La mayoría de las especies registradas en el estudio fueron de áreas abiertas y representaron el 45,3% del total; las de interior de bosque constituyeron el 25,7%; las de áreas de borde, el 20,0% y las de hábitats acuáticos, el 9,1%. En los estadios SS1 y SS2 predominaron las especies de áreas abiertas (68,3% y 51,7%, respectivamente), mientras que en los estadios SS3 y SS4 predominaron las especies de interior de bosque (50,0% y 58,3%, respectivamente). De estas especies, la mayoría fueron de especificidad alta y representaron el 61,9% del total; las de especificidad media fueron el 36,0% y las de especificidad baja, el 2,1% (Tabla 2).
Los órdenes Pelecaniformes (e.g. Bubulcus ibis), Accipitriformes (e.g. Coragyps atratus) que presentaron mayor abundancia en los estadios SS1 y SS2 están asociados a hábitat intervenidos y fueron de hábitos generalistas y de amplia distribución, principalmente, con especies de preferencias de hábitats abiertos y de borde y con alta especificidad, que utilizan las zonas de potreros para forrajeo. Los órdenes Cuculiformes y Columbiformes presentaron mayor abundancia en el estadio SS1, lo que se puede deber a que especies, como Crotophaga ani o Columbina talpacoti, se asocian con plantaciones agrícolas. Esto coincide con lo encontrado por Martínez-Bravo et al. (2013), quienes mencionan que en zonas de pastoreo se presentó una dominancia de especies adaptadas a áreas abiertas, que aprovechan la abundancia de invertebrados y pequeños vertebrados, disponibles al momento del corte de los pastos.
De otra parte, los órdenes Galliformes (e.g. Ortalis columbiana) y Tinamiformes (e.g. Tinamus major) presentaron mayor abundancia en los estadios SS3 y SS4, con diferencias del estadio SS2 (Mann-Whitney, P=0,015 y P=0,002, respectivamente) y el orden Apodiformes mostró mayor abundancia en los estadios SS3, SS4 y SS2, con diferencias del estadio SS1 (Mann-Whitney P=0,035) (Tabla 2). El orden Piciformes presentó mayor abundancia en el estadio SS4, con diferencias del estadio SS1 (Mann-Whitney P=0,012); el orden Coraciiformes registró mayor abundancia en SS3, con diferencia de los estadios SS1 y SS2 (Mann-Whitney P= 0,021 y P= 0,036, respectivamente) y el orden Psittaciformes presentó mayor abundancia en los estadios SS1 y SS4, con diferencia de los estadios SS2 y SS3 (Mann-Whitney P= 0,027 y P= 0,029, respectivamente) (Tabla 2).
En los estadios SS3 y SS4, los órdenes de aves encontradas se relacionan con mayores valores de las variables estructurales de vegetación, como el área basal, la altura máxima y el número de árboles por hectárea. Estas características regulan la temperatura del interior del bosque, la cantidad de luz y facilitan el aumento de la humedad, lo que ayuda a la descomposición de la hojarasca que, a su vez, determina el incremento de nichos ecológicos, que benefician a aves sensibles a la degradación ecológica (Eisermann, 2006; Shahabuddin & Kumar, 2006; Arriaga-Weiss et al. 2008; Gray et al. 2007; Renjifo et al. 2014). Allí, se encontraron especies, cuya preferencia de hábitat es principalmente de interior de bosque y, en menor medida, de bordes, con una alta especificidad de hábitat. Esto es similar a lo descrito por Casas et al. (2016), quienes encontraron que bosques intermedios y avanzados en sucesión tenían hábitats más heterogéneos y algunas especies y gremios se encontraron solo en estas etapas. Por su parte, Santamaría-Rivero et al. (2016) determinaron que la composición de las especies de aves y de gremios tróficos difería entre las etapas iniciales y avanzadas durante la temporada reproductiva y Leyequién et al. (2014) encontraron diferencias significativas en la riqueza de especies de insectívoros de corteza entre las clases de bosque, lo que sugiere que la diversidad de especialistas en hábitat aumenta con la sucesión y los cambios asociados en la estructura forestal.
En estos estadios más avanzados SS3 y SS4, los órdenes Galliformes y Tinamiformes (e.g. Ortalis columbiana, Tinamus major) presentaron mayor abundancia. Estas aves usan troncos de árboles caídos para forrajear, refugiarse, anidar entre las raíces de los árboles y están restringidas a ambientes mejor conservados, donde existe mayor heterogeneidad de microhábitats (Eisermann, 2006). Estas especies juegan un rol importante en el mantenimiento de bosques tropicales, al dispersar semillas de gran tamaño y habitar bosques maduros (Sedaghatkish, 1996). Por su parte, el orden Apodiformes y, en particular, la familia Trochilidae (e.g. Glaucis hirsutus, Phaethornis striigularis), se relaciona con hábitats de interior de bosque, ya que dependen de especies vegetales con flores, que contienen abundante polen y néctar. Leyequién et al. (2010) relacionan positivamente a especies de esta familia, con áreas de sucesiones medias y avanzadas.
Diversidad funcional de aves. Los estadios SS1 y SS2 presentaron una similitud de gremios tróficos del 66,3% y las sucesiones SS3 y SS4 una similitud del 90,2%; la similitud entre las dos agrupaciones fue de 32,0% (Figura 1B). Los gremios tróficos más representativos en abundancia fueron insectívoros (IN), con 36,1% y frugívoros (FR), con 34,4% (Tabla 3). Los gremios omnívoros (OM), carroñeros (CR) y granívoros (GR) registraron mayores abundancias en los estadios SS1 y SS2 y diferencia en relación a los estadios SS3 y SS4 (Tukey, P=0,001; P= 0,002 y P= 0,0008, respectivamente), mientras que el gremio frugívoros (FR) presentó una abundancia mayor en el estadio SS4 y fue diferente al estadio SS1 (Tukey, P= 0,002) y el gremio Nectarívoros (NE), que mostró la mayor abundancia en los estadios SS3 y SS4, con diferencias significativas a las encontradas en los estadios SS1 (Tukey, P= 0,001; P= 0,004) y SS2 (Tukey, P= 0,0003 y P= 0,005) (Tabla 3).
Tabla 3 Valores medios (+/-DE) de los porcentajes de abundancia de gremios tróficos, para aves observadas en los cuatro estadios sucesionales, en la Reserva Natural Hacienda San Pedro, Departamento de Antioquia, Colombia.
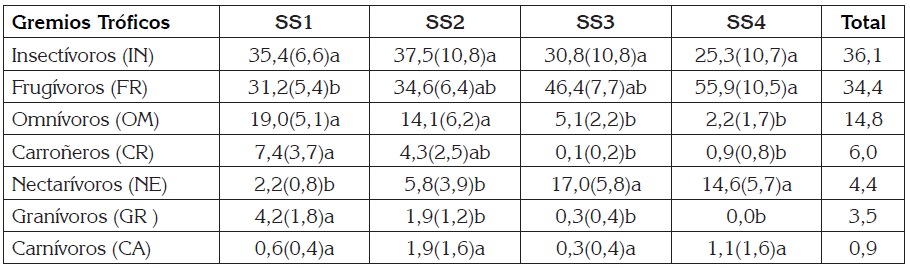
SS1: Sucesión secundaria edad 0-5 años. SS2: Sucesión secundaria con edad entre 10-13 años. SS3:Sucesión secundaria edad 18-20 años. SS4 Sucesión secundaria mayor 50 años. Desviación estándar (DE). Letras diferentes en la misma fila indican diferencias significativas (p<0,05).
Las aves de los gremios OM y CR, se asociaron a zonas de disturbio antrópico en el estadio SS1, con usos de suelos en ganadería y en agricultura, donde encuentran una buena oferta de alimento, por lo que se ven beneficiadas por la fragmentación del ecosistema (Gray et al. 2007; Mastrangelo & Gavin, 2012). Por su parte, las aves del gremio GR también han sido relacionadas con áreas abiertas y zonas de cultivos, de donde obtienen con mayor facilidad su alimento (Wenny et al. 2011). El gremio carnívoros CA no presentó diferencias significativas entre estadios, pero fue más abundante en la sucesión SS2 y es poco frecuente en etapas de sucesión SS1 y SS3, lo que se puede deber a que estas aves permanecen sobrevolando los sitios de borde cazando especies de interior del bosque, como lo han reportado Marquez et al. (2005).
El gremio frugívoro (FR) presentó un aumento en su abundancia con la edad de sucesión del bosque, incluyendo especies, como Ramphastos swainsonii, Ortalis columbiana, Odontophorus gujanensis, y Tinamus major, que están en alguna categoría de amenaza o son especies endémicas. Son especialistas de interior de bosque y se asocian con una mayor heterogeneidad y mejor calidad ecológica de sus hábitats. Estas especies cumplen un papel como dispersores de semillas, fundamental para el establecimiento de especies vegetales, pioneras de la sucesión del bosque (Shahabuddin & Kumar, 2006; Ribeiro & Melo, 2012). Por lo anterior, la pérdida y la fragmentación de bosques las hace más propensas a extinciones locales por cambios en la estructura y la composición del hábitat (Eisermann, 2006; Renjifo et al. 2014). Esto es similar a lo reportado por Casas et al. (2016) y Santamaría-Rivero et al. (2016), quienes encontraron que este gremio presentó mayor diversidad en bosques en estadios medios y avanzados y con una mayor complejidad estructural de la vegetación.
Igualmente, aunque el gremio insectívoros IN no presentó diferencias entre estadios, algunas especies de este gremio se asocian al interior de bosque, en los estadios SS3 y SS4 (e.g. Habia gutturalis, Henicorhina leucosticta); estas aves son amenazadas y consideradas sensibles a la pérdida y fragmentación de los ecosistemas (Sekercioglu et al. 2002; Renjifo et al. 2014) y son más vulnerables a los cambios en la estructura y la composición del hábitat (Bregman et al. 2014; Casas et al. 2016; Santamaría-Rivero et al. 2016) e, incluso, con el tiempo podrían desaparecer localmente por su baja abundancia y por ser de rango restringido y especialistas de bosques (Sekercioglu et al. 2002; Shahabuddin & Kumar, 2006; Leyequién et al. 2014). Por último, el gremio nectarívoros NE tuvo mayor abundancia en estadios de sucesión SS3 y SS4, donde disminuye la disponibilidad de luz, el viento, la lluvia y las fluctuaciones de temperatura, beneficiando a estas especies, que buscan néctar y polen con alto contenido energético, ya que son especies con tazas metabólicas muy altas (Tobalske et al. 2004).
El ACP permitió separar las variables que caracterizan la estructura de vegetación en tres grupos: el primero, conformado por el área basal en m2 (G), el número de especies (N spp.) y el número de especies por m2 (N spp/m2); el segundo, por la altura máxima (Alt máx) y la altura promedio en metros (Alt) y, el tercero, por el número de árboles por hectárea (N árboles/ha). Con base en esto, se seleccionaron las variables: G, Alt máx y N árboles/ha, como las de mayor peso en cada grupo. El ACC mostró una relación significativa (p= 0,002) entre la composición de las especies de aves y las variables estructurales de vegetación. El primer eje del diagrama de dispersión del ACC explicó un 84,3% de la segregación entre las especies de aves de interior de bosque (e.g. Phaethornis anthophilus, Phaethornis striigularis, Henicorhina leucosticta, Manacus manacus, Machaeropterus regulus), con las áreas con mayor complejidad estructural, con árboles de mayor altura, mayor área basal y mayor número de árboles por hectárea y asociada a los estadios de sucesión SS3 y SS4 (Figura 2). Por su parte, el lado izquierdo del diagrama de dispersión del ACC mostró la segregación entre las especies más generalistas (e.g. Thraupis episcopus, Milvago chimachima, Pitangus sulphuratus), que estuvieron más relacionadas a áreas con menores valores de las variables estructurales de la vegetación y asociadas a los estadios de sucesión SS1 y SS2 (Figura 2).
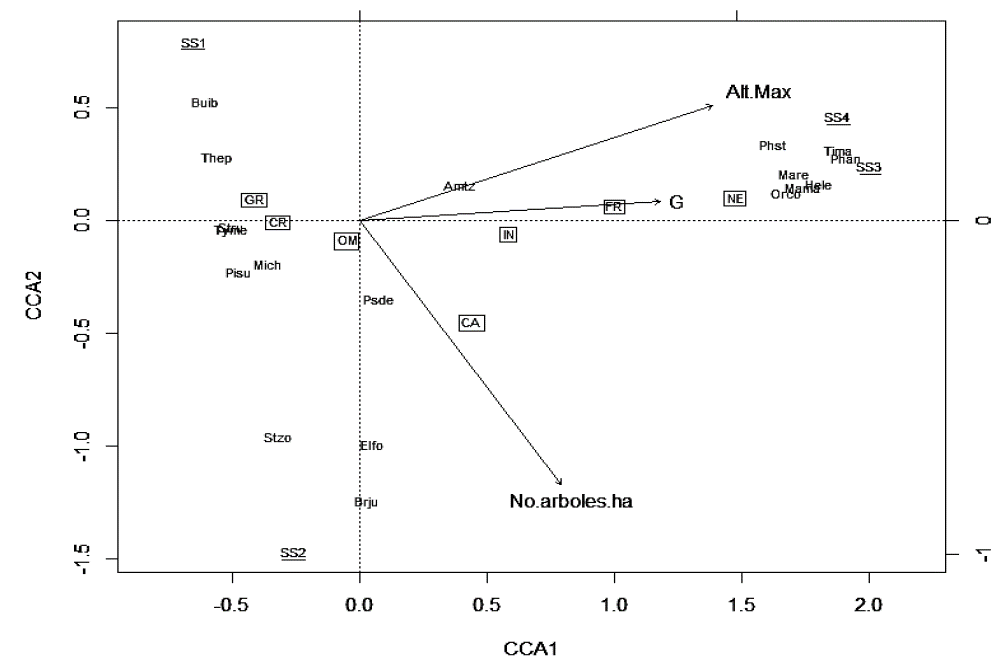
Figura 2 Diagrama de ordenación del análisis de correspondencia canónica (ACC) que relaciona las especies de aves, los gremios tróficos (cajas) y las variables estructurales de hábitat (flechas), con los cuatro estadios sucesionales (subrayado), en la Reserva Natural Hacienda San Pedro, Antioquia, Colombia. Especies: Thraupis episcopus (Thep); Bubulcus ibis (Buib), Stelgidopteryx ruficollis (Stru), Brotogeris jugularis (Brju), Tyrannus melancholicus (Tyme), Ortalis columbiana (Orco), Manacus manacus (Mama), Machaeropterus regulus (Mare), Amazilia tzacatl (Amtz), Phaethornis striigularis (Phst), Psarocolius decumanus (Psde), Tinamus major (Tima), Streptoprocne zonaris (Stzo), Henicorhina leucosticta (Hele), Pitangus sulphuratus (Pisu), Phaethornis anthophilus (Phae), Milvago chimachima (Mich) Elanoides forficatus (Elfo). Gremios tróficos: frugívoros (FR), insectívoros (IN), granívoros (GR), nectarívoros (NE), omnívoros (OM), carnívoros (CA), carroñeros (CR). Vectores de variables estructurales de vegetación: altura máxima en metros (Alt max), área basa en m2/ha (G), número arboles (No arboles ha); Sucesión secundaria edad 0-5 años (SS1), Sucesión secundaria 10 edad-13 años (SS2), Sucesión secundaria edad 18-20 años (SS3), Sucesión secundaria mayor a 50 años (SS4).
A nivel de gremios tróficos, se observó que NE (e.g. Phaethornis anthophilus, Phaethornis striigularis), FR (e.g. Pionus menstruus, Manacus manacus) e IN de interior (e.g. Henicorhina leucosticta, Habia gutturalis), se asociaron con los estadios más avanzados y maduros SS3 y SS4 (Figura 2); los gremios OM (e.g. Bubulcus ibis y Phimosus infuscatus), CR (e.g. Cathartes aura, Coragyps atratus) y GR (e.g. Columbina talpacoti), se relacionaron con el estadio SS1 y los gremios CA (e.g. Elanoides forficatus, Milvago chimachima) e IN (e.g. Streptoprocne zonaris, Stelgidopteryx ruficollis), se asociaron con áreas de borde del estadio SS2 (Figura 2).
Después del abandono de prácticas agropecuarias, la regeneración natural permitió un incremento de especies vegetales y el bosque ganó mayor altura, área basal y número de árboles por hectárea, lo que favoreció el incremento de la diversidad funcional del ensamblaje de aves, lo que permitió validar la hipótesis de que la diversidad funcional de aves sería mayor, a medida que la estructura de la vegetación avanzara hacia estadios de mayor regeneración natural. Por su parte, la diversidad taxonómica fue mayor en el estadio SS2 apoyando la hipótesis de las perturbaciones intermedias, ya que no responde positivamente al incremento de la estructura de la vegetación en estadios de mayor regeneración natural.














