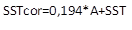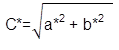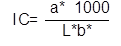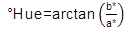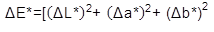INTRODUCCIÓN
La fresa (Fragaria ananassa) y la mora (Rubus glaucus Benth) son frutas cuya producción en Colombia superó las 60.000 y 100.000t, respectivamente, durante el 2016 (MADR, 2018). Dentro de sus aspectos nutricionales, ambas frutas tienen un alto potencial antioxidante (17,0±1,3µmol Trolox/g, para fresa fresca variedad Maya, según ensayo FRAP (Capocasa et al. 2008) y hasta 6956±472µmol Trolox/100g de mora fresca, de acuerdo con el ensayo DPPH (Horvitz et al. 2017)), siendo, a su vez, fuente de minerales (235,15mg/100g, de mora y 207,55mg/100, fresa) y vitamina C (21mg ácido ascórbico/100g de mora y 58,8mg ácido ascórbico/100g, fresa) (USDA, 2018), los cuales son necesarios en una dieta balanceada.
En los últimos años, uno de los factores que ha provocado el aumento en el consumo de frutas y de hortalizas es la prevención o el control de enfermedades (Figueira et al. 2016). En algunos casos, lo anterior puede ser explicado por la presencia de antioxidantes, los cuales, han demostrado propiedades terapéuticas contra enfermedades, como la diabetes tipo 2 (Johnson & Gonzalez de Mejia, 2016), el infarto de miocardio (Cassidy et al. 2016) o los padecimientos neurodegenerativos, como el Alzheimer (Chang et al. 2013). Conforme a lo anterior, la identificación de dichos compuestos, a partir de los desechos de la agroindustria, podrían diversificar el uso de los coproductos del sector alimentario.
La industria de alimentos ocupa una importante posición económica y genera grandes volúmenes de residuos, en su mayoría biodegradables, los cuales, se producen a lo largo del proceso, en gran cantidad y no son aprovechados adecuadamente. Un informe de la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) determinó que, cerca de un tercio de las partes comestibles de los alimentos para el consumo humano, se pierde o se desperdicia, ya que, sin importar el nivel de industrialización de los países, dichas pérdidas se generan, en mayor o menor medida, desde la producción primaria hasta el consumo final en los hogares (FAO, 2012). Por consiguiente, existe un gran interés por dar valor agregado a los coproductos del beneficio agrícola, siendo fuentes de compuestos con potencial nutracéutico y antioxidante, tales como el resveratrol, la cumarina, β-caroteno entre otros (da Silva et al. 2014).
En este trabajo. se realizó la caracterización y la cuantificación de antioxidantes, parámetros fisicoquímicos (humedad, pH, °Brix y color) y nutricionales (minerales y vitamina C), para residuos de fresa y de mora, en diferentes métodos de conservación, con el fin de dar a conocer su potencial en la obtención de compuestos bioactivos, generar interés en su recuperación, diversificar el uso de los subproductos, propios del beneficio de dichas frutas y así, disminuir la pérdida y el desperdicio de los mismos, durante la cadena productiva.
MATERIALES Y MÉTODOS
Material vegetal. La fresa y la mora, se adquirieron en un mercado local y los residuos, se obtuvieron tras despulpar la fruta en una máquina despulpadora (DE-101, Caval, Bogotá, Colombia), con una malla de 0,75mm; posteriormente, 2kg de mezcla de residuos, corteza, semilla y lodo, se congelaron hasta su pretratamiento (-18±1°C).
Preparación de la muestra y diseño experimental. El material vegetal se descongeló en un horno microondas (700W), durante 10 minutos, alcanzando una temperatura de 4°C, de acuerdo con lo descrito por Holzwarth et al. (2012). Posteriormente, las muestras fueron distribuidas, con el fin de disponerlas en cuatro condiciones de conservación, las cuales, fueron: fresco (21,6±1°C y 35±4%, de humedad relativa), refrigerado (4±1°C y 26±4%, de humedad relativa), secado convencional (37°C durante 24h, en estufa de secado, MLW Coimsa, USA) y liofilizado (fase de congelación a -34°C, durante 24h y sublimación a 22°C, 4300 Pa, durante 8 días, en liofilizador Drycol, Bogotá, Colombia). Previo al análisis, las muestras sometidas a deshidratación fueron molidas en un molino de palas (retsch sk 100, Hann, Alemania), usando un tamiz de 0,5mm de diámetro. Por último, las muestras fueron empacadas al vacío (multivac chamber machine C200, Bremen, Alemania) y almacenadas a 21,6±1°C y 35±4%, de humedad relativa.
El diseño experimental consistió en evaluar, durante 4 semanas, el comportamiento de los parámetros fisicoquímicos, antioxidantes y vitamina C, teniendo 4 variables correspondientes a los pretratamientos, como fresco, refrigerado, secado, liofilización. Para el análisis estadístico, se realizó un análisis de varianza (ANOVA, p<0,05; Statgraphic Plus, 5.1, Manugistic Inc, Rockville, MD, EE.UU).
Para la determinación de antioxidantes y vitamina C, se realizaron extractos en relación (1:40), con una solución de metanol al 80%, los cuales, se centrifugaron a 6000 RPM, durante 15min, en una centrífuga (Rotofix 32 A KASAI Hettich zentrifugen, Canadá). Para los análisis fisicoquímicos, se realizaron extractos (1:5) con agua destilada, excepto para el análisis de color y humedad, medidos directamente sobre la muestra.
Humedad. 0,5g de muestra fueron colocados en una balanza de humedad (Mettler toledo HG43-s Halogen, Switzerland, Suiza). Después del tiempo de medición, el equipo arrojó el contenido de agua de la muestra expresado en porcentaje (%).
Potencial de hidrógeno (pH). Se utilizó un Potenciómetro S20 SevenEasy, (Mettler Toledo, Suiza), de acuerdo con el método AOC 943.02 (AOAC, 1995).
Sólidos solubles totales (°Brix). Se evaluó por refractometría, utilizando un refractómetro digital (ATAGO PAL-alpha, USA) previamente calibrado con agua destilada. El resultado fue expresado como grados Brix (°Brix) y corregidos (ICONTEC, 1997), de acuerdo con la ecuación 1.
Donde, SSTcor: sólidos solubles totales corregido (°Brix), A: porcentaje de ácido, SST: sólidos solubles totales (°Brix).
Color. Para la evaluación del color, se utilizó un Colorímetro CIE.Lab (Konica Minolta CR-400, Japón), con lecturas en términos de L*, a* y b*, empleando una placa de BaSO4 estándar (X 79,80, Y 84,97, Z 90,74), para la calibración del instrumento. Las medidas de color de las muestras, se llevaron a cabo en la superficie de ésta, donde se calculó croma (Ecuación 2), índice de color (Ecuación 3), ángulo Hue (Ecuación 4) y diferencia de color (Ecuación 5) (Sahin & Summu, 2006).
Dónde, L*, luminosidad; a*, posición entre rojo y verde; b*, posición entre amarillo y azul; C, croma; IC, índice de color; °Hue, ángulo de tono; ΔE*, diferencia de color; ΔL*, diferencia de luminosidad; Δa*, diferencia en la posición entre rojo y verde; Δb*, diferencia en la posición entre amarillo y azul.
Determinación del contenido de minerales. Se basó en la digestión de las muestras por triplicado, con ácido nítrico, en un recipiente cerrado, donde se controlaron variables de temperatura y de tiempo, mediante un digestor microondas. La metodología consistió en pesar 0,3g de muestra seca directamente, dentro de un tubo de digestión y adicionar 9mL de HNO3 (65%), siendo este tapado de inmediato. El programa de digestión consistió en una rampa de 180ºC/5min y, luego, de 180ºC/10min, con una potencia de 700W. Los tubos, se enfriaron y las muestras se trasladaron a un matraz aforado de 100mL, con una solución de HNO3 (1%), con agua Milli-Q, determinando, así, manganeso (Mn), boro (B), zinc (Zn), calcio (Ca), fósforo (P), potasio (K), hierro (Fe), sodio (Na) y magnesio (Mg), por espectrometría de masas por plasma de acoplamiento inductivo (ICP-MS, 7500ce, Agilent Technologies, Manchester, U.K.) (EPA, 2007).
Determinación del contenido de vitamina C. Esta técnica tiene como fundamento el ácido ascórbico, tratado con 2-nitroanilina diazotada, pasando a 2-nitrofenilhidrazida del ácido, el cual, en presencia de un exceso de NaOH, forma una sal sódica de color rojo- violeta, que tiene un máximo de absorción de 540nm. El ensayo, se realizó como lo describe Bernal de Ramírez (1998) por triplicado, que consistió en tomar una alícuota de 10µL de 2- nitroanilina 0,16% y 20µL de nitrito de sodio 0,08%, recién preparado; luego, se adicionó 380µL de etanol 96%, 50µL de la muestra (extracto) y 50µL de ácido oxálico 0,15%; se mezcló y se dejó en reposo 5 minutos; posteriormente, se adicionó 120µL de NaOH 10% y 380µL de agua destilada. Finalmente, la mezcla se leyó en el espectrofotómetro (Thermo Scientific Evolution 300, EE.UU), a una absorbancia de 540nm y se comparó con una curva de calibración de ácido ascórbico (R2>0.99). Para el blanco, se tomó una alícuota de 50µL de ácido oxálico, como muestra durante el experimento.
Determinación de antioxidantes por el método de FRAP. Este método, se basa en la reducción del ion férrico (Fe3+) a ion ferroso (Fe2+), en condiciones ácidas; se determinó, de acuerdo con el método descrito por Benzie & Strain (1996) por triplicado. 940µL de reactivo FRAP (compuesto por buffer acetato de sodio 0,3M, con pH 3,6, TPTZ 0,01M y cloruro férrico 0,02M (10:1:1)), fueron mezclados con 30µL de etanol-agua (80:20) y 30µL de extracto en un tubo Eppendorf. Esta disolución, se incubó a 37°C, durante 1h, en ausencia de luz, tras ello, se homogeneizó en vortex. Posteriormente, se leyó la absorbancia a 593nm, en el espectrofotómetro (Espectrofotómetro evolution 300 thermo scientific, Matlock, Inglaterra) y se comparó con una curva de calibración de Trolox (R2>0,99). Para el blanco, se tomó una alícuota de 940µL de FRAP y 60µL de metanol-agua (80:20).
Determinación de antioxidantes por el método de DPPH. Se basa en el principio de aceptación de un hidrógeno (H) en el átomo de la molécula captadora DPPH, dando la reducción de DPPH a DPPH2, el cual, se determinó de acuerdo con el método descrito por Brand-Williams et al. (1995) por triplicado; para ello, se tomó una alicuota de 200µL de reactivo DPPH, 800µL de metanol-agua (80:20) y 50µL del extracto; luego, se incubó a 37°C, durante una hora y en ausencia de luz se homogenizó en vortex; posteriormente, se leyó la absorbancia en el espectofotómetro a 515nm (Thermo Scientific Evolution 300,EEUU) y se comparó con una curva de calibración de Trolox (R2>0.99). Para el blanco, se tomó una alícuota de 1000µL de metanol-agua (80:20).
RESULTADOS Y DISCUSIÓN
Parámetros fisicoquímicos. El máximo valor de humedad alcanzado fue para los residuos de fresa, que fue de 88%, en fresco y refrigerado (Tabla 1), similares al contenido de humedad reportado para mora y para frambuesa (86,13±0,12% y 85,84±1,66%, respectivamente) (Yang & Choi, 2016).
Tabla 1 Parámetros fisicoquímicos de los residuos de mora y de fresa.
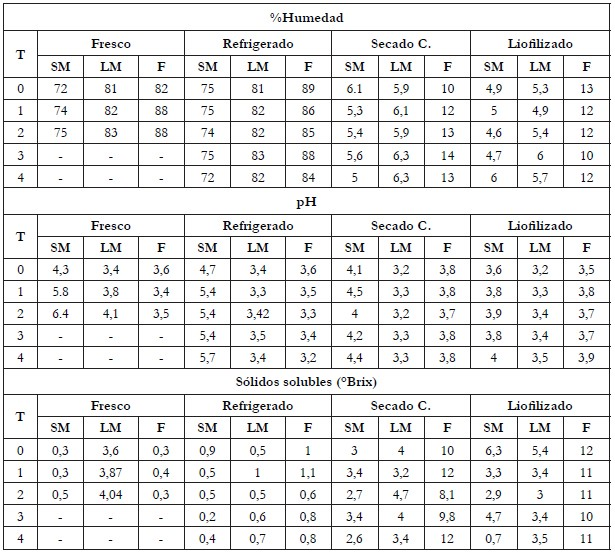
SM= Semilla de mora, LM= Lodo de mora, F=Residuo de fresa.
Los residuos de mora y de fresa presentaron pH entre 3,2 (lodo de mora liofilizado) y 4,7 (semilla de mora liofilizada), durante la semana cero (Tabla 1), siendo comparables con los valores determinados por Yang & Choi (2016), para frambuesa silvestre (3,39±0,11), mora (3,49±0,10) y morera (4,73±0,11); a su vez, son similares a lo obtenido por de Souza et al. (2014), para fresa (3,73±0,01) y arándanos (3,64±0,05). Durante las semanas de almacenamiento, las muestras secas mostraron mayor estabilidad en el pH en comparación con los residuos frescos y refrigerados; lo anterior, puede ser explicado por la reducción de humedad en las muestras, que permitió la inhibición de los procesos de deterioro, disminuyendo la actividad enzimática y los cambios químicos relacionados.
Las muestras secas presentaron el mayor contenido de sólidos solubles totales (Tabla 1), como es el caso de los residuos de fresa liofilizada (entre 10-12°Brix), similares a lo reportado en fresa (10,50±0,50°Brix), frambuesa roja (10,33±0,58°Brix) (de Souza et al. 2014) y arándano rojo (9,93±0,05°Brix) (Yang & Choi, 2016). Los sólidos solubles en las muestras de lodo y semilla de mora liofilizada (5,4 y 6,3°Brix, respectivamente), son similares a lo obtenido por Van de Velde et al. (2016), para mora fresca de variedad ‘Jumbo’ (5,5±1,0°Brix), ‘Blacksatin’ (7,0±1,0°Brix) y ‘Dirksen’ (6,9±0,6°Brix); no obstante, la semilla de mora liofilizada sufrió una disminución en el contenido de sólidos solubles, especialmente, durante la semana 4, que puede estar relacionada con el aumento en la humedad, dada a causa de las condiciones de almacenamiento.
Color. De acuerdo con las figuras 1A y 2A, el croma se mantuvo estable en todas las condiciones de experimentación durante el tiempo de almacenamiento; dicho parámetro estuvo entre 9,33 (semilla de mora fresca, durante la primera semana) y 24,3 (residuo de fresa liofilizado, en la tercera semana), siendo las muestras secas, las que presentaron mayor saturación con respecto a los productos frescos y refrigerados. Por otro lado, el ángulo Hue no presentó ningún cambio con los pretratamientos o la materia prima, obteniendo para todas las condiciones, un °Hue de 1,54±0,01. Por consiguiente, la diferencia de color (figura 1B y 2B), con respecto al estándar (L= 71,54, a*= 12,87 y b= 6,76), estuvo entre 1,51 (residuo de fresa fresca, durante la semana 0) y 11,44 (residuo de fresa liofilizado, en la cuarta semana), De acuerdo con Obón et al. (2009), las diferencias de color empiezan a ser evidentes cuando el parámetro es superior a 5 unidades, siendo el residuo de fresa liofilizado la muestra que más difiere respecto al estándar de medición. Lo anterior, se puede explicar, debido al aumento en la concentración de pigmentos, tales como antocianinas en las muestras secas, generando colores más intensos a comparación de los productos frescos, cuya diferencia con el estándar es menor.
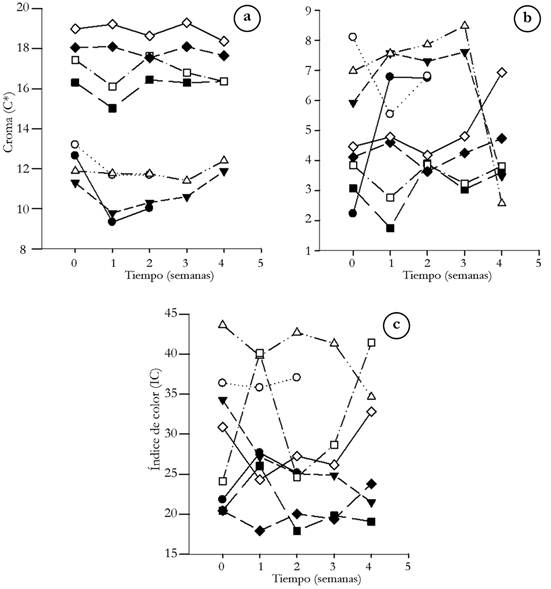
Figura 1 Parámetros de color para los residuos de mora (● semilla de mora fresca, ○ lodo de mora fresco, ▼ semilla de mora refrigerada, Δ lodo de mora refrigerado, ■ semilla de mora por secado convencional, □ lodo de mora por secado convencional, ♦ semilla de mora liofilizada, ◊ lodo de mora liofilizado): a. croma; b. diferencia de color; c. índice de color.
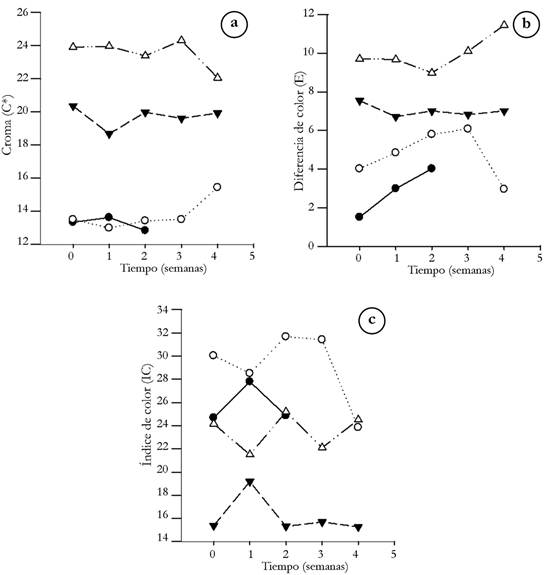
Figura 2 Parámetros de color para los residuos de fresa (● fresco, ○ refrigerado, ▼ secado convencional, Δ liofilizado): a. croma; b. diferencia de color; c. índice de color.
Según la figura 1C y 2C, el índice de color osciló entre 15,27 y 43,63, representando desde el naranja intenso hasta el rojo profundo, respectivamente (Vignoni et al. 2006); sin embargo, es de resaltar que compuestos, como las antocianinas, se ven afectados por la temperatura (Liu et al. 2018), generando cambios de color dentro de la matriz de las materias primas, sometidas a secado convencional. Por ende, lo anterior puede explicar la variabilidad en el índice de color del lodo de mora seco por métodos convencionales, cuyos resultados no muestran un comportamiento definido durante el almacenamiento.
Determinación del contenido de minerales. De acuerdo con la tabla 2, las semillas de mora son el coproducto con mayor contenido en minerales y en nitrógeno (de acuerdo con prueba de Tukey (p<0.05); a excepción del potasio, cuya concentración fue superior en los residuos de fresa (1,47±0,06g /100g, de muestra seca en base seca); por consiguiente, el coproducto con menor cantidad de minerales fue el lodo de mora.
Tabla 2 Contenido de minerales en residuos de mora y de fresa (media± desviación estándar n=3).
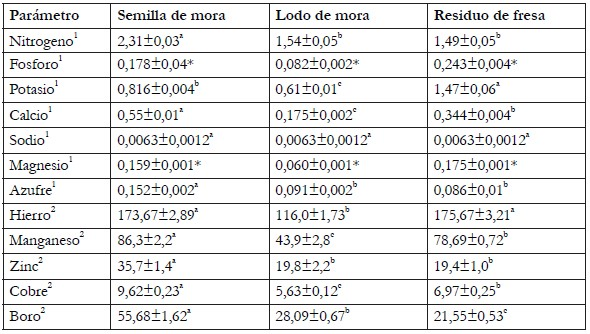
Letras iguales en la misma fila significa que no hay diferencias significativas, basadas en la prueba de Tukey (p<0.05). *No es posible determinar diferencias significativas, basado en la prueba de normalidad Shapiro-Wilk (p<0.05). 1 Parámetro expresado como g/100 g muestra en base seca. 2 Parámetro expresado como mg/kg muestra en base seca.
El elemento mayor con más alta presencia en los subproductos de fresa y de mora fue el potasio, superando lo reportado para semillas de fresa desengrasadas (0,4,8g de K/100g d.m) (Grzelak-Błaszczyk et al. 2017) y para subproductos de manzana (0,71g/100g); sin embargo, se ha reportado mayor cantidad de potasio en subproductos de papa (3,73g/100g), pepino (4,61g/100g), melón (3,53g/100g) y sandía (4,77 g/100 g) (Tarazona-Díaz & Aguayo, 2013). Adicionalmente, el elemento menor predominante en los coproductos estudiados es el hierro, superior a lo reportado para subproductos de manzana (33,8mg/kg), pepino (81mg/kg), melón (66,6mg/kg) y sandía (59,1 mg/kg) (Tarazona-Díaz & Aguayo, 2013). Por otro lado, los subproductos estudiados tienen una baja presencia en sodio y cobre (ambos con menos de 1mg/100g, en base seca). Conforme a lo anterior, los coproductos del beneficio de la mora y la fresa tienen potencial para su utilización en productos que requieran el enriquecimiento de minerales, especialmente, de potasio y de hierro.
Poder antioxidante y contenido de vitamina C. Los coproductos que tienen mayor poder antioxidante, según ensayo FRAP, fueron la semilla de mora y el residuo de fresa, ambos liofilizados (21,79±0,12 y 16,50±0,01mg Trolox eq/g, respectivamente) (Figuras 3A y 4A), mientras que por DPPH, el lodo de mora y el residuo de fresa, ambos por secado convencional (13,28±0,017mg y12,73±0,01mg Trolox eq/g), fueron los que presentaron los mayores resultados (Figura 3B y 4B). La disminución del contenido de agua, debida a los tratamientos, pudo ser la causante de la alta concentración de antioxidantes en los subproductos, siendo mayor a lo reportado para grosellas, almacenadas a 25 y 4°C (1,85 y 1,75mm Trolox eq/100g FW, respectivamente, según ensayo DPPH) (Piljac-Žegarac & Šamec, 2011), al extracto de fresa tipo Alba (22,85±0,39 y 7,71±0,32µmol Trolox eq/g FW, de acuerdo con ensayo FRAP y DPPH) (Gasparrini et al. 2017) y a la pulpa de mora ‘Brazos’ y ‘ Tupy’ (64,63±3,08 y 44,43±4,06µM Trolox/g, según FRAP); sin embargo, es inferior a lo determinado en corteza de sandía variedad Motril y Boston (0,062mg ácido ascórbico equivalente, según DPPH) (Tarazona-Díaz et al. 2010).
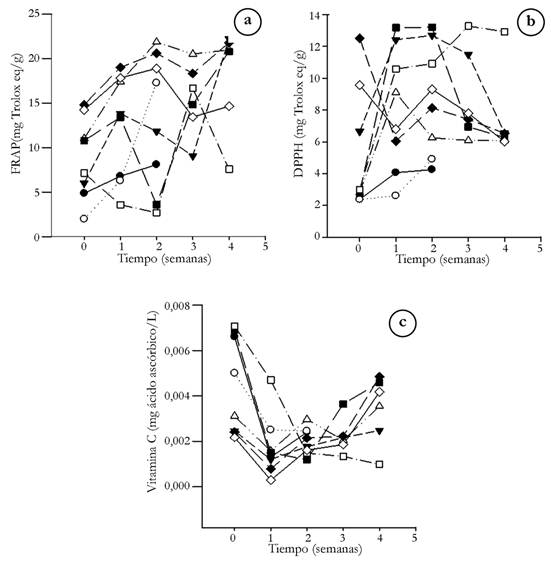
Figura 3 Poder antioxidante y contenido de vitamina C para los residuos de mora (● semilla de mora fresca, ○ lodo de mora fresco, ▼ semilla de mora refrigerada, Δ lodo de mora refrigerado, ■ semilla de mora por secado convencional, □ lodo de mora por secado convencional, ♦ semilla de mora liofilizada, ◊ lodo de mora liofilizado): a. FRAP; b. DPPH; c. vitamina C.
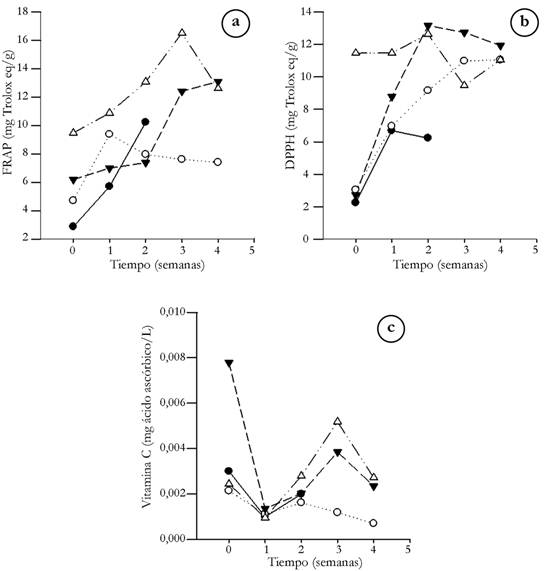
Figura 4 Poder antioxidante y contenido de vitamina C para los residuos de fresa (● fresco, ○ refrigerado, ▼ secado convencional, Δ liofilizado) a. FRAP; b. DPPH; c. vitamina C.
Lo anterior demuestra que los residuos de fresa y mora son fuente potencial para la obtención de compuestos con alto poder antioxidante.
Los subproductos tienen un bajo contenido de Vitamina C (Figura 3C y 4C), siendo el residuo de fresa, tratado por secado convencional, el subproducto con mayor cantidad de ácido ascórbico (7,1*10-3±7,4*10-4mg ácido ascórbico/L), inferior a lo reportado para limón sin corteza (53,0mg ácido ascórbico/100g) y guayaba (228,3mg ácido ascórbico/100g) (USDA, 2018), frutos que se destacan dentro de la dieta por su contenido en vitamina C. Asimismo, los resultados del presente estudio son inferiores a lo determinado para productos con bajo contenido en vitamina C, como el Kiwano (0,925mg/100g) o la granada (1,56mg/100g) (Valente et al. 2011). Tal concentración de vitamina C en los subproductos, se puede deber a que, durante el procesamiento de la fresa y la mora, cabe la posibilidad de que, tales materias primas, hayan sido sometidas a altas temperaturas, degradando la vitamina C, debido a su carácter termolábil (Athmaselvi et al. 2017), lo que hace que no tengan el potencial para la obtención de dicho compuesto.