INTRODUCCIÓN
El banano es considerado el cuarto alimento más consumido en el mundo después del arroz, el trigo y el maíz (Akila et al. 2011; Siddhesh et al. 2015). Muchos de los cultivares son híbridos naturales, seleccionados por los primeros agricultores y, actualmente, los bananos comestibles provienen de dos especies diploides Musa acuminata (AA) y M. balbisiana (BB) (Perrier et al. 2011). Se conocen más de 50 subgrupos, pero solo Gros Michel y Cavendish, producen la mayor cantidad de fruta, siendo Cavendish el más importante (Ploetz, 2015b). En América Latina y el Caribe, se concentra cerca del 28% de la producción mundial (M. acuminata AA), con tres de los diez productores y exportadores más importantes en el mundo (Dita et al. 2013).
Dentro de las enfermedades limitantes del cultivo está el mal de Panamá, causado por Fusarium oxysporum Schlechtend. f. sp. cubense (E.F. Smith) W. C. Snyder & H. N. Hansen, siendo una de las más destructivas en banano (Akila et al. 2011; Belgrove et al. 2011; Ploetz, 2015b), por la epidemia que causó la raza 1 en América Central, a mitad del siglo XX, en “Gros Michel” (Nel et al. 2007), obligando al cambio por cultivares resistentes del tipo Cavendish (Buddenhagen, 2009). Los bananos pertenecientes a Cavendish tienen nuevamente amenazada la producción y la sostenibilidad, debido a su susceptibilidad, a una nueva variante del hongo, denominada raza tropical 4 (RT4) (Meldrum et al. 2013a; Ploetz, 2015a), hecho que debió preverse, considerando lo sucedido con Gros Michel y el riesgo de tener extensos monocultivos con clones estrechamente relacionados con la genética.
F. oxysporum hace parte de la comunidad de hongos del suelo y es considerado como componente natural de la rizosfera de las plantas; todas las cepas de la especie son saprófitas y pueden sobrevivir sobre materia orgánica; sin embargo, algunas son fitopatógenas y penetran las raíces del hospedante, induciendo marchitamientos vasculares (Fravel et al. 2003); posee, además, gran especificidad patógeno-hospedante (Ploetz, 2006), que ha llevado a la identificación de alrededor de 150 formas especiales y razas fisiológicas (Gordon, 2017), como F. oxysporum f. sp. cubense (Ploetz, 2015b), F. oxysporum f. sp. lycopersici (Marín-Serna et al. 2014) y F. solani f. sp. passiflorae (Ángel-García et al. 2018).
F. oxysporum f. sp. cubense (Foc), originario del Sudeste de Asia, está presente en todas las zonas productoras (Nel et al. 2007). Es un microorganismo genética y patogénicamente diverso, del cual, se han identificado cuatro razas: la raza 1, afecta a Gros Michel y Manzano (AAB); la raza 2, ataca a los cultivares ABB, conocidos como Guineo, Cuadrado, Topocho y Chatos; la raza 3, a heliconias (Heliconia L.) y la raza 4, a cultivares susceptibles a las razas 1, 2 y del tipo Cavendish (Hennessy et al. 2005; Ploetz, 2015b). Dentro de la raza 4, se ha identificado la raza tropical (RT4) y la subtropical (ST4), ambas pertenecientes a diferentes grupos de compatibilidad vegetativa; la primera, causa enfermedad en trópicos y subtrópicos y, la segunda, solo en el subtrópico (Belgrove et al. 2011). Esta nueva variante del patógeno tiene la capacidad de infectar no solo a los bananos tipo Cavendish sino también al plátano (Shirani & Sijun, 2018).
Aunque no existen reportes de la recombinación sexual para Foc, este es un patógeno altamente variable, que utiliza otros mecanismos, como mutación, elementos transponibles en el genoma, anastomosis hifal, flujo de genes y selección (Costa et al. 2014), que dificultan su manejo y ponen de manifiesto la gravedad de sus ataques que sobrepasan, en tiempo y en espacio, la capacidad humana de desarrollar variedades resistentes o tolerantes.
Externamente, Foc produce dos tipos de síntomas: síndrome de la hoja verde y síndrome de la hoja amarilla. En el primero, las hojas permanecen verdes hasta que el peciolo se dobla y colapsa; en el segundo, el más común, los bordes de las hojas adultas se tornan amarillas y se dividen longitudinalmente, avanzando, de manera gradual, hacia las hojas jóvenes (Pérez et al. 2014) (Figura 1a). En genotipos susceptibles, las esporas del hongo germinan estimuladas por compuestos orgánicos, que son liberados por las raíces del hospedante; la penetración la realiza directamente por la cofia de la raíz, con la ayuda de enzimas degradativas o mediante el crecimiento intercelular, momento a partir del cual procede la colonización, desde el ápice de la raíz (Gordon, 2017). U una vez el hongo avanza por el tejido vascular, causa una decoloración que se extiende hacia el pseudotallo (Ploetz, 2006; Pérez et al. 2014) (Figura 1b). Los síntomas son más evidentes entre 5 y 6 meses después de la siembra, caracterizados por la muerte de las plantas y pérdidas en el rendimiento (Ploetz, 2006; Akila et al. 2011; Sun et al. 2011).

Figura 1 a. Síntomas externos del mal de Panamá; b. Necrosamiento de los haces vasculares; c-d. Crecimiento característico de Fusarium oxysporum f. sp. cubense en medio PDA.
El patógeno, en medio de cultivo, produce micelio de color blanco con fondo rojizo (Figura 1c), que se acentúa con el tiempo (Figura 1d), produciendo microconidios, con forma elíptica, oval o de riñón, usualmente, sin septos (Figura 2A); macroconidios, con forma de hoz y tres septos (Figura 2B) y clamidosporas (Figura 2C), con paredes lisas o ásperas, formadas individualmente, en pares o en cadenas (Leslie & Summerell, 2006; Pérez et al. 2014; Siddhesh et al. 2015). Las clamidosporas pueden sobrevivir por más de 30 años en ausencia de hospedante principal (Ploetz, 2006), pero el hongo, igualmente, tiene la capacidad de infectar arvenses (Ploetz, 2015b), musáceas silvestres (Musa spp.) y heliconias (Heliconia spp.) (Pérez et al. 2014). En Colombia, Fusarium oxysporum f. sp. cubense se detectó en rizomas e inflorescencias de Heliconias (Alarcón, 2007) y Fusarium spp., en pseudotallos, pedicelos, inflorescencias y rizomas de las variedades Salmón, Orange, Kawachi y Edge of night (López & Castaño-Zapata, 2012).
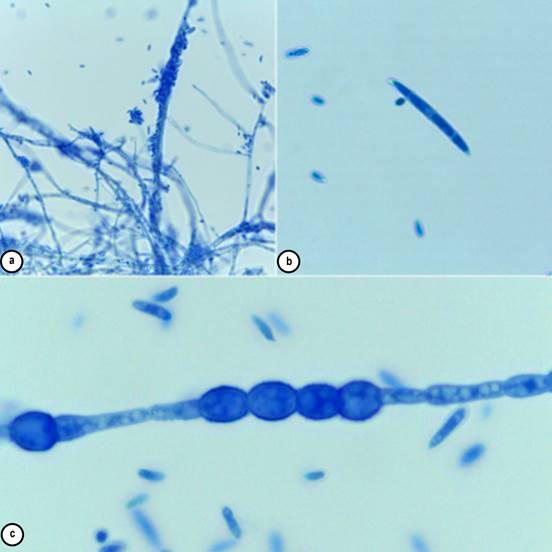
Figura 2 Estructuras reproductivas del hongo. a. Microconidios; b. Macroconidio; c. Clamidosporas en cadena.
La dispersión de los patógenos habitantes del suelo, como Foc, es usualmente a cortas distancias, excepto por el movimiento de plantas contaminadas que, además, permiten la introducción de nuevos alelos entre las poblaciones existentes, ocasionando grandes cambios en su estructura genética (Costa et al. 2014). En este caso, se ha documentado que la diseminación del hongo en las plantaciones se hace a través de suelo, agua, herramientas, equipos agrícolas, ropa, botas, material de siembra (Ploetz, 2015a), por el picudo negro (Cosmopolites sordidus Germar) (Meldrum et al. 2013a) y por nematodos fitoparásitos, como Radopholus similis (Cobb) Thorne (Pérez et al. 2014). Otras prácticas que pueden contribuir con la adaptación y la dispersión de este hongo son los agroecosistemas modernos, donde la producción bananera se caracteriza por el uso intensivo de prácticas de manejo, como riego, variedades resistentes y prácticas culturales (Costa et al. 2014).
El mal de Panamá es una enfermedad monocíclica, típica de marchitez vascular, en la que, por efecto del hongo y las respuestas del hospedante, se produce la oclusión de los vasos del xilema, impidiendo el transporte de agua y de nutrientes (Akila et al. 2011; Pérez et al. 2014). Algunas de las prácticas para el manejo de la enfermedad son preventivas, como la aplicación de fumigantes al suelo (Fravel et al. 2003), siembras en campos libres del patógeno y el empleo de semilla sana (Ploetz, 2015a).
Debido a la dificultad de controlar el hongo por su sistemicidad y como respuesta a las preocupaciones que surgen del uso inadecuado y excesivo de los productos químicos, es necesario establecer una alerta ante la inminente llegada al país de la RT4, enfatizando en la prevención, mediante la implementación de alternativas de manejo integrado (MIE), cuyos principios básicos son: exclusión o erradicación del patógeno, escape de la infección, desarrollo y uso de la resistencia genética, protección de las plantas y reducción de la incidencia de la enfermedad (Castaño-Zapata, 1994; Jiménez & Jiménez, 2011), conceptos que pueden ser aplicados, mediante la utilización conjunta de las estrategias disponibles, reduciendo los efectos adversos del patógeno sobre un cultivo, sin disminuir la calidad y el rendimiento.
Para el mal de Panamá, se ha estimado la exclusión, como la estrategia más efectiva (Pérez, 2015), pero considerando el desconocimiento de aspectos biológicos del patógeno y ecológicos de la enfermedad, en lo que respecta a la interacción Cavendish - F. oxysporum f. sp. cubense RT4, la mejor opción es el uso de variedades resistentes (Ploetz, 2015a) que, combinadas con otras prácticas, conllevan a la aplicación del concepto de MIE, estrechamente ligado al modelo logístico de James Edward Van der Plank (1963). Éste, cuantifica la tasa de desarrollo de una enfermedad (r) y caracteriza su progreso, mediante la obtención de valores de enfermedad (X) e inóculo inicial (X o ), en un espacio de tiempo (t), variables que se expresan mediante la ecuación X = Xoer.t, siendo ℮ = la constante universal equivalente a 2,7182.
MATERIALES Y MÉTODOS
Se realizó una búsqueda de información, a través Internet, enfatizando en las bases de datos científicas, como Dialnet, Scielo, Science direct, Scopus, Google académico y Jstor, donde se obtuvo la información relevante del tema, publicada durante 30 años, por medio de más de 80 artículos científicos, tanto en español como en inglés, con las palabras clave Fusarium oxysporum f. sp. cubense raza tropical 4, Fusarium wilt, Fusariose, Plantains, Bioactive compounds, banana production.
RESULTADOS Y DISCUSIÓN
El control de patógenos habitantes del suelo es complejo, más aún, cuando producen estructuras de resistencia, como sucede con Fusarium y aunque se han desarrollado diferentes prácticas para su manejo, incluido el control químico con fungicidas sistémicos, la naturaleza de estos productos es una amenaza, por el aumento de la resistencia del patógeno. Se ha indicado, que el manejo para todas las razas, incluida la RT4, sea similar a las empleadas para Ralstonia solanacearum (Smith), las cuales, están enfocadas, principalmente, a disminuir el inóculo inicial (X 0 ), y consideran aspectos, como la delimitación de áreas de acceso, aplicación de fumigantes, eliminación de plantas enfermas y rotación con especies no hospedantes (Pérez et al. 2014).
Control legal. La cuarentena, cuyo efecto epidemiológico es sobre X 0 , es una medida todavía viable en Colombia y complementa el “Plan Nacional de Foc RT4”, para mantener el patógeno en la categoría de plaga cuarentenaria ausente. Este mecanismo constituye una primera e importante barrera, porque, una vez el patógeno se ha introducido en un cultivo, su erradicación es imposible (Ploetz, 2015b), ya que los esfuerzos para contener la enfermedad en los países donde está presente, a través de la cuarentena inter o intra nacional, no han sido efectivos, como ha sido evidente por la diseminación del hongo entre continentes, países y regiones (Dale et al. 2017).
En todo caso, las medidas a establecer deben ser coordinadas y en cooperación con los entes directamente involucrados, como son productores, importadores y exportadores; la vigilancia constante es fundamental para la detección temprana de focos de la enfermedad, mediante el flujo de información continuo, en cooperación con las instituciones gubernamentales involucradas, con el asesoramiento de especialistas en micología, para la identificación correcta del patógeno y la raza presente, sumado a la investigación requerida, para mejorar o desarrollar técnicas más eficientes para la detección oportuna del hongo.
De igual manera, el material de propagación, sitios donde se produce, el tránsito de material infectado y las personas provenientes de países donde el patógeno está presente, deben ser estrictamente controlados, para facilitar el establecimiento de estrategias de manejo de la enfermedad y la implementación de medidas cuarentenarias, ante una potencial llegada de la RT4 al país.
Resistencia. La naturaleza de la enfermedad reduce las formas de manejo; usualmente, la siembra de materiales susceptibles debe provenir de semilla sana y sembrarse en suelos libres del patógeno (Ploetz, 2015a), prácticas que afectan el inóculo inicial (X 0 ). Aun así, el uso de materiales resistentes es la estrategia más efectiva para el manejo de la enfermedad (Fravel et al. 2003; Costa et al. 2014; Ploetz, 2015a); estos materiales, dependiendo de su naturaleza y los genes involucrados, tienen un efecto epidemiológico sobre el inóculo inicial (X 0 ), si la resistencia es monogénica o sobre la tasa de desarrollo de la enfermedad (r), si es poligénica (Castaño-Zapata, 2002).
Infortunadamente, los programas de mejoramiento genético no han logrado producir materiales con iguales o mejores características de productividad y de calidad que satisfagan las exigencias del mercado, en aspectos como la calidad de la fruta (Molina et al. 2011; Wang et al. 2013), pero es posible que estos materiales tengan aceptación en lugares donde las condiciones de pos-cosecha y la tolerancia a diferentes sabores no sean relevantes (Ploetz, 2015a) o donde el cambio no represente un riesgo para la economía nacional y regional, como ocurre en la región de Urabá - Antioquia, Colombia, en donde el impacto económico y social sería de grandes proporciones.
La Fundación Hondureña de Investigación Agrícola, FHIA, desarrolló materiales de banano resistentes a F. oxysporum f. sp. cubense RT4 (Aguilar, 2013); incluyeron, también, híbridos resistentes a la raza 1 y subtropical 4 y otros con mayor resistencia que el cultivar Gros Michel (Smith et al. 2014). De igual manera, en Asia se han logrado nuevas líneas altamente resistentes a Foc RT4, con rendimientos y calidad comparables a las variedades comerciales (Molina et al. 2011; Molina et al. 2016; Dale et al. 2017), en donde varios genotipos de parientes silvestres de banano han mostrado diferentes niveles de resistencia a la raza 4 del hongo (Li et al. 2014; Zuo et al. 2018).
En subespecies de M. acuminata, como burmannica, microcarpa y siamea, se han encontrado alelos con resistencia a Foc R1; en la subsp. Malaccensis, a las razas 1 y 4 (Shirani & Sijun, 2018) y en M. basjoo y M. itinerans, alta resistencia a Foc TR4; aunque por la riqueza genética que se encuentra en los materiales silvestres y la cual puede ser objeto de variación en el grado de resistencia, se requieren selecciones cuidadosas (Li et al. 2014).
Control cultural. Para evitar la dispersión de la raza 4, se ha recomendado la eliminación de un anillo simple o doble alrededor de las plantas enfermas (Meldrum et al. 2013a). Esta práctica, comúnmente usada para el manejo de la enfermedad, tiene efecto epidemiológico en la reducción del inóculo inicial (X 0 ), además de evitar la diseminación del patógeno hacia áreas libres, pero necesita complementarse con otras estrategias para ampliar su efectividad, debido a que, conociendo la naturaleza del patógeno y la enfermedad, no garantiza por sí sola un método de control efectivo.
La rotación de cultivos, que igualmente reduce el inóculo inicial (X 0 ), tiene limitaciones por la capacidad del hongo para sobrevivir por largo tiempo, mediante clamidosporas, aún en ausencia del hospedante principal; no obstante, otras estrategias, como la siembra intercalada o rotación con especies no hospedantes del hongo, como yuca (Manihot esculenta Crantz) (Buddenhagen, 2009), puerro chino (Allium tuberosum Rottler ex Spreng.) (Huang et al. 2012; Zhang et al. 2013b) y piña Ananas comosus (L.) Merr. (Wang et al. 2015), reducen la incidencia de la enfermedad; del mismo modo, el uso de cubierta vegetal al suelo y alrededor de la base de las plantas, disminuye la incidencia de Foc (X o ), alargando el periodo de desarrollo de los síntomas de la enfermedad (r) (Pattison et al. 2014).
Otras prácticas que tienen efecto sobre el inóculo inicial (X 0 ) son el uso de desinfestantes de superficie sobre botas, herramientas y maquinaria (Nel et al. 2007). Está confirmada la efectividad del cloruro de polimetilamonio (Sporekill), sobre Foc, después de 30 segundos de exposición (Meldrum et al. 2013b); la esterilización del suelo con calor, colocando cascarilla de arroz en los sitios donde se han observado plantas enfermas (Ploetz, 2015a) o el aislamiento de sitios afectados con láminas de aluminio o zinc, para luego quemarlos, incluyendo los rizomas de las plantas afectadas (Pérez et al. 2014).
La solarización del suelo es un tratamiento efectivo y representa una alternativa ante la ausencia de estrategias seguras para el control de patógenos; su efecto está en la reducción del inóculo inicial (X0) y se puede mejorar en combinación con un fumigante al suelo, aunque estos últimos son poco efectivos, debido al ciclo del cultivo (Herbert & Marx, 1990); sin embargo, Hermanto et al. (2012) demostraron que en un suelo infectado con Foc RT4, sometido únicamente al tratamiento físico, la aparición de la enfermedad se retrasó más tiempo que rotando con maíz durante dos siembras consecutivas y barbecho durante 10 meses.
El manejo de arvenses, se debe considerar dentro de un programa de MIE, ya que actúan como hospedantes alternos del hongo, afectando el inóculo inicial (X 0 ) y la tasa de desarrollo (r), al ser portadoras endofíticas del hongo y contribuyendo a la acumulación de inóculo, especialmente gramíneas (Pérez, 2015; Deltour et al. 2017). Especies de la familia Asteraceae, como el rabo de buey Cyanthilium cinereum (L.) H.Ros, de la cual, se ha aislado la raza 4, merece atención (Hennessy et al. 2005).
Otro efecto del control cultural es la reducción de la tasa de desarrollo de la enfermedad (r). Al respecto, se reporta que es posible disminuir la germinación de los conidios, con la aplicación de fuentes de calcio (Ca) y de hierro (Fe), la modificación de la temperatura del suelo, el contenido de agua y pH (Peng et al. 1999) y se puede evitar la penetración del hongo, a través de las raíces, mediante fertilización a base de amonio (NH4), como se ha demostrado in vitro y en cultivos hidropónicos (Zhang et al. 2013a).
Control biológico. Debido al uso inadecuado de fungicidas y la capacidad del patógeno de adquirir resistencia a estos, el control biológico toma vigencia en los programas de MIE (Fravel et al. 2003) y su efecto se refleja sobre el inóculo inicial (X 0 ) y la tasa de desarrollo de la enfermedad (r). La literatura científica indica a los suelos portadores de aislamientos no patogénicos de Fusarium spp. o pertenecientes a otra forma especial, actuando como supresivos a cepas patogénicas (Amir & Alabouvette, 1993), estableciendo competencia por carbono (Fravel et al. 2003), nutrientes, sitios de infección o inducción de resistencia sistémica (Forsyth et al. 2006); efectos similares a los inducidos por bacterias promotoras del crecimiento vegetal (Lian et al. 2008; Fishal et al. 2010) y cepas no patogénicas de Bacillus y Pseudomonas (Saravanan et al. 2003; Lian et al. 2008; Thangavelu & Jayanthi, 2009; Fishal et al. 2010). De igual manera, los compuestos volátiles de hongos endófitos aislados de Musa spp. han mostrado un efecto inhibitorio altamente significativo sobre Foc R4 (Ting et al. 2010).
Respecto a la resistencia inducida y aunque se conocen efectos de activación enzimática por el metil jasmonato sobre plántulas de banano inoculadas con Foc RT4 (Sun et al. 2011), aún se considera que no están bien dilucidados los mecanismos, por los cuales, el jasmonato contribuye en la reducción de la enfermedad (Shirani & Sijun, 2018). En el mismo sentido, el ácido salicílico ha demostrado tener un papel importante en inducir resistencia en plantas de banano a Foc RT4 (Wang et al. 2014) y en plantas de Cavendish inoculadas con Foc R1; se ha observado, la acumulación endógena de esta última hormona vegetal y la activación de la expresión génica de la misma, mejorando la resistencia a Foc RT4 (Wu et al. 2013).
Referente a otros microorganismos, se ha documentado que B. subtilis inhibe el crecimiento micelial, coloniza los tejidos de la planta, disminuye la decoloración vascular y la incidencia de la enfermedad (Sun et al. 2011); asimismo, Wang et al. (2013) comprobaron que la combinación de B. amyloliquefaciens W19 y compuestos orgánicos, además de disminuir la incidencia de la marchitez, proporcionan nutrientes a las plantas de banano, resultados que se interpretan, desde el punto de vista epidemiológico, como una reducción en la tasa de desarrollo (r) del mal de Panamá, efecto que también ha sido demostrado con las bacterias biocontroladoras y biofertilizantes Burkholderia sp. y Herbaspirillum sp. (Weber et al. 2007); Gamma-proteobacterias (Köberl et al. 2017); con el hongo micorrízico arbuscular Gigaspora margarita (Borges et al. 2007); con Trichoderma harzianum y Glomus mosseae (Mohandas et al. 2010).
Estudios que muestran efecto sobre el inoculo inicial (X0) y que involucren el uso de organismos vivos, reportan a Serratia marcescens como inductora de producción de enzimas involucradas en la defensa de las plantas de banano, suprimiendo la incidencia de la enfermedad (Ting et al. 2010) y Streptomyces griseus afectando el desarrollo de Foc R4, al inducir la generación de hifas distorsionadas y protuberantes, inhibiendo la formación de esporas y degradando la pared celular del hongo (Zacky & Ting, 2013).
Getha & Vikineswary (2002) demostraron que Streptomyces violaceusniger G10 inhibe el crecimiento micelial, distorsiona, induce ramificación excesiva, causa lisis en los extremos de las hifas e impide la germinación de los conidios; efectos similares a los observados por Thangavelu & Gopi (2015), con las bacterias endofíticas Pseudomonas putida, Achromobacter sp., Rhizobium sp., Ochromobactrum sp. y Bacillus flexus Tvpr1, que inhiben la germinación de los conidios y el crecimiento micelial del hongo; igualmente, se ha demostrado que el quitosano inhibe el crecimiento micelial, esporulación y germinación del hongo (Al-hetar et al. 2011).
Es obvio el efecto de los microorganismos benéficos sobre las cepas patogénicas, pero también es claro que cada uno de los resultados deben ser validados bajo las condiciones propias del cultivo, donde se identifiquen los organismos endófitos o rizosféricos y que, potencialmente, causen los mismos efectos reportados; además, existe el desafío de producirlos masivamente, considerando que son organismos vivos, que pueden cambiar su biología bajo condiciones adversas, de modo que, para garantizar su efectividad y su patogenicidad, se requiere de muchos años de investigación.
Control químico. Los fungicidas químicos afectan directamente la tasa de desarrollo de la enfermedad (r) y han sido la estrategia más ampliamente usada para el control de enfermedades, por la facilidad en su uso, la consecución y por la rapidez con que se observan los resultados, pero no es nueva la preocupación que causa el uso inadecuado e indiscriminado que se les ha dado, sobre aspectos, como la salud humana, la vida silvestre y el ambiente, esto agregado a las mutaciones y la resistencia que ha adquirido el hongo a los fungicidas (Ramu et al. 2016) y sus efectos genotóxicos, sobre algunas especies de plantas (Dane & Dalgic, 2005).
Aunque Lakshmanan et al. (1987) demostraron que el fungicida carbendazim al 2%, inyectado en los rizomas de banano es eficiente, el resultado puede no ser el mismo en otros países, lo que pone de manifiesto la imposibilidad, en muchos casos, de la aplicabilidad explicita de los resultados, que están en ocasiones condicionados a particularidades del clima, de la cepa patogénica o a las variedades cultivadas. Otros estudios realizados por Nel et al. (2007), concluyeron que procloraz, propiconazole, benomil y los fungicidas inhibidores de la demetilación, además de reducir la incidencia de la enfermedad y el crecimiento del hongo, aumentan los rendimientos del cultivo.
Fungicidas botánicos. Extractos de plantas medicinales, como pimienta común (Piper betle L.) (Gnanasekaran et al. 2015) y neem (Azadirachta indica A. Juss.), tienen actividad antifúngica sobre F. oxysporum f. sp. cubense (Mengane & Kamble, 2014); asimismo, los aceites esenciales de clavos Eugenia aromatica (L.) Baill. y Syzygium aromaticum (L.) Merr. & L.M.Perry (L.), de canela (Cinnamomum zeylanicum Blume.), de hojas de Zimmu (Allium cepa L. x Allium sativum L.) y de puerro chino tienen efecto inhibitorio sobre el crecimiento micelial y germinación de conidios, incluyendo a la raza 4 (Monteiro et al. 2013; Gopi & Thangavelu, 2014; Zuo et al. 2015; Villa et al. 2015;Juniawan et al. 2016).
Transformación genética. Este mecanismo parece ser el más eficiente y promisorio para mejorar la resistencia o tolerancia a enfermedades de plantas (Shirani & Sijun, 2018); para ello, se han empleado diferentes técnicas, como el bombardeo de partículas o transformación de genes intervenidos por Agrobacterium tumefasciens (Ghag et al. 2014; Subramanyam et al. 2011), el uso de parámetros bioquímicos (Subramaniam et al. 2006) y la proteómica, con la cual, se han logrado identificar la expresión de proteínas reguladoras, luego de inoculaciones con Foc RT4 (Li et al. 2013).
Estas investigaciones aún siguen siendo exploratorias y no se han probado bajo condiciones de campo. En este último caso, existen algunos reportes con resultados promisorios (Pei et al. 2005), como los obtenidos por Dale et al. (2017), quienes probaron en campo qué materiales transgénicos de Cavendish mostraron resistencia a Foc RT4, conservándose libres de la enfermedad por un periodo de tres años; sin embargo, no se sabe de materiales de este tipo comercialmente disponibles (Shirani & Sijun, 2018).
Prácticas de manejo integrado. No son muy comunes los estudios donde se combinen diferentes estrategias de manejo del mal de Panamá; no obstante, se destacan resultados importantes, como el de Akila et al. (2011), con la mezcla de extractos metanólicos de hojas de trompeta del diablo (Datura metel L.), con cepas de Pseudomonas fluorescens y Bacillus subtilis, cuya combinación tiene un efecto sinérgico sobre la reducción de la incidencia de la enfermedad; lo mismo que la incorporación al suelo de residuos de maíz o de arroz en combinación con la inundación o saturación de agua, que inactivan a F. oxysporum f. sp. cubense (Wen et al. 2015). Asimismo, la aplicación conjunta de fertilizantes, a base de compost maduro y Bacillus amyloliquefaciens NJN-6, con efecto supresivo del mal de Panamá (Shen et al. 2013), efectos similares a los obtenidos con la mezcla de estiércol de cerdo y Bacillus subtilis N11, (Zhang et al. 2014a) o Bacillus amyloliquefaciens W19 (Wang et al. 2016).
Otra alternativa es la suplementación de la fertilización con silicio (Si), solo o con cáscaras de macadamia y cepas no patogénicas del hongo, para disminuir la incidencia del mal de Panamá (Kidane & Laing, 2010; Fortunato et al. 2012), resultado que también se ha obtenido con la integración de un agente de biocontrol, como las bacterias promotoras de crecimiento vegetal y una enmienda orgánica, como lo demostraron Zhang et al. (2014b), al mezclar compost con Paenibacillus polymyxa SQR-21, Trichoderma harzianum T37, Bacillus amyloliquefaciens N6 y Bacillus subtilis N11.
CONCLUSIONES Y RECOMENDACIONES
La identificación de métodos y de microorganismos que provean diferentes niveles de control de F. oxysporum f. sp. cubense, se requieren para afrontar los ataques del hongo. La efectividad de las prácticas mencionadas en esta revisión (Tabla 1), representa un desafío para productores, fitopatólogos y fitomejoradores; por consiguiente, la tendencia de los estudios in vitro e in situ, aunque de gran relevancia, se deben validar bajo condiciones de campo, a través del tiempo y espacio, concordantes con las características de los materiales comerciales; considerando la larga supervivencia del hongo en el suelo, la susceptibilidad de los cultivares de banano y la ausencia de la integración de medidas efectivas para su control, quedando claro que el desarrollo de genotipos con resistencia genética, preferiblemente poligénica, es la prioridad inmediata para afrontar a este patógeno.
Tabla 1 Efecto epidemiológico de las principales prácticas de manejo del mal de Panamá, causado F. oxysporum f. sp. cubense.
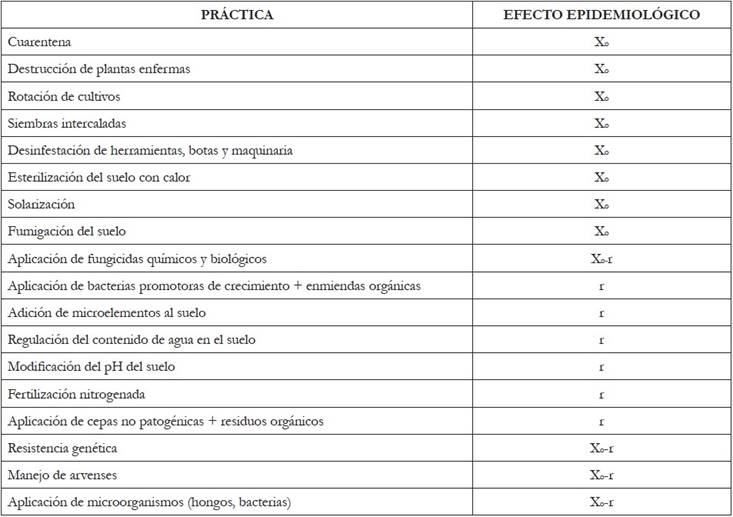
Xo = Inóculo inicial; Xo-r = Inóculo inicial y tasa de desarrollo de la enfermedad
Considerando que las poblaciones de Foc entre regiones pueden variar, se requiere caracterizar la diversidad genética del hongo entre cultivares y entre regiones del país, con lo cual, se beneficiarán los programas de fitomejoramiento, al tener un conocimiento más amplio de su biología.
La coordinación y la cooperación entre instituciones gubernamentales y de investigación es primordial, para establecer los protocolos necesarios para una oportuna y correcta detección del hongo, incluyendo, a la raza presente.














