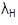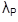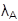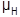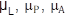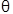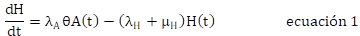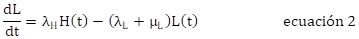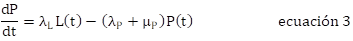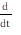INTRODUCCIÓN
El mosquito Aedes (Stegomyia) aegypti (Linnaeus, 1762) (Diptera: Culicidae) es el principal vector de arbovirus importantes, como el dengue, el chicunguña y el Zika (Souza-Neto et al. 2019). Ante la ausencia de vacunas eficaces para cada uno de estos arbovirus, la disminución del tamaño poblacional del vector utilizando insecticidas, se convierte en alternativa eficaz para disminuir el impacto de estas enfermedades (Bardach et al. 2019; WHO, 2013). En Colombia, las estrategias de control para el vector están dirigidas a la participación comunitaria, la eliminación de potenciales criaderos, el uso de agentes biológicos, como copépodos, peces larvívoros y el uso de productos de síntesis química, principalmente organofosforados (OP) y piretroides (PY) (MinSalud et al. 2011). En casos de epidemia, a gran escala, son utilizados insecticidas OP, desde 1970 y PY, desde 1990 (Aguirre-Obando et al. 2015), para interrumpir el ciclo epidemiológico del vector; no obstante, el uso continuo de OP y PY ha seleccionado poblaciones resistentes en Colombia (Aponte et al. 2019) y en el mundo (Smith et al. 2016). Lo anterior dificulta los programas de control y abre la necesidad de buscar alternativas para disminuir la presión selectiva efectuada en las poblaciones del vector.
Una alternativa contemplada, a nivel mundial, así como en el plan de control vectorial del dengue en Colombia para disminuir la presión de selección por OP y PY, es la utilización del larvicida microbiológico Bacillus thuringiensis var. israelensis (Bti) (Bravo et al. 2013; Land et al. 2019; Lacey, 2007). El Bt, un microorganismo cosmopolita, es una bacteria entomopatógena Gram + proveniente del suelo, con variedades aisladas de agua, insectos plaga, granos almacenados, entre otros, que se caracteriza por la producción de cristales de proteínas, conocidas como δ-endotoxinas o proteínas Cry, denominadas Cry y Cyt. Este tipo de proteínas son las responsables de las propiedades entomocidas del Bti (Boyce et al. 2013). El modo de acción del Bti incluye la ingestión de los cristales por las larvas, su solubilización en el intestino medio y la liberación de las protoxinas, que se convierten proteolíticamente en toxinas. Posteriormente, estas toxinas activadas interactúan con los receptores del intestino medio, se insertan en las membranas provocando la formación de poros, que conducen a la permeabilidad celular y lisis osmóticas, que dañan el epitelio y generando, como resultado, la muerte del individuo (Vachon et al. 2012).
El uso de Bti, en su forma comercial, a lo largo del mundo en el control de larvas de mosquitos vectores, incluyendo A. aegypti, no muestra efectos adversos en otros artrópodos, aves, peces o mamíferos, incluyendo al hombre, organismos que podrían estar asociados a hábitats donde se desarrollan los mosquitos. Estos resultados muestran la posibilidad de reducir poblaciones vectores de enfermedades, con un bajo impacto ambiental (IRAC, 2019).
Por otro lado, las toxinas Cry (Cry4Aa, Cry4Ba, Cry10Aa, Cry11Aa, Cry11Ba y Cry30) y Cyt (Cyt1Aa y Cyt2Ba) extraídas del Bti, se emplean para el control de larvas de A. aegypti, así como para estadios inmaduros de otros géneros vectores de enfermedades, como Anopheles, Culex y Aedes (Soares-da-Silva et al. 2015); no obstante, la aplicación de Bti en el control del mosquito vector del dengue, el chicunguña y el Zika, a nivel mundial, no es frecuente, probablemente, debido a los problemas inherentes a su uso, tasa de ingestión, edad y densidad de las larvas, temperatura, radiación solar, costos, entre otras (Land et al. 2019). Adicionalmente, estudios en campo y laboratorio en poblaciones del género Aedes utilizando Bti, no muestran el desarrollo de resistencia, incluso, después de 36 años de uso continuo y más de 5.000 toneladas de este producto, en 400mil ha (Becker et al. 2018; da Silva et al. 2018). Particularmente en Colombia, los trabajos de campo y laboratorio realizados por Kroeger et al. (1995), Armengol et al. (2006), Ocampo et al. (2009), Gómez-Vargas et al. (2018) y Paz et al. (2019), muestran que la aplicación de Bti puede ser considerada como una estrategia viable, utilizable en los programas de control vectorial.
Una de las prioridades en los programas es establecer el perfil de susceptibilidad de los productos usados para el control de vectores, como por ejemplo, el Bti, en condiciones de laboratorio y extrapolar su uso al campo (MinSalud et al. 2011). Una vez conocido este perfil, es importante conocer la frecuencia y el tiempo de uso convenientes para un control eficaz. Una aproximación a este abordaje es el empleo de modelos matemáticos, los cuales, permiten hacer predicciones del comportamiento a corto, mediano y largo plazo, sin necesidad de trabajo experimental (Momo & Capurro, 2006). Así, el uso de datos obtenidos en campo o laboratorio, particularmente las concentraciones letales 50 y 95 del producto de interés, que posteriormente son incorporados a modelos matemáticos, permiten simular el uso de estas concentraciones en tiempos específicos (Meredith et al. 2019), por tanto, diseñar estrategias de control del mosquito A. aegypti y así prevenir el dengue, el chicunguña y el Zika.
Actualmente, los modelos matemáticos son ampliamente utilizados en las ciencias aplicadas; por ejemplo, con modelos matemáticos orientados a artrópodos vectores de enfermedades, se puede evaluar la efectividad de las acciones de control vectorial (McAuley et al. 2015). Esto, a pesar de sus limitaciones, entre las cuales, están la dificultad en la estimación de los parámetros que, por diversos factores, no siempre están disponibles; el error en la solución numérica y, por tanto, en las aproximaciones de los valores de las variables de estado y la simplificación del modelo eliminando términos, variables o parámetros, para hacer su solución más sencilla.
Estudios anteriores basados en modelos matemáticos presentan predicciones de la acción de insecticidas sobre el control del vector del dengue (Carvalho et al. 2019). Particularmente, Duque et al. (2006) realizaron simulaciones a 12 meses, utilizando una aplicación de Bti considerando tres temperaturas (20, 25, 30°C), encontrando que los mayores picos de la población de mosquitos se alcanzan rápidamente a altas temperaturas; sin embargo, este modelo no consideró aplicaciones sucesivas de Bti.
Esta investigación tiene como objetivo determinar la efectividad del uso del Bti para el control vectorial de A. aegypti. Para ello, se determinó experimentalmente la susceptibilidad de larvas de A. aegypti a Bti y, utilizando las dosis letales 50 y 95 (CL50 y CL95) obtenidas, se simuló el comportamiento poblacional del vector, a partir de un modelo matemático, usando aplicaciones sucesivas de Bti, en diferentes escenarios.
MATERIALES Y MÉTODOS
Se colectaron 1.970 larvas de A. aegypti (NL = Número de larvas) de cuatro localidades de la ciudad de Armenia (Quindío, Colombia), donde, históricamente, se han reportado casos de dengue. Ancianato del Carmen (NL = 430; 4°31’37’’N, 75°42′38”O), barrio Berlín (NL = 490; 4°32’1’’N, 75°40’47’’O), Ciudadela La Patria (NL = 550; 4°32’22’’N, 75°42’8’’O) y Terminal de Transportes (NL = 500; 4°31’38’’N, 75°41’2’’O). Las colectas, se realizaron siguiendo la metodología descrita en WHO (1981), para determinar índices de infestación en A. aegypti. De cada localidad, se colectaron aleatoriamente larvas de mosquitos de 10 diferentes tanques de almacenamiento de agua, ubicados en viviendas seleccionadas. Estos tanques estaban separados entre sí, por al menos 100m. Las larvas de cada localidad fueron llevadas al laboratorio y mantenidas bajo condiciones controladas (temperatura 25 ± 1°C, humedad 80 ± 10% y fotoperiodo 12 horas), hasta la emergencia de los adultos. Una vez emergidos y siguiendo la clave taxonómica descrita en Forattini (2002), fueron seleccionados todos los ejemplares de A. aegypti. Para cada punto de colecta, las larvas de la generación F1 fueron utilizadas como material para determinar, en bioensayos dosis-respuesta, el estado de susceptibilidad de las poblaciones, siguiendo la metodología de la OMS (WHO, 1981). Larvas de A. aegypti, tercero o cuarto instar inicial, fueron sometidas a pruebas de sensibilidad con Bti, utilizando el producto líquido Bt-horus ® SC 1,200UIT/mg, para determinar la mortalidad larval entre el 5 - 95%.
Se utilizaron dos grupos control, un control interno por localidad, donde no se usó Bti y otro de referencia para las cuatro localidades, conformada por la cepa Rockefeller; cepa susceptible a insecticidas de A. aegypti (CDC), suministrada por el Centro de Investigaciones Tropicales (Cintrop) de la Universidad Industrial de Santander. Este grupo de individuos, al igual que cada población de A. aegypti colectada fue sometida a diferentes concentraciones de Bti. Para cada concentración, se evaluaron cuatro réplicas de 20 larvas. La mortalidad larval fue cuantificada después de 24h de exposición. Todos los bioensayos fueron repetidos cuatro veces.
Los datos de mortalidad, expresados en número de individuos muertos por dosis, fueron utilizados para calcular las concentraciones letales 50 y 95 (CL50 y CL95) y analizados, a través del método log-probit, de Finney (1971), utilizando el programa Probit, de Raymond (1993). Con las CL50 y CL95 obtenidas para cada localidad, se calculó el factor de resistencia 50% (FR50) y 95% (FR95), determinando la razones entre las CL 50 y 95, correspondientes a la cepa evaluada y a la cepa susceptible de referencia Rockefeller; FR95 < 3,0, indicará susceptibilidad de las poblaciones, mientras que FR95 > 3,0, cambio de insecticida por otro con diferente mecanismo de acción (Saúde, 2006). Adicionalmente, se realizó un nuevo análisis para estimar el perfil de susceptibilidad del municipio de Armenia (Armenia, nombre asignado en los resultados), en el cual, se colectó el material de análisis; para esto, fueron estimadas nuevamente las CL50 y CL95, utilizando los datos de mortalidad de todas las localidades evaluadas, así como las FR50 y FR95.
El modelo aplicado en este trabajo es una adaptación de un modelo estructurado en edad, que usó los resultados obtenidos experimentalmente de CL50 y CL95 para el Bti (Edelstein-Keshet, 1988). No se tuvieron en cuenta parámetros ambientales. Se consideraron 4 estadios para A. aegypti: Huevo, larva (incluye desde el primero hasta el cuarto instar), pupa y adulto. Las variables H(t), L(t), P(t) y A(t) representan el número de individuos en el tiempo t (medido en días), en los estadios huevo, larva, pupa y adulto, respectivamente. A través de cada estadio, las tasas vitales se asumieron constantes.
Los parámetros utilizados en el modelo matemático fueron:
El sistema en ecuaciones diferenciales que interpreta la dinámica poblacional es:
La ecuación 1 corresponde al comportamiento de la población de huevos, el cambio en el tiempo es ocasionado por la oviposición de adultos hembra ( λ A θ) y la tasa de transición de huevos a larva ( λ H ) y muerte ( μ H ). Las ecuaciones 2, 3, y 4 representan los cambios de las poblaciones en el tiempo de larvas, pupas y adultos, respectivamente, con entrada ocasionada por la transición de individuos de la etapa anterior (λ) y salida por muerte (μ) y transición a la etapa posterior.
Se obtuvo la solución numérica del sistema usando el método de Runge-Kutta de orden 4 (Burden & Faires, 2005) implementado en ambiente MATLAB® (MathWorks, 2012). Este método proporciona, de manera explícita, soluciones a problemas de valor inicial de primer orden, como el propuesto aquí, con error local de truncamiento de orden 4, el cual, permite prescindir del cálculo y evaluación de las derivadas y, además, efectúa 4 evaluaciones por paso, para dar respuestas más exactas y obtener una mayor precisión.
Usando esta solución numérica, se simuló la dinámica poblacional del vector del dengue, suponiendo la no aplicación de larvicida, así como aplicaciones sucesivas de Bti de las CL50 y CL95, cada 30 y cada 60 días, durante 1 y 5 años. En todas las simulaciones, las poblaciones iniciales fueron de 10 individuos en cada estadio. Los parámetros biológicos utilizados en las simulaciones se encuentran consignados en la tabla 1. Estos parámetros fueron estimados a partir de los datos proporcionados en Bar-Zeev (1958), Li, et al. (1985), Manrique et al. (1998) y Rebêlo et al. (1999).
Tabla 1 Parámetros biológicos de poblaciones naturales de A. aegypti utilizados en las simulaciones computacionales.

* Estos valores fueron estimados a partir de datos tomados de Li et al. (1985), Manrique et al. (1998) y Rebêlo et al. (1999).
RESULTADOS Y DISCUSIÓN
Cuando las poblaciones de A. aegypti fueron analizadas por localidad, el FR95 presentó variaciones entre 1,0 (Ancianato del Carmen, Ciudadela La Patria y el Terminal de Transportes) y 1,1 (Barrio Berlín); sin embargo, cuando las poblaciones del vector del dengue fueron evaluadas como una unidad única (Armenia), el FR95 fue de 1,0 (Tabla 2).
Tabla 2 Perfil de susceptibilidad al Bti de poblaciones colombianas de A. aegypti, se muestra las medias (desviación estándar), para la pendiente de la recta, CL y FR. Adicionalmente, se presenta el perfil de susceptibilidad para la ciudad de Armenia, que se obtuvo a partir de los datos de mortalidad de todas las localidades analizadas.
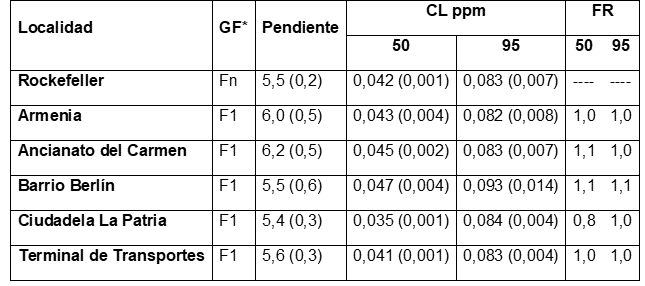
*GF = Generación filial
Por su parte, los bioensayos dosis-respuesta por localidad, indican variaciones en la CL50 entre 0,035 (Ciudadela La Patria) y 0,047ppm (Barrio Berlín) y en la CL95 entre 0,083 (Ancianato del Carmen) y 0,093ppm (Barrio Berlín), mientras que, cuando se estimaron las CL50 y CL95 para Armenia, fueron de 0,045 (CL50) y 0,083ppm (CL95). Si se comparan los valores de las CL50 y CL95 de las poblaciones de campo y la cepa de referencia Rockefeller, estos presentan la misma respuesta biológica (Tabla 2). Este patrón, también se visualiza gráficamente, a través de la pendiente de la recta de las poblaciones evaluadas y la cepa de referencia Rockefeller (Figura 1).
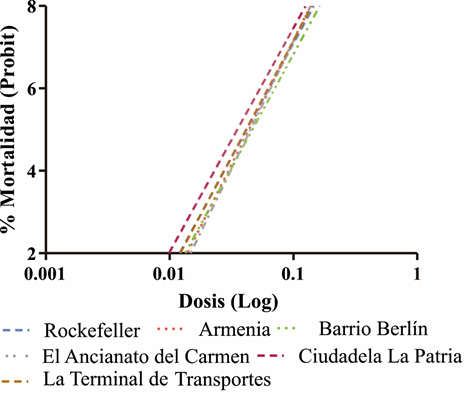
Figura 1 Líneas de mortalidad Log-Dosis para la generación F1 de algunas poblaciones naturales de A. aegypti de Colombia, susceptibles al Bti. La cepa de referencia Rockefeller fue incluida como población control.
Algunos ensayos numéricos obtenidos a partir del modelo, se muestran en las figuras 2, 3 y 4. La figura 2 indica el comportamiento de las poblaciones del vector sin la aplicación del larvicida, corresponde a la solución numérica del modelo y constituye un comportamiento de referencia. Por otra parte, los ensayos numéricos a corto (30 y 60 días), mediano (1 año) y largo plazo (5 años), con aplicaciones de las CL50 y CL95, muestran, en todos los casos, que la aplicación del Bti lleva a la disminución de las poblaciones del vector; sin embargo, la diferencia fundamental es el tiempo necesario para llegar a niveles aceptablemente bajos. Se muestran aquí algunos resultados representativos, que dan cuenta del comportamiento de las poblaciones del vector bajo el control sostenido en el tiempo, utilizando Bti (Figuras 3 y 4).

Figura 3 Comportamiento de poblaciones de A. aegypti frente a aplicaciones sucesivas de la dosis letal 50 del larvicida Bti: a. Cada 30 días, durante 1 año; b. Cada 60 días, durante 1 año; c. Cada 30 días, durante 5 años; d. Cada 60 días, durante 5 años.
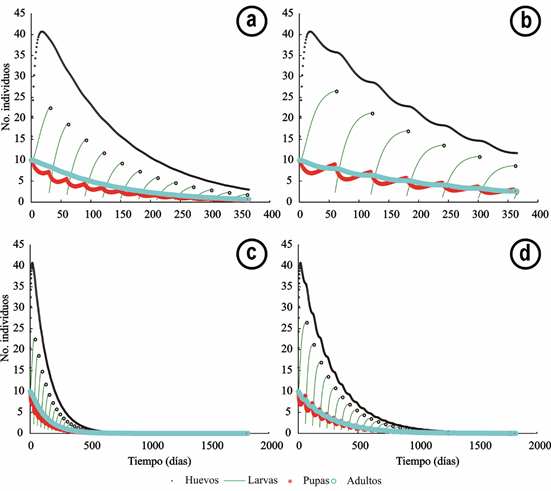
Figura 4 Comportamiento de poblaciones de Aedes aegypti frente a aplicaciones sucesivas de la dosis letal 95 del larvicida Bti: a. Cada 30 días, durante 1 año; b. Cada 60 días, durante 1 año; c. Cada 30 días, durante 5 años; d. Cada 60 días, durante 5 años.
La figura 3 muestra el comportamiento de las poblaciones de A. aegypti frente a aplicaciones periódicas sucesivas de la CL50. Las figuras 3a y 3b corresponden a aplicaciones cada 30 y cada 60 días, respectivamente, durante 1 año. Las figuras 3c y 3d corresponden a aplicaciones realizadas cada 30 y cada 60 días, respectivamente, durante 5 años. Se observa que el control sostenido de las larvas consigue mantener niveles bajos de las poblaciones del vector; sin embargo, se evidencia mayor efectividad con intervalos de aplicación de 30 días.
En la figura 4, se observa la dinámica poblacional de A. aegypti frente a aplicaciones periódicas sucesivas de la CL95. Las figuras 4a y 4b corresponden a aplicaciones realizadas cada 30 y cada 60 días, respectivamente, durante un año. Las figuras 4c y 4d corresponden a aplicaciones cada 30 y cada 60 días, respectivamente, durante 5 años. También, aquí se observa que la presión sobre las larvas consigue mantener niveles bajos del vector y se evidencia mayor efectividad con intervalos de aplicación de 30 días. Además, comparado con el comportamiento de la CL50 mostrado en la figura 2, se evidencia la mayor efectividad de la CL95; por ejemplo, mientras que la primera lleva a recuperar el nivel inicial de 10 huevos en 450 días, aproximadamente, la segunda lo recupera en 200 días, aproximadamente, es decir, menos de la mitad del tiempo.
Los resultados aquí consignados indican susceptibilidad de las poblaciones de A. aegypti frente al larvicida Bti. Estos resultados son similares a los encontrados en poblaciones del género Aedes de diferentes países que, después de varios años de ser controladas con Bti, no han desarrollado resistencia (Becker et al. 2018; Land et al. 2019). Una revisión sobre los métodos de control vectorial implementados en las poblaciones del género Aedes en Europa, por ejemplo, muestra al Bti como un producto vigente y eficaz para controlar estadios larvales (Baldacchino et al. 2015).
Según Elleuch et al. (2015), la presencia en el Bti de toxinas Cyt, retrasa o impide el desarrollo de resistencia a las toxinas Cry; no obstante, estudios de presión de selección en A. aegypti utilizando la toxina Cry11Aa, una de las cuatro toxinas Cry que componen el Bti, han mostrado un aumento en la CL50 (F1, CL50 = 0,0263ppm), después de 54 generaciones (F54, CL50 = 0,3456ppm) (Cadavid-Restrepo et al. 2012). Similares resultados fueron registrados por Jahan & Shahid (2012), al exponer larvas de A. aegypti a concentraciones entre 1,25 y 100ppm por 60 minutos de Bti WDG, presentación de Bti utilizada en Pakistán. En ambos casos, estos cambios no impactan negativamente el uso del Bti como larvicida.
Los valores obtenidos para la CL50 estuvieron entre 0,035 y 0,047ppm y para CL95 entre 0,083 y 0,093ppm. Estos concuerdan con otros estudios; Boudjelida et al. (2007) encontraron valores de CL50 entre 0,002 a 0,3ppm. También, Araújo et al. (2007) y Aguilar-Meza et al. (2010), realizando bioensayos en laboratorio y posteriormente en campo con poblaciones de A. aegypti de Brasil, Francia y México, registraron CL50 entre 0,0015 y 0,26ppm. Respecto a la CL95, las concentraciones evaluadas aquí, fueron menores a las recientemente encontradas por Gómez-Vargas et al. (2018), quienes determinaron la efectividad de tabletas de Bti serotipo H14, Bti-CECIF, producido en Colombia, hallando valores entre 0,40 a 0,93ppm.
Lo anterior corrobora la viabilidad del uso de Bti en los programas de control vectorial de Colombia, donde se utilizan tres larvicidas: el Bti, el triflumurón (inhibidor de la síntesis de quitina en insectos) y el OP temephos (MinSalud et al. 2011), donde la resistencia está ampliamente diseminada (Grisales et al. 2013), lo que enfatiza, aún más, el uso del Bti. No obstante, los problemas inherentes al uso del Bti en campo, como tasa de ingestión, edad y densidad de las larvas, temperatura, radiación solar, entre otras, deben ser evaluados (Zhao et al. 2019).
De otro lado, después de establecer experimentalmente las CL50 y CL95, el modelo matemático que describe la dinámica del vector, permite evaluar estrategias de aplicación de Bti a corto, mediano y largo plazo. Se encontró que ambas dosis letales consiguen mantener las poblaciones del vector a bajos niveles, variando el tiempo necesario para conseguirlo; se disminuye, así, la posibilidad de transmitir los virus del dengue, el chicunguña o el Zika.
Los resultados aquí encontrados son importantes, ya que, una vez se presente un brote de las tres enfermedades, es prioritario conocer los alcances de las estrategias de control vectorial a ser utilizadas. Por tanto, se sugiere que esta estrategia se utilice en los reservorios de agua urbanos, como tanques de agua, llantas usadas, entre otros; sin embargo, es prudente explorar el impacto en conjunto con las estrategias vectoriales dirigidas a los estados adultos del vector del dengue, como el uso de PY y el OP Malation, ya que es en este estadio donde se reproduce y, consecuentemente, aumenta su población.
En conclusión, el presente estudio sugiere que la aplicación de Bti sostenida a través del tiempo constituye un componente adecuado para el manejo de poblaciones larvales de A. aegypti, en la ciudad de Armenia.