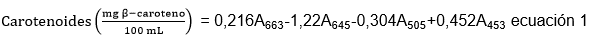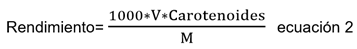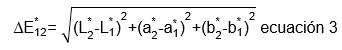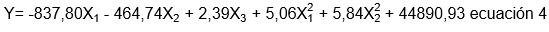INTRODUCCIÓN
El maracuyá (Passiflora edulis f. flavicarpa) es un fruto tropical originario de Sudamérica, cuyos principales países productores son Brasil, Perú, Colombia, Zimbabue y Kenia (Wijeratnam, 2016); sin embargo, la producción está enfocada, básicamente, en la utilización de la pulpa y como la corteza representa entre el 50 y 55% de la masa total del fruto (Kulkarni & Vijayanand, 2010), se identifica la necesidad de estudiar alternativas de aprovechamiento de este subproducto que, en la mayoría de casos, es desechado.
Se ha encontrado que la corteza de maracuyá es buena fuente de fibra y antioxidantes (Betim Cazarin et al. 2014), de la cual, se han realizado estudios, como la trituración de la corteza, formando una harina que se puede incorporar en la fermentación de yogures (do Espírito Santo et al. 2012); desarrollo y caracterización de películas flexibles, a partir de almidón de mesocarpio de maracuyá con nanopartículas (Nascimento et al. 2012); obtención de potenciador de aromas, a partir de residuos de maracuyá (Leão et al. 2014); extracción de pectinas (de Oliveira et al. 2015) y su uso como alimento probiótico (Santos et al. 2017). Adicionalmente, en la corteza se reporta un contenido de carotenoides de hasta 4,85mg β-caroteno/100g corteza seca (Hernández-Santos et al. 2015), destacándose el contenido de β-caroteno y luteína (dos Reis et al. 2018), convirtiéndola en una materia prima con potencial para la obtención de ese tipo de compuestos.
Los carotenoides son pigmentos naturales sintetizados por plantas, algas y bacterias fotosintéticas, atribuyéndoseles numerosas propiedades terapéuticas contra enfermedades, como el cáncer de hígado (Kim & Park, 2018), la degeneración macular (Wu et al. 2015) e, inclusive, la tuberculosis (Aibana et al. 2017). Además, el color de los carotenoides oscila entre el amarillo y el naranja (Sigurdson et al. 2017), lo que los constituye en una alternativa innovadora frente al uso de colorantes sintéticos, como la tartrazina o el amarillo crepúsculo.
La tartrazina es un colorante alimenticio sintético aprobado por la unión europea (E 102) y la FDA (Yellow # 5) que, junto a otros aditivos, como el rojo allura, el azul brillante y el amarillo crepúsculo, representan el 90% de los colorantes utilizados en alimentos, para el consumo infantil (Batada & Jacobson, 2016); adicionalmente, estudios reportan que el consumo de tartrazina puede afectar la conducta de dicha población (McCann et al. 2007). Asimismo, se han realizado estudios con ratas, donde se reporta que, al nivel de la ingesta diaria admisible, se presentan alteraciones de los marcadores bioquímicos del tejido cerebral (Bhatt et al. 2018). Por lo anterior, los consumidores han dirigido su atención a la utilización de aditivos alimentarios seguros, incentivando el uso de colorantes naturales que, además de mejorar las cualidades organolépticas, son capaces de dar valor agregado y no representar peligros para la salud.
Para obtener colorantes, como los carotenoides, diversos autores han utilizado materias primas, como la zanahoria, la corteza de mango y los residuos de melón, donde se emplean técnicas de extracción, como la extracción asistida por ultrasonidos (Benmeziane et al. 2018), la extracción con fluidos supercríticos (de Andrade et al. 2018; Sánchez-Camargo et al. 2019) y la extracción asistida por microondas (Elik et al. 2020); no obstante, aunque se identificó la presencia de carotenoides en corteza de maracuyá (dos Reis et al. 2018; Hernández-Santos et al. 2015), no existen estudios que exploren la extracción de tales compuestos, a partir de esta materia prima.
En resumen, la necesidad de diversificar el mercado del maracuyá y su potencial en carotenoides podría hacer de la corteza una materia prima valiosa, para la obtención de colorantes de vanguardia. Por consiguiente, el objetivo de este proyecto fue comparar tres técnicas de extracción de carotenoides, a partir de la corteza de maracuyá, evaluar los factores de concentración de etanol, proporción solvente - materia prima y tiempo y determinar la diferencia de color del extracto respecto a una disolución de tartrazina.
MATERIALES Y MÉTODOS
Material vegetal: El material vegetal estuvo compuesto por 4kg de maracuyá (P. edulis f. flavicarpa), proporcionados por un proveedor local en Bogotá D.C., Colombia. Las frutas seleccionadas fueron lavadas (solución de 100ppm de hipoclorito de sodio, pH 6,5, durante 2min) (Tarazona-Díaz & Aguayo, 2013) y almacenadas bajo condiciones de refrigeración, a 8°C, durante 12 horas, en el laboratorio de la Universidad de Bogotá Jorge Tadeo Lozano (UJTL).
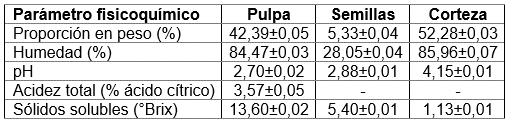
Caracterización fisicoquímica del material vegetal y estimación del estado de madurez: Se separaron cada una de las partes del fruto con las que se realizó la caracterización fisicoquímica inicial, donde se determinó: peso con una balanza de precisión (Explorer pro Ohaus, México); porcentaje de humedad, con una balanza de humedad (Mettler toledo HG43-s Halogen, Switzerland, Suiza); pH, con un pH-metro/ionómetro, con una precisión de pH relativo de ± 0,002 (SevenCompact™ S220, Switzerland, Suiza); sólidos solubles totales (°Brix), con un refractómetro (Atago Pocket Refractometer, Niigata, Japón) y acidez titulable, según AOAC (1995), expresada en términos de ácido cítrico. Para la determinación del estado de madurez, se compararon los resultados obtenidos en la pulpa con la literatura existente. Todas las determinaciones fueron realizadas por triplicado.
Tratamiento de las muestras: La corteza, se cortó manualmente en trozos de 4cm, aproximadamente, congelados posteriormente (-34°C, 24 horas) y liofilizados (22°C, 4300Pa, 8 días), hasta obtener un porcentaje de humedad de 4,6% (Liofilizador Drycol, Bogotá, Colombia). Luego, se realizó la etapa de molienda, en un molino de impacto de palas (Retsch sk-100, Hann, Alemania), con un tamiz de 0,75mm, en la descarga. Seguido de la deshidratación y del proceso de molienda, se procedió a la caracterización del tamaño de partícula, por medio del análisis granulométrico por tamizado, con mallas 40 (Do = 425 μm), 45 (Do = 355 μm), 60 (Do = 250 μm), 80 (Do = 180 μm), 100 (Do = 150 μm) y 120 (Do = 125μm), de la serie ASTM E-11. La muestra pulverizada fue empacada al vacío (Multivac Chamber Machine C200, Bremen, Alemania) y almacenada en un ambiente seco y oscuro, a temperatura ambiente (20 ± 2°C).
Obtención del extracto por tres métodos convencionales: Se realizaron tres métodos de extracción: inmersión, baño termostático y extracción soxhelt, en las condiciones reportadas por la bibliografía. El propósito fue determinar el método, mediante el cual, se obtiene el mayor rendimiento de extracción, medido en µg β-caroteno/100 g de muestra.
Método de inmersión: 5,0g de muestra se maceraron, con 30mL de etanol al 90%, acidificado con ácido cítrico al 0,03% (en relación 1:6); la inmersión, se realizó durante 2h, en un agitador a 500RPM (Ika, Staufen, Alemania) y en ausencia de luz. La temperatura de operación fue de 29°C, de acuerdo con lo planteado por Mojica et al. (2017).
Baño termostático: Fueron sumergidos 5,0g de muestra, con 200mL de etanol al 90%, acidificado con ácido cítrico al 0,03%; la temperatura del baño termostático fue de 60°C (Memmer, Alemania), durante 24h. El tiempo de extracción, se tomó de acuerdo con lo reportado por Khazaei et al. (2016), en ausencia de luz.
Extracción Soxhlet: Se ensambló el montaje soxhlet, con un balón de 250mL, sobre una plancha de calentamiento (Velp, Italia), utilizando una proporción de materia prima: solvente de 1:40 y un tiempo de 2h. En la parte superior del montaje, se utilizó agua de enfriamiento, a 18°C.
Luego de obtener el extracto por cada uno de los métodos fueron centrifugados, a 6000RPM, durante 15 minutos, para la cuantificación de carotenoides.
Determinación del rendimiento de extracción de carotenoides: Se siguió el protocolo descrito por Nagata & Yamashita (1992), que permitió realizar la determinación de carotenoides, a partir de la lectura de las absorbancias, en la muestra a 453, 505, 645 y 663nm, en el espectrofotómetro (Espectrofotómetros evolution 300 thermo scientific, Matlock, Inglaterra), haciendo uso de la ecuación 1.
Donde, Aα es la absorbancia dada a la longitud de onda α. La determinación de la concentración de carotenoides, se realizó por triplicado, expresándose como mg β-Caroteno/100mL. Seguido de ello, se estableció el rendimiento de extracción, de acuerdo con la ecuación 2.
Donde, M es la masa de la muestra sometida a la extracción (g) y V es el volumen del extracto (mL). La determinación del rendimiento fue el factor para la elección del mejor método de extracción de este estudio.
Efecto de la proporción materia prima: solvente, concentración de etanol y tiempo de operación en la extracción de carotenoides por método Soxhlet: Se llevó a cabo un diseño experimental factorial de 3 variables y dos niveles (23). Cada variable, se evaluó en los niveles especificados en la tabla 1 y cada condición, se realizó por triplicado, generándose un diseño central compuesto de 15 combinaciones, incluyendo una réplica en el punto central. La variable de respuesta fue el rendimiento de extracción de carotenoides (µg β-caroteno/100g muestra). Para evaluar el efecto de los factores estudiados, se utilizó la metodología de superficie de respuesta (Myers & Montgomery, 2002), ejecutando el programa de prueba Design-Expert 9,0,6 (Stat-Ease, Delaware, USA Echip, 2014).
La selección del modelo que mejor se ajustó a los datos experimentales, se realizó a partir de un análisis de varianza (p<0,05), donde se seleccionaron los términos, que en la prueba F-valor proporcionaron un valor p<0,05. A partir del modelo, se seleccionaron las mejores condiciones de extracción, de acuerdo con los límites establecidos para cada variable (Tabla 1).
Diferencia de color entre el extracto y una disolución de tartrazina: El extracto obtenido a partir de las mejores condiciones de extracción, se comparó con una disolución etanólica de tartrazina al 0,042%. La determinación de color, se efectuó por espectroscopía, de acuerdo con la metodología descrita por Juárez et al. (1997), por triplicado, usando, como blanco, agua desionizada y celdas UV de 1,5-3 mL de capacidad. A partir de ello, se determinó la diferencia de color (ecuación 3), según lo expuesto por Sahin & Summu (2009).
RESULTADOS Y DISCUSIÓN
Caracterización fisicoquímica del material vegetal y estimación del estado de madurez: En la tabla 2, se muestran los resultados obtenidos de la caracterización inicial de la materia prima. El pH de la pulpa es superior a lo reportado por Barbosa de Oliveira et al. (2017), para maracuyá, completamente maduro orgánico (2,43 ± 0,05) y convencional (2,34 ± 0,03). Adicionalmente, la acidez titulable, se asemeja a lo determinado por Vianna-Silva et al. (2010), para maracuyá, a los 63 días después de la antítesis (3,8% ácido cítrico) y para maracuyá completamente madura orgánica (3,99 ± 0,05% ácido cítrico) (Barbosa de Oliveira et al. 2017). Asimismo, los sólidos solubles totales son similares a lo estimado para maracuyá a 72 días después de la antítesis (12,9 °Brix) (Vianna-Silva et al. 2010), asemejándose a la maracuyá convencional, medianamente madura (13,13 ± 0,40°Brix) (Barbosa de Oliveira et al. 2017). Por consiguiente, a pesar de que no hay una norma técnica que estipule los estados de madurez del maracuyá, la comparación de los resultados con la literatura evidencia que la materia prima utilizada estaba en un estado de madurez avanzado.
Por otra parte, la proporción de los subproductos se asemeja a lo obtenido por Kulkarni & Vijayanand (2010), quienes caracterizaron el fruto de maracuyá con 13,0 ± 1,10% de semillas y 50,0 ± 1,06% de corteza, demostrando que la corteza corresponde a su principal componente. La semilla, aunque es el derivado minoritario y con menor contenido de agua, representa interés para la extracción de aceites (dos Reis et al. 2018).
El pH en la pulpa y la semilla fue inferior al de la corteza, mostrando un comportamiento similar a lo reportado para pulpa y corteza de gulupa (con pH de 2,77 ± 0,02 y 4,30 ± 0,10, respectivamente), por Herrera-Ramirez et al. (2019). Lo anterior puede indicar que la corteza contiene una menor cantidad de compuestos de carácter ácido, así como la posible presencia de compuestos tipo tampón en su matriz, en comparación con la pulpa y la semilla; no obstante, el pH de la pulpa y la semilla fue inferior a lo evidenciado por Santos et al. (2017), para pulpa de Passiflora cincinnata (3,20±0,01) y, según de Oliveira et al. (2015), para la corteza de maracuyá (5,00±0,02). Adicionalmente, la pulpa mostró la mayor cantidad de sólidos solubles, superando lo descrito por Santos et al. (2017), para P. cincinnata (11,00±0,00°Brix), mientras que la acidez obtenida en el presente estudio es menor a la reportada por Barbosa de Oliveira et al. (2017), para P. edulis S, bajo condiciones convencionales de cultivo (4,82±0,03% de ácido cítrico). Es importante resaltar que las diferencias evidenciadas entre el presente estudio y la literatura pueden ser explicadas por variables, como el cultivo, el lugar de siembra, el clima, el estado de madurez durante la recolección, el tamaño del fruto (Rodriguez-Amaya, 2012).
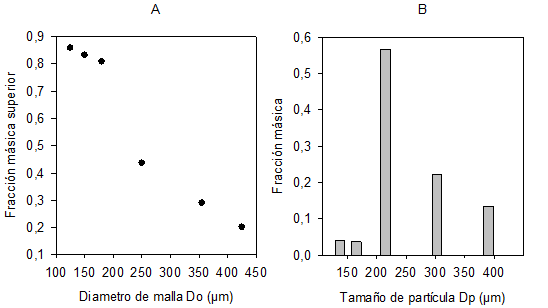
Tratamiento de muestras (liofilización, molienda y tamizado): En la etapa de liofilización, se removió el 94,69% de humedad en la corteza, reduciéndola desde 84,76% hasta 4,56%. De acuerdo con la figura 1a y 1b, la mayor parte de la muestra registró diámetros de partícula entre los 180 y 250µm, evidenciando que más del 50% de la muestra es de 215µm. A partir de lo anterior, se obtuvo un tamaño medio de partícula de 237µm (diámetro medio superficie-volumen). La determinación del tamaño de partícula de la materia prima es importante, debido a que, es posible que una mayor difusión de colorantes se presente, si el tamaño de grano disminuye (Brennan et al. 2006).
Fase de extracción y determinación del rendimiento: El rendimiento de extracción de carotenoides fue de 10,34 ± 5,18; 113,08 ± 8;84 y 1037,99 ± 48,70µg de β-Caroteno/100g, muestra para los tratamientos de baño termostático, inmersión y extracción soxhlet, respectivamente. La temperatura de extracción y el flujo del solvente en el montaje pueden ser factores de aumento del coeficiente de transferencia de masa, favoreciendo la lixiviación (Brennan et al. 2006), lo cual, hace que la extracción por método soxhlet sea la más efectiva, coincidiendo con lo afirmado por Saini & Keum (2018).
El resultado obtenido por el método soxhlet es inferior al determinado por Hernández-Santos et al. (2015), para corteza de maracuyá seca (4,86 mg β-caroteno/100g); sin embargo, supera lo encontrado por de Oliveira et al. (2014), para pulpa de maracuyá (entre 0,036-0,631mg carotenoides/100g de muestra liofilizada). Por otra parte, el contenido de carotenoides es inferior a lo extraído de otras materias primas reconocidas por su contenido de carotenoides, tales como, como la corteza de zanahoria liofilizada (205,6±16,4µg carotenoides/g de zanahoria liofilizada) (de Andrade et al. 2018); no obstante, a pesar de que el rendimiento de extracción de carotenoides en corteza de maracuyá fue menor al de la zanahoria, se evidenció que el subproducto del presente estudio tiene potencial para la obtención de carotenoides.
Efecto de la proporción materia prima: solvente, concentración de etanol y tiempo de operación en la extracción de carotenoides por método Soxhlet: A partir de los resultados experimentales (Tabla 3), se realizó el ANOVA (Tabla 4), para el modelo de mejor ajuste, el cual fue (ecuación 4):
Tabla 3 Diseño central compuesto 23 para la extracción de carotenoides, a partir de la corteza de maracuyá liofilizada y molida.
El modelo reportó significancia (p-valor<0,0001 en la prueba F), mientras que el estadístico R2 ajustado (Tabla 4) indicó que el 88,8% de la variabilidad en el rendimiento de la extracción de carotenoides, medidos como b-caroteno, es explicado por la concentración de etanol, la proporción solvente materia prima y el tiempo (p-valor<0,05 para cada factor en la prueba F, a excepción de X3 y X 1 2 , que tienden a ser significativos con p-valor<0,1); sin embargo, a pesar de que el modelo evidenció un comportamiento cuadrático, las condiciones de extracción óptimas coincidieron con el límite superior de trabajo (90% v/v etanol, 50mL solvente/g muestra y 150 min), con las cuales, se estima un rendimiento de extracción de 2208,53 µg β-caroteno/100 g muestra (Figura 2).
Tabla 4 Análisis de varianza y coeficientes de determinación para el modelo de mejor ajuste durante la extracción Soxhlet de carotenoides, en corteza de maracuyá liofilizada y molida.
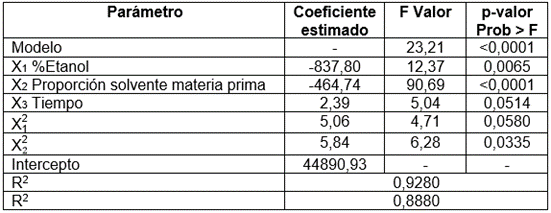
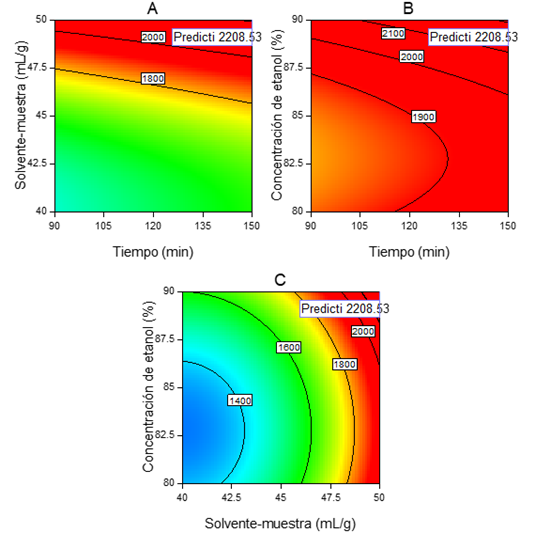
Figura 2 Gráficos de contorno y combinación óptima para la extracción de carotenoides, a partir de corteza de maracuyá molida y liofilizada. a. Tiempo y proporción solvente-materia (90% etanol); b. Tiempo y Concentración de etanol (50mL solvente/g muestra); c. Proporción solvente-muestra y concentración de etanol (150min).
El aumento del tiempo o la proporción solvente-materia prima permiten una mayor extracción del pigmento, de acuerdo con el modelo, lo cual, difiere respecto a lo determinado por Gu et al. (2008), quienes durante la extracción de carotenoides asistida con HCl, a partir de Rhodobacter sphareoides, identificaron que los factores tiempo y proporción solvente-materia prima tienen un comportamiento cuadrático marcado, siendo 30°C y 40mL/g, las condiciones óptimas de operación, respectivamente. Por otra parte, los carotenoides son extraídos con el uso de solventes orgánicos (Saini & Keum, 2018), razón por la cual, la condición óptima de operación, de acuerdo con el modelo, fue etanol al 90%.
Diferencia de color entre el extracto y una disolución de tartrazina: La diferencia de color reportada entre el extracto óptimo y la solución de tartrazina fue de 3,70 unidades CIELab en promedio, lo cual, evidenció que el producto de lixiviación de la corteza de maracuyá tiene potencial para su uso como aditivo alimentario, ya que podría reemplazar a los colorantes sintéticos, como la tartrazina, además de proporcionar posibles efectos terapéuticos propios de los carotenoides.