INTRODUCCIÓN
La Clase Cephalopoda Cuvier, 1797 tiene ca. 800 especies de calamares, sepias, nautilos y pulpos de distribución cosmopolita en ambientes nectónicos, demersales o bentónicos (Jereb & Roper, 2005). Tienen un amplio espectro alimentario y son presa de peces, aves y mamíferos marinos. Se caracterizan por su rápido crecimiento con fases post-eclosión planctónicas y algunas bentónicas, denominadas paralarvas, semejantes a los adultos (Sweeney et al. 1992; Rodhouse et al. 2014). Pese a su gran plasticidad, por sus ciclos de vida cortos, los cefalópodos son especialmente sensibles a las condiciones ambientales, por lo cual, se han considerado indicadores de cambios ambientales locales. La mayoría hacen parte de la pesca artesanal e incidental de camarón o carnada de peces y pocas especies de calamares y de pulpos tienen valor comercial (Rodhouse et al. 2014).
En el Pacífico Americano, la información concerniente a las paralarvas es inexistente o rudimentaria (con varias tesis no publicadas) y se ha enfocado, especialmente, en la influencia oceanográfica sobre las familias, dada su difícil identificación específica, e.g., en el Pacífico Oriental Tropical (POT) (Vecchione, 1999), en particular, en aguas de México (Alejo-Plata et al. 2012; Alejo et al. 2013; Hendrickx et al. 2015; Aceves et al. 2017; García et al. 2018; Ruvalcaba et al. 2018) y Chile (Vega et al. 1999; Vega et al. 2000; Carrasco et al. 2012; Ibañez et al. 2012; Pardo et al. 2016) y pocos en Costa Rica (Vecchione, 1999), Perú (Cardoso et al. 2005; Ayón, 2018) y Colombia (Rosales & López, 2007).
Esta investigación, se orientó a identificar las familias de paralarvas y a evaluar su abundancia y distribución en el OPC durante cinco cruceros oceanográficos del Estudio Regional del Fenómeno El Niño (ERFEN)-Colombia. Los resultados sirven para fortalecer las series de tiempo y comprender los cambios históricos en la comunidad paralarval, para posteriores comparaciones, a nivel local meso y macroescalar, e.g., la influencia de El Niño y la Oscilación Decadal del Pacífico, así como para el análisis del posible desarrollo futuro de las pesquerías de cefalópodos en el OPC, en vista de que la infomación sobre sobre la captura, en especial, de calamares adultos, es incipiente (De la Hoz et al. 2017).
MATERIALES Y MÉTODOS
Área de estudio. El OPC (01°30’-06°30’ latitud norte, 77°45’-84°00’ longitud oeste, ca. 349.000Km2) (Figura 1 a-b), está influenciado por los desplazamientos de la Zona de Convergencia Intertropical, los vientos Alisios del norte y sur y los eventos El Niño y La Niña. Los flujos superficiales mesoéscalares son la Corriente Sur Ecuatorial, más intensa en el segundo semestre del año o periodo cálido lluvioso, en particular, en septiembre; las Corrientes de Panamá, Colombia (paralela a la costa con remolinos ciclo- y anticiclónicos), y Chocó, y surgencias costeras y oceánicas todo el año, particularmente entre agosto y septiembre. Son notorios el amplio régimen mareal y la elevada descarga dulcecuícola costero-nerítica (CCCP, 2002; Devis, 2003; Corredor et al. 2011).

Figura 1 a. Estaciones ERFEN-Colombia para el estudio de las paralarvas de cefalópodos; b. Esquema simplificado de las corrientes superficiales en el OPC (basado en Corredor et al. 2011). CSE= Corriente Sur Ecuatorial, CC= Corriente de Colombia, GAC= Giro Anticiclónico, CP= Corriente de Panamá, CCH= Corriente del Chocó.
Obtención de las paralarvas y los datos abióticos. Las muestras, se obtuvieron en cinco cruceros oceanográficos: 23/jun-12/jul/01, 27/ago-15/sep/01, 03-22/sep/02, 01-21/sep/03 y 18/sep-08/oct/04. Se mantuvo la numeración original de las 113 estaciones del Programa ERFEN-Colombia (Figura 1). Su número/campaña dependió de factores logísticos y las condiciones climáticas, así que no fue posible contar con un grupo total homogéneo de estaciones en número, ubicación y hora de las faenas. Los arrastres de zooplancton, se efectuaron en el primer metro superficial, usando una red cónica (Ø= 50cm, longitud 1,85m y poro 363μm), provista de un flujómetro General Oceanics, para determinar el volumen de agua filtrada. Las muestras, se fijaron en solución de agua de mar con formaldehído al 10% y se conservaron en formaldehído al 4%; en ambos casos, neutralizado con tetraborato de sodio. Los datos de temperatura (°C) y de salinidad (Unidades Prácticas de Salinidad= UPS) fueron medidos con una sonda CTD (Conductividad, Temperatura, Depth= profundidad), Seabirds Electronics.
Identificación. De cada muestra de zooplancton, se extrajeron todas las paralarvas, identificándolas con base en su habitus y longitud del manto (LM mm) (micrómetro ocular de 0,01mm-microscopio), presencia de aletas y probóscide, número de brazos y tentáculos, tipo de ojos y número y posición de los cromatóforos (Sweeney et al. 1992; Alejo et al. 2013).
Análisis de la información. La abundancia paralarval (Pl/estación), se estimó según la fórmula: Pl = 1000m3.Pl/π.r2.d, donde: Pl = individuos contabilizadas, r = radio de la red, d = distancia del arrastre, π.r2.d = volumen de agua filtrada (Smith & Richardson, 1979). Los rangos de baja, media y alta abundancia, se definieron mediante cuartiles, previa transformación con log (x+1). Para evaluar las asociaciones entre la abundancia paralarval, la temperatura, la salinidad y la abundancia día (06:00-18:00h) vs. noche (18:01-05:59h), se realizaron análisis de agrupamiento y factores, en este caso, por el método de componentes principales y rotación ortogonal varimax de los factores, a fin de homogenizar su distribución y la varianza explicada por factor. Ante la ausencia de normalidad (Shapiro-Wilk) y homocedasticidad (Bartlett), se aplicó la prueba de Mann-Whitney (U), con el fin de cotejar diferencias y semejanzas de las variables abióticas y la abundancia entre las subáreas nerítica, intermedia y oceánica, así como la prueba de Kruskal-Wallis (p<0,05), para la comparación inter-periodos (en ambos casos, nivel de significancia <0,05). Se usó el programa SPSS Statistics 20®.
RESULTADOS Y DISCUSIÓN
Estructura termo-halina en la superficie del OPC. En general, la salinidad exhibió su amplio rango (24,8-35,0UPS) y distribución usual, con valores más bajos hacia la zona nerítica, como consecuencia de la alta pluviosidad propia del OPC y el gran número de ríos (CCCP, 2002), en contraste con el rango térmico más estrecho (24,4-29,7°C) y temperaturas más altas en la misma zona (Figura 2 a), definiendo un gradiente termohalino inverso costa-océano. La temperatura y profundidad de la termoclina evidenciaron El Niño moderado 2002-2003, que influenció especialmente el extremo suroccidental del OPC (Devis, 2003). Este esquema, se vió reflejado estadísticamente, pues solo se detectaron diferencias significativas de la salinidad entre las sub-áreas nerítica y oceánica (U M-W: 2763; p=0,00038), así como de esta variable y la temperatura (K-W: H= 12,76; p<0,1252 y H= 45,49; p<0,00001, respectivamente), entre los cinco periodos evaluados.
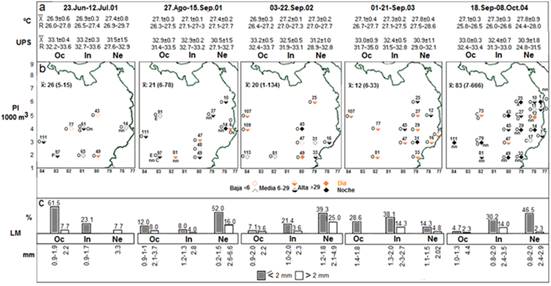
Figura 2 a-b. Temperatura (°C), salinidad (UPS) y abundancia paralarval (Pl/1000 m3) por periodo evaluado en el OPC. c. Abundancia de paralarvas (%) según la LM (mm). Sub-áreas: Ne= nerítica, In= Intermedia, Oc= Oceánica. R= rango. O= Ommastrephidae, A= Ancistrocheiridae, C= Cranchiidae, E= Enoplotheutidae, G= Gonatidae, Oc= Octopodidae, On= Onychotheutidae, P= Pyrotheutidae. No se incluyen las estaciones con ausencia de paralarvas.
Composición. En todos los periodos predominó el orden Teuthida Naef, 1916 (calamares) (Roper & Jereb, 2010), en especial, la familia Ommastrephidae Steenstrup, 1857 (n= 124; 66,3%), siendo única en dos de ellos. Fueron raras Ancistrocheiridae Pfeffer, 1912 (n= 1; 14,2%), Cranchiidae Prosch, 1847 (n= 3; 1,5%), Enoploteuthidae Pfeffer, 1900 (n= 1) y Pyroteuthidae Pfeffer, 1912 (n= 1; 0,5% cada una); Gonatidae Hoyle, 1886 y Onycoteuthidae Gray, 1847 (n= 1; 0,2% cada una). Del orden orden Octopoda Leach, 1818 (pulpos) solo apareció Octopodidae D'Orbigny, 1839 (n= 1; 0,2%); el 16,4% fue nn (Figura 2 a). De Ancistrocheiridae, se identificó Ancistrocheirus lesueuri (Orbigny, 1842) (18/sep-08/oct/04, una estación), especie amenzada (Allcock & Barratt, 2014), de la cual, solo se sabe que, posiblemente, desova en el fondo, cerca del talud continental o en océano abierto, a lo largo del año (Arkhipkin, 1997). Se sospecha la existencia de otra especie en el Pacífico Americano, sin diferenciarse aún (De Silva et al. 2015).
Las paralarvas de Cranchiidae (27/ago-15/sep/01, una estación; 18/sep-08/oct/04, cuatro estaciones) son comunes en aguas superficiales, donde muchas habitan hasta ca. 50-100mm LM (Vosset al. 1992). Pyroteuthidae (23/jun-12/jul/01, una estación) y Enoploteuthidae (27/ago-15/sep/01, dos estaciones), comprenden pocas especies (Ruvalcaba et al. 2018), disminuyendo la probabilidad de capturar sus paralarvas. Tienen estrategias reproductivas y de desove similares (Young et al. 1992), aunque su hábitat difiere en profundidad (Ruvalcaba et al. 2018), lo que sustenta su aparición separada en los dos periodos de 2001, mientras que su coexistencia en sep/05 (Rosales & López, 2007), se atribuye al muestreo oblícuo. La exigua aparición de Octopodidae (27/ago-15/sep/01, una estación), se explica por el rápido asentamiento en el mismo ambiente bentónico-nerítico-costero de los adultos, con menor potencial de dispersión que los cefalópodos pelágicos, cuya vida planctónica varía de días a meses (Vega et al. 2000; Carrasco et al. 2012; Rodhouse et al. 2014; Villanueva et al. 2016; De Silva et al. 2015; García et al. 2018; Ruvalcaba et al. 2018). Las paralarvas de Gonatidae suelen habitar los primeros 200m (Bower & Takagi, 2004; Jorgensen, 2007) y las de Onychoteuthidae hasta los 500m (Roper & Jereb, 2010), explicando su captura en sendas estaciones (27/ago-15/sep/01).
En sep/05, Rosales & López (2007) hallaron Ommastrephidae (61,0%), Cranchiidae (13,0%), Enoploteuthidae, Pyroteuthidae, Bolitaenidae, Oegopsina, Onychoteuthidae y Octopodidae (≤6,0%). Aunque solo consideraron cuatro estaciones, las semejanzas/disimilitudes con el presente estudio, se podrían deber a las condiciones ambientales diferentes y los muestreos oblicuos (Z̅= 160m), en 2005.
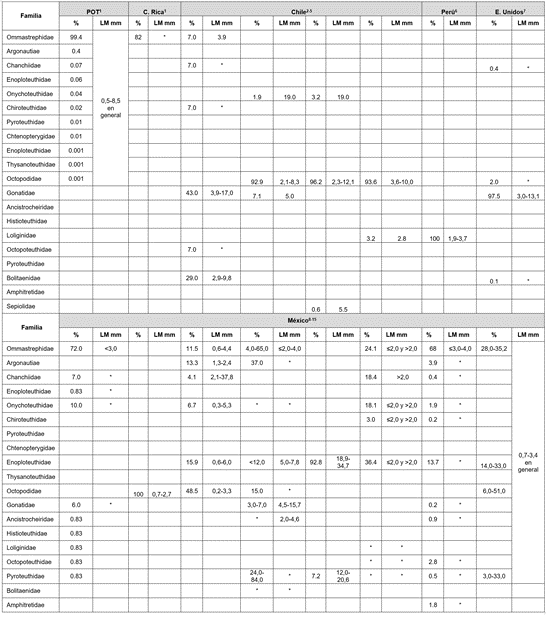
Pese a la dificultad para identificar las paralarvas (Rodhouse et al. 2014; Ruvalcaba et al. 2018), la lista de las ocho familias registradas en el OPC es considerable, comparada con otras regiones del Pacífico Americano, que totalizan 19 familias, con variaciones en la abundancia y la LM (Tabla 1), así como en la ocurrencia, dependiendo de la época del año, dinámica oceanográfica, número de estaciones y tipo de muestreo. Una forma de contribuir con estos análisis es conociendo la distribución de los calamares adultos por taxa (Boyle & Rodhouse, 2005; Rodhouse et al. 2014), lo que, eventualmente, pudiera corresponder a algunos de los grupos de paralarvas capturados, pero en Colombia, los registros sobre su pesca, en especial, en el Pacífico colombiano, son esporádicos y puntuales y solo mencionan las especies Loliolopsis diomedeae y Dosidicus gigas, sin especificar meses, ni lugares de captura (De la Hoz et al. 2017).
Tabla 1 Familias de cefalópodos en fase paralarval (%) reportadas en el Pacífico Americano. LM= longitud del manto. En blanco= No hallada. *Sin dato. 1Vecchione (1999), 2Vega et al. (1999), 3Vega et al. (2000), 4Carrasco et al. (2012), 5Pardo et al. (2016), 6Cardoso et al. (2005), 7Jorgensen (2007), 8Granados et al. (2010), 9Alejo-Plata et al. (2012), 10Alejo et al. (2013), 11De Silva et al. (2015), 12Hendrickx et al. (2015), 13Aceves et al. (2017), 14García et al. (2018), 15Ruvalcaba et al. (2018).
Abundancia y distribución. Se realizaron 133 arrastres, 64 con paralarvas, cuyo bajo número (∑= 213) concuerda con lo observado en otras regiones (Granados et al. 2010; Alejo et al. 2013; De Silva et al. 2015; Hendrickx et al. 2015; Aceves et al. 2017; García et al. 2018; Ruvalcaba et al. 2018), relacionado con su habilidad para esquivar las redes (Alejo et al. 2013).
En orden cronológico, los promedios fueron similares en los tres primeros periodos (26, 21 y 20 Pl/1000m3, respectivamente), mientras en el tercero fue el más bajo (12 Pl/1000m3) y, en el último, el más elevado (83 Pl/1000m3) (Figura 2 b); 56,98% de las paralarvas, se registró en aguas intermedias, quizás por el transporte y la concentración en el giro anticiclónico imperante allí (CCCP, 2002; Corredor et al. 2011) o en combinación con condiciones ambientales de transición costa-océano; 26,27% correspondió a aguas neríticas, donde son comunes las surgencias, remolinos ciclónicos y anticiclónicos a lo largo de la Corriente de Colombia (CCCP, 2002; Corredor et al. 2011) y 10,29% en aguas oceánicas, influenciadas por surgencias y el ramal occidental del giro anticiclónico, que pudo transportar paralarvas a esa subárea, donde se ubica la isla Malpelo, hábitat de pulpos (Domínguez et al. 2013) y calamares (Estupiñán et al. 2017), en sus inmediaciones. En todo caso, las abundancias no mostraron diferencias significativas entre las sub-áreas (U M-W: 494; p=0,72786), pero sí entre periodos (K-W: H= 19,98; p= 0,0005).
Durante los episodios registrados de El Niño en el OPC, entre 1993 y 2007, de septiembre a noviembre, se multiplicaron los remolinos y la Corriente Sur Ecuatorial (océano-costa) incrementó su velocidad, mientras en la Corriente de Colombia (norte-sur) disminuyó, sin variar en el giro anticiclónico, reduciéndose la tasa de dispersión larvaria y la conectividad (Corredor et al. 2011). Esto no fue claro en sep/02, bajo la influencia de El Niño-moderado (jun/02-may/03), detectado en la franja suroccidental hasta la costa del OPC (Devis, 2003); no obstante, un posible indicio del impacto del evento fue la mera presencia de Ommastrephidae, quizás en detrimento de las demás familias, pues pese a la plasticidad y ágil adaptación a condiciones ambientales cambiantes, estos organismos son muy sensibles a las influencias ambientales, con un fuerte efecto en el éxito de desove y eclosión y en el subsiguiente crecimiento y supervivencia paralarval (Rodhouse et al. 2014). En este sentido, Vecchione (1999) anota que el aumento en la abundancia paralarval está relacionado con el incremento térmico, por ejemplo, en el Golfo de California, donde también influyen los volúmenes de zooplancton y la concentración de clorofila (De Silva et al. 2015).
No se explicó la situación análoga en sep/03 (post-El Niño), pero ya que los aspectos reproductivos y ecológicos de la mayoría de cefalópodos son prácticamente desconocidos (Rodhouse et al. 2014; Ruvalcaba et al. 2018), se podría presumir una recuperación lenta de las poblaciones de las familias distintas de Ommastrephidae, tras la ocurrencia de El Niño, hasta llegar a condiciones generales más favorables en 2004, como apuntan los resultados para ese periodo.
El impacto positivo o negativo de El Niño, con cambios considerables en la abundancia, la distribución y los ensamblajes taxonómicos de las paralarvas, debido a las surgencias, remolinos, convergencias y frentes, relacionados con alta productividad biológica a lo largo del Pacífico Oriental, se ha comprobado desde hace tiempo (Vecchione, 1999; Vega et al. 1999; Vega et al. 2000; Granados et al. 2010; Carrasco et al. 2012; De Silva et al. 2015; García et al. 2018; Ruvalcaba et al. 2018).
Se pudo medir la LM de 135 paralarvas (63,4% del total), predominando las recien eclosionados (≤2 mm) (Sweeney et al. 1992) (Figura 2 c), con mayor representación en tres periodos hacia la zona nerítica, donde pululan los remolinos (CCCP, 2002; Corredor et al. 2011). Algo análogo ocurre en otras altitudes, incluso, en areas de surgencia que, como los remolinos, tienen una alta productividad primaria y secundaria (Alejo et al. 2013; Aceves et al. 2017; García et al. 2018; Ruvalcaba et al. 2018). En los otros dos periodos, tales tallas fueron más representativas en aguas intermedias y oceánicas, respectivamente, semejante a lo reseñado por Aceves et al. (2017). En el OPC existen surgencias costeras y oceánicas permanentes, sobre todo de agosto a septiembre, sugiriendo su posible efecto sobre la abundancia y la distribución paralarval, al igual que los remolinos. La LM indica que, en el OPC, la eclosión de las paralarvas ocurre más temprano que en otras áreas (Figura 2, Tabla 1), posiblemente, debido a las mayores temperaturas.
Variación de la abundancia día vs. noche. Hace casi tres décadas (Sweeney et al. 1992), se ha comprobado la migración batimétrica de las paralarvas, abundando más en la noche, en los primeros 200m, particularmente, en los estratos superficiales, sobre o en la termoclina, en ocasiones, asociadas a los procesos de surgencia, según varios estudios en el Pacífico oriental (Vega et al. 2000; Granados et al. 2010; Ibañez et al. 2012; Ruvalcaba et al. 2018). En el OPC, la abundancia general nocturna superó la diurna (83,2 vs. 16,8%); si bien no se efectuaron muestreos estratificados es plausible aludir a la migración nictimeral, como también lo hicieron Rosales & López (2007), en sep/05, aunque no se descarta que la noche, probablemente, restrinja la capacidad de las larvas para evitar las redes.
En todo caso, considerando la relación entre estaciones día:noche (60:73) y las abundancias, no hubo diferencias significativas entre las sub-áreas (U M-W: 1348; p=0,1031), ni entre los periodos (K-W: H= 2,66; p= 0,10318).
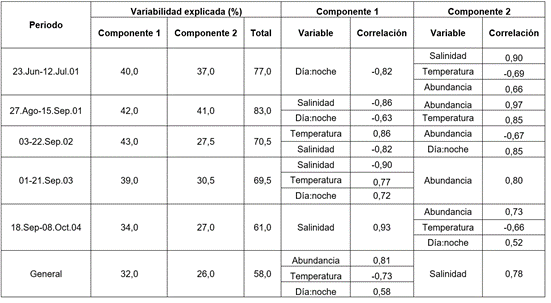
Análisis estadístico. El análisis factorial explicó satisfactoriamente la varianza acumulada en la relación abundancia-variables abióticas en los dos primeros componentes (61,0-83,0%). Las correlaciones más altas para la salinidad y la temperatura fueron -0,86 a 0,93 y -0,69 a 0,86, respectivamente. Para la relación día:noche variaron entre -0,63 y 0,85 (en general 0,58) (Tabla 2), indicando efectos positivos y negativos de estas variables en la abundancia paralarval, con variaciones/periodo, seguramente dependiendo de las condiciones particulares en cada caso.
Tabla 2 Correlaciones significativas en los componentes 1 y 2 del análisis de factores por componentes principales, para el estudio de las paralarvas en el OPC.
El análisis de agrupamiento abundancia-variables abióticas mostró inter-anualmente dos conjuntos de estaciones (día vs. noche), interiormente, asociados por sub-áreas o estaciones mezcladas (Figura 3), corroborando la relevancia nictimeral y las características termo-halinas en la distribución espacio-temporal de las paralarvas, en el contexto complejo de la variabilidad ambiental en el OPC; no obstante, su distribución en todo el OPC no concuerda con lo expresado por Boyle & Rodhouse (2005) y Jereb & Roper (2005), quienes aseveran que la mayoría de especies de cefalópodos son estenohalinas y euritérmicas, por lo que la salinidad sería uno de los principales determinantes abióticos de su distribución geográfica, como también lo refieren Pardo et al. (2016), para los fiordos chilenos, conocidos ecosistemas de alta productividad, con gran fluctuación y variabilidad espacial de la salinidad.
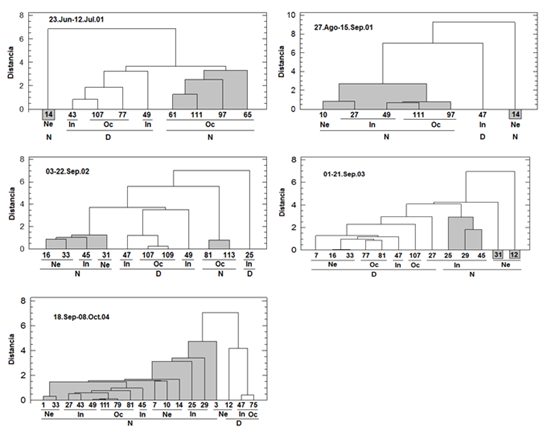
Figura 3 Dendrograma modo-Q mostrando el agrupamiento entre las estaciones de muestreo, con base en las abundancias paralarvales y las variables abióticas en los cinco periodos evaluados en el OPC. Sub-áreas: Ne= nerítica, In: intermedia, Oc: oceánica. D: día, N: noche.
En este contexto, puesto que la comunidad paralarval estuvo dominada por Ommastrephidae, quizás sobre ésta influyó más la temperatura, pues es un factor primordial para su sobrevivencia y crecimiento; su desarrollo óptimo está entre 15,0 y 29,0°C y, en aguas costeras de Baja California, las mayores capturas de paralarvas de esta familia ocurren entre 20,5 y 24,0°C (Vecchione, 1999), dentro del rango en el OPC (24,4-29,7°C), durante este estudio.
Para comprender en profundidad la dinámica de la comunidad paralarval en el OPC, en los próximos estudios, se sugiere profundizar en su taxonomía, mediante técnicas moleculares e incluir en los análisis la productividad primaria y secundaria y las relaciones tróficas de las paralarvas con otros zoopláncteres, considerando muestreos estratificados. Además, contemplar una cronología más robusta, que incluya un registro de las corrientes simultáneo con los muestreos en diferentes meses, para poder conocer la estructura comunitaria y establecer el patrón y la magnitud de la dispersión larvaria, impulsada por las corrientes y la conectividad poblacional entre los individuos de cada localidad (Rodhouse et al. 2014; Villanueva et al. 2016). También falta establecer la aparición de otras familias, diferentes de Ommastrephidae, lo que aportará al conocimiento de los ciclos biológicos, para comprender la dinámica poblacional y, especialmente estimar el reclutamiento de potenciales taxa comerciales, como sugieren Rodhouse et al. (2014).
De la presente investigación, se puede concluir que, muy probablemente, en el OPC, la distribución horizontal de las paralarvas se deba a su alto potencial de dispersión meso-escalar, mediado por la acción combinada del giro geostrófico, la Corriente Sur Ecuatorial y la Corriente de Colombia. En este aspecto, también es relevante el gradiente termo-halino, pues aparentemente los desoves y eclosión tienden a ser más recurrentes hacia la zona nerítica de mayor temperatura. En la distribución, además influye la variación circadiana, con mayores abundancias nocturnas, posiblemente relacionadas con las migraciones verticales de las paralarvas.
La eclosión de las paralarvas en el OPC acontece más temprano que en otras áreas del Pacífico Americano, atribuíble a las mayores temperaturas.
Además de otras variables no consideradas aquí, e.g., la disponibilidad de alimento y la presencia de depredadores, la variación inter-anual en la estructura termohalina y la composición taxonómica debe responder a los cambios oceanográficos y climáticos en el OPC, resaltándose la influencia de El Niño-moderado que, aparentemente, en detrimento de las demás familias, benefició a Ommastrephidae, que por su abundancia y distribución parece ser la base de la comunidad de cefalópodos en esta área.














