INTRODUCCIÓN
Los fibroblastos son células constituyentes esenciales de los tejidos conectivos. Estas células participan, activamente, en la renovación de los componentes de la matriz extracelular (MEC) y están implicadas en la homeostasis y reparación tisular (Carrel & Ebeling, 1926). Aunque todos los fibroblastos contribuyen, de manera activa, en la renovación de la MEC, su potencialidad depende de la sensibilidad a señales micro-ambientales específica de cada tejido. Esta heterogeneidad, también obedece a su origen embriológico. La mayor parte de los fibroblastos derivan del mesodermo, entre ellos, los fibroblastos dérmicos, pero otros fibroblastos, se originan de la cresta neural (CN), particularmente, los encontrados en estructuras cráneofaciales, como los fibroblastos del ligamento periodontal y fibroblastos gingivales (Smith et al. 2019; Chai et al. 2000).
Los fibroblastos gingivales (FGs), células mayoritarias del tejido conectivo y responsables de la síntesis de los elementos de la MEC gingival, han sido objeto de un interés particular en los últimos años, dado su potencial regenerativo. Los componentes de la MEC, favorecidos por los FGs, hace posible la creación de un microambiente que alberga células inflamatorias, vasculares e, incluso, las células madre del tejido gingival (Bucur et al. 2018). Morfológicamente, los FGs presentan un núcleo redondo y voluminoso, su forma es alargada y fusiforme, con proyecciones anatómicas hacia otros componentes de la MEC, con quien se interrelacionan. Funcionalmente, se ha demostrado que los FGs también son esenciales en la regulación de los procesos de cicatrización y de reparación del tejido gingival (Simancas-Escorcia & Díaz-Caballero, 2019; Boor & Floege, 2012).
En estado activo, los FGs son capaces de proliferar y de generar la formación de un tejido de granulación luego de la síntesis de citoquinas, que participan en la respuesta inflamatoria del tejido gingival. A partir de la formación de este nuevo tejido, los FGs pueden recolonizar, migrar y diferenciarse, favoreciendo la síntesis de una nueva MEC (Simancas-Escorcia & Díaz-Caballero, 2019). Por ello, los FGs autólogos podrían ofrecer un potencial tisular prometedor en la reparación de defectos patológicos sistémicos y de la cavidad oral; sin embargo, concebir estas células por su capacidad reparativa en otros tejidos luego de su trasplantación o, incluso, como un modelo in vitro, obliga a enriquecer la comprensión de sus aspectos fisiológicos.
La comprensión funcional de los FGs implica conocer las interacciones celulares y funciones que desempeñan las organelas celulares, aun cuando estas células son sometidas a condiciones particulares de cultivo in vitro (Bartold et al. 2000). Actualmente, el desarrollo de modelos de estudio celulares continúa siendo una herramienta fundamental en el progreso de conocimientos en el área de biología celular. La utilización de medios de cultivos apropiados para suplir las necesidades metabólicas y funcionales de las células cultivadas son vitales para su supervivencia y proliferación. Un elemento esencial de los medios de cultivo es el Suero Fetal Bovino (SFB), cuya composición facilita el aporte de proteínas, vitaminas, oligoelementos y factores de crecimiento, que contribuyen al mantenimiento, el crecimiento y la proliferación celular (Brunner, 2010).
La variación del SFB puede influir en la morfología, la fisiología y las características bioquímicas de las células cultivadas y, en consecuencia, afectar el mantenimiento de la homeostasis celular (Lynn & Arthur, 1984). Es probable que los FGs, así como cualquier otro tipo de célula, puedan sufrir la pérdida de sus características morfo-funcionales, cuando algunos de los elementos esenciales, para su cultivo in vitro, sean modificados (Odioso et al. 1995); sin embargo, se desconoce si estos cambios relacionados con la variación de los componentes del medio de cultivo celular, particularmente el SFB, tengan un impacto sobre las organelas, esenciales en la homeostasis celular (Ballabio et al. 2020). Por lo tanto, resulta menester conocer si la modificación en la concentración del SFB afectará el aspecto morfológico y funcional de los FGs cultivados in vitro, incluyendo las organelas celulares, como el retículo endoplasmático (RE), las mitocondrias y los lisosomas.
Considerando los aspectos descritos, el presente trabajo tuvo como objetivo estandarizar un protocolo de cultivo celular de fibroblastos gingivales humanos, considerando diferentes concentraciones del suero fetal bovino, como elemento esencial, en el medio de cultivo celular y describir su impacto en la supervivencia, el crecimiento y la expresión de diferentes marcadores de estructura de las principales organelas celulares, implicadas en la homeostasis celular.
MATERIALES Y MÉTODOS
Estudio de tipo descriptivo, que comprendió el análisis morfológico e inmunohistoquímico de fibroblastos gingivales in vitro.
Cultivo celular. Los fibroblastos gingivales fueron cultivados a partir de biopsias provenientes de tres (3) donantes, clínicamente sanos, sometidos exodoncia, por razones ortodónticas. Una biopsia de tejido gingival fue tomada en la zona de premolares y, en seguida, lavada en una solución de solución salina tamponada con fosfato (PBS 1X, Gibco™), suplementada con 1% de penicilina-estreptomicina (10,000U/mL) (Gibco™). El tejido biológico fue segmentado en explantes de 1-2mm3 y, posteriormente, cultivados en frascos de 25cm2, con un medio de cultivo, compuesto por DMEM (dulbecco modified Eagles minimal essential medium) (1X) con GlutaMAX™ (Gibco™), 20% de Suero Fetal Bovino-SFB (Gibco™), 1% de penicilina-estreptomicina (10,000U/mL) (Gibco™), 0,5 de Anfotericina B (Gibco™) y 50µm/mL de ácido ascórbico (Gibco™). Incubados a 37°C, en una atmosfera húmeda con 5% de CO2.
A una confluencia de 70-80%, la disgregación celular fue realizada con Trysina EDTA, Gibco™ y cultivadas en frascos de 25cm2, en dos medios de cultivo: Medio de cultivo 1, compuesto de DMEM (1X) con GlutaMAX™ (Gibco™), 10% de Suero Fetal Bovino-SFB (Gibco™), 1% de penicilina-estreptomicina (10,000U/mL) (Gibco™), 0,5% de Anfotericina B (Gibco™) (DMEM + SFB 10%) y el Medio de cultivo 2 compuesto de DMEM (1X) con GlutaMAX™ (Gibco™), ausencia de SFB, 1% de penicilina-estreptomicina (10,000U/mL) (Gibco™), 0,5% de Anfotericina B (Gibco™) (DMEM + SFB 0%). Ambos medios de cultivo fueron reemplazados dos veces por semana hasta la obtención de una confluencia de, aproximadamente, 90%. Una vez alcanzado este porcentaje y manteniendo las mismas condiciones de cultivo, los FGs de cada paciente fueron replicados (pasaje 2) y distribuidos en dos placas, con el propósito de realizar el posterior análisis morfológico e inmunohistoquímico.
Análisis Morfológico: La morfología celular fue observada a lo largo de la proliferación por medio del microscopio invertido Axio Vert (Zeiss), con contraste de fase. En paralelo, una contra-coloración nuclear, con el marcador de ácido nucleico Hoechst 33342 (Thermo Fisher Scientific); en las dos condiciones de cultivo celular permitió constatar la viabilidad de las células fibroblásticas, a lo largo de la experimentación.
Inmunohistoquímica: Luego de una semana de cultivo, las células destinadas a la detección inmunológica se fijaron, mediante la utilización de una solución de PBS1X (Gibco™), que contenía 4% de paraformaldehído (Sigma-Aldrich®) - 5% sacarosa (Sigma-Aldrich®) durante 15 minutos. Posteriormente, las células fueron permeabilizadas utilizando 0,5% de Triton X-100 (Sigma-Aldrich®) y, seguidamente, incubadas durante 20 minutos en PBS1X, que contenía 1% de BSA (Sigma-Aldrich®) / 1% de glicina (Sigma-Aldrich®), a temperatura ambiente. Luego, las células estuvieron en contacto con los anticuerpos primarios a 4°C, durante toda la noche. A continuación, las células se incubaron con los anticuerpos secundarios apropiados durante 2h, a temperatura ambiente. Los núcleos celulares fueron coloreados con DAPI (Life Technologies Corporation), finalizando con el montaje, mediante la solución Immu-MountTM (Thermo Scientific).
Los anticuerpos primarios utilizados fueron: anti-TOMM20 (Rabbit / IgG polyclonal antibody, dilución 1:400, PA5-52843, Thermo Fisher Scientific), para la inmunolocalización de mitocondrias, específicamente, la subunidad 20 de la traslocasa de la membrana externa (TOMM20); anti-LAMP1 (Rabbit / IgG polyclonal antibody, dilución 1:400, PA5-95849, Thermo Fisher Scientific), para la identificación los lisosomas, puntualmente la proteína de membrana asociada a lisosoma-1 (LAMP1) y, anti-calnexin (Rabbit / IgG polyclonal antibody, dilución 1:200, C4731, Sigma-Aldrich®), para la inmunodetención del retículo endoplasmático, a través de la proteína de membrana integral de tipo 1 (calnexina). El anticuerpo secundario empleado para los tres anticuerpos primarios fue Alexa Fluor 488 donkey anti-conejo (1:400 Life Technologies Corporation). La coloración mediante la faloidina fue realizada después de la incubación del segundo anticuerpo, utilizando Alexa FluorTM 594 Phalloidin (Thermo Fisher Scientific), durante 15 minutos, de acuerdo con las recomendaciones del fabricante. Todas las coloraciones fueron observadas en el microscopio Leica DM2500 LED.
Declaración sobre aspectos éticos. Para su ejecución, esta investigación tuvo en cuenta las normas éticas establecidas en la declaración de Helsinki y previa lectura, aprobación y firma del consentimiento informado, por parte de los participantes.
RESULTADOS Y DISCUSIÓN
Este trabajo realizó la estandarización de las condiciones necesarias requeridas para el cultivo celular de fibroblastos gingivales humanos. Dentro de estas condiciones, se tuvo en cuenta un elemento vital que participa a la supervivencia, el crecimiento y la proliferación de las células cultivadas in vitro, como es la adición al medio de cultivo del SFB. Los fibroblastos gingivales humanos cultivados en presencia de SFB, a una concentración de 10% y su ausencia, mostraron una supervivencia a lo largo 7 días de cultivo. La observación microscópica permitió constatar FGs el aspecto fusiforme, núcleos redondos y voluminosos, indicando la supervivencia y viabilidad de estas células, durante el tiempo de cultivo (Figura 1 A-F).

Figura 1 Microfotografías de la contra-coloración nuclear con Hoechst 33342, de los fibroblastos gingivales, cultivados con la condición de cultivo 1 (DMEM+SFB 10%) (a, b, c) y la condición de cultivo 2 (DMEM+SFB 0%), (d, e, f) durante 24 horas, 4 y 7 días. SFB: Suero Fetal Bovino. Barra blanca: 200µm.
En ausencia de SFB (DMEM + SFB 0%) y en presencia de SFB, a una concentración de 10% (DMEM + SFB 10%), los fibroblastos gingivales alcanzaron tasas de confluencia diferenciales, al final de una semana. Los FGs en contacto con la condición del medio de cultivo 1 (DMEM + SFB 10%), obtuvieron una confluencia de, aproximadamente, 20-30%, a las 24 horas; de 80-90%, en 4 días y, finalmente, 100%, en los 7 días de cultivo (Figura 2 A, B, C). El seguimiento de las células fibroblásticas sumidas con la condición del medio de cultivo 2 (DMEM + SFB 0%), permitió observar una confluencia estimada de alrededor del 20%, a las 24 horas; 40-50%, en 4 días y del 60-70%, a los 7 días, después de iniciado su cultivo (Figura 2 D, E, F).

Figura 2 Microfotografías muestran la migración y la confluencia de los fibroblastos gingivales en contacto con la condición de cultivo 1 (DMEM+SFB 10%) (a, b, c) y la condición de cultivo 2 (DMEM+SFB 0%) (d, e, f), posterior a 24 horas, 3 y 7 días de cultivo celular. SFB: Suero Fetal Bovino. Barra blanca: 1000µm.
Citoesqueleto y organelas celulares: La expresión de la actina, elemento fundamental en la arquitectura del citoesqueleto y del movimiento celular, fue inmunodetectado, por medio de la faloidina. Una detención positiva de la actina presente en los FGs fue constatada en las dos condiciones de cultivo celular, llevadas a cabo en el presente estudio, junto al marcaje inmunológico de las mitocondrias, los lisosomas y RE. El inmunomarcaje con TOMM20 permitió constatar la presencia de las mitocondrias en los fibroblastos gingivales (Figura 3). La expresión de TOMM20 fue mayor en las células en contacto con la condición de cultivo 1 (DMEM + SFB 10%) (Figura 3 B); sin embargo, el marcaje mitocondrial también estuvo presente en las células cultivadas con la condición de cultivo 2 (DMEM + SFB 0%) (Figura 3 E).
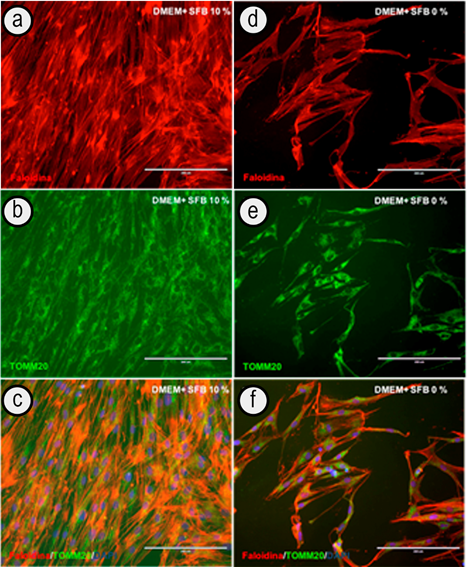
Figura 3 Inmunofluorescencia de la actina (en rojo) y las mitocondrias (en verde), de fibroblastos gingivales, a diferentes concentraciones de suero fetal bovino. Doble marcaje: actina (faloidina) / mitocondrias (TOMM20), de fibroblastos gingivales, en la condición de cultivo 1 (a, b, c) y condición de cultivo 2 (d, e, f). Núcleos coloreados con DAPI (azul). Barra blanca: 200µm.
De manera similar, los resultados indican que en la monocapa de células fibroblásticas gingivales cultivadas en el medio de cultivo 1 (DMEM + SFB 10%) y el medio de cultivo 2 (DMEM + SFB 0%), tuvieron una expresión de la proteína de membrana asociada a los lisosomas-1 (LAMP-1) (Figura 4). Se observó que en la condición de cultivo 1, un mayor número de fibroblastos gingivales presentaron este marcaje lisosomal (Figura 4 B), mientras que en los fibroblastos gingivales en contacto con la condición de cultivo 2, el marcaje de LAMP-1 estuvo presente, pero solo en ciertas células (Figura 4 E).

Figura 4 Inmunomarcaje de la actina (en rojo) y los lisosomas (en verde), en fibroblastos gingivales, en contacto con medio de cultivo en presencia y ausencia de suero fetal bovino. Un doble marcaje revela la actina (faloidina) y los lisosomas (LAMP1), de fibroblastos gingivales, en la condición de cultivo 1 (a, b, c) y condición de cultivo 2 (d, e, f). Núcleos coloreados con DAPI (azul). Barra blanca: 200µm.
Con el objeto de conocer el impacto del medio de cultivo con presencia y/o ausencia del SFB sobre las organelas, también se realizó un inmunomarcaje del retículo endoplasmático (Figura 5). El inmunomarcaje del RE, llevado a cabo mediante la calnexina, indica que la intensidad de su detención fue más importante en los FGs cultivados con el medio de cultivo 1 (DMEM + SFB 10%) (Figura 5 B), en comparación con los fibroblastos gingivales en contacto con el medio de cultivo 2 (DMEM + SFB 0%) (Figura 5 E).

Figura 5 Micrografía que muestra el inmunomarcaje de la actina (en rojo) y del retículo endoplasmático (en verde), en fibroblastos gingivales, en contacto con medio de cultivo en presencia y ausencia de suero fetal bovino. Un doble marcaje evidencia la actina (faloidina) y el retículo endoplasmático (Calnexina), de fibroblastos gingivales, en la condición de cultivo 1 (A, B, C) y condición de cultivo 2 (D, E, F). Núcleos coloreados con DAPI (azul). Barra blanca: 200µm.
Estudios precedentes realizados en diferentes tipos celulares en presencia o ausencia de suero fetal bovino han permitido constatar cómo este componente afecta el rendimiento de los cultivos celulares (Gürdal et al. 2018; Farzaneh et al. 2018). El medio de cultivo DMEM hace posible el crecimiento celular in vitro, proporcionando los nutrientes esenciales requeridos por los fibroblastos gingivales. El presente estudio ha demostrado que la utilización de DMEM en ausencia de SFB, disminuye la proliferación celular de los fibroblastos gingivales. Cuando las células fibroblásticas gingivales son cultivadas utilizando DMEM con una concentración de 10% de SFB, estas células alcanzaron un grado de confluencia de 100% en una semana, en comparación con 60-70% de las células con DMEM, en ausencia de SFB.
Diversas razones pueden justificar por qué la ausencia de SFB disminuyó la proliferación de los fibroblastos gingivales en cultivo. En primer lugar, DMEM sin SFB pudo haber inducido la muerte o la interrupción del ciclo celular de los FGs. En efecto, luego de 24h del cultivo celular, un número no cuantificable de células fibroblásticas flotantes o totalmente separadas del soporte de cultivo fueron observadas en la condición con el medio de cultivo 2. Si un proceso apoptótico fue el responsable de la muerte de los fibroblastos gingivales durante las primeras horas de cultivo y la explicación de por qué la condición de cultivo 1 (DMEM + SFB 10%) no indujo tantas células flotantes, podría ser dilucidado por el hecho que la ausencia de SFB afectó la interacción de receptores membranales tipo integrinas y, en consecuencia, la producción, la organización y la remodelación de los componentes de la MEC. De hecho, la MEC es la que aporta la integralidad estructural y un microambiente por las células, permitiendo las interacciones celulares de almacenamiento y liberación de factores de crecimiento al igual que la transmisión de señales mecano-sensoriales (Bucur et al. 2018).
Los filamentos de actina, como parte del citoesqueleto celular, son esenciales en la migración, la interacción con las otras células, el buen desarrollo de las propiedades mecánicas de la superficie celular y la morfogénesis de las organelas celulares (Svitkina, 2018). La observación del entramado proteico del citoesqueleto, mediante la identificación de la actina, reveló un sistema de filamentos mucho más compacto y denso en los fibroblastos gingivales, cultivados en presencia del medio de cultivo, con SFB. Aunque en las células cultivadas en ausencia SFB fueron positivas al inmunomarcaje con la faloidina, se observó que, bajo esta condición de cultivo, muchas células son distantes entre sí y carecen de una estructura compacta. Este fenómeno, se puede atribuir a la ausencia de integrinas, que permiten la mediación de la adhesión celular por medio de ligandos, como la fibronectina, laminina, colágeno, vitronectina, entre otras. Asimismo, en ausencia de SFB, una carencia de factores estabilizadores del pH que, en condiciones normales permiten inhibir las proteasas, como la α-antitripsina, podrían ser otra causa del aislamiento intercelular observado (Brunner, 2010). En consecuencia, la ausencia de las integrinas y la ausencia de inhibición de proteasas pudo desencadenar una menor adherencia y migración de las células fibroblásticas cultivadas, en ausencia de SFB.
El presente estudio también permitió constatar el efecto del SFB sobre las mitocondrias, los lisosomas y el retículo endoplasmático. En cuanto a las mitocondrias, se conoce que la supervivencia y la proliferación celular es dependiente de la expresión coordinada entre el núcleo y estas organelas, que participan en la generación de energía, metabolismo de nucleótidos y aminoácidos (Richter et al. 2013). Las mitocondrias llevan a cabo la formación de una red dinámica e interconectada, incluso, relacionada con otros compartimientos celulares, que influyen en la fisiología de un organismo, regulando la comunicación entre las células y los tejidos. El presente estudio identificó la expresión de las mitocondrias, mediante la traslocasa de la membrana externa, subunidad 20 (TOM20), una proteína que presenta un dinamismo conformacional y hace parte del complejo proteínico de la membrana externa de la mitocondria, cuya función es la intervención en el movimiento de proteínas, a través de la membrana hacia el interior del espacio intramembranoso mitocondrial (Komuro et al. 2013). En las condiciones de cultivo 1 (DMEM+SFB 10%) y 2 (DMEM+SFB 0%), se constató la presencia en los FGs de las mitocondrias, a través de TOMM20. Estos resultados muestran que la ausencia del SFB, aunque si bien afecta la tasa de crecimiento de las células en cultivo, parece no impactar la estructura de mitocondrias y ni, probablemente, la función mitocondrial.
Expectantes de conocer si la ausencia de SFB afecta los lisosomas y, por ende, las funciones regulatorias de la homeostasis celular y la posible degradación de macromoléculas, como lípidos, ácidos nucleicos y las proteínas, un inmunomarcaje del principal constituyente de la membrana lisosómica, la proteína de membrana asociada a lisosoma tipo 1 (LAMP1), fue realizada en el presente trabajo. Los resultados revelaron la presencia de los lisosomas en ambas condiciones de cultivo testadas. El hecho que el marcaje lisosomal fue igual de importante en los fibroblastos gingivales cultivados con el medio de cultivo en ausencia de SFB, nos permite afirmar que, probablemente, la homeostasis celular y el proceso de degradación de macromoléculas se conserva en las células fibroblásticas, sometidas a la ausencia de SFB. La detención de LAMP1 podría dar indicios que los lisosomas, determinantes en los procesos de muerte celular, se encuentran en su estado fisiológico, desempeñando un rol activo regulatorio, que favorece la homeostasis celular. Estos resultados distancian de la idea que la ausencia de SFB puede causar un colapso de los lisosomas que desencadenaría en la liberación indiscriminada de enzimas proteolíticas, que inducirían a una necrosis, apoptosis o proceso autofágico (Guicciardi et al. 2004).
Otra organela celular identificada en este estudio, por su vital importancia y variada funcionalidad celular, fue el retículo endoplasmático. El RE, conocido como un sistema de membranas que hace posible el mantenimiento de la homeostasis celular, la síntesis de proteínas asociadas a la membrana, la corrección del plegamiento y la modificación postraduccional de proteínas y glicoproteínas, demostró una mayor expresión en los fibroblastos gingivales, en contacto con el medio de cultivo 1 (DMEM+SFB 10%). Aunque la detención del RE, gracias a la calnexina (proteína involucrada en el plegamiento y control de calidad de glucoproteínas), también estuvo presente en los fibroblastos cultivados con el medio de cultivo 2 o en ausencia de SFB. La identificación de la calnexina, al igual que TOMM20 y LAMP1, indica que la ausencia de SFB no afectaría el funcionamiento de estas organelas celulares, permitiendo avalar la utilización de los fibroblastos gingivales, como modelo de estudios in vitro, en presencia y/o ausencia de SFB. Diversos estudios, donde se desean conservar los aspectos fisiológicos de los fibroblastos gingivales, han optado por la utilización de SFB a 10%, concentración similar a la llevada a cabo en el presente estudio (Soares et al. 2018; Ritchhart & Joy, 2018); sin embargo, con el fin de utilizar los fibroblastos gingivales, como modelos en el desarrollo de diversos procesos patológicos, tales como la mineralización ectópica, muchos estudios optan por disminuir o suprimir la presencia de SFB (Ritchhart & Joy, 2018; Takeuchi et al. 2017; Basso et al. 2017).
A pesar del número reducido de pacientes incluidos en la presente investigación y el empleo exclusivo de análisis descriptivos morfológicos e inmunohistoquímicos, los resultados reportados indican que los fibroblastos gingivales son células capaces de sobrevivir, proliferar y conservar sus características morfológicas, cuando son cultivadas en presencia y ausencia de SFB; in embargo, es claro que la ausencia de SFB disminuye la proliferación de los FGs cultivados. Futuros trabajos investigativos deberán complementar los hallazgos observados aquí y establecer comparaciones con FGs, provenientes de pacientes con alteraciones gingivales localizadas o sistémicas, incluyendo, aquellas de origen genético. Para ello, la identificación y la cuantificación de niveles de expresión génica y de proteínas involucradas en la proliferación celular y su regulación serán de gran utilidad, para comprender el potencial terapéutico de los fibroblastos gingivales.















