INTRODUCCIÓN
Con más de 300 especies válidas, AnastrephaSchiner, 1868, es el género más diverso de los Tephritidae neotropicales y uno de los más diversos de toda la familia (Norrbom et al. 1999a; 1999b; 2012; 2015; 2018a; 2018b; Norrbom, 2004a; Zucchi & Moraes, 2008; Norrbom & Korytkowski, 2009; 2011; 2012; Uramoto et al. 2016; Mengual et al. 2017). Su distribución es exclusiva de los trópicos y subtrópicos americanos, presentando, como límites más al norte, el sur de los Estados Unidos (el Valle del Río Grande de Texas, sur de la Florida) y, más al sur, el norte de Argentina (Hernández-Ortiz & Aluja, 1993; Norrbom et al. 1999a; Hernández-Ortiz, 2007; Norrbom et al. 2012). En Colombia, se registran 83 especies (Rodriguez et al. 2018).
Varias especies del género Anastrepha, se consideran plagas de gran importancia económica, tanto por los daños directos que causan a la producción frutícola como por las restricciones cuarentenarias, que son impuestas a los países exportadores de fruta (White & Elson-Harris, 1992; Norrbom, 2004b; Martínez & Serna, 2005; Martínez-Alava, 2007; Sarmiento et al. 2012; Norrbom et al. 2012).
Toxotrypana, se propuso como género de Tephritidae, con Toxotrypana curvicaudaGerstaecker, 1860, como especie tipo (Norrbom et al. 2018a). Recientemente, con base en estudios morfológicos (Norrbom et al. 1999b, 2018a; b) y moleculares (Mengual et al. 2017), se demuestra que las especies del género Toxotrypana, se relacionan estrechamente con aquellas del género AnastrephaSchiner, 1868 y que Toxotrypana surge dentro de Anastrepha.
En consecuencia, con base en el estudio de Mengual et al. (2017) y Norrbom et al. (2018b) reconocen, formalmente, la sinonimia entre Anastrepha y Toxotrypana y consideran a las especies, previamente clasificadas en Toxotrypana, como el grupo curvicauda de Anastrepha.
El grupo curvicauda, se distribuye exclusivamente en el Neotrópico e incluye siete especies, todas miméticas con avispas (Norrbom et al. 1999a; 2012; Norrbom, 2010). Para la identificación taxonómica de adultos de estas especies, se conocen las claves de Blanchard (1960) y Norrbom et al. (2012).
El grupo curvicauda contiene especies económicamente importantes, como A. curvicauda, una plaga habitual de la papaya (Carica papaya L.). Asimismo, se conoce que las especies del grupo curvicauda se alimentan de semillas en desarrollo y sus tejidos asociados, principalmente, en frutos de las familias Asclepiadaceae, Apocinaceae y Caricaceae, que tienen un epicarpio grueso y producen látex (Weems, 1969; Adarve, 1979; Landolt et al. 1985; Landolt, 1999; Peña et al. 1986; Chuman et al. 1987; Castrejon-Ayala & Camino-Lavin, 1991; Tigrero, 1992; Norrbom, 2010; Norrbom et al. 1999b; Frías et al. 2006).
En el presente trabajo, se hace una descripción morfológica de una especie nueva de Anastrepha grupo curvicauda, a partir de especímenes recolectados en tres localidades de Cundinamarca y de Santander, Colombia.
MATERIALES Y MÉTODOS
Los especímenes, se recolectaron en los municipios de Albán (N4º51'26,8'' W74º25'02,3''; N4º51'49,0'' W74º25'39,7''; N4º50'38,6'' W74º26'52,0'') y Anolaima (N4º48'18,9'' W74º28'40,8''), del departamento de Cundinamarca y el municipio de Vélez (N5º57’30,1'' W73º39’26,1''), departamento de Santander.
Los términos morfológicos usados en este documento, se basan en McAlpine (1981) y White et al. (1999). Para la venación alar, se siguió la nomenclatura de Cumming & Wood (2017) y para las bandas alares, a Stone (1942), White et al. (1999) y Norrbom et al. (2018b). Los nombres de las bandas y franjas dorsales del tórax, se indican en la figura 3a y la venación alar en la figura 3c. Las medidas registradas en la descripción, se tomaron como se indica en Norrbom et al. (2012), con excepción de las siguientes: el ancho del mesonoto es aquí la medida transversal al nivel de la seta notopleural posterior; el ancho de la franja sublateral presutural es una relación del ancho de esta franja al nivel de su mayor amplitud posterior y el ancho de la franja submedial a ese mismo nivel; el ancho de la franja lateral es una relación del ancho de esta franja y el ancho de la franja sublateral postsutural al nivel de la seta supralar postsutural; el ancho del ala es la medida desde el margen anterior hasta el margen posterior al nivel del ápice de la vena R1 y el ancho del aculeus es la medida del ancho al nivel de la mitad de su longitud.
Para el estudio de los genitales, se desprendió y calentó el abdomen en una solución de Hidróxido de Potasio, para luego disecarlos, mediante la metodología de White & Elson-Harris (1992) y Martínez & Serna (2005). Para el examen y toma de fotografías de alas y de genitales, estos apéndices se transfirieron a láminas portaobjetos, con algunas gotas de glicerina y se cubrieron con una laminilla cubreobtejos. Alas y genitales desprendidos, se envasaron con glicerina en un microvial, el cual, se sujetó de manera permanente al mismo alfiler del espécimen. Las medidas, se realizaron con ocular micrométrico.
Las características morfológicas, se estudiaron con un estereomicroscopio NIKON SMZ-1000; para los genitales, se usó un microscopio Olympus CX31.
Las imágenes de cabeza y de tórax, se tomaron con una cámara SONY ILCE-5000, adaptada a un estereomicroscopio NIKON SMZ-1000, mediante uno de los lentes oculares. Las imágenes de los genitales de hembra y de macho, se tomaron con una cámara SONY ILCE-5000, adaptada a un microscopio Olympus CX31. Las imágenes del habitus, se tomaron con una cámara SONY ILCE-5000 y un lente macro Sony E 30mm F3,5. Las imágenes digitales, se apilaron con el programa Helicon Focus® y se editaron con Adobe® Photoshop® CC versión 14,0.
Los acrónimos de las colecciones en las que se depositaron los especímenes son: UNAB-Universidad Nacional Agronomía Bogotá, Museo entomológico de la Facultad de Ciencias Agrarias de la Universidad Nacional de Colombia; FSCA-Florida State Collection of Arthropods, Gainesville; USNM-National Museum of Natural History, Smithsonian Institution, Washington D.C.
Extracción de ADN y secuenciación: El ADN, se extrajo de las patas de un adulto hembra de A. ligiae (referencia USNM: USNMENT01354140) y tejidos abdominales de diez larvas de A. ligiae (referencias FSCA: FF20171101.01-10), mediante los kits Sangre y Tejidos (Qiagen DNeasy). Se desarrollaron PCRs focalizados en la región de código de barras 5’-COI, mediante dos series de cebadores: LCO1490/HCO2198 (Folmer et al. 1994) y C1-J-1632/C1-N-2191 (Kambhampati & Smith, 1995; Simon et al. 1994). Las condiciones de termociclado para LCO1490/HCO2198 fueron: 1) desnaturalización a 95ºC por 2min, (32 ciclos 2-4); 2) 98ºC por 20s; 3) 50ºC por 30s; 4) 72ºC por 30s y 5) extensión final a 72ºC por 7min. Las condiciones de termociclado para C1-J-1632/C1-N-2191 fueron: 1) desnaturalización inicial a 95ºC por 2min, (30 ciclos de 2-4); 2) 98ºC por 20s; 3) 40ºC por 30s; 4) 72ºC por 30s y 5) extensión final a 72ºC por 7min.
Las reacciones positivas del PCR, se purificaron y se prepararon para la secuenciación con química de “BigDye Terminator v3.1 Cycle Sequencing (Applied Biosystems)”. La secuenciación bidireccional fue desarrollada en la plataforma “SeqStudio Genetic Analyzer (Applied Biosystems)”, en la “Division of Plant Industry”, en el Florida Department of Agriculture and Consumer Services, Gainesville, FL, USA. Trazas de las secuencias fueron cortadas y ensambladas en continuo, en el “Sequencer 5.4.6 (Gene Codes Corporation)”. Las nuevas secuencias de barcode de los COI generados fueron depositadas en el GenBank (MK015754-MK015764).
Análisis de Código de barras COI: La secuencia de alineamiento resultante fue de 693bp, para una amplitud de matriz, con nivel de cubrimiento aproximado del 90%. Las distancias genéticas inter e intraespecíficas fueron calculadas usando el modelo Kimura 2-parámetro (K2P) (Kimura, 1980), en MEGA7, con una eliminación parcial de los datos faltantes, mediante el corte del sitio de cobertura en el 95%. Los datos de código de barras del COI fueron también visualizados, mediante la creación de un árbol de neighbor-joining, con los mismos parámetros. La existencia de una brecha en el código de barras fue determinada mediante la comparación de los rangos calculados de distancias K2P intra e interespecíficas, para cada especie.
RESULTADOS Y DISCUSIÓN
Anastrepha ligiae Martínez & Serna, especie nueva

Figura 1 a y b. Habitus en vista dorsal de Anastrepha ligiae: a. (Holotipo); b. (Paratipo, Colombia: Cundinamarca, Albán, Vda. San Rafael, UNAB 4918).

Figura 2 Cabeza de Anastrepha ligiae (Holotipo): a. vista anterior; b. vista lateral; c. vista dorsal.
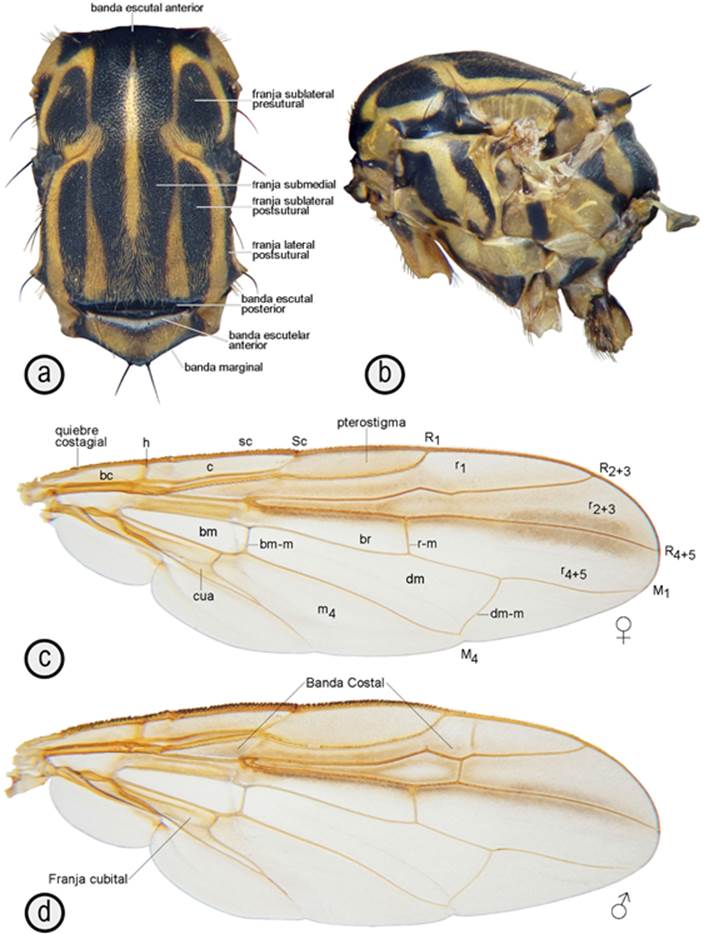
Figura 3 Tórax y ala de Anastrepha ligiae: a. vista dorsal (Holotipo); b. vista lateral (Paratipo macho, Colombia: Cundinamarca, Albán, Vda. San Rafael, UNAB 4918); c. (hembra, Colombia: Cundinamarca, Albán, Vda. San Rafael, UNAB 4979); d. (Paratipo macho, Colombia: Cundinamarca, Albán, Vda. San Rafael, UNAB 4918).

Figura 4 Terminalia de la hembra y macho de Anastrepha ligiae (Paratipo, Colombia: Cundinamarca, Albán, Vda. San Rafael, UNAB 4918): a. Aculeus; b. Punta del aculeus; c. Membrana eversible; d. terminalia del macho vista lateral (epandrio, surstilo, proctiger, prensisetas); e. terminalia del macho vista posterior (epandrio, surstilo, prensisetas).

Figura 5 Árbol de neighbor-joining K2P de Código de barras 5’-CO1 para el grupo especies curvicauda.
Diagnosis. Anastrepha ligiae, se puede distinguir de las otras especies de Anastrepha grupo curvicauda, por la siguiente combinación de caracteres: franjas submediales escutales negras conectadas anteriormente a la banda escutal anterior y proyectadas posteriormente hasta conectarse con la banda escutal posterior, con leve constricción al nivel de la sutura transversa. Anaterguito con franja anteroventral negra. Fémures con manchas marrón oscuro a negras. Oviscapo recto a levemente curvado dorsalmente. Longitud del oviscapo 7,33-9,70mm. Esta especie, se asemeja más a otras no descritas, que también tienen ovipositores, relativamente cortos y casi rectos.
Descripción. Cuerpo amarillento con marcas negras y setas principalmente marrón oscuro a negras (Figura 1).
Cabeza (Figura 2): Amarillenta con marcas marrón oscuro a negras. Vertex con una banda negruzca, anteriormente hasta el nivel de las setas orbitales anteriores o anterior a estas, posteriormente hasta el nivel de la seta vertical medial y lateralmente hasta el ojo. Frente con una mancha oscura subcircular desde la sutura ptilinal extendida posteriormente hasta, aproximadamente, la mitad de la frente y lateralmente hasta las setas frontales. Cara amarillenta con manchas oscuras. Carena facial plana a ligeramente convexa en vista lateral (Figura 2 b), con arrugas transversales (Figura 2 a) y con una mancha desde el nivel del ápice del pedicelo o base del primer flagelómero hasta el margen facial inferior, extendida sobre las esquinas lateroventrales o con una mancha que se extiende desde el nivel de la base del primer flagelómero hasta el margen facial inferior y dividida medialmente, además de dos manchas oscuras sobre las esquinas lateroventrales; en algunos especímenes, se presenta únicamente una mancha tenue al nivel de la mitad proximal del primer flagelómero. Parafacia amarilla, Surcos antenales (Figura 2 a) sin manchas oscuras. Gena (Figura 2 b) con una mancha inferior al ojo, en ocasiones ventrada, hasta las setas genales. Occipucio en vista posterior (Figura 2 c), con un par de manchas diagonales dorsales, que limitan dorsalmente con la seta vertical externa y mesialmente con el esclerito occipital medial y se puede extender más abajo, a lo largo de la sutura, que delimita el esclerito occipital medial hasta una mancha oscura, que cubre la parte posteroventral del occipucio y posterior de la postgena. Esclerito occipital medial con tres manchas oscuras casi contiguas, ubicadas justo superior al foramen occipital; mancha medial casi dos veces la longitud de las manchas laterales y bifurcada dorsalmente; la mancha medial, se puede presentar del mismo tamaño que las manchas laterales o dos veces la longitud de las manchas laterales, pero no bifurcada. Setas de la cabeza (Figura 2), en general, cortas y débiles, de color marrón oscuro a negro; setas ocelares muy débiles o indistinguibles, más cortas que las setas postoculares y, en ocasiones, asimétricas en número; setas postocelares, seta vertical lateral y seta vertical medial presentes; uno o dos pares de setas orbitales pequeñas y débiles; una o dos setas frontales, asimétricas en número, relativamente pequeñas y débiles, de menor tamaño que las setas postocelares. Antenas (Figuras 2 a, b) no extendidas hasta el margen facial ventral, abarcando cerca de 5/6 de la cara. Arista con pubescencia corta, de longitud no mayor al ancho basal de la arista. Clípeo con manchas oscuras irregulares (Figura 2 a). Palpo en vista lateral uniformemente setuloso (Figuras 2 a, b). Labela con manchas oscuras irregulares (Figura 2 b).
Tórax (Figuras 3 a, b): Mesonoto 3,20-3,77mm de longitud; 2,05-2,55mm de ancho al nivel de la seta notopleural posterior; proporción ancho/largo 0,64-0,70. Escuto con depresión medial longitudinal.
Lóbulo postpronotal completamente microtricoso. Escuto mayormente no microtricoso, microtriquias presentes en el notopleurón y sobre el margen lateral postsutural del escuto. Escutelo con microtriquias en el disco, margen lateral y posterior sin microtriquias.
Mesonoto (Figuras 3 a, b): Cubierto de sétulas doradas y negras; setas relativamente pequeñas; setas presuturales supra-alares, acrosticales y escutelares-basales ausentes o indistinguibles de las sétulas circundantes. Setas notopleurales, postsuturales supra-alares, postalares y escutelares-apicales presentes y tan largas o más largas que la longitud del escutelo. Setas postpronotales presentes o ausentes, cuando presentes más cortas que la longitud del escutelo. Setas intra-alares y dorsocentrales presentes, cortas y débiles, de longitud menor o igual a la mitad de la longitud del escutelo. Mesopleurón con parches de sétulas doradas. Setas anepisternales, katepisternales, y anepimerales ausentes o indistinguibles de las sétulas circundantes.
Escuto amarillo con las siguientes marcas negras (Figura 3 a): Banda escutal anterior cubriendo todo el margen escutal anterior, incluyendo la esquina anteromedial del lóbulo postpronotal; franjas submediales conectadas anteriormente a la banda escutal anterior y proyectadas posteriormente hasta conectarse con la banda escutal posterior, con una leve constricción al nivel de la sutura transversa; franjas sublaterales presuturales ensanchadas posteriormente, en su parte posterior de 2,29-3,20 veces el ancho de la franja submedial al mismo nivel; franjas sublaterales postsuturales proyectadas posteriormente hasta conectarse con la banda escutal posterior; banda escutal posterior cubriendo el margen anterior de la sutura escuto-escutelar en toda su extensión, conectada con las franjas submediales y sublaterales postsuturales; franjas laterales postsuturales delgadas, de 0,2-0,3 el ancho de las franjas sublaterales postsuturales al nivel de la seta supra-alar postsutural. Notopleurón negro.
Escutelo (Figuras 3 a, b): Amarillo con banda oscura anterior, que cubre todo el margen posterior de la sutura escuto-escutelar, proyectada posteriormente en su porción media y una banda marginal, que recorre todo el margen lateral y posterior; en ocasiones, esta última se presenta como un par de manchas anterolaterales, que se extienden adelgazadas y tenues sobre el margen del escutelo hasta la base de las setas escutelares apicales o como un par de manchas anterolaterales separadas de otra mancha tenue, confinada al extremo posterior.
Subescutelo y medioterguito negro (Figura 3 b): Anaterguito con una franja negra anteroventrada. Kataterguito, con banda negra en su margen posterior.
Pleura torácica amarillenta con marcas oscuras (Figura 3 b): Proepisternón, con manchas oscuras sobre su margen dorsal, en el margen posterior y limitando con el espiráculo anterior y arriba de la base de la coxa. Proepimerón, con una mancha posterior oscura sobre la base de la coxa. Anepisternón, con 2 bandas negras, la anterior oblicua, desde el espiráculo anterior hasta el ángulo entre la sutura anapleural y el fragma anepisternal y la posterior, desde el notopleurón hasta el katepisternón; la parte dorsal de esta mancha anterior a la sutura anepisternal y el resto de la mancha posterior a la sutura, en ocasiones, interrumpida ventralmente. Katepisternón, con una mancha marrón oscura a negra, desde el nivel de la coxa anterior hasta la base de la coxa media y una mancha oscura sobre el margen posterodorsal del esclerito. Merón, con una mancha oscura inferior. Anepimerón, con una mancha dorsoventrada medial negra, extendida sobre el margen dorsal y anterior, pero más tenue o separada de una pequeña mancha anterior más tenue. Ampolla mayor, principalmente marrón oscuro a negra, en ocasiones, únicamente con una mancha anterior. Proceso pleural alar mayormente marrón oscuro. Metaepisternón, con una mancha sobre el margen posterior a lo largo de la sutura metapleural. Metepimerón de color marrón oscuro a negro.
Patas amarillentas con manchas marrón oscuro. Pata protorácica: coxa con una mancha anterobasal; trocánter amarillento; fémur con mancha distal oscura; tibia marrón oscuro; basitarso marrón claro y restantes tarsómeros amarillentos. Pata mesotorácica: coxa con mancha oscura posterobasal; trocánter con mancha oscura tenue sobre la superficie posterior; fémur con mancha marrón oscuro posterodistal y una mancha tenue anterodistal; tibia amarillenta con mancha oscura postero-proximal; tarso amarillento. Pata metatorácica: coxa y trocánter mayormente oscuro; fémur con superficie posterior marrón oscuro y superficie anterior con mancha distal; tibia con superficie posterior marrón oscuro y amarillenta discalmente, tarso amarillento. Sétulas mayormente marrón oscuro en la pata protorácica y amarillentas a doradas en las patas meso y metatorácicas; de longitud no mayor al ancho máximo de las tibias y sin setas sobresalientes. Tibias y tarsos densamente cubiertos de sétulas robustas y fémur con sétulas más finas y menos densamente cubierto. Probasitarso más ancho que meso- y metabasitarso.
Alas (Figuras 3 c, d): Longitud 9,88-12,18mm; ancho 3,07-4,10mm; proporción del ancho y la longitud del ala 0,25-0,35. Vena Costal solo en el macho, desde el quiebre costagial hasta el ápice de la vena R1, con 3-4 hileras de setas robustas, mucho más robustas que las setas circundantes; ápice de R1 a 0,61-0,64 de la longitud total del ala; celda c 0,85-1,09 veces tan larga como el pterostigma; pterostigma 4,85-5,80 veces tan largo como ancho; R2+3 fuertemente sinuosa, con venas espurias surgiendo de estas sinuosidades; M1 levemente curvada anteriormente en el ápice; proporción de la distancia de bm-m a r-m sobre la distancia de bm-m a dm-m 0,66-0,67; vena r-m proximal al ápice de R1 o al mismo nivel, con el extremo anterior más proximal que el extremo posterior; dm-m sinuosa y con el extremo anterior más distal que el posterior; celda cua con extensión posterodistal larga y aguda, 2,3-2,7 veces el ancho de la celda. Patrón de coloración alar principalmente marrón claro con tonalidad más oscura sobre el margen posterior de R4+5; banda Costal ancha, continua sobre el margen anterior del ala, desde la base hasta el ápice, cubriendo completamente las celdas bc, c, sc, r1, r2+3; el ancho de la celda br desde el nivel de la vena humeral (h) hasta el nivel del ápice de la vena bm-m y continuándose sobre el margen anterior de esta celda y la celda r4+5: banda S reducida a una banda débil sobre la celda cua y la base de la celda m4 (franja cubital); banda V ausente. Halterio amarillento con el capítulo marrón oscuro.
Abdomen de la hembra (Figuras 1 a, 4a-c): peciolado (Figura 1 a), con fuerte constricción en ¼ anterior del sinterguito 1+2 y amplitud mayor en el segmento 4; terguitos abdominales amarillentos con amplias bandas negras; sinterguito 1+2 marrón oscuro anterior a la constricción, con banda negra amplia posterior a la constricción y margen posterior amarillento; terguitos 3-5 con banda negra amplia y margen posterior amarillento; terguito 6 completamente amarillento. Terguitos cubiertos de sétulas marrón oscuro a negras sobre las bandas negras y sétulas amarillentas a doradas sobre las bandas amarillentas; margen lateral del terguito 3 y margen lateral y posterior de los terguitos 4-6 con setas marrón oscuro sobresalientes. Esternitos abdominales amarillentos, con manchas marrón oscuro; esternito 1 con márgenes laterales y mitad posterior marrón oscuro; esternito 2 completamente amarillento; esternitos 3-6 con margen anterior oscurecido. Esternitos cubiertos mayormente con sétulas amarillas a doradas; con setas sobresalientes marrón oscuro sobre el margen posterior de los esternitos 3-6. Oviscapo marrón claro, con el extremo basal dorsal y lateral marrón oscuro y la mitad basoventral mayormente amarillenta; cubierto de sétulas marrón oscuro; con curvatura dorsal leve a moderada y engrosado basalmente; más largo que el abdomen; de longitud 7,33-9,70mm, 2,45-2,57 veces la longitud del mesonoto; distancia desde el extremo anterior del oviscapo a los espiráculos 1,29-1,42mm; membrana eversible (Figura 4 c), con 34-40 ganchos dorsobasales en patrón semicircular, con cuatro hileras irregulares, moderadamente largos y esclerotizados. Aculeus (Figura 4 a) en vista ventral de lados paralelos, extremo basal ligeramente expandido; longitud del aculeus 6,98-9,0mm; ancho del aculeus 0,15-0,19mm en la mitad de su longitud. Punta del aculeus (Figura 4 b) 0,25-0,30mm de longitud, 0,03-0,04 veces longitud del aculeus; 0,15-0,18mm de ancho, 0,57-0,63 veces más largo que ancho; basalmente ligeramente expandido, triangular, de márgenes serrados y rectos, con 41-45 dientes diminutos, irregulares; base del margen serrado redondeada; ancho de la punta del aculeus al nivel del inicio del margen serrado 0,18-0,20mm; longitud del margen serrado de la punta del aculeus 0,19-0,22mm. Proporción de la longitud del margen serrado de la punta del aculeus sobre el largo de la punta 0,73-0,76.
Abdomen del macho peciolado (Figura 1 b), con fuerte constricción en ¼ anterior del sinterguito 1+2 y amplitud mayor en el segmento 4. Terguitos abdominales amarillentos con amplias bandas negras; sinterguito 1+2 marrón oscuro anterior a la constricción, banda negra amplia posterior a la constricción y margen posterior amarillento; terguitos 3-4 con banda negra amplia y margen posterior amarillento; terguito 5 con una mancha medial marrón oscura ensanchada lateralmente hacia el extremo anterior; terguitos cubiertos mayormente de setas amarillentas a doradas, margen lateral de todos los terguitos y el margen lateral y posterior de los terguitos 4-5 con setas robustas sobresalientes marrón oscuro. Esternitos abdominales amarillentos con manchas marrón oscuro; esternito 1, con los márgenes laterales y la mitad posterior marrón oscuro; esternito 2 completamente amarillento; esternitos 3-5, con el margen anterior oscurecido. Esternitos cubiertos mayormente con sétulas amarillas a doradas, con setas sobresalientes marrón oscuro sobre el margen posterior de los esternitos 3-5. Epandrio en vista lateral más corto que alto (Figura 4 d); con el margen posterodorsal redondeado. Surstilo lateral extremadamente corto, extendido más allá de las prensisetas por 0,2 veces la longitud de la prensiseta (Figuras 4 d, e); en vista lateral ápice truncado; en vista posterior con el ápice romo; margen medial y lateral convexos. Proctiger con las áreas esclerotizadas ventrales y laterales conectadas (Figura 4 d). Longitud del falo 14,55mm, 3,86 veces el largo del mesonoto; longitud del glans 0,53mm.
Distribución. Anastrepha ligiae, se conoce únicamente en Colombia, para las localidades aquí registradas, en Cundinamarca y en Santander, entre los 1.500 y 2.600m s.n.m., sobre la Cordillera Oriental de los Andes colombianos.
Hospedante. Las larvas, se observaron alimentándose de semillas de Vasconcellea pubescens A. DC., (Caricaceae); este es el primer registro de esta planta hospedante para el género Anastrepha.
Material tipo. Holotipo hembra COLOMBIA: Cundinamarca: Albán, Vda. San Rafael, Fca. Villa Rosita, N4º50’38,6’’ W74º26’52,0’’, 2225m, criado en papayuela - Vasconcellea pubescens (Caricaceae), 10-Jun-2018, J. Martínez (UNAB 4917). Paratipos (n= 18): COLOMBIA: Cundinamarca: Albán, Vda. San Rafael, Fca. Villa Rosita, N4º50’38,6’’ W74º26’52,0’’, 2225m, criado en papayuela - Vasconcellea pubescens (Caricaceae), 10-Jun-2018, J. Martínez, 6♀ 6♂ (UNAB 4918); datos iguales, 1♀ 1♂ (FSCA UNAB 4918); datos iguales, en trampa McPhail con proteína hidrolizada, 10-Jun-2018, J. Martínez, 1♀ 1♂ (UNAB 4918); datos iguales, Vda. Los Alpes, Fca. Casa de Teja, N4°51’26,8’’ W74°25’02,3’’, 2640m, criado en papayuela - Vasconcellea pubescens (Caricaceae), 10-Jun-2018, J. Martínez, 1♀ 3♂ (UNAB 4919); Albán-Corralejas, 4°50'40.1"N 74°26'52,4"W, 2216m, 8 Oct 2017, F. Serna y D. Cubillos, captura manual en frutos de papayuela. 3♀ (USNM USNMENT01354140-42); Anolaima, Vda. Santo Domingo, Fca. El Porvenir, N4º48’18,9’’ W74º28’40,8’’, 1553m, en trampa McPhail con proteína hidrolizada, 13-Jun-2015, J. Martínez, 1♀ (UNAB 4920); Santander: Vélez, Vda. Aco Peña Blanca, Fca. La Unión, N5º57’30,1’’ W73º39’26,1’’, 1836m, en trampa McPhail con TML+Torula, 1-Mar-1-Sep-2008, L. Núñez, 1♀ (UNAB 4921).
Otros especímenes examinados. COLOMBIA: Cundinamarca: Albán, Vda. Los Alpes, Fca. Normandía, N 4º 51’ 49,0’’ W 74º 25’ 39,7’’, 2391m, en Trampa McPhail, con proteína hidrolizada en papayuela - Vasconcellea pubescens (Caricaceae), 20-may-2018, J. Martínez, 1♀ (UNAB 4974); datos iguales, 04-jun-2018, J. Martínez, 1♂ (UNAB 4975); datos iguales, criado en papayuela - Vasconcellea pubescens (Caricaceae), 04-jun-2018, J. Martínez, 2♀ 2♂ (UNAB 4976); datos iguales, Fca. Casa de Teja, N 4º 51’ 26,8’’ W 74º25’ 02,3’’, 2640m, criado en papayuela - Vasconcellea pubescens (Caricaceae) 04-jun-2018, J. Martínez, 4♂ (UNAB 4978); datos iguales, Fca. Villa Rosita, N 4º 50’ 38,6’ W 74º 26’ 52,0’’, 2225m, en Trampa McPhail con proteína hidrolizada, 27-may-2018, J. Martínez, 2♀ 1♂ (UNAB 4979); datos iguales, 10-jun-2018, J. Martínez, 2♀ 1♂ (UNAB 4981); datos iguales, criado en papayuela - Vasconcellea pubescens (Caricaceae), 04-jun-2018, J. Martínez, 1♂ (UNAB 4980).
Etimología. El nombre de esta especie es en honor a la Dra. Ligia Núñez-Bueno, por su notable contribución al conocimiento del género Anastrepha en Colombia y su incesante trabajo con insectos de importancia agrícola.
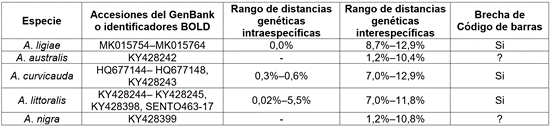
Análisis del Código de barras COI. Representando cinco especies, 24 códigos de barras 5’-COI del grupo curvicauda estuvieron disponibles para el análisis. Las especies A. australis y A. nigra estuvieron representadas por un único código de barras. La variación intraespecífica, cuando fue posible calcularla, fue generalmente baja. Los rangos de distancias intraespecíficas variaron desde 0% (A. ligiae) hasta 5,5% (A. littoralis) (Tabla 1; Figura 5). Los rangos de distancias genéticas variaron desde 1,2% (A. australis y A. nigra) hasta 12,9% (A. ligiae y A. curvicauda) (Tabla 1; Figura 5). Para las especies A. ligiae, A. curvicauda, y A. littoralis existe una brecha de código de barras, aunque basada relativamente en pocas secuencias. Para establecer la existencia de una brecha de código de barras entre las especies A. nigra and A. australis, se necesitará mayor muestreo.
Tabla 1 Anastrepha grupo especies curvicauda, identificación de secuencias y cálculos de distancias de secuencias de códigos de barras de COI.
Comentarios. Anastrepha ligiae pertenece al grupo curvicauda (=Toxotrypana), cuyas especies se pueden reconocer por la siguiente combinación de caracteres, según Norrbom et al. (2012): cuerpo amarillo con manchas marrón oscuras o predominantemente marrones; patrón del ala con una sola banda costal ancha, que se extiende a lo largo del margen anterior del ala y una franja débil en la celda cua y m4; escuto con depresión medial longitudinal; vena R2+3 con 3 sinuosidades fuertes, por lo general, con venas espurias, surgiendo, de estas, sinuosidades; la mayoría de las setas de la cabeza y el tórax de tamaño reducido o ausentes; vena costal del ala del macho, por lo general, con setas robustas; abdomen alargado y peciolado, el primer segmento (sinterguito 1 + 2), estrechado medialmente.
Las relaciones entre las especies dentro del grupo curvicauda, se sugieren en la figura 5, que indica que A. ligiae está relacionada con A. nigra y A. australis, mientras A. curvicauda y A. littoralis, otro clado aparte de especies, cercanamente relacionadas.















