INTRODUCCIÓN
Los brotes de enfermedades fúngicas y el ataque de insectos conducen al detrimento en la calidad de los bienes y servicios que las plantas ofrecen, bajo condiciones estables (Nárdiz & De Cal, 2006). Es por ello, que desde el 2010, se presta especial atención al estado fitosanitario de las poblaciones de frailejón Espeletia sp. (Asteraceae), presentes en los ecosistemas paramunos andinos, debido a que reportan síntomas, como deformación de lámina foliar, clorosis, pudrición radicular y necrosis que, posiblemente, estén asociados con la presencia de hongos fitopatógenos y a la herbivoría por parte de insectos de los órdenes Lepidoptera y Coleoptera (Salinas et al. 2013; Varela, 2014) y que pueden poner en riesgo la prestación de servicios ecosistémicos, como la regulación hídrica.
En 2017 surge el primer reporte de síntomas en frailejones del sur del país, en el páramo de Paja Blanca (Nariño), en la especie Espeletia pycnophylla; sin embargo, no se cuenta con información sobre la entomofauna asociada a esta especie de frailejón, previo a la aparición de los síntomas, hecho que dificulta determinar si ha ocurrido o no una modificación en la composición de insectos, que pueda estar relacionada con la actual condición de E. pycnophylla; además, se desconoce si las especies de hongos presentes en el cuerpo de los insectos se han reportado previamente en frailejones con síntomas de diferentes páramos, información necesaria para establecer si los insectos pueden facilitar el ingreso y la colonización de fitopatógenos en la planta (Tack & Dicke, 2013).
Dado que resulta indispensable comprender la dinámica del problema fitosanitario en E. pycnophylla, la presente investigación hace énfasis en la interacción entre insectos, hongos y frailejones, puesto que, se presume, que tanto la composición de insectos como de sus hongos asociados pueden variar, de acuerdo con el estado de salud de la población de frailejones (Ulyshen, 2016). En este sentido, los objetivos de la presente investigación fueron identificar cambios en las comunidades de insectos asociados a E. pycnophylla sin síntomas y con síntomas evidentes y evaluar si estos cambios en las comunidades de insectos se reflejan en los hongos asociados.
MATERIALES Y MÉTODOS
Área de estudio. El área de estudio corresponde a zonas del páramo de Paja Blanca con presencia de poblaciones sintomáticas, ubicadas en el municipio de Gualmatán (Nariño, Colombia) (Figura 1). Los límites altitudinales del páramo van desde los 3.200 a 3.650m. s.n.m., en los que domina vegetación achaparrada, asociaciones Pajonal-matorral, frailejonal y pajonal y las temperaturas medias anuales oscilan entre los 10,2 y 11,6ºC (Muñoz-Guerrero, 2017).
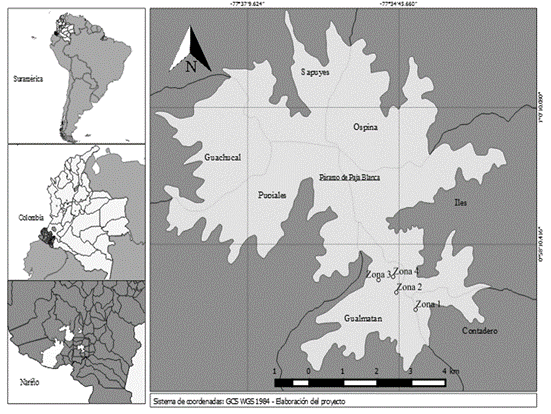
Figura 1 Localización del área de estudio y de las zonas de colecta, ubicadas en el páramo de Paja Blanca, Nariño (Colombia).
Colecta e identificación de insectos. El muestreo, se realizó en época seca del 2018, en cuatro zonas del páramo; en cada una, se seleccionaron seis frailejones sanos y seis con síntomas de clorosis, deformación y necrosis foliar. Los frailejones seleccionados presentaron alturas entre 70-90cm. En cada frailejón, se colectaron, de forma manual, insectos en estado adulto, tanto en la roseta como en la necromasa, los cuales, fueron dispuestos en viales plásticos estériles.
Los insectos, se identificaron hasta el nivel taxonómico más detallado posible, en los laboratorios de la Universidad de Nariño, mediante guías y claves taxonómicas (Triplehorn & Johnson, 2004; Fernández & Mason, 2006), comparación con material de referencia, que reposa en la Colección Entomológica de la Universidad de Nariño CEUN y la colaboración de especialistas.
Análisis ecológico. La diversidad alfa de los insectos colectados en frailejones sanos y con síntomas, se calculó con base en los números de Hill, donde la diversidad se expresa como qD, que se basa en el número efectivo de especies, donde q determina la influencia de la abundancia de las morfoespecies sobre los valores de diversidad. La diversidad de orden q=0 representa la riqueza, la diversidad de orden q=1, le da peso a las especies típicas y se calcula como el exponencial del índice de entropía de Shannon y la diversidad de orden q=2, que le da mayor peso a las especies dominantes y se calcula con el inverso del índice de Simpson (Jost, 2006).
Para identificar el recambio de taxones entre los dos estados de frailejón evaluados, se aplicó el índice de similitud de Jaccard, mediante, el cual, es posible expresar el grado de semejanza de los individuos contenidos en dos muestras diferentes. Este coeficiente toma valores entre 0, cuando las muestras no comparten taxones y 1, cuando tienen la misma composición de especies (Moreno et al. 2011). Estos análisis, se realizaron con el paquete “iNEXT” del programa estadístico R 3.3.0 (Chao et al. 2014).
Cultivo de hongos a partir de estructuras de insectos. De cada taxón de insecto, se extrajeron piezas bucales y el canal alimentario. Se maceraron con agua estéril y se sembró 0,1mL, en medio de cultivo PDA (agar dextrosa papa), con rifampicina. Los exoesqueletos de cada taxón de insecto, se lavaron con agua estéril en tubos Eppendorf y se llevaron a vortex, por un minuto. Del agua resultante del lavado, se sembró 0,1mL, en medio PDA. Todos los cultivos, se incubaron a 15°C y humedad relativa de 80% durante, aproximadamente, cinco días (Jaber et al. 2016).
Identificación morfológica y molecular de hongos. Las colonias emergentes se purificaron y tras su crecimiento, se identificaron hasta el nivel de género, mediante el uso de claves taxonómicas (Barnett & Hunter, 1998; Cepero de García et al. 2012). A partir de cultivos monospóricos, se extrajo y se purificó ADN, siguiendo el protocolo propuesto por Griffith & Shaw (1998).
Para la amplificación de la región ITS del ADNr, se usaron los cebadores universales ITS1 e ITS4, descritos por White et al. (1990) y Álvarez-López et al. (2013). El volumen de la solución final para amplificación por PCR fue de 25µL (12,5µL, de OneTaq Quick Load 2X Máster Mix/Standard Buffer - Promega; 1µL de cada cebador; 1µL de BSA y 2µL de la muestra de ADN (100ng/µL)). El producto, se visualizó por electroforesis en gel de agarosa 1,2% con 1µL de Hydragreen®. El gel, se corrió a 70V, durante 40 minutos. Los tamaños de las bandas, se compararon con un marcador de 100pb (Checa et al. 2015). Los productos de PCR, se secuenciaron por el método de Sanger, enviando las muestras al centro de investigación Corpogen (Bogotá, Colombia).
La búsqueda de identidad con otras secuencias reportadas en la base de datos de GenBank, se realizó mediante el programa BLAST (Basic Local Alignment Search Tool), del NCBI. Los hongos identificados fueron ingresados al cepario de la Universidad de Nariño.
Mediante revisión de literatura de los taxones de insectos identificados, las estructuras corporales y los hongos identificados, se relacionaron los resultados con el estado de E. pycnophylla del páramo de Paja Blanca.
RESULTADOS Y DISCUSIÓN
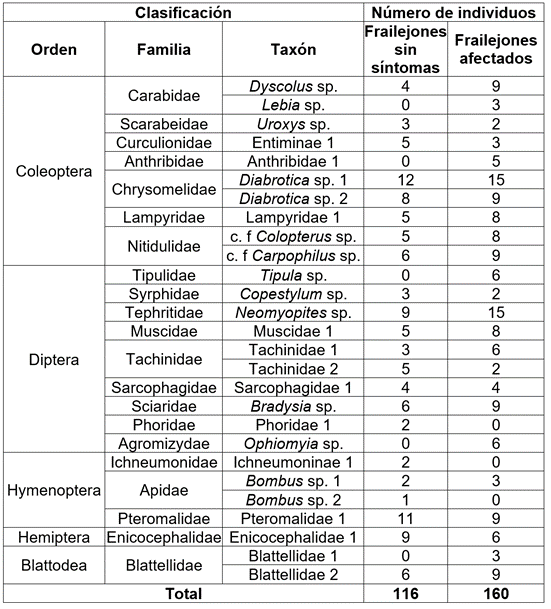
Análisis ecológico insectos. De los 276 individuos colectados, el 75% corresponde a los órdenes Diptera y Coleoptera y, la gran mayoría, estuvieron presentes, tanto en frailejones sanos como afectados (Tabla 1). Alzate (2010) afirma que la riqueza y abundancia de Coleoptera y Diptera, se debe a la alta disponibilidad de materia orgánica en descomposición aprovechable; asimismo, Amat-García & Ríos-Vargas (1991) proponen que la dominancia de estos órdenes, se atribuye a las condiciones de humedad que presenta, tanto la roseta como la necromasa y que resultan adecuadas para los diferentes estados de desarrollo.
Tabla 1 Identificación de insectos asociados a plantas de Espeletia pycnophylla sanas y afectadas, del páramo de Paja Blanca (Nariño, Colombia).
Los valores de diversidad en términos de los números de Hill (q0, q1 y q2), para insectos colectados en frailejones sanos, fueron de 22, 18,85 y 16,6, respectivamente y de 25, 21,2 18,8, para frailejones afectados y de acuerdo con los intervalos de confianza, no se detectaron diferencias significativas (Figura 2). En consecuencia, la riqueza, la diversidad y la dominancia de taxones fue similar en los dos estados de frailejones muestreados, por lo que se infiere que los frailejones sintomáticos no se encuentran en un estado de daño en sus estructuras, que de paso a la colonización y la dominancia de insectos, propios de un estado de descomposición avanzado y que, por el contrario, aún mantienen condiciones adecuadas, que le permiten ser hábitat de diferentes taxones de insectos. La diversidad de la entomofauna puede ser un reflejo del estado de conservación en que se encuentran los frailejones, puesto que, en condiciones de baja intervención antrópica, donde la vegetación de páramo se ha desarrollado durante largos periodos de tiempo, la diversidad de la artropofauna encuentra una mayor homogeneidad ambiental y diversidad de recursos (Eraso-Puentes & Amarillo-Suárez, 2016).
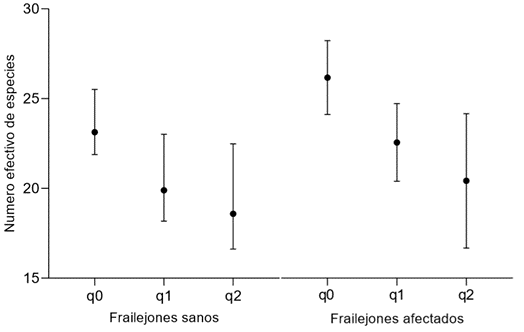
Figura 2 Perfiles de diversidad para frailejones sanos y afectados. Los puntos indican las medias y las líneas horizontales en cada intervalo representan los valores máximos y mínimos, con una significancia del 95%.
El recambio de especies arrojó un valor de similitud de 0,7, de manera que no se identificó mayor variación en la composición de insectos, que se pueda atribuir al estado de afectación de los frailejones evaluados. Los resultados obtenidos contrastan con los de Camacho & Marroquin (2016), en Espeletia lopezii, del Parque Nacional Natural el Cocuy, en donde se evaluó la composición de coleópteros, en tres estados fitosanitarios: muertos, enfermos y sanos, concluyendo que, en estado sano, existe una mayor diversidad de coleópteros, mientras que en el estado de descomposición más avanzado, hay dominancia de coleópteros Entiminae (Curculionidae) y Barinidae.
Hongos identificados. La identificación morfológica y molecular permitió reconocer 10 taxones hasta el nivel de especie y 11, a nivel de género (Tabla 2).
Tabla 2 Identidad, porcentaje de similitud, código de accesión (GenBank) y código de colección de los hongos aislados de diferentes estructuras de insectos asociados a frailejones sin síntomas y afectados, del páramo de Paja Blanca (Nariño, Colombia).
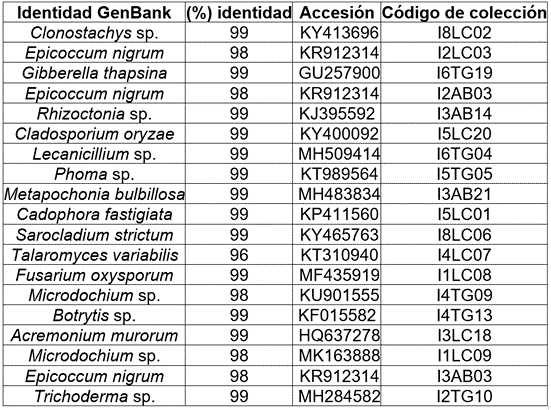
Los géneros Paecilomyces sp., Penicillium sp. y Trichoderma sp., se reportan en E. grandiflora y tienen capacidad biocontroladora sobre fitopatógenos, como Fusarium oxysporum (Miles et al. 2012). Epicoccum, endófito de Espeletia spp. (Cabezas et al. 2012; Varela, 2014; Flores-Bazauri et al. 2015), evidencia potencial biocontralador sobre F. oxysporum y Rhizoctonia solani (Ogórek & Plaskowsk, 2011). Talaromyces variabilis, se emplea en la producción de antibióticos (Dutta et al. 2014), Clonostachys sp. tiene capacidad de inhibir in vitro el crecimiento de F. oxysporum y Phoma sp. y Mucor sp., se han aislado de Espeletia grandiflora y pueden ser empleados como potenciales controladores de hongos fitopatógenos (Anacona et al. 2005).
Fusarium sp. contiene especies endófitas y fitopatógenas. Algunas especies endófitas tienen potencial para ser utilizados como controladores biológicos de insectos u otros hongos, mientras que las especies fitopatógenas generan pérdidas económicas significativas, debido al devastador impacto que pueden tener en las cosechas (Villa-Martínez et al. 2015); por ejemplo, Fusarium oxysporum, causante de marchitez vascular en una amplia gama de cultivos (Vásquez-Ramírez & Castaño-Zapata, 2017).
Botrytis sp. causa estrangulamiento del tallo, manchas y pudrición de raíces, se asocia con la pudrición foliar de Espeletia grandiflora (García-Castañeda et al. 2015) y al igual que Cladosporium sp., es un posible causante de la pérdida de pubescencia foliar en Espeletia paipana (Buitrago et al. 2015). Rhizoctonia sp. ataca a las plantas de cultivo, a nivel de las raíces, generando manchas necróticas, que se desarrollan hasta los tallos y los pecíolos de las hojas, causando la caída y muerte de la planta (Lahlali & Hijri, 2010).
Relación entre hongos aislados y estructuras corporales de insectos. Se logró aislar un total de 17 taxones de hongos entre géneros y especies, a partir del aparato bucal, el canal alimentario y exoesqueleto de insectos, presentes en frailejones afectados (Tabla 3) y 11 taxones de hongos entre géneros y especies, a partir de las estructuras mencionadas de insectos, presentes en frailejones sin síntomas (Tabla 4).
Tabla 3 Hongos aislados de estructuras de insectos presentes en plantas de E. pycnophylla afectadas, del páramo de Paja Blanca (Nariño). A.B= aparato bucal; C.A canal alimentario y L.C=lavado del cuerpo.
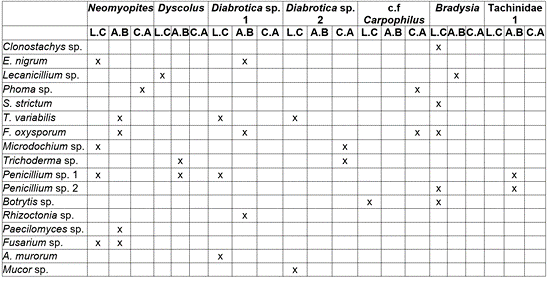
Tabla 4 Hongos aislados de estructuras de insectos presentes en plantas de E. pycnophylla sin afectación, del páramo de Paja Blanca (Nariño). A.B= aparato bucal; C.A=canal alimentario y L.C=lavado del cuerpo.

El aparato bucal chupador del género Neomyopites le permite absorber líquidos de las frutas, los carbohidratos y los nutrientes, que son liberados por las hojas de las plantas. La alimentación, a través de una probóscide, implica el contacto de esta estructura con el sustrato que, en el caso de encontrarse contaminado, puede facilitar la dispersión de hongos (Coronado-Gonzalez et al. 2009).
Especies del género Dyscolus sp., se reportan en Espeletia argentea, del Parque Nacional Natural Páramo de Chingaza, ingresando a la planta por cavidades que construyen en la base de la roseta, produciendo daño a hojas maduras. Posiblemente, la presencia de fitopatógenos en su aparato bucal, se deba al consumo de otros invertebrados, como Collembola, larvas de Lepidoptera y Psocoptera, que se pudieron alimentar de tejidos de plantas afectadas y cuyas esporas presentes en el cuerpo pudieron entrar en contacto con las mandíbulas del depredador (Matta et al. 2017).
Los géneros de insectos con aislamientos de fitopatógenos, a partir de lavados de cuerpo, fueron Neomyopites, Dyscolus y Bradysia. Neomyopites sp. no presenta reportes como trasmisor mecánico; sin embargo, cabe mencionar el caso de Anastrepha fraterculus, que pertenece a la misma tribu Myopitinii, cuyas hembras ovopositan en frutos de uva, facilitando el ingreso de fitopatógenos, que causan la caída del fruto, como Cladosporium spp., Botrytis cinerea, Fusarium spp. y Rhizopus spp., que se aislaron a partir de patas, alas, cabeza y ovopositor (Machota et al. 2013). Posiblemente, las setas en el cuerpo de Neomyopites sp., igualmente, faciliten la adhesión de esporas de hongos y su posterior dispersión.
La capacidad de transportar patógenos de Bradysia sp., se ha documentado en Eucalyptus spp., donde las plántulas son afectadas, tanto por herbivoría de larvas como por la dispersión de hongos patógenos. El tipo de microorganismo que es transmitido, depende del estado de desarrollo de Bradysia sp., de manera que los adultos pueden transportar, en su cuerpo, conidias de hongos patógenos, que producen estadios de dispersión aérea, como B. cinerea, F. oxysporum que, luego, se pueden transmitir a plantas sanas (Gillespie & Menzies, 1993; Santos et al. 2012).
Shamshad et al. (2009) explican que Bradysia ocellaris tiene mayor capacidad de carga de esporas que Lycoriella ingenua (Sciaridae), ya que, la primera, presenta una hilera de cerdas a manera de peine en las tibias delanteras, que facilitan la adhesión de esporas.
Como se ha mencionado, Dyscolus sp. se puede encontrar en Espeletia sp. depredando otros artrópodos; la explicación de la presencia de fitopatógenos se puede argumentar, teniendo en cuenta que la capacidad de carga de inóculo está relacionada, además, con el tamaño del individuo, el área de superficie y la anatomía del insecto. Teniendo en cuenta que entre los insectos colectados Dyscolus sp. es el de mayor tamaño, se puede esperar que tenga esporas asociadas a su cuerpo (Schweigkofler et al. 2005).
El aislamiento de hongos a partir del canal alimentario es una aproximación a la capacidad de los hongos de mantenerse viables en el interior de los insectos y a que, posiblemente, se puedan mantener infectivas en sus deposiciones que, de llevarse a cabo sobre plantas sanas, contribuiría a la dispersión de hongos fitopatógenos, tal como ocurre en larvas del género Bradysia, en las que se ha documentado la capacidad de consumo de tejidos de raíz afectados con fitopatógenos, como el Oomycete Pythium sp., cuyas oosporas pueden sobrevivir en el canal alimentario y mantenerse viables después del proceso de excreción (Hyder et al. 2009).
El estudio de la diversidad de insectos en ecosistemas de páramo aporta al conocimiento de este grupo en regiones poco exploradas, permitiendo reconocer que hay una gran diversidad taxonómica y que existe la necesidad de profundizar en los inventarios, abordando diferentes variables, que permitan tener un mayor entendimiento sobre posibles patrones en la distribución de insectos que aporten información, que pueda ser utilizada en la formulación y en la ejecución de estrategias encaminadas a la conservación de ecosistemas de gran importancia, como son los páramos.
Se recomienda plantear, a futuro, investigaciones que profundicen en el papel de los insectos en la dispersión de fitopatógenos, partiendo de las reglas para determinar si un insecto es vector de un patógeno vegetal, propuestas por Leach (1940), que plantean, en primer lugar, una asociación estrecha entre el insecto con la planta enferma; segundo, registrar si el insecto debe realiza visitas periódicas a plantas sanas; tercero, el insecto debe estar asociado con el patógeno que causa la enfermedad en cuestión y, cuarto, confirmar que la visita de plantas sanas por insectos infestados de patógenos resulta en el desarrollo de la enfermedad.















