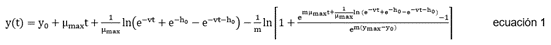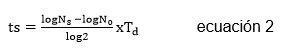INTRODUCCIÓN
Uno de los grandes intereses por parte de la industria alimenticia es la prolongación de la vida útil de los alimentos, sin comprometer su estructura, conservando las características propias, como el color, el aroma, el sabor y la textura, así como sus componentes nutricionales. Las biopelículas (BP), se presentan como una interesante alternativa para la conservación de los alimentos y solución frente a la problemática medio ambiental que polímeros sintéticos causan, debido a su prolongado periodo de degradación y toxicidad (González et al. 2016).
Existe una variedad de materiales empleados para el diseño de BP; entre los principales, se encuentran proteínas, lípidos, polisacáridos y sus mezclas (Costa et al. 2018). Dentro de los polisacáridos, el carragenato es uno de los más utilizados para el diseño de BP. Es un biopolímero lineal aniónico soluble en agua, obtenido a partir de algas rojas, que promueven la formación de geles, a través de un proceso de secado moderado, en el que se evapora el disolvente, formando una red tridimensional, a partir de la liberación de dobles hélices, formando una película sólida con capacidad de retención de agua y una estructura superficial homogénea (Gie et al. 2018; Osorio et al. 2017).
Las biopelículas activas (BPA) son un segmento interesante en el área de empaques, que consiste en la adición de compuestos activos con propiedades antimicrobianas y antioxidantes (Arnon & Poverenov, 2018). Estos compuestos activos pueden ser extraídos de plantas, como el matarratón (Gliricidia sepium), un árbol caducifolio, perteneciente a la familia de las leguminosas, nativo de Meso América, Centroamérica y del norte de Sudamérica, que logra alcanzar alturas de hasta 12 metros (Patil et al. 2015). Dentro de su composición, se ha reportado la presencia de pinitol, cumarinas, hidrocarburos, flavonas, isoflavonas, pterocarpanos y flavonoides glucosídicos, en hojas y raíces (Kabore et al. 2012; Von Son-de Fernex et al. 2017). Entre sus aplicaciones, se encuentran propiedades bioactivas, como antioxidante, antimicrobiano e insecticidas (Patil et al 2015; Ríos- De Álvarez et al. 2012; Sinha, 2013).
La desventaja de las BPA, se presenta al momento de su elaboración, en el que parte del compuesto activo se pierde producto de la evaporación, limitando, de esta forma, la acción antimicrobiana de la BPA (Peralta et al. 2015), por lo que se plantea proteger el principio activo, mediante la microencapsulación, dado que esta técnica permite retenerlo dentro de una membrana fuerte, semipermeable y esférica, con diámetros que van desde micras hasta 1mm (Cano et al. 2016; Castro-Rosas et al. 2017). De esta forma, el principio activo, se contiene por más tiempo, evitando las pérdidas por procesamiento, para luego liberarse de forma gradual y controlada en un medio definido, mediante tecnologías emergentes, como el ultrasonido.
El ultrasonido (US) es el nombre que reciben las ondas sonoras con frecuencias mayores a aquellas que pueden ser detectadas por el oído humano. Es una forma de energía que viaja en ondas de sonido iguales o mayores a 20.000 vibraciones por segundo (Hoover, 2000; Bermúdez-Aguirre & Barbosa-Cánovas, 2008; Rezek et al. 2008; Arroyo et al. 2011). El US ha sido utilizado ampliamente en procesos de extracción de compuestos, a partir de material vegetal (De Sousa et al. 2020). El principal efecto del US en los procesos de extracción es el incremento de la permeabilidad del material, que contiene el compuesto a extraer. A medida que la temperatura aumenta, se forman burbujas de cavitación, que colapsan y aumentan la presión, conllevando a una ruptura del material, facilitando la penetración del disolvente en la matriz, por tanto, hay un mayor contacto del disolvente con el analito, promoviendo una mayor solubilidad (Huang et al. 2019).
Por otra parte, el queso costeño es un producto autóctono de la Costa Caribe Colombiana, región que se caracteriza por una alta producción de leche bovina (aproximadamente, el 60% de la producción total del país). Se caracteriza por ser una variedad de queso no madurado, es decir, fresco, elaborado con leche de vaca sin pasteurizar, con un sabor salado entre moderado y fuerte (Ruíz et al. 2017). Al tratarse de un producto con alto porcentaje en producción artesanal con técnicas rudimentarias, en las que predominan las malas condiciones higiénico sanitarias en su procesamiento, se convierte en un producto alimenticio con alto contenido de microrganismos patógenos, como Salmonella, L. monocytogenes y S. aureus, causantes de intoxicación alimentaria (Frazier et al. 2003; Ruíz et al. 2017).
Por lo mencionado anteriormente, el objetivo del presente trabajo fue evaluar la influencia del ultrasonido en el desarrollo de BPA, a base de matarratón (Gliricidia sepium) y su incidencia en la vida útil microbiológica del queso costeño.
MATERIALES Y MÉTODOS
Obtención de extracto acuoso. Se recolectaron hojas verdes de G. sepium en el cerro de la popa, ubicado en la ciudad de Cartagena, a 148m s.n.m., en árboles de edad madura (14 a 20 años). Se realizó una clasificación, selección, lavado y desinfección de las hojas, en una solución de hipoclorito, a 200ppm, durante 5min. Posteriormente, fueron secadas por 4 días, a 32°C. La extracción del principio activo, se llevó a cabo mediante hidrodestilación por arrastre con vapor, siguiendo la metodología propuesta por González et al. (2018), utilizando un sistema de destilación compuesto.
Microencapsulación. Las microcápsulas fueron elaboradas utilizando metodología propuesta por González et al. (2013), usando dispersiones poliméricas de Goma Gelana de bajo acilo (0,75% p/v) (Modernist Panty Kitchen Alchemy) y carbonato de calcio (30mM) en agua, bajo agitación constante (300rpm), a 90°C, por 15min. Luego, se dejó enfriar la preparación, con el fin de incorporar el EA (40% v/v) y evitar así la volatilización de los compuestos presentes en el extracto. Posteriormente, el proceso de gelificación, se realizó mediante la incorporación de δ-gluconolactona hasta alcanzar un pH de 4,2. A la dispersión polimérica, se le agregó aceite de canola en una proporción (1:2 v/v) (dispersión: aceite), bajo agitación constante por 15min, aumentado las revoluciones, formando una emulsión. Finalmente, el aceite es removido por adsorción y las microcápsulas contenidas en la fase acuosa fueron centrifugadas (Hamilton Bell VanGuard V6000) dos veces, a 5000rpm, durante 10min, con solución salina (0,85% NaCl) y almacenadas a 4°C, hasta su uso.
Determinación del diámetro de las microcápsulas. 100μL de microcápsulas fue utilizado para determinar el diámetro de las microcápsulas. La muestra fue diluida en una solución salina estéril en un portaobjetos y analizado en un microscopio óptico (Carl Zeiss Microscopy GmbH, Kongsalee 9 - 21), integrado a una cámara digital. Las microfotografías obtenidas fueron procesadas con ayuda del programa de cómputo Zen Image Pro-Plus versión 4.
Obtención de biopelículas. Las BPA fueron realizadas por método de Casting, siguiendo la metodología propuesta por González et al. (2018), empleando Kappa Carrageenan 0,35% p/v, como biopolímero y carbonato de Calcio (CaCO3) 30mM, como donador de cationes. Los reactivos fueron disueltos en agua destilada conteniendo glicerol al 12% v/v (plastificante). Posteriormente, la mezcla fue sometida a calentamiento bajo agitación constante, por un periodo de 15min, a 90°C. Una vez transcurrido el tiempo, se dejó enfriar hasta 40°C y se adicionaron las microcápsulas (100μL) y δ-Gluconolactona, con el fin de liberar los cationes presentes en el carbonato y facilitar la gelificación del polímero. Para la formación de las BPA, se adicionaron volúmenes específicos (10mL) de cada solución en cajas de Petri. Luego, se realizó el secado en una incubadora (memmert IN 160), a 40°C, durante 72 horas, aproximadamente, asegurando la uniformidad de las BPA.
Aplicación de ultrasonido. Las BPA con área conocida fueron sometidas a tratamiento ultrasónico 40KHz, 40°C, por 10min, en un baño ultrasónico (Labware Scientific Model KSL5120-5). Esta relación de potencia temperatura y tiempo seleccionada, se basó en estudios cinéticos de liberación principios activos, llevados a cabo en el grupo de investigación.
Estimación de la vida útil microbiológica. Para determinar la funcionalidad de las BPA sobre el queso costeño, se llevó a cabo la estimación de la vida útil microbiológica de esta matriz alimentaria. Tres cinéticas de crecimiento a distintas temperaturas (7 - 37°C) fueron construidas por triplicado, reportando el promedio aritmético de los 15 puntos utilizados. Las bacterias aerobias mesófilas fueron usadas como microorganismos indicadores. Es importante destacar que los datos de las cinéticas se modelaron matemáticamente, mediante la ecuación de Baranyi & Roberts (1994) (Ecuación 1), por medio del programa de cómputo DMFit 2.0:
Donde, y(t) es la concentración celular o el diámetro de las colonias, y0 es la concentración o diámetro inicial, μmáx es la velocidad específica de crecimiento (1/h), m es un parámetro de curvatura para caracterizar la transición de la fase exponencial, ѵ es un parámetro de curvatura para caracterizar la transición a la fase exponencial y ho es un parámetro adimensional que cuantifica el estado fisiológico inicial de las células. Una vez obtenidos los parámetros cinéticos de crecimiento microbiano, se procedió a estimar la vida útil microbiológica utilizando la ecuación de Monod-Hinshelwood (Ecuación 2) (González et al. 2016).
Donde, ts es el tiempo necesario para que se desarrolle la alteración en el alimento, Ns (ufc/g) es el valor correspondiente a la población de seguridad (valor máximo permisible antes de considerarse alterado el producto), N0 (ufc/g) es el valor correspondiente a la población inicial presente en el producto y Td es el tiempo duplicación de la población alterante específica.
RESULTADOS Y DISCUSIÓN
Diámetro de las microcápsulas. La microscopía óptica reveló la forma de las microcápsulas obtenidas con gelana de bajo acilo. En la figura 1, se aprecian estructuras esféricas rígidas bien definidas después de los procesos de centrifugación, que tienen lugar en la etapa de separación de las microcápsulas; este tipo de estructuras son originadas por la reacción de los iones divalentes con los grupos carboxilo de las moléculas de gelana (Chandrasekaran & Thailambal, 1990; Sanderson, 1990).
En cuanto a los diámetros de las microcápsulas, se obtuvieron valores promedios de 273,768±0,564µm y un área promedio de 60685,893µm2. Es importante resaltar que estos valores fueron calculados a partir de cinco repeticiones por microfotografía. El tamaño de las microcápsulas es un aspecto relevante cuando son incorporadas a matrices alimentarias, ya que el tamaño puede afectar las características sensoriales de los productos alimenticios (Tyle, 1993). Además, la adición de microcápsulas en biopelículas conlleva a una modificación de las propiedades mecánicas y reológicas de las mismas, como fue previamente reportado por González et al. (2018).
Microcápsulas con diámetros grandes ofrecen un mayor porcentaje de encapsulación y protección del compuesto activo, pero una pobre dispersión en el medio; por otro lado, diámetros muy pequeños, dan como resultado microcápsulas huecas y con baja eficiencia de encapsulación (Zhao et al. 2008). Un diámetro óptimo para las microencapsulaciones, se sitúa entre un máximo de 1mm y un mínimo de 80µm (Cano et al. 2016; Castro-Rosas et al. 2017)
Estimación de vida útil microbiológica. Este parámetro, se puede determinar mediante la estimación de los parámetros cinéticos de crecimiento microbiano del microorganismo indicador, previo modelado de los datos, utilizando la ecuación de Baranyi & Roberts (1994). Los valores obtenidos en la estimación de la vida útil microbiológica, se presentan en la tabla 1, donde se puede apreciar que, el mayor tiempo de vida útil (42,8 días), se encontró en muestras de queso recubiertas con la BPA, mientras que las muestras de queso sin BPA mostraron una vida útil de 16,1 días. Este resultado puede ser atribuido a la presencia de compuestos con características antimicrobianas presentes en el extracto acuoso de G. sepium. Es notable destacar que la bioactividad (antioxidante, antimicrobiana, antifungica e insecticida) de esta legumbre ha sido reportada previamente (Nazli et al. 2011; Sinha, 2013). En la figura 2, se observa la velocidad de cinética de crecimiento microbiano en queso costeño en un rango de temperaturas de 7 a 37°C, demostrando que la aplicación de la BPA es capaz de incrementar el tiempo de duplicación en las temperaturas evaluadas, conllevando al mencionado aumento en la vida útil microbiológica, debido a una disminución en los tiempos de duplicación celular.
Tabla 1 Valores de estimación de vida útil en queso costeño, sin biopelícula y con biopelícula activa.

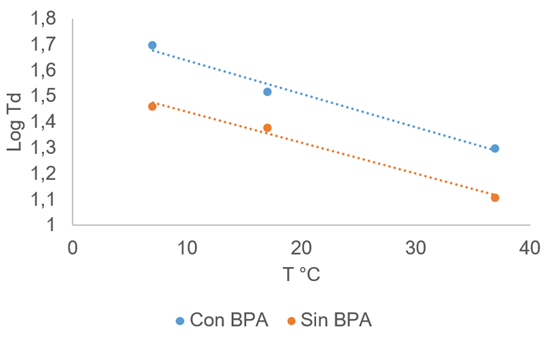
Figura 2 Velocidad de cinética de crecimiento microbiano en queso costeño a diferentes temperaturas, sin biopelícula y con biopelícula activa.
De acuerdo con la resolución 02310 de 1986, capítulo XVIII, artículo 129 del Ministerio de Salud de la República de Colombia, el queso fresco refrigerado en empaque hermético tiene una duración sanitaria aproximada de 18 días y refrigerado empacado al vacío, de 30 días. Considerando los resultados obtenidos en la presente investigación, la aplicación de BPA, a base de goma gelana y conteniendo microcápsulas cagadas con extracto acuoso, logra incrementar la vida útil del queso 26,7 días, aproximadamente. Estos resultados son similares a los publicados por Gorrasi et al. (2016), quienes reportaron un incremento de 20 días en la vida útil microbiológica en queso mozarela, empacados en un recubrimiento activo, diseñado a partir de tereftalato de polietileno (PET) e hidróxido doble en capas (LDH), intercalado con aniones de salicilato y carbonato dispersos en un sellado térmico, a base de solvente.
En términos generales, la aplicación de BPA conteniendo extracto acuoso de G. sepium logra incrementar la vida útil microbiológica del queso costeño. Cabe mencionar que no existen muchas investigaciones relacionadas con queso costeño y la determinación de su vida útil microbiológica. En investigaciones futuras, se considera pertinente determinar los compuestos responsables de la mencionada actividad antimicrobiana, así como realizar estudios sobre la aceptación sensorial de los quesos recubiertos y evaluar la influencia de otros tipos métodos de extracción de compuestos bioactivos, así como otras fuentes vegetales.