INTRODUCCIÓN
La familia Orquidaceae es uno de los taxones con más especies reportadas (Chase et al. 2015). En Colombia, en términos de riqueza y de abundancia, la región Andina cuenta con un 87,2 %; Amazónica y Pacífica, con 10,6 %; el Caribe, 5 % y la región de la Orinoquía, 4 % (Mejía Rosero & Pino Benítez, 2010). La mayoría de las especies de orquídeas tienden a tener áreas de distribución restringidas y muchas especies se encuentran en peligro de extinción, debido a la pérdida de hábitat, ocasionada por la expansión de la frontera agrícola, el desarrollo urbano, la degradación del hábitat de los parches restantes y la pérdida de interacciones ecológicas críticas (Gale et al. 2018; Evans et al. 2020; Shefferson et al. 2020).
Dentro de la familia Orquidaceae se encuentra el género Rodriguezia, que cuenta con más de 30 especies; es una orquídea epífita, que forma grupos pequeños de pseudobulbos (entre uno a veinte), una hoja por pseudobulbo e inflorescencias laterales colgantes (1 o 2 por pseudobulbo) (Ospina-Calderón et al. 2015). Las plantas crecen en grupos de varios ejes, en zonas de baja humedad y alta luminosidad y se pueden encontrar fácilmente sobre cafetos (Coffea arabica), guayabos (Psidium guajava), cítricos (Citrus spp.), pomarrosos (Syzygium jambos), más precisamente, sobre la corteza desnuda de estos arbustos (Calderón, 2006; Valencia, 2014). En Colombia, Rodriguezia granadensis (Lindl.) Rchb. f., se reporta en bosques andinos, en rangos altitudinales que van de los 700 a los 3.900 m s.n.m. (Calderón, 2006; Gil & Jácome 2014), siendo, un ejemplo, la Reserva Forestal natural de Yotoco, en el Valle del Cauca (Ventre‐Lespiaucq et al. 2017). Esta orquídea presenta su floración y producción de cápsulas en las épocas de mayor precipitación (Gil-Clavijo et al. 2020).
Las plantas de la familia Orchidaceae son micótrofas y este fenómeno se observa, principalmente, en la germinación de la semilla y en la fase vegetativa (Sarsaiya et al. 2019; Sathiyadash et al. 2020). En la interacción micorrícica entre hongo y planta, las orquídeas dependen de los nutrientes que le proporciona el micosimbionte, el cual, les suministra minerales, agua y carbono (Kuga et al. 2014). La importancia de la relación simbiótica que existe entre microorganismos endófitos, rizosféricos o micorrízicos y las raíces de las orquídeas radica en hacer posible la germinación de las semillas y la toma de nutrientes, debido a que, en ausencia o déficit de éstos, los procesos fisiológicos de estas plantas se podrían ver afectados (Jacquemyn et al. 2017; Herrera et al. 2017). La relación simbiótica entre las orquídeas y los hongos formadores de micorrizas es diferente a otras simbiosis, ya que, al principio, es unidireccional, debido a que el hongo le aporta a la semilla y aunque se creyó que los hongos micorrícicos no recibían recompensa, hoy, se sabe que estos también reciben carbono, cuando las orquídeas han crecido y desarrollan hojas para hacer fotosíntesis (Dearnaley & Cameron, 2016; Yeh et al. 2019). Por tanto, la distribución de las orquídeas también estaría influenciada por la presencia de hongos formadores de micorrizas (Jacquemyn et al. 2017).
Las hifas de los hongos micorrícicos forman complejos en espiral llamadas pelotones en la región parenquimática del córtex de las raíces. Los pelotones varían en cuanto a forma, tamaño y arreglo de la masa hifal (Hadley & Williamson, 1971; Kaur, 2020). Los pelotones pueden ser funcionalmente activos durante algún periodo de tiempo y, posteriormente, se desintegran o se lisan dentro de las células corticales, formando una estructura redonda agrupada o en forma de disco; se tornan de color amarillo o café (Kaur, 2020).
Los hongos formadores de micorrizas juegan un rol importante en los procesos germinación y de establecimiento de las orquídeas en los diferentes ecosistemas, por lo cual, el objetivo de la presente investigación fue identificar los géneros de los hongos formadores de micorrizas asociados a las raíces de R. granadensis, presentes en el agroecosistema Hacienda Betania, en el municipio de Fusagasugá, Cundinamarca, como marco inicial del desarrollo de protocolos de germinación y de establecimiento de esta orquídea, para producción comercial.
MATERIALES Y MÉTODOS
Área de estudio. La investigación, se realizó en el agroecosistema Hacienda Betania, ubicada en la vereda El Resguardo, corregimiento Occidental del municipio de Fusagasugá, departamento de Cundinamarca, propiedad de la Alcaldía municipal, con coordenadas Latitud 4° 21' 37,3" N y Longitud 74° 22' 29,98" W. Esta área corresponde a la zona de vida denominada bosque húmedo montano bajo (Bh-MB), con una altitud entre los 1.400 y 1.600 m s.n.m. y una temperatura entre 18 y 24 °C. Esta hacienda cuenta con un bosque en recuperación que, anteriormente, se dedicaba a la producción de café (C. arabica).
Fase de campo. Para la colecta de las muestras, se realizó un recorrido general de la hacienda Betania, con el fin de identificar la presencia de R. granadensis en floración (Figura 1), determinar los puntos de muestreo y ubicar plantas que no mostraran síntomas visuales de problemas fitosanitarios ni de deficiencias nutricionales. Para el muestreo, se identificaron los forofitos (soporte o tutor de una planta epífita), que tuvieran las orquídeas que se buscaban (R. granadensis), como los puntos de muestreo en donde cada planta representaba una muestra (en algunos forofitos, se encontró más de una planta). Las muestras, se obtuvieron a partir de forofitos a una altura no mayor a 3 metros, para facilitar la colecta.
Para la toma de las muestras, se tomó una muestra de raíz completa por planta con ayuda de un bisturí desinfectado, previamente, con etanol al 70 %; luego, las muestras colectadas se envolvieron en servilletas y se guardaron en bolsas de papel, rotuladas con los datos de punto de muestreo, forofito y estado fenológico de la planta. Las muestras, se almacenaron en nevera e, inmediatamente, se trasladaron al laboratorio de microbiología de la Universidad de Cundinamarca - sede Fusagasugá, para el respectivo aislamiento, en un lapso no mayor a 24 horas, después de su recolección.
Fase de laboratorio: observación de enrollamientos hifales. Cada muestra compuesta por la raíz completa, se dividió en tres submuestras: proximal (P), media (M) y distal (D) (Figura 2); luego, se hicieron cortes transversales en cada submuestra, para obtener explantes de, aproximadamente, 1 mm, los cuales, se observaron al microscopio, con el fin de observar enrollamientos hifales (pelotones).

Figura 2 Esquema de la muestra con las respectivas partes utilizadas para el aislamiento de raíz de la orquídea Rodriguezia granadensis.
Aislamiento. El aislamiento, se realizó utilizando la metodología adaptada de Ordóñez C. et al. (2012); las raíces se lavaron con agua potable, para eliminar residuos; luego, se realizaron cortes de 0,5 cm de longitud (explantes) de la raíz, para obtener las submuestras (P, M y D), las cuales, se desinfectaron, superficialmente, con un tratamiento de lavado inicial con hipoclorito de sodio al 5 %, durante 30 segundos, luego con etanol, al 70 %, por 30 segundos y un enjuague con agua destilada estéril, por un minuto.
La siembra de los explantes desinfectados, se realizó sobre un medio de cultivo de papa dextrosa agar (PDA) 39 g.L-1 + 0,05 g.L-1 de cloranfenicol, para inhibir el crecimiento bacteriano; posteriormente, se realizaron tres repiques para la obtención de cultivo en el medio Sabouraud dextrosa agar (SDA) 65 g.L-1 + 0,05 g.L-1 de cloranfenicol y un último repique en medio selectivo, para Rhizoctonia (Ko y Hora). Las muestras, se mantuvieron en una incubadora Binder® serie bd avantgarde.line, a una temperatura de 25 °C, hasta observar el desarrollo micelial de los hongos asociados a la raíz (Moreno López & Ariza Castillo, 2020).
Identificación macroscópica y microscópica de los géneros. La descripción de las características macroscópicas, se realizó a los 7 días después de siembra, en donde se evaluó: textura, tipo de crecimiento y presencia del micelio. La identificación de los hongos, se realizó utilizando un microscopio binocular Leica® Dm500, empleando la clave taxonómica de Barnett & Hunter (1998).
Determinación del índice de diversidad, frecuencia de colonización y abundancia de los hongos encontrados. Para determinar la diversidad de los hongos micorrícicos encontrados, se utilizó el índice de Shannon-Wiever (H´) (Beltrán-Nambo et al. 2018); se evaluó el porcentaje de frecuencia de colonización (% FC=((número de unidades muestreadas positivas para la especie/número de unidades muestreadas analizadas)x100) y abundancia relativa (% A= ((número de aislamientos del género/número de aislamientos totales)x100)), del hongo identificado (Lizarazo et al. 2015).
RESULTADOS Y DISCUSIÓN
Fase de campo. El total de plantas de R. granadensis encontradas fue de 20, en 11 puntos diferentes, las cuales, estaban sobre guayabos y cítricos, de la siguiente manera: 70 % de las muestras, en arbustos de guayabo, de los cuales, un 70 % estaban senescentes y, el otro 30 %, en producción; 20 % en arbustos de naranjo (Citrus X Sinensis), que se encontraban en fase de producción y el 10 % restante, en arbustos de mandarino (Citrus reticulata); de éstos, un 60 %, se encontraba en producción y, el otro 40 %, senescentes.
La distribución de R. granadensis es similar a la reportada por Reina-Rodríguez & Otero (2011), quienes indican que, en hábitats transformados o intervenidos, esta orquídea se distribuye en parches y muestra preferencia por arbustos de guayabos y de cítricos. De manera similar, Gil-Clavijo et al. (2020) reportaron a los guayabos como el forofito donde crece R. granadensis, en un paisaje fragmentado en el Valle del Cauca (Colombia), lo cual, se debe a las condiciones ambientales que estos le proporcionan (Mejía Rosero & Pino Benítez, 2010).
Fase de laboratorio.
Identificación de enrollamientos hifales (pelotones). En los cortes transversales de las diferentes partes de la raíz de R. granadensis analizadas por separado (Figura 3), se obtuvo que, en las submuestras del extremo proximal, un 70 % de las células presentaron pelotones; en la submuestra parte media de la raíz, un 60 % y en el extremo distal de la raíz, un 35 %.
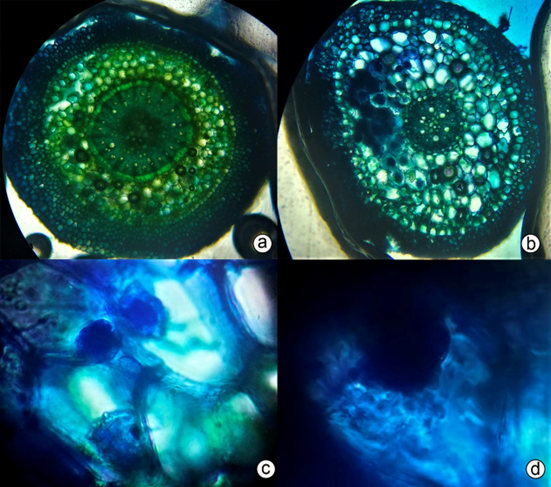
Figura 3 Corte transversal en raíz de la orquídea Rodriguezia granadensis. a) Cilindro central sin presencia de pelotones; b) Corte transversal con presencia de pelotones; c) Pelotones e hifas teñidos con azul de metileno; d) Acercamiento de pelotones. Fotografía microscópica (40x y 100x).
Rivas et al. (1998), Rasmussen & Whigham (2002) y Bertolini et al. (2014) encontraron pelotones en raíces que estaban en contacto con el sustrato, es decir, la corteza del forofito, debido a que en las orquídeas epífitas los hongos entran en contacto con el sustrato por medio de las hifas, que salen de las raíces y absorben nutrientes.
Zettler & Corey (2018) indican que los pelotones son digeridos como fuente de carbono (micotrofia), de una forma controlada, según las necesidades de la planta; por otra parte, el número de pelotones en la raíz varía de una planta a otra. En las plantas epífitas, a inicios de las épocas lluviosas, se encuentra mayor cantidad respecto a la temporada seca. Osorio-Gil et al. (2008), Bertolini et al. (2014) y Jiménez-Peña et al. (2018) reportan que la cantidad de pelotones se incrementa al aumentar la madurez de la raíz y al estar en contacto con el sustrato, es decir, la corteza del forofito y al ser estas plantas epífitas, su desarrollo está sujeta, en cierta forma, a la asociación micorrízica, es decir, depende del carbono suministrado por el hongo. Asimismo, Ma et al. (2015), también observaron pelotones en raíces de las orquídeas epífitas Dendrobium spp. y Cymbidium spp., que estuvieron en contacto con el sustrato.
Caracterización microscópica de las muestras. Se obtuvieron 44 submuestras, de las cuales, 39 pertenecen al género-forma Rhizoctonia (Figura 4), lo que corresponde al 88,64 % de los aislamientos; cinco submuestras (11,36 % de los aislamientos), no presentaron esporulación y se denominaron micelia sterilia, ya que tampoco se logró observar las características que permitieran identificarlos como Rhizoctonia. El género-forma Rhizoctonia, se caracteriza por la ausencia de conidias y por formar hifas hialinas, cuando pasa por su etapa juvenil y, a medida que va madurando, se torna de color amarillo, café rojizo a oscuro. Se pueden observar células largas y ramificaciones formando un ángulo recto con la hifa principal, haciéndose más estrecha en el punto de la bifurcación y la presencia de un septo cerca de ésta (Figura 4 a, b, c, e, f, g). En ocasiones es posible observar células elipsoides a globosas, conocidas como células monilioides (Figura 4 d, h, i, j) (Ding et al. 2014; Zettler & Corey, 2018).
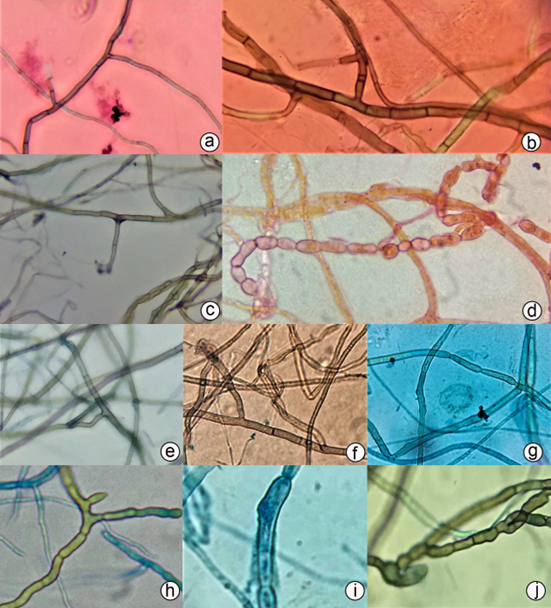
Figura 4 Aislamientos de hifas teñidas con azul de lactofenol identificadas morfológicamente como género-forma Rhizoctonia; vista microscópica en 40 x y 100 x. a) P4M6F; b) P4M4M; c) P1M1M; d) P4M6M, se puede observar células monilioides; e) P4M1M; f) P4M4M; g) P2M1I; h) P2M1M; i) P2M2I; j) P8M1M.
Características macroscópicas de los aislamientos. El 70 % de las submuestras caracterizadas presentó una textura micelial algodonosa; el 30 % restante, tuvo una textura felposa. En cuanto al tipo de crecimiento de las colonias, el 31,82 % presentaron color blanco; el 27,27 %, café rojizo; el 20-45 %, color café oscuro y el 20,45 % restante, amarillo. En cuanto a la presencia del micelio, el 40,91 % fue abundante; el 36,36 %, moderado y 22,73 %, poco (figura 5). Se ha descrito que el color de las colonias del género Rhizoctonia varía entre colores que van de blanco, crema a castaño y crecimiento abundante (Giovannini et al. 2005; Zettler & Corey, 2018), lo cual, coincidió con lo observado en esta investigación.
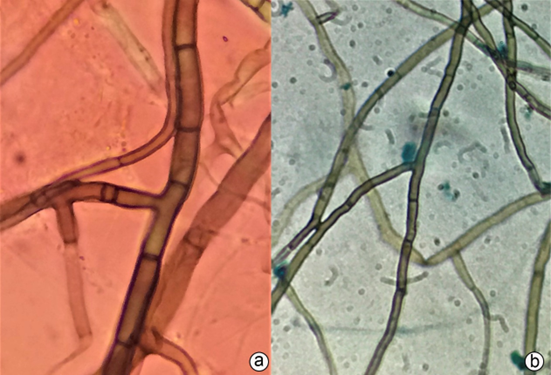
Figura 5 a-b) Células del micelio en cultivo puro obtenido de explantes de raíces de la orquídea Rodriguezia grandensis.
Según la parte de la raíz, se presentó mayor porcentaje del género-forma Rhizoctonia en la parte media, con 36 %, seguida de la parte proximal, con 33 % y la parte final, con 31 %, coincidiendo con Durán et al. (2007) y Ordóñez C. et al. (2012), quienes reportaron, en las orquídeas Gavilea araucana, Vanilla planifolia, Elleanthus amethystinoide, Trichoceros antennifer, Epidendrum chioneum, Stelis sp., Epidendrum sp. y Pleurothallis linguifera, mayor colonización del género-forma Rhizoctonia, en la zona media de la raíz, seguida de la región basal y, finalmente, la apical.
Se reporta que los hongos formadores de micorrizas en orquídeas son miembros del complejo de Rhizoctonia, que comprende taxones de tres familias fúngicas distintas: Tulasnellaceae, Ceratobasidiaceae y Serendipitaceae (Smith & Read, 2008; Dearnaley et al. 2012) y esta asociación, se considera como el estado ancestral de la familia (Dearnaley et al. 2012; Ogura-Tsujita et al. 2021). Los hongos del género Rhizoctonia tienen diferentes estrategias tróficas puediendo actuar como fitopatógenos, endófitos, saprófitos, hongos micorrícicos orquídeas o ectomicorrícicos (Veldre et al. 2013; Ogura-Tsujita et al. 2021).
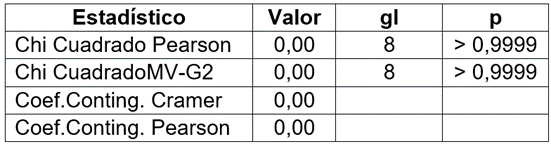
Para determinar si había una asociación entre la presencia del género-forma Rhizoctonia, la parte de la raíz y el forofito, se realizó una prueba de Chi-cuadrado (Tabla 1), obteniendo resultados de probabilidad asociada mayor a 0,05, lo que indica, que no hay asociación entre estos factores.
Tabla 1 Asociación entre la presencia del género-forma Rhizoctonia y las variables submuestra y forofito.
Determinación del índice de diversidad, frecuencia de colonización y abundancia de los géneros fúngicos encontrados. Teniendo en cuenta que se encontraron dos grupos de géneros fúngicos asociados a las raíces de R. grandensis encontrados en este trabajo (género-forma Rhizoctonia y micelia sterilia), la diversidad de los hongos endófitos hallados fue muy baja, con H’=0,487, siendo el género-forma Rhizoctonia, el endófito dominante. Esto sugeriría, que R. grandensis representa un nicho ecológico pobre en cuanto a micobiota endofítica, por lo que arroja un resultado cercano a cero. Este valor posiblemente cambie, si realizan los cálculos después de la identificación molecular de estos aislamientos.
En cuanto al porcentaje de frecuencia de colonización (% FC) y abundancia relativa (% A), el género-forma Rhizoctonia, presentó 95 % de colonización en las muestras analizadas y un 65 % de abundancia relativa del género-forma Rhizoctonia, en los aislamientos realizados. Estas variables indican que Rhizoctonia spp. se encuentra como hongo micorrízico orquideoide disponible en los forofitos del agroecosistema del área de estudio. Bayman et al. (1997) reportan que en raíces de la orquídea Lepanthes sp., el género Rhizoctonia tiene una frecuencia de colonización de 45 %, seguido del género fúngico Xyllaria, con un 29 %. Ordóñez et al. (2015) obtuvieron una frecuencia de colonización del genero-forma Rhizoctonia en raices de orquideas Masdevallia coccinea Linden ex Lindl., del 83,8 %, en plantas jóvenes y el 54,8 %, en plantas adultas. Por el contrario, en aislamientos de raíz de Dendrobium nobile no se reporta la presencia de Rhizoctonia, sino de los géneros Colletotrichum, Phomopsis, Clonostachys, Fusarium, Penicillium, Trichoderma y Xyllaria (Yuan et al. 2009). No se reportan estudios similares para orquídeas del género Rodriguezia en otros ecosistemas naturales o en sistemas productivos.
El reconocimiento de los hongos asociados a las raíces de orquídeas R. grandensis permitirán realziar estudios que evalúen el efecto de los microorganismos asociados a las raíces en el crecimiento vegetal, el análisis de los efectos que hace el hongo micorrícico orquideoide encontrado en la estimulación de la tolerancia a estrés, las defensas de la planta y cómo mejora la absorción de nutrientes.
De forma general, se concluye que, en las raíces de R. granadensis, el género fúngico más abundante es Rhizoctonia, por lo tanto, se recomienda realizar trabajos tendientes a la identificación de las especies asociadas y profundizar en el entendimiento de la interacción micorrícica, para propender por el cuidado de esta orquídea en condiciones naturales y hacer un aprovechamiento de este conocimiento para la propagación, a nivel comercial.
















