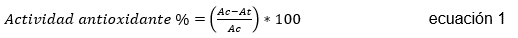INTRODUCCIÓN
Frente a un proceso infeccioso causado por un agente patógeno es necesario fortalecer la defensa celular, para contrarrestar el daño ocasionado por el estrés oxidativo y controlar el desbalance del sistema antioxidante que causa la enfermedad, mediante el uso de antioxidantes (Castillo-Velarde, 2019). De esta manera, se ha relacionado que una dieta rica en antioxidantes estimula el sistema inmune y reduce la aparición de enfermedades infecciosas (Castillo-Velarde, 2019), neurodegenerativas y crónicas y de otros de efectos adversos, ocasionados por las especies reactivas de oxígeno (EROs), sobre diferentes funciones fisiológicas.
Las plantas medicinales son una fuente de principios activos antioxidantes, que presentan un efecto positivo frente a una amplia gama de enfermedades, debido a que tienen compuestos, como polifenoles, flavonoides, esteroides, esteroles y terpenos. Estos compuestos cumplen diversas funciones de protección, como mecanismo de defensa frente a factores bióticos y abióticos adversos, facilitando la supervivencia de las plantas (Pérez-Alonso & Jiménez, 2011; Borchardt et al. 2009).
Los compuestos fenólicos corresponden a un grupo de metabolitos muy diverso y ampliamente distribuido en plantas superiores, que comprende moléculas sencillas, como los ácidos fenólicos, taninos y ligninas, además de los flavonoides, que presentan importantes propiedades biológicas (Bahmani et al. 2015; Martin, 2018; Retuerto-Figueroa et al. 2020). Estos compuestos son interesantes, desde el punto de vista farmacológico, ya que poseen una gran diversidad estructural (Cerón-Carrillo et al. 2014), además de tener diferentes mecanismos de acción antioxidante, los cuales, pueden estar mediados por reacciones de óxido-reducción o por captación de radicales libres (Coronado et al. 2015).
En este sentido, se reporta la necesidad de realizar evaluaciones de la capacidad antioxidante de los compuestos de una muestra de forma independiente, como la interacción de los diferentes compuestos con su microambiente. Por tal razón, es importante combinar más de un método para la evaluación antioxidante, ya que se sabe que ningún método refleja, por sí solo, la capacidad antioxidante total de una muestra, ya que no expresa la capacidad de antioxidantes de compuestos lipofílicos e hidrofílicos (Pérez-Jiménez & Saura-Calixto, 2007).
Algunos usos etnomedicinales de las plantas pueden ser de tipo antimicrobiano, antirreumático, anticancerígeno, antifúngico, para tratar enfermedades degenerativas y renales (Sierra, 2016; Retuerto-Figueroa et al. 2020; Piluzza & Bullitta, 2011).
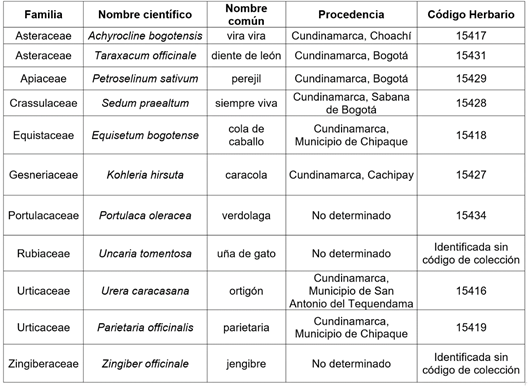
En Colombia, el conocimiento tradicional sobre el uso de plantas trasciende por generaciones, a través de prácticas tradicionales (González et al. 2001). En estudios previos de etnomedicina en Colombia, se encuentran plantas que se usan de manera tradicional para el tratamiento de infecciones urinarias (IU), por ejemplo: ortigón (Urera caracasana (Jacq.) Griseb), cola de caballo (Equisetum bogotense [Kunth.]), parietaria (Parietaria officinalis L.), vira vira (Achyrocline bogotensis [Kunth.]), caracola (Kohleria hirsuta [Kunth.] Regel), diente de león (Taraxacum officinale (F.H. Wigg), siempre viva (Sedum praealtum [A.DC.]), verdolaga (Portulaca oleracea L.), perejil (Petroselinum sativum [Hoffm]), jengibre (Zingiber officinale [Roscoe]) y uña de gato (Uncaria tomentosa [Schult. DC.]) (Pabón et al. 2017). En algunas de estas plantas, no se conoce su potencial antioxidante, ni sus compuestos fenólicos; sin embargo, a partir de la información sobre las aplicaciones medicinales, se evidencia su uso potencial como antioxidante.
Por lo anterior, es importante aportar a este conocimiento tradicional, debido a que pueden ser fuente de principios activos, que benefician la salud. En este sentido, el objetivo de este estudio fue realizar la cuantificación de polifenoles y de flavonoides y determinar su relación con la actividad antioxidante de estas 11 plantas usadas en la medicina tradicional colombiana, para tratar IU.
MATERIALES Y MÉTODOS
Selección y adquisición del material vegetal. La selección de las plantas para el tratamiento de IU se realizó según Pabón et al. (2017) y fueron adquiridas en la plaza de mercado principal del municipio de Soacha, Cundinamarca. El material fresco proviene de diferentes municipios, teniendo en cuenta la información dada por los vendedores. Un ejemplar de cada especie, previamente identificado, reposa en el Herbario del Museo de La Universidad de La Salle Bogotá, Colombia (Tabla 1).
Obtención de extractos. Los extractos vegetales fueron obtenidos, principalmente, de hojas y de tallos, en la mayoría de las plantas, de rizoma (caracola y jengibre) y corteza (uña de gato). Se tomaron 600 g de material fresco, secado y molido para la maceración, con etanol al 96 %, a temperatura ambiente, que se mantuvo protegido de la luz. La solución filtrada fue concentrada por destilación a presión, reducida en un Rotavapor IKA RV10 (Sanabria Galindo, 1983).
Cuantificación de compuestos fenólicos y flavonoides
Método de Folin-Ciocalteu para la cuantificación de fenoles totales. Se preparó una curva patrón de ácido gálico, con una solución estándar de 0,1 mg/mL y se realizaron 10 diluciones seriadas, completando el volumen de cada una a 500 μL con agua destilada. Posteriormente, 10 mg de extracto se disolvió en 1 mL etanol y se diluyó en una proporción 1:5 con agua destilada. A cada una de las muestras, previamente preparadas, se les adicionó 250 μL del reactivo de Folin-Ciocalteu 1 N, se dejó actuar por 5 minutos y luego 1250 μL de Na2CO3 al 20 %. Las muestras, se dejaron reposar por 2 h y la absorbancia fue medida a 760 nm. Todas las muestras, se realizaron por triplicado y los resultados fueron expresados en mg de ácido gálico por g de extracto (mgEAG/g extracto) (Blainski et al. 2013).
Método de Tricloruro de aluminio para la cuantificación de flavonoides. Se realizó una curva patrón de catequina con una solución estándar (1,5 mg/mL en metanol al 10 %), de la cual, se tomó un volumen de 106,6 μL, para la primera concentración; se agregaron 1893,4 μL de MeOH al 10 % y, posteriormente, se realizaron diluciones seriadas (79, 39, 19, 9 y 5 mg/L). El ensayo, se realizó en una microplaca de 96 pozos; a cada pozo, se le adicionaron 75 μL de cada una de las soluciones de la muestra a 10 mg/ mL, 75 μL de NaNO2 a 6 mg/mL, 75 μL de AlCl3*6H2O a 22 mg/mL y 75 μL de NaOH 0,8 M. Inmediatamente, se leyó la absorbancia a 510 nm, en un lector de placa (Biotec, EPOCH), usando el Software Gen 5 (Biotec); como control negativo, se usó metanol al 10 %. Todos los ensayos, se realizaron por triplicado y los resultados fueron expresados como mg de catequina por gramo de extracto (mg ECT/ g extracto) (Magalhães et al. 2012).
Evaluación de la actividad antioxidante
Método DPPH (2,2-difenil-picril-hidrazilo). Las pruebas, se realizaron en microplacas de 96 pozos. En cada pozo, se adicionó 140 µL de DPPH (0,06 mg/mL) y 50 µL de extracto (10 mg/mL); después de 30 min, se midió la absorbancia a 515 nm, en un microlector de placa (Biotec, EPOCH), usando el Software Gen 5 (Biotec). Como controles positivos, se utilizaron ácido gálico (0,075 mg/mL), catequina y quercetina (5 mg/L) (Shalaby & Shanab, 2013). Los ensayos, se realizaron por triplicado y los resultados fueron expresados como porcentaje de inhibición del radical libre DPPH (ecuación 1), donde Ac es la absorbancia de la solución metanólica DPPH y At es la absorbancia de la muestra.
Ensayo del potencial reductor férrico (FRAP). El poder antioxidante de reducción férrica se realizó siguiendo la metodología descrita por Benzie & Devaki (2018). Se midió la absorbancia a 593 nm y se preparó una curva patrón de una solución de trolox (0 - 0,139 mM). El ensayo, se ejecutó por triplicado y los resultados fueron expresados como mmol equivalentes a trolox (ET)/g extracto.
Análisis estadístico. Todos los resultados fueron expresados como el promedio de los ensayos por triplicado, con su respectiva desviación estándar. Para determinar la relación entre cada una de las variables, se determinó el coeficiente de correlación de Pearson, con un intervalo de confianza del 95 % y un nivel de significancia de p <0,0001. Los datos fueron analizados usando el programa estadístico InfoStat y Excel.
RESULTADOS Y DISCUSIÓN
Cuantificación de fenoles y flavonoides. Se cuantificó el contenido de fenoles y flavonoides de once plantas, usadas en la medicina tradicional colombiana, para tratar infecciones urinarias (Tabla 2). Se encontró que el extracto etánolico U. tomentosa fue el que presentó el mayor contenido fenólico, con un valor de 90,87 mgEAG/g, siendo inferior a lo reportado en la literatura, para este mismo tipo de extracto, con valores entre 196-321 mgEAG/g (Navarro-Hoyos et al. 2018). Asimismo, las especies P. oleracea y T. officinale presentaron valores de 28,30 mgEAG/g y 19,47 mgEAG/g, respectivamente, que se encuentran acordes con los reportados para el extracto etanólico de P. oleracea (21,08 mgEAG/g) (Kim et al. 2018) y superior al metanólico (17,88 mgEAG/g) (Ercisli et al. 2008). Igualmente ocurre para T. officinale, con valores reportados que oscilan entre 22,3-32 mg EAG/g (Ivanov, 2014).
Tabla 2 Actividad antioxidante y cuantificación de compuestos de extractos de 11 plantas por los métodos DPPH y FRAP.
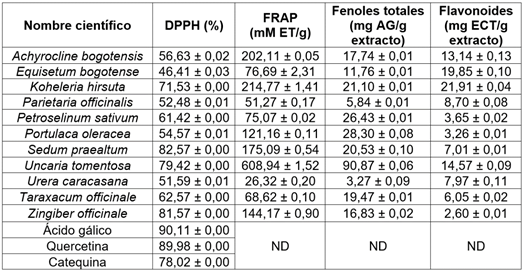
Los valores representan la media de tres repeticiones ± la desviación estándar. ND: No determinado
El extracto de Z. officinale presentó un valor de 16,83 mg EAG/g, resultado inferior al reportado previamente para el extracto etánolico (137,5 mgEAG/g), similar a los extractos metanólicos (1-13 mgEAG/g) (Nassrullah, 2015; Tohma et al. 2017) y superior al de acetato de etilo (8 mgEAG/g) (Asimi et al. 2013). De manera similar ocurrió con P. officinalis, se obtuvo un valor de 5,84 mgEAG/g, cercano al reportado previamente (2,8 mgEAG/g), para el extracto metanólico e inferior al reportado para el de acetona-agua (20,71 mgEAG/g) (Piluzza & Bullitta, 2011).
Las diferencias que se presentan al contrastar con la literatura, tanto en el contenido de compuestos fenólicos como en los flavonoides, muchas veces, dependen de las condiciones ambientales donde se encuentre la planta, siendo la temperatura, las precipitaciones, el tipo de suelo, la humedad relativa y la exposición a los rayos UV del sol, algunos fenómenos que afectan la producción de este tipo de metabolitos (Soto-Vásquez, 2015). También, las diferencias en el contenido de compuestos fenólicos se pueden atribuir a los diversos tipos de solventes utilizados en el proceso de extracción, la temperatura y el tiempo de exposición. Cabe resaltar que, dependiendo del tipo de solvente utilizado en el proceso de extracción, va a depender la polaridad de los compuestos extraídos, siendo así, un solvente de alta polaridad, como el etanol, el que va a provocar el rompimiento de la membrana celular, permitiendo que se extraigan la mayor cantidad de compuestos fenólicos, por su naturaleza polar (Garrido et al. 2013).
Este trabajo contribuye al conocimiento químico, en cuanto a la cuantificación de compuestos fenólicos del extracto etanólico de las especies E. bogotense, A. bogotensis, K. hirsuta, que presentaron un contenido fenólico intermedio (28,30-11,76 mgEAG/g) y para la especie U. caracasana, ya que ninguna de ellas presenta reportes de este tipo de cuantificaciones. Para otras especies, como P. sativum y P. officinalis, se presentan reportes de cuantificación para otro tipo de solventes (Piluzza & Bullita, 2011); sin embargo, este es el primer reporte del extracto etanólico.
Teniendo en cuenta que los compuestos fenólicos corresponden a un grupo de metabolitos muy diverso, que comprende moléculas sencillas, como los ácidos fenólicos, taninos y ligninas, además de los flavonoides, se cuantificó el contenido de flavonoides de las especies de estudio. De esta manera, se encontró que K. hirsuta fue la especie que presentó mayor contenido de flavonoides (21,91 mgECT/g), en comparación con las otras especies (Tabla 2). Este trabajo aporta al conocimiento sobre la cuantificación de flavonoides para las especies U. caracasana, K. hirsuta, A. bogotensis, y E. bogotense. Para otras especies, como Z. officinale, P. oleraceae, P. officinalis, U. tomentosa, S. praealtum, P. sativum y T. officinale, no fue posible hacer una comparación, ya que los reportes se presentan en otras unidades como mg, equivalentes a quercetina (mgEQ/g) o mg, equivalentes a rutina o están para otro tipo de extractos (Ghasemzadeh et al. 2010; Piluzza & Bullita, 2011; Kim et al. 2018).
Actividad antioxidante. Sobre los resultados de la actividad antioxidante evaluada en este estudio permitieron identificar que las especies que tienen alta capacidad antioxidante, en los dos métodos evaluados (FRAP y DPPH), fueron U. tomentosa, S. praealtum, Z. officinale y K. hirsuta, siendo este potencial muy cercano a la actividad de compuestos con actividad antioxidante, como lo son el ácido gálico, catequina y quercetina (Coronado et al. 2015). De esta manera, estas especies son prometedoras para ampliar los estudios y es importante que sean consideradas en los futuros tratamientos de enfermedades relacionadas con el estrés oxidativo, como ejemplo, enfermedades degenerativas o tratar infecciones urinarias, por sus propiedades antimicrobianas y antifúngicas (Piluzza & Bullitta, 2011; Sierra, 2016; Retuerto-Figueroa et al. 2020). Los resultados de estas especies sugieren que la actividad antioxidante puede estar determinada por dos mecanismos diferentes: el de donar átomos de hidrógenos o de electrones, de esta manera, proporciona protección contra el daño oxidativo y la estabilización radicales libres (Coronado et al. 2015).
En resultados previos de U. tomentosa, se reportó este potencial en otras unidades o para otro tipo de extractos (hidroalcohólicos de la corteza), por lo que, a pesar de no poder ser comparados, sí se puede verificar el potencial antioxidante de esta especie (Doroteo et al. 2013). Asimismo, se corroboró el potencial de S. praealtum, que presentó alta actividad antioxidante en el ensayo de DPPH y que, de acuerdo con reportes previos, el extracto etanólico de hojas a una concentración de 1 mg/mL, presenta un porcentaje de inhibición del 70,85 % e, incluso, su potencial antioxidante también se ha corroborado por otros métodos (Márquez Rosales et al. 2012).
De la misma manera, ocurrió para la especie Z. officinale, de la cual, se reportó su alto potencial antioxidante, por su capacidad de captar radicales libres del DPPH, con valores por encima del 50 % (Ghasemzadeh et al. 2010; Asimi et al. 2013; Nassrullah, 2015); sin embargo, los resultados obtenidos de esta especie por el método FRAP, no pudieron ser comparados por este método, debido a que en los reportes previos se expresan en otras unidades de concentración y para otros solventes de extracción (Nassrullah, 2015; Tohma et al. 2017).
Por otra parte, A. bogotensis (202,11 mMET/g, 56,63 %), P. oleraceae (121,16 mMET/g, 54,57 %) y E. bogotense (76,69 mMET/g, 46,41 %) presentaron alta actividad en la capacidad de reducir el ion férrico al estado ferroso (FRAP) y una actividad intermedia en DPPH, por lo que su potencial esta dado, principalmente, por la capacidad reductora del ion férrico al ion ferroso, debido a la transferencia de electrones. La especie P. oleraceae, en este trabajo, presentó un valor superior al reportado para este mismo tipo de extractos 27,85 % (1 mg/mL) (Kim et al. 2018) e inferiores a los acuosos que presentan un mayor potencial (45-80 %) (Oliveira et al. 2009). Los resultados obtenidos en el método de FRAP fueron consistentes con lo reportado por Kim et al. (2018), para la cual, se ha encontrado que, aunque es bajo su potencial para la eliminación de radicales hidroxilos, es mayor su capacidad para la quelación de hierro (Hinneburg et al. 2006).
En cuanto a las especies que tuvieron una actividad intermedia en el método DPPH y baja en FRAP fueron T. officinale, P. sativum, P. officinalis y U. caracasana (Tabla 2). Para T. officinale, el resultado obtenido en el método FRAP fue superior a lo reportado por Ivanov (2014), para este mismo tipo de extracto, mientras que en el ensayo de DPPH, solo tiene reportes para el extracto acuoso, con un porcentaje 32,8 % (0,5 mg/mL) (Favari et al. 2013) y para el extracto metanólico, entre el 60-80 % (1-4 mg/mL) (Pădureţ et al. 2016). Para P. sativum, solo se tienen reportes para el extracto acuoso (4,09 mMET/g) y se ha establecido, para esta especie, mayor eficiencia de la acción antioxidante, en mecanismos que generan aniones superóxido frente a radicales hidroxilos (Troncoso & Guija 2005; Wojdyło et al. 2007).
Cabe aclarar que los resultados de actividad antioxidante pueden variar dependiendo del tipo de extracto, del método de extracción, del lugar de crecimiento de la planta y de la concentración de compuestos fenólicos, a los cuales, se les atribuye esta actividad (Chiapetti et al. 2019).
Este estudio contribuye en el conocimiento de actividad antioxidante por los métodos de FRAP y DPPH, así como en la cuantificación de fenoles y flavonoides para las especies U. caracasana, K. hirsuta y E. bogotense, Además, es el primer reporte para la especie A. bogotensis, P. officinalis, U. tomentosa y S. praealtum, de su potencial de actividad antioxidante, por el método de FRAP.
Correlación de actividad antioxidante y contenido de fenoles y flavonoides. Garrido et al. (2013) indican que la actividad antioxidante tiene una fuerte relación con el contenido de compuestos fenólicos de los extractos de plantas, por lo que se espera que, si un extracto tiene mayor contenido fenólico, también sea mayor su capacidad antioxidante. En este sentido, se realizó la correlación entre la cuantificación de compuestos fenólicos, flavonoides y la actividad antioxidante, obtenida por los métodos FRAP y DPPH, se determinó que solo los compuestos fenólicos presentaron una alta correlación positiva (R= 0,93, p <0,001), con el método antioxidante de FRAP (Tabla 3). En este trabajo, se corrobora esta hipótesis, en donde se evidencia que las especies que tuvieron un alto contenido de compuestos fenólicos también tuvieron alto potencial en el ensayo de FRAP, como U. tomentosa, K. hirsuta, A. bogotensis, S. praealtum y Z. officinale y P. oleraceae.
Tabla 3 Coeficientes de correlación de Pearson y probabilidad entre el contenido fenólico y actividad antioxidante.
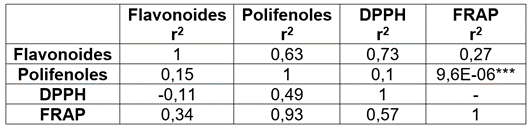
Significancia *: p <0,0001***
Esta hipótesis además es consistente con reportes de Palomino et al. (2009) y Parikh & Patel (2017). Adicionalmente, se encontró una baja correlación entre el contenido fenólico y los flavonoides (R= 0,15, p >0,05), por lo que se sugiere que compuestos fenólicos diferentes a los flavonoides, por ejemplo, derivados del ácido caféico, también juegan un papel importante en la actividad antioxidante (Palomino et al. 2009), por lo que es importante ampliar los estudios en la cuantificación e identificación y correlación de otros metabolitos.
Es importante tener en cuenta que las correlaciones no son completamente lineales, ya que si bien el método de cuantificación de fenoles totales Folin-Ciocalteu es específico para este tipo de metabolitos, también existen otro tipo de metabolitos no fenólicos que pueden afectar la actividad antioxidante o por interacciones antagonistas o sinérgicas (Palomino et al. 2009).
Este estudio permitió evidenciar que las especies U. tomentosa, S. praealtum y K. hirsuta fueron las que tuvieron mayor potencial antioxidante y un alto contenido de polifenoles; sin embargo, hay que tener en cuenta que los métodos para evaluar la capacidad antioxidante nos dan una idea aproximada de lo que podría suceder en un ensayo in vivo y que la capacidad antioxidante de una muestra viene dada por la interacción sinérgica entre diferentes compuestos y su microambiente, así como por el mecanismo de acción, de cada uno de ellos (Pérez-Jaramillo et al. 2017).
Este trabajo, también permitió aportar nuevo conocimiento para la mayoría de las especies que contaban con pocos estudios de cuantificación de polifenoles y potencial antioxidante. Se sugiere que, para estas plantas, se evalúe su potencial en otras actividades biológicas relacionadas con sus usos etnomedicinales, que pueden estar relacionados con la actividad antioxidante y, de esta manera, puedan ser consideradas como una fuente potencial de principios activos.