INTRODUCCIÓN
La salinización de los suelos es una forma de degradación, que disminuye drásticamente su calidad y su capacidad productiva. Alrededor del 20 % de las tierras de regadío, que producen un tercio de los alimentos del mundo, están afectadas por la salinidad (Machado & Serralheiro, 2017). La concentración de sales conlleva a la degradación de los suelos, al disminuir la porosidad y la permeabilidad e incrementar la compactación (Mata-Fernández et al. 2014).
Indistintamente del origen de la salinidad natural o antrópica, en zonas con baja precipitación, se pueden presentar procesos de salinización, debido a que la evaporación del agua deja en el suelo sales que no son disueltas, ni redistribuidas y, por tanto, se acumulan (Mazuela Águila, 2013). Las plantas sometidas a estrés salino pueden presentar disminución en la tasa de germinación, disminución en la longitud del tallo y del área foliar, menor desarrollo de las raíces y número de frutos y reducción en el peso fresco del tallo y las hojas (Can Chulim et al. 2014; Goykovic Cortés & Saavedra Del Real, 2007; Cardona et al. 2018). Los efectos negativos de la salinidad en las plantas se presentan porque este fenómeno genera toxicidad, desbalance nutricional, incremento de especies reactivas del oxígeno, pero, principalmente, estrés hídrico, el cual, reduce la capacidad de las plantas de obtener agua, generando un déficit en el potencial osmótico y, por tanto, produce cambios metabólicos similares a los causados por el marchitamiento (Machado & Serralheiro, 2017).
Una opción para mejorar el crecimiento y el desarrollo de las plantas de cultivo bajo condiciones de estrés salino es la aplicación de bioestimulantes, debido a que estos agentes tienen efectos positivos sobre el crecimiento vegetal, pero también pueden tenerlo sobre la tolerancia a distintos tipos de estrés biótico y abiótico (Van Oosten et al. 2017). La adaptación o tolerancia a la salinidad está regulada por mecanismos moleculares, bioquímicos y fisiológicos; algunos de estos son: homeostasis iónica, activación de enzimas o compuestos antioxidantes, acumulación de solutos compatibles y protección osmótica (Gupta & Huang, 2014). En este sentido, bioestimulantes, como las bacterias promotoras de crecimiento vegetal (PGPR) y los ácidos húmicos (AH), han demostrado diferentes beneficios para las plantas contribuyendo, tanto a la estimulación de su crecimiento como a la mejora en la tolerancia, cuando crecen en condiciones de estrés salino (Ouni et al. 2014; Sánchez López et al. 2016; Esringü et al. 2016).
La zona norte del departamento del Cesar presenta suelos con alta susceptibilidad a la salinización (IDEAM et al. 2017), esta situación se acentúa en el corregimiento de Guacoche, en el municipio de Valledupar, debido a las bajas precipitaciones propias del clima semiárido (OTEC, 2015). Estas condiciones pueden afectar la productividad en cultivos de importancia para la agricultura familiar, entre ellos, el fríjol caupí, reconocido por su alto contenido proteico y de minerales esenciales. La relevancia de este cultivo en el municipio de Valledupar, se refleja al registrar la mayor cantidad de productores en la región Caribe (Martínez Reina et al. 2020).
Teniendo en cuenta lo anterior, en este trabajo se evaluó el efecto de la aplicación de dos agentes bioestimulantes, Bacillus mycoides y AH sobre el crecimiento de plantas de fríjol caupí, en un suelo que presenta condiciones de estrés salino, determinando variables relacionadas con la expresión de mecanismos de tolerancia a la salinidad.
MATERIALES Y MÉTODOS
Preparación de los bioestimulantes. La cepa Bacillus mycoides str. BGSC1-DN3 fue obtenida de la colección de bacterias promotoras de crecimiento vegetal del laboratorio del Grupo de investigación en Microbiología Agrícola y Ambiental, de la Universidad Popular del Cesar. Esta cepa fue previamente tipificada, mediante análisis de secuenciación del gen ribosomal 16S; en ensayos previos (datos no publicados), esta bacteria promovió el crecimiento en plántulas de fríjol caupí y maíz, en condiciones de laboratorio. Otras cepas de B. mycoides han estimulado el crecimiento de plantas, como papa, girasol y tomate (Ambrosini et al. 2016; González F. & Fuentes M., 2017; Yi et al. 2018). A partir de un cultivo de la cepa en caldo nutritivo, se preparó un inóculo de B. mycoides, a una concentración de 1X108 UFC mL-1, ajustada mediante espectrofotometría, hasta alcanzar una absorbancia de 0,2, a una longitud de onda de 600 nm. Se siguió un protocolo de inmovilización celular, desarrollado entre el grupo de Microbiología Agrícola y el grupo DSP-ASIC Builden Group, de la Universidad Popular del Cesar, para encapsular las células de B. mycoides presentes en el inóculo bacteriano, utilizando alginato de sodio comestible al 1 % y una solución de cloruro de calcio al 4 %, en un dispositivo extrusor de perlas de alginato.
Los AH, se obtuvieron a partir de un carbón de bajo rango tipo lignito, mediante solubilización bacteriana del carbón, siguiendo el protocolo descrito por Valero et al. (2014), empleando una cepa de Microbacterium sp. A partir de este método de extracción bacteriano, se pueden obtener AH con diferencias en su estructura supramolecular, las cuales, están relacionas con un mayor grado de bioactividad frente a los AH, obtenidos de manera tradicional (Valero et al. 2018). Posteriormente, se preparó una solución de AH, a una concentración de 100 mg L-1 de AH, en cloruro de calcio 2 mM.
Desarrollo del experimento. El estudio, se realizó en un terreno periurbano, ubicado en el corregimiento de Guacoche (Valledupar), a una latitud de 10°49´72.71” N y longitud 73°16´74.88” O; este predio ha estado dedicado tradicionalmente a la agricultura familiar. El suelo presenta un pH de 7,8, un alto contenido de iones de calcio, magnesio, sodio, sulfatos y bicarbonatos y una conductividad eléctrica de 5,8 dS m-1, medida en el extracto de saturación, por lo que se clasifica como suelo salino (Shahid et al. 2018).
El experimento, se estableció bajo un diseño en bloques completos al azar, con 4 tratamientos, 2 bloques y 6 repeticiones por tratamiento. Para el establecimiento del experimento, se hicieron surcos de 30 cm de ancho, con una distancia de 60 cm entre ellos, se sembraron semillas de fríjol caupí a dos o tres centímetros de profundidad, colocando una semilla de fríjol por sitio y a una distancia de 20 cm entre plantas.
Después de ocho días de la siembra, tras la emergencia de las plántulas, se aplicaron los siguientes tratamientos: 1) bioestimulación de la planta, aplicando AH en solución, mediante aspersión foliar (AH); 2) bioestimulación de la planta, aplicando en la rizosfera una suspensión del inóculo de B. mycoides, inmovilizado en perlas de alginato (P) y 3) bioestimulación de la planta, mediante aplicación combinada de la solución de AH por aspersión foliar y la suspensión de B. mycoides inmovilizado (PAH). Las plantas sin aplicación de bioestimulantes, se tomaron como tratamiento control. Se aplicó riego por aspersión cada tres días, el control de malezas se realizó de forma manual.
Variables evaluadas. 70 días después de la germinación, se registraron las mediciones de las variables respuesta. Para ello, se escogieron al azar doce plantas por tratamiento, para medir los siguientes parámetros indicadores de tolerancia al estrés: 1) contenido hídrico relativo (CHR), 2) índice de contenido de clorofila, 3) concentración de prolina y 4) concentración de polifenoles.
Para la determinación de CHR, se midió la masa fresca de tres hojas por planta; luego, las hojas se colocaron en cámara húmeda por dos horas, para llevarlas a saturación hídrica. Posteriormente, se retiraron las hojas, se removió el exceso de agua y se determinó el peso en condición de turgencia y después se secaron las hojas, en un horno en horno a 70 °C, hasta peso constante, para medir la masa seca. El CHR, se calculó aplicando la expresión CHR= (mf-ms/mt-ms) x 100, donde, mf masa fresca, ms masa seca y mt masa a plena turgencia (Melgarejo et al. 2010).
Para estimar el contenido total de clorofila, se empleó el medidor de clorofila CCM 200 plus Opti sciencies. Los medidores portátiles no destructivos se han utilizado con éxito en algunas especies, registrando altas correlaciones con la determinación de clorofila en laboratorio (Mendoza-Tafolla et al. 2022). Las lecturas, se realizaron en tres hojas del tercio medio de cada planta, tomando este dato en cinco ubicaciones aleatorias para cada hoja; las cinco lecturas, se promediaron para obtener una sola lectura por hoja.
La determinación de prolina, se realizó a partir de un macerado de hojas frescas, utilizando nitrógeno líquido; se agregaron 10 mL de etanol grado reactivo por cada gramo de tejido macerado. La mezcla, se dejó reposar 12 horas a 4 °C y, posteriormente, fue centrifugada a 3000 rpm, por 10 min. El contenido de prolina fue medido por espectrofotometría, utilizando una mezcla de reacción de ninhidrina en ácido acético, etanol y agua, según el método propuesto por Carillo & Gibon (2011).
Los polifenoles, se cuantificaron a partir de un extracto obtenido al pesar 1 g de hojas pulverizadas, al cual, se adicionaron 10 mL de metanol al 96 % y se dejó reposar por dos horas. Posteriormente, se agregó el reactivo Folin- Ciocalteu y una solución de NaCO3 al 20 % y se midió la absorbancia a 760 nm, siguiendo el protocolo descrito por Salgado-Chávez et al. (2020). La concentración de polifenoles fue estimada con base en una curva estándar de ácido gálico, usado como patrón de referencia para la determinación de compuestos fenólicos y se expresó en términos de mg/g EAG (equivalente de ácido gálico).
Análisis estadístico. Para cada una de las variables registradas, se determinaron los parámetros de normalidad de los datos, se realizó el análisis de varianza y la prueba de Tukey, para determinar diferencias significativas entre tratamientos, además de la correlación de Pearson, para determinar la relación entre las variables, con una confianza del 95 %, mediante el programa estadístico Minitab 18.
RESULTADOS Y DISCUSIÓN
El índice de contenido de clorofila presentó incremento en todas las plantas sometidas a los tratamientos con bioestimulantes, con respecto a las plantas del tratamiento control (Tabla 1), se observa un aumento del 48,33 %, estadísticamente significativo, en respuesta al tratamiento P.
Tabla 1 Valores medios de clorofila, contenido hídrico relativo, prolina y polifenoles, en plantas de fríjol caupí, en respuesta a la aplicación de B. mycoides y ácidos húmicos.
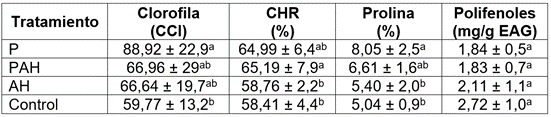
CHR=Contenido hídrico relativo; Tratamientos bioestimulación de la planta aplicando en la rizosfera; P= suspensión del inóculo de B. mycoides inmovilizado en perlas de alginato; PAH= solución de ácidos húmicos + suspensión de B. mycoides inmovilizado; AH=solución de ácidos húmicos.
Los promedios con diferente letra son estadísticamente significativos, p ≤0,05.
La disminución en el contenido de clorofila es una respuesta común de las plantas ante factores causantes de estrés, como la salinidad, que reducen los niveles de pigmentos fotosintéticos, ya sea que inhiban la síntesis de precursores de los pigmentos o afecten estructuralmente los cloroplastos (Chávez Suárez et al. 2015), de modo que los fotosistemas absorben luz de manera poco eficiente, reduciendo su capacidad fotosintética (Liu et al. 2018). Por tanto, el incremento en el contenido de clorofila observado en respuesta a la aplicación de este tratamiento, se puede relacionar como efecto asociado en la mitigación del estrés. Esta observación concuerda con resultados previos reportados por Chen et al. (2016), quienes encontraron que el contenido de clorofila aumentó significativamente en plantas de maíz, con la inoculación de la bacteria Bacillus amyloliquefaciens, en condiciones de estrés salino. Igualmente, Li & Jiang (2017) observaron protección contra la salinidad con un incremento en el contenido de clorofila en maíz, al aplicar B. aquimaris.
Los valores de prolina fueron superiores en las plantas sometidas al tratamiento P, con un aumento del 49,07 %, siendo estadísticamente significativa la diferencia respecto a los demás tratamientos (Tabla 1). El incremento en la síntesis y posterior acumulación de prolina en plantas estresadas, no solo como producto de la inducción de la biosíntesis, sino por la inactivación de la degradación de este aminoácido (Reddy et al. 2004), es un indicador de tolerancia al estrés, debido a que la prolina es uno de los principales solutos compatibles que se acumulan en las plantas sometidas a estas condiciones y se produce como resultado de un mecanismo de ajuste osmótico, que permite mantener la absorción de agua y la presión de turgencia, evitando los daños causados por el desbalance hídrico. La prolina, también está relacionada con la estabilización de estructuras sub-celulares, membranas, proteínas y eliminación de radicales libres (Pereyra Cardozo & Quiriban, 2014), por lo que promueve ciertas funciones celulares, que le permiten a la planta mitigar las condiciones adversas de crecimiento.
De acuerdo con lo anterior, el incremento en el contenido de prolina observado en respuesta a la aplicación de B. mycoides, inmovilizado en perlas, se puede deber a la activación de este mecanismo de osmorregulación, el cual, pudo contribuir a que las plantas mantuvieran un buen estado fisiológico y aminorar el estrés salino, reflejado en el aumento del contenido hídrico y de clorofila, variables con las que se observó una correlación positiva (Tabla 2).
Tabla 2 Correlaciones entre las variables clorofila, contenido hídrico relativo prolina y polifenoles.
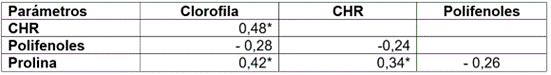
CHR=Contenido hídrico relativo.
* Significancia p ≤0,05.
La acumulación de prolina, como efecto de la aplicación de microorganismos promotores del crecimiento vegetal, se reporta en fríjol caupí, por Manaf & Zayed (2015), quienes evidenciaron incrementos de prolina en presencia de micorrizas y Pseudomonas fluorescens, al aumentar los niveles de sales, así como Bano & Fatima (2009), quienes coinocularon cepas de Rhizobium sp. y Pseudomonas sp. en maíz, afectado por la salinidad. Se ha demostrado la capacidad de la prolina, ya sea libre o unida a polipéptidos, para reaccionar directamente con H2O2 y OH- y formar radicales libres estables (Liang et al. 2013). El papel de la prolina, como desintoxicador de radicales libres, ocasionado por PGPR, ha sido evidenciado por Upadhyay et al. (2012), al reportar un aumento en el contenido de prolina, mientras que la actividad de las enzimas antioxidantes se redujo significativamente en plantas de trigo, tratadas con B. subtilis y Arthrobacter sp.
El contenido hídrico relativo (CHR) mostró un aumento significativo en respuesta a la aplicación del tratamiento PAH, con un incremento del 11,61 % (Tabla 1). Teniendo en cuenta que la salinidad conlleva principalmente al estrés hídrico y, en consecuencia, a la reducción de la capacidad de las plantas de obtener agua, un aumento en esta variable puede denotar una mejora del estado hídrico de las plantas. Este aumento, se puede deber a una disminución en la pérdida de agua regulada por las estomas o una mayor capacidad de absorción y retención de agua, como resultado de un ajuste osmótico (Shtaya et al. 2019). Un resultado similar fue obtenido por Saghafi et al. (2018), quienes reportaron incrementos en el CHR hasta de un 8,78 %, con cepas de Rhizobium, aplicadas en canola bajo estrés salino. En similares condiciones de estrés, Karlidag et al. (2010) observaron un aumento en el contenido hídrico en fresas, al tratarlas con varias cepas PGPR. mientras que, Khorasaninejad et al. (2018), reportan un incremento en CHR proporcional a la concentración de AH, aplicados en plantas de Echinacea purpurea, bajo estrés hídrico.
En general, los resultados presentados sugieren la activación de mecanismos de ajuste osmótico en las plantas, los cuales, ayudaron a mantener la absorción de agua y la presión de turgencia. El ajuste osmótico, se puede dar por la biosíntesis de osmolitos orgánicos y la acumulación de iones (Lamz Piedra & González Cepero, 2013); con base en la correlación positiva entre el contenido hídrico y los valores de prolina (Tabla 2), se puede sugerir que el tratamiento de bioestimulación con B. mycoides mejoró el estado hídrico de las plantas de fríjol caupí, como consecuencia de la acumulación de prolina, como soluto compatible y este efecto es mejorado por la aplicación conjunta de la bacteria y AH. Al respecto, Chen et al. (2007) obtuvieron niveles más altos de prolina libre y, en consecuencia, una mayor tolerancia al estrés osmótico, en plantas de A. thaliana, al introducirle genes derivados de B. subtilis.
El estrés salino puede conllevar al estrés oxidativo, a causa del aumento de las especies reactivas del oxígeno, los cuales, pueden alterar el metabolismo celular (Eyidogan & Öz, 2007). Los polifenoles hacen parte del sistema antioxidante de las plantas y se sintetizan en situaciones de estrés, para proteger las estructuras celulares frente al daño oxidativo. Respecto a la cuantificación de polifenoles, se observó una tendencia a la disminución del contenido en las plantas tratadas con bioestimulantes; sin embargo, para esta determinación, no hubo diferencia significativa entre tratamientos (Tabla 1).
Del presente estudio, se puede concluir, que las afectaciones fisiológicas causadas por estrés salino en plantas de fríjol caupí pueden ser atenuadas con la aplicación de bioestimulantes a base de B. mycoides, inmovilizado en perlas de alginato, puesto que se evidenció mejora del estado hídrico y la capacidad fotosintética de las plantas, al obtener mayores valores de CHR y clorofila, con tratamientos donde estaba presente esta bacteria. La tolerancia a la salinidad se relacionó con la producción y la acumulación de prolina, soluto compatible asociado con la osmorregulación. Lo observado justifica la continuidad de estudios con la aplicación de B. mycoides, inmovilizado en perlas y permite plantear ensayos en otros cultivos de importancia para la agricultura familiar, en regiones con suelos que presenten problemas de salinidad, con miras al desarrollo de un bioinoculante.















