INTRODUCCIÓN
El género Capsicum pertenece a la familia Solanaceae, nativo de Centro y Sur América, comprende más de 30 especies, cinco de ellas cultivadas y utilizadas por el hombre para su consumo: Capsicum annuum, Capsicum frutescens, Capsicum chinense, Capsicum pubescens y Capsicum baccatum (Kenyon et al. 2014; Parisi et al. 2020). Las diferentes características y propiedades del ají (Capsicum spp.) hacen de esta hortaliza un producto atractivo en los mercados internacionales, puesto que, además de usarse como condimento en la cocina tradicional, el ají, es fuente de colorantes y de principios activos, empleados en la industria cosmética y farmacéutica (Kenyon et al. 2014; Parisi et al. 2020).
En la actualidad, la calidad del fruto y la productividad agrícola se ven afectados por el cambio climático y las enfermedades de origen bacteriano, fúngico y viral (Kenyon et al. 2014; Pinto et al. 2016; Parisi et al. 2020), incluso, se documenta que la incidencia viral en zonas productoras de ají ha aumentado en los últimos años, en las regiones tropicales y subtropicales (Kenyon et al. 2014).
En Colombia, esta problemática se evidencia en cultivares de ají, sembrados en el departamento del Valle del Cauca, en donde, recientemente, se aislaron y se caracterizaron, molecularmente, tres virus que afectan la producción de esta solanácea: el begomovirus (familia Geminiviridae), virus del mosaico rugoso del ají (Pepper rugose mosaic virus, PRMV), el cucumovirus (familia Bromoviridae) Cucumber mosaic virus (CMV-ají) y el potyvirus (familia Potyviridae), virus del moteado severo del ají (Pepper severe mottle virus, PepSMoV) (Vaca-Vaca et al. 2019; Rivera-Toro et al. 2020; Rivera-Toro et al. 2021). Investigaciones recientes demostraron que CMV-ají y PepSMoV son agentes infecciosos para las plantas de ají, ya que pueden inducir síntomas, como deformación y mosaicos dorados en sus hojas, ocasionar retraso en el crecimiento de las plantas y afectar su desarrollo (Rivera-Toro et al. 2020; Rivera-Toro et al. 2021).
Aunque las investigaciones sobre las enfermedades de origen viral se realizan mayoritariamente en los cultivos es cierto que las plantas silvestres son fundamentales en la generación de variación genética viral y parte clave de la epidemiología viral en los agroecosistemas (Duffus, 1971; Prajapat et al. 2014; Rodríguez-Negrete et al. 2019). Las arvenses pueden ser fuentes de virus aun no conocidos, ser reservorios de virus importantes para la agricultura u hospederas de vectores biológicos (Apablaza et al. 2003; Wisler & Norris, 2005; Prajapat et al. 2014; Rodríguez-Negrete et al. 2019).
En este contexto, en el Valle del Cauca, se reporta la presencia de begomovirus en arvenses asociadas a los cultivos de tomate y ají (López-López et al. 2019; Vaca-Vaca et al. 2020). En el caso de PRMV, este se detecta en las especies arvenses Eclipta prostrata, Desmodium tortuosum, Rhynchosia minima, Panicum polygonatum, Capsicum rhomboideum y Solanum americanum (López-López et al. 2022); no obstante, hasta el momento, el conocimiento sobre los hospederos alternos de CMV-ají y PepSMoV en los ecosistemas agrícolas de Colombia es limitado.
Al considerar la diversidad de especies arvenses en las zonas productoras de ají y su papel como posibles reservorios de virus, que pueden ser transmitidos a nuevos hospederos, se justifica la realización del presente estudio, el cual, tuvo como objetivo identificar hospederos alternos de los virus CMV-ají y PepSMoV, en arvenses asociadas al cultivo de ají, en el departamento del Valle del Cauca (Colombia). Esta información es importante para conocer cuál es la distribución de estos virus, sus hospederos alternos y su papel en los ecosistemas agrícolas del departamento. Lo anterior, es de gran utilidad para implementar un manejo eficiente en el control de PepSMoV y CMV-ají, que permitan disminuir su incidencia en las plantas susceptibles y reducir el daño causado por las enfermedades virales.
MATERIALES Y MÉTODOS
Recolección de material vegetal. Durante el 2018, se recolectaron plantas arvenses en el departamento del Valle del Cauca, provenientes de nueve fincas productoras de ají, ubicadas en los municipios de Bolívar, Candelaria, La Unión, Roldanillo, Tuluá, Vijes y Yumbo (Figura 1). Las plantas, se seleccionaron de manera aleatoria dentro y alrededor de las parcelas. Las hojas de cada una de las plantas, se almacenaron en tubos cónicos de plástico con tapa de rosca FalconTM, de 50 mL, con sílica gel, a temperatura ambiente; adicionalmente, parte del tejido foliar de cada arvense, se molió con nitrógeno líquido (N2) y se transfirió a tubos de plástico EppendorfTM de 2 mL, para su almacenamiento final, a -20 °C, hasta su posterior análisis.
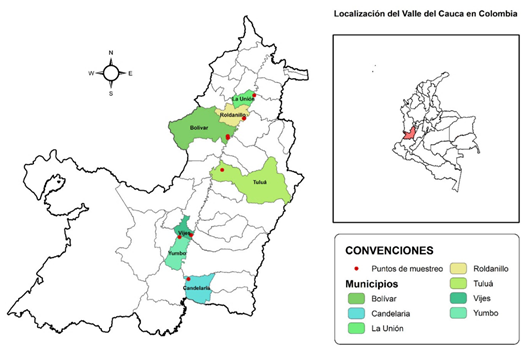
Figura 1 Localización geográfica de los puntos de muestreos de arvenses asociadas al cultivo de ají, con el fin de identificar hospederos alternos de los virus CMV-ají y PepSMoV, realizados en el Valle del Cauca, Colombia.
Determinación taxonómica de las arvenses. La determinación taxonómica de las arvenses, se llevó a cabo en el Herbario “José Cuatrecasas Arumí” de la Universidad Nacional de Colombia, sede Palmira. Se utilizaron claves taxonómicas, se realizaron comparaciones con ejemplares del herbario y se corroboró la nomenclatura de cada especie, en la base de datos TROPICOS del Missouri Botanical Garden (http://www.tropicos.org).
Extracción de ARN total. El ARN total, se obtuvo empleando el reactivo TRIsure™ (Bioline), de acuerdo con las instrucciones del fabricante, a partir de 100 mg de tejido foliar deshidratado en sílica gel y molido, con N2 líquido. La integridad del ácido nucleico, se verificó por electroforesis en geles de agarosa al 0,7 % (p/v), teñidos con bromuro de etidio (10 mg/mL), utilizando, como tampón, TAE 1X (tris-ácido acético-EDTA). En la electroforesis, se usó el marcador de peso molecular 1 kb DNA Ladder (New England Biolabs INC) y se visualizó 1 µL del ARN total. Los geles de agarosa, se revelaron en el transiluminador ChemiDoc™ XRS (BioRad ™) y se fotografiaron con el Software Quantity One - 4.6.5.
Síntesis de ADNc. Una vez aislado el ARN total, se realizó la síntesis de ADN complementario (ADNc), mediante la reacción en cadena de la polimerasa con transcriptasa inversa (Reverse Transcription Polymerase Chain Reaction, RT-PCR, por sus siglas en inglés). Para la reacción de RT-PCR, se empleó el Kit RevertAid RT Reverse Transcription (Thermo Scientific TM), utilizando hexámeros al azar, en un volumen final de 20 µL, de acuerdo con el protocolo descrito por el fabricante. Cada reacción contenía: 0,5 µg de ARN, hexámeros al azar, buffer 5X, inhibidor de ARNasas RiboLock, 10mM de los cuatro dNTPs y 200 U de la enzima transcriptasa inversa RevertAid.
Amplificación de secuencias virales empleando RT-PCR. Para la amplificación de la secuencia de CMV, se utilizaron dos pares de cebadores: i) CMV-F (5'-CCT-CCG-CGG-ATG-CTA-ACT-T-3') y CMV-R (5'-CGG-AAT-CAG-ACT-GGG-AGC-A-3'), descritos por Herrera-Vásquez et al. (2009), que amplifican un fragmento de 586 pb del gen CP (Coat Protein, CP); ii) CMV-Ají-F (5´-CTT-TAC-GAA-CTG-TCA-CCC-3´) y CMV-Ají-R (5´-AAC-TAT-TAA-CCA-CCC-AAC-C-3´), cebadores específicos, diseñados por Rivera-Toro et al. (2020), para detectar la cuasiespecie CMV-ají aislado en plantas de ají y que amplifican un fragmento de 229 pb del gen CP.
Para determinar la presencia de potyvirus en las plantas arvenses, se empleó el par de cebadores NIb2F (5´-GTI-TGY-GTI-GAY-GAY-TTY-AAY-AA-3´) y NIb3R (5´-TCI-ACI-ACI-GTI-GAI-GGY-TGN-CC-3´), descritos por Zheng et al. (2010), que amplifican una secuencia conservada de 350 pb de la región NIb (Nuclear inclusion B), del genoma potyviral. La detección específica de PepSMoV, se llevó a cabo con el par de cebadores Pep-F (5´-GTT-GGA-AAG-AAG-GTA-GTG-3´) y Pep-R (5´-TGA-AGG-TAG-GTT-TCG-AGT-3´), descritos por Rivera-Toro et al. (2021) y que amplifican una secuencia de 289 pb de la región CP.
Las amplificaciones, se llevaron a cabo con el ADNc de las 121 plantas arvenses, utilizando la enzima ADN polimerasa OneTaq® (New England Biolabs), en los termocicladores T100 y C1000 (BioRad) y en un volumen final de 25 μL (1 μL de ADNc, buffer 1X, 200 μM de dNTPs, 0,2 μM de cada cebador,1,25 U de AND polimerasa OneTaq y agua Mili-Q).
Las condiciones de las PCR, se establecieron según lo descrito por los autores para cada par de cebadores (Herrera-Vásquez et al. 2009; Zheng et al. 2010; Rivera-Toro et al. 2020 y Rivera-Toro et al. 2021). Los fragmentos amplificados, se visualizaron por electroforesis en geles de agarosa al 0,8 % y 1 % (p/v); como marcador de peso molecular, se usó 1 kb DNA Ladder (New England Biolabs INC). Los geles, se visualizaron en el transiluminador BioRad y el Software Quantity One - 4.6.5.
RESULTADOS Y DISCUSIÓN
121 arvenses fueron colectadas en nueve lotes de cultivo de ají (Capsicum spp.), localizados en siete municipios del Departamento del Valle del Cauca, Colombia: Bolívar (19 plantas), Candelaria (17), La Unión (7), Roldanillo (25), Tuluá (38), Vijes (10) y Yumbo (5) (Figura 1). La mayoría de las muestras (113) fueron asintomáticas y solo 21 presentaron síntomas de infección viral: deformación en hojas, epinastia, clorosis o mosaicos dorados (Tabla 1; Figura 2c , 2j, 2i).
Tabla 1 Arvenses identificadas como reservorios de CMV-ají y PepSMoV en el Valle del Cauca.
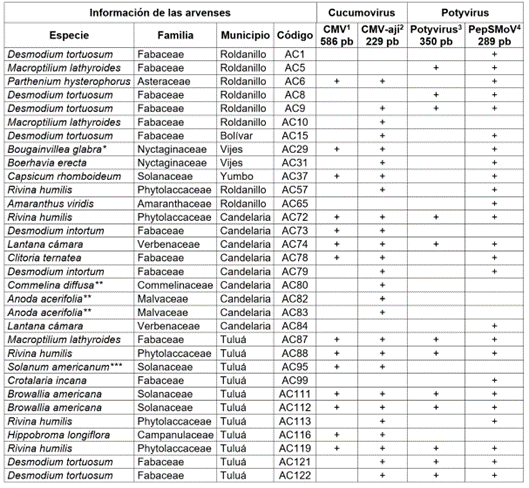
1 Herrera-Vásquez et al. (2009); 2Rivera-Toro et al. (2020); 3Zheng et al. (2010); 4Rivera-Toro et al. (2021). Síntomas: *Deformación en hojas **Mosaicos dorados en hojas ***Epinastia.

Figura 2 Arvenses asociadas al cultivo de ají, identificadas como reservorios de CMV-ají y PepSMoV, en el Valle del Cauca. a) Amaranthus viridis L.; b) Hippobroma longiflora (L.) G. Don; c) Commelina diffusa Burm. f.; d) Parthenium hysterophorus L.; e) Clitoria ternatea L.; f) Crotalaria incana L.; g) Desmodium tortuosum (Sw.) DC.; h) Desmodium intortum (Mill.) Urb.; i) Macroptilium lathyroides (L.) Urb.; j) Anoda acerifolia Cav.; k) Boerhavia erecta L.; l) Bougainvillea glabra Choisy; m-n) Rivina humilis L.; o) Browallia americana L.; p) Capsicum rhomboideum (Dunal) Kuntze; q) Solanum americanum Mill.; r) Lantana camara L.
La presencia de virus CMV, CMV-ají, potyvirus y PepSMoV en las arvenses colectadas fue evaluada mediante RT-PCR. Los resultados de los ensayos moleculares en las 121 muestras de tejido foliar analizadas revelaron una incidencia del 21,5 %, para la cepa CMV-ají; del 20,6 %, para PepSMoV; del 11,6 %, para CMV y del 10,7 %, para potyvirus (Tabla 1, Figura 3, Figura 4). CMV-ají, se detectó en 26 plantas provenientes de los municipios de Bolívar (1/19), Candelaria (8/17), Roldanillo (4/25), Tuluá (10/38), Vijes (2/10) y Yumbo (1/5), pero no se detectó en las muestras originarias del municipio de La Unión (0/7) (Tabla 1, Figura 1, Figura 5). Dentro de este grupo de plantas están especies de las familias Amaranthaceae, Campanulaceae, Commelinaceae, Compositae, Leguminosae, Malvaceae, Nyctaginaceae, Phytolaccaceae, Solanaceae y Verbenaceae, destacándose, entre ellas, la familia Leguminosae, con 13 individuos y cinco especies. Asimismo, sobresalen las especies D. tortuosum y R. humilis por presentar el mayor número de individuos con virus (Tabla 1). Scholthof et al. (2011) y Lim et al. (2022) estiman que en el mundo hay más de 1.200 especies hospederas de CMV, pertenecientes a más de 100 familias botánicas monocotiledóneas y dicotiledóneas. Dentro de este grupo de plantas, P. hysterophorus, S. americanum (sinonimia Solanum ptycanthum) y C. diffusa han sido reportados previamente como hospederos de CMV (Hobbs et al. 2000; Ormeño N. & Sepúlveda R., 2005; Sacristán et al. 2004; Farreyrol et al. 2010; Jalender et al. 2017). De acuerdo con la bibliografía, H. longiflora, C. ternatea, D. tortuosum, D. intortum, M. lathyroides, A. acerifolia, B. erecta, B. glabra, R. humilis, B. americana, C. rhomboideum y L. camara representarían nuevos reportes como hospederas de CMV (Tabla 1, Figura 2).
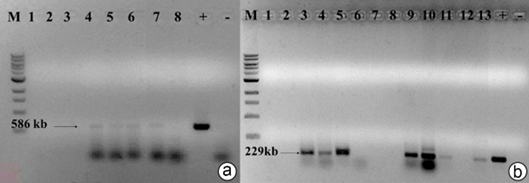
Figura 3 Detección viral del cucumovirus CMV por RT-PCR en arvenses asociadas al cultivo de ají, en el Valle del Cauca. a) Amplificación de un fragmento 586pb del gen de CP del virus CMV. 1) Parthenium hysterophorus (AC69), 2) Lagascea mollis (AC70), 3) Ipomoea tiliacea (AC71), 4) Rivina humilis (AC72), 5) Desmodium intortum (AC73), 6) Lantana camara (AC74.), 7) Clitoria ternatea (AC78), 8) Lantana camara (AC84). b) Amplificación por PCR de un fragmento de 229pb de la región CP del virus CMV-ají. 1) Parthenium hysterophorus (AC69), 2) Lagascea mollis (AC70), 3) Rivina humilis (AC72), 4) Desmodium intortum (AC73), 5) Lantana camara (AC74), 6) Emilia sonchifolia (AC75), 7) Lagascea mollis (AC76), 8) Bidens pilosa (AC77), 9) Clitoria ternatea (AC78), 10) Desmodium intortum (AC79), 11) Commelina diffusa (AC80), 12) Ipomoea tiliacea (AC81), 13) Anoda acerifolia (AC82). Visualizado en el gel de agarosa al 1%. M: Marcador de peso molecular 1kb DNA Ladder, (+) Control positivo ADN plasmídico, que porta un fragmento de CMV-ají; (-) control negativo.
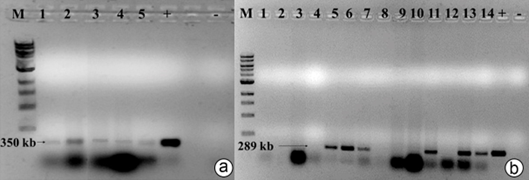
Figura 4 Detección del potyvirus PepSMoV por RT-PCR en arvenses asociadas al cultivo de ají .a) Amplificación de un fragmento de 350pb de la región NIb del genoma de los potyvirus. 1) Macroptilium lathyroides (AC87), 2) Rivina humilis (AC88), 3) Browallia americana (AC111), 4) Rivina humilis (AC119), 5) Desmodium tortuosum (AC122). b) Amplificación de un fragmento de 289pb de la región CP del virus PepSMoV. 1) Cyanthillium cinereum (AC107), 2) Emilia sonchifolia (AC108), 3) Emilia sonchifolia (AC109), 4) Solanum americanum (AC110), 5) Browallia americana (AC111), 6) Browallia americana (AC112), 7) Rivina humilis (AC113), 8) Galinsoga parviflora (AC115), 9) Hippobroma longiflora (AC116), 10) Solanum americanum (AC118), 11) Rivina humilis (AC119), 12) Indigofera lespedezioides (AC120), 13) Desmodium tortuosum (AC121), 14) Desmodium tortuosum (AC122). Visualizado en gel de agarosa al 1%. M: Marcador de peso molecular 1kb DNA Ladder. (+) Control positivo, ADN plasmídico que contiene un fragmento de PepSMoV (-) Control negativo.
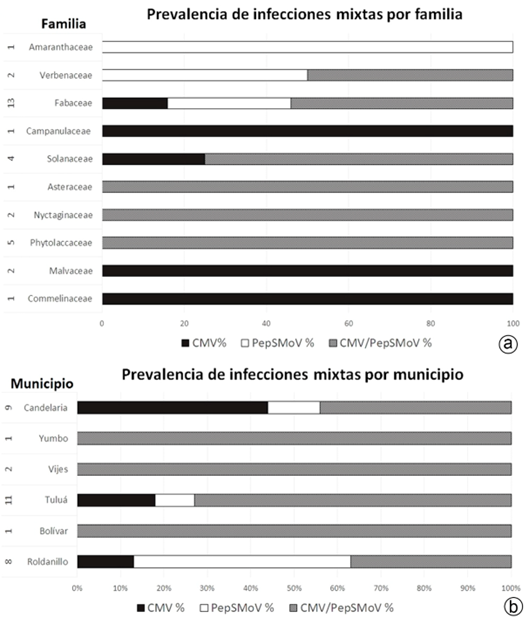
Figura 5 Prevalencia de infecciones mixtas de CMV y PepSMoV en arvenses asociadas al cultivo de ají, en Valle del Cauca. a) Por familia de arvense; b) Por municipio de colecta. En la columna de la izquierda, se muestra el número de muestras positivas para los virus CMV y PepSMoV.
PepSMoV, se detectó en 25 plantas recolectadas en los municipios de Bolívar (1/19), Candelaria (5/17), Roldanillo (8/25), Tuluá (9/38), Vijes (1/10) y Yumbo (1/5) y, al igual que el virus CMV-ají, PepSMoV no se detectó en muestras provenientes del municipio de La Unión (Tabla 1, Figura 4 y Figura 5). Estas 25 plantas están distribuidas en 7 familias, 12 géneros y 13 especies: A. viridis, P. hysterophorus, C. ternatea, D. tortuosum, D. intortum, M. lathyroides, C. incana, Boerhavia erecta, B. glabra, R. humilis, B. americana, C. rhomboideum y L. camara (Figura 2). Estudios previos reportan la presencia de potyvirus en Abutilon abutilastrum, Amaranthus viridis, Anoda cristata, Clitoria ternatea, Crotalaria incana, Desmodium tortuosum, Solanum americanum y Solanum rostratum (Spence & Walkey, 1995; Davis et al. 2002; Ormeño N. & Sepúlveda R., 2005; Segundo et al. 2007; Bermúdez-Guzmán et al. 2018; Sultana et al. 2019). En consecuencia, P. hysterophorus, D. intortum, M. lathyroides, B. erecta, B. glabra, R. humilis, B. americana, C. rhomboideum y L. camara representan nuevos reportes como hospederos de potyvirus (Tabla 1, Figura 2). Estas 13 especies representan los primeros reportes para Colombia y, a nivel mundial, de plantas silvestres hospederas de PepSMoV, un potyvirus reportado recientemente afectando cultivos de ají en Colombia (Rivera-Toro et al. 2021).
En cuanto a su distribución, los hallazgos presentados en este estudio comprueban que, tanto CMV-ají como PepSMoV, se encuentran ampliamente distribuidos en el departamento (Tabla 1, Figura 1 y Figura 5b).
Es importante señalar, que los virus PepSMoV (Potyvirus, familia Potyviridae) y CMV-ají (Cucumovirus, familia Bromoviridae) fueron aislados y caracterizados molecularmente en plantas de ají (Capsicum spp.), cultivadas a cielo abierto, en el departamento del Valle del ají (Rivera-Toro et al. 2020; 2021).
Apablaza et al. (2003) mencionan que las arvenses portadoras de virus sintomáticas y asintomáticas cumplen un rol importante en la propagación de los virus. En este estudio, los resultados muestran que el 84,4 % de las 32 plantas identificadas como hospederas de CMV-ají y PepSMoV fueron asintomáticas (Tabla 1). Los síntomas de infección viral (mosaicos dorados, deformación y enrollamiento en las hojas fueron observados en las arvenses B. glabra (AC29), Commelina diffusa (AC80), Anoda acerifolia (AC82 y AC83) y S. americanum (AC95) (Tabla 1; Figura 2c, 2j y 2i).
Los resultados de los análisis moleculares mostraron la presencia de infecciones mixtas de CMV-ají & PepSMoV, en 57 % (19/33), de las arvenses positivas a virus (Figura 5). El análisis de prevalencia de CMV-ají & PepSMoV por familia de arvense mostró que están distribuidas en 10 Familias, donde Fabaceae presentó la mayor cantidad de muestras positivas (7/13), seguido de Phytolaccaceae (5/5) (Figura 5a). La especie Bougainvillea glabra (Familia Nyctaginaceae) resultó positiva para CMV-ají & PepSMoV y mostró enrollamiento en sus hojas en el momento del muestreo (Figura 2i). Cuando se analiza la prevalencia de infecciones mixtas por municipio es preocupante encontrar que, en seis de siete municipios productores de ají, se identificaron arvenses que hospedaban ambos virus, CMV-ají & PepSMoV (Figura 5b).
En las plantas es común encontrar infecciones por uno o más virus y la variedad de síntomas observados en una infección mixta depende del tipo de interacción (sinergia, antagonismo o neutralismo), que se establece entre los virus coinfectantes (Mochizuki et al. 2016; Salánki et al. 2018). Varios autores, como Wang et al. (2002), Murphy & Bowen (2006) y Jaramillo Zapata et al. (2011) señalan que CMV tiene una relación sinérgica con los potyvirus. Asimismo, estos últimos, pueden interactuar de forma sinérgica con CMV y otros virus coinfectantes, favoreciendo el movimiento célula a célula, la acumulación de partículas virales, el acrecentamiento de los síntomas y la distribución del virus heterólogo (Mochizuki et al. 2016).
Los potyvirus (PepSMoV) y cucumovirus (CMV) son virus económicamente importantes en el sector agrícola, que usan como vector biológico de trasmisión a los áfidos y su éxito adaptativo se explica por la diversidad genética de sus poblaciones (Adams et al. 2005; Revers & García, 2015; Jacquemond, 2012; Salánki et al. 2018). Hasta ahora, se han identificado más de 86 especies de áfidos transmisores de CMV, entre los cuales, se destacan Myzus persicae y Aphis gossypii (Hobbs et al. 2000; Jacquemond, 2012). Rivera-Toro et al. (2020) plantean que, posiblemente, CMV-ají (subgrupo IA) es transmitido con mayor frecuencia por A. gossypii, que por M. persicae. En el Valle del Cauca, la presencia de estas dos especies de áfidos, consideradas como vectores, se ha registrado en cultivos de ají en municipios en donde se han detectado los virus CMV-ají y PepSMoV (Gallo-Franco et al. 2019; Rivera-Toro et al. 2020; 2021); esto podría explicar la prevalencia de infecciones mixtas de CMV-ají & PepSMoV en las arvenses colectadas en los diferentes municipios de departamento del Valle del Cauca (Figura 5b). En Parthenium hysterophorus (AC9), un arvense que presentó infección mixta (Tabla 1), se observó la presencia de áfidos en campo durante la colecta, lo cual, indica que estos insectos están jugando un papel importante en el movimiento de las partículas virales de CMV-ají & PepSMoV, entre el cultivo de ají y las arvenses aquí identificadas.
Dado que, en la actualidad, las interacciones entre CMV-ají & PepSMoV se desconocen, sería importante evaluar en futuros trabajos qué tipo de interacción - sinergismo, antagonismo o neutralismo - ocurre entre estos virus y qué consecuencias epidemiológicas podrían traer para el cultivo de ají.















