INTRODUCCIÓN
La papa (Solanum tuberosum L.) es considerada como el cuarto cultivo alimenticio más importante, a nivel mundial, debido a que sus tubérculos poseen excelentes propiedades nutritivas (FAO, 2008), al ser fuente de carbohidratos, fibras, antioxidantes, proteínas, vitaminas y minerales (Burlingame et al. 2009). En Colombia, este cultivo se localiza en las zonas altas (> 2000 m s.n.m.) de las tres cordilleras, comprendiendo un área de 128.222 ha y un rendimiento promedio de 21 t ha-1. Cerca del 90 % de la producción de papa, se concentra en los departamentos de Cundinamarca (37 %), Boyacá (27 %), Nariño (20 %) y Antioquia (6 %), con unas 100 mil familias, dedicadas a este cultivo, como fuente principal de ingresos (MADR, 2020).
La susceptibilidad a plagas y enfermedades del cultivo de la papa y, en particular, las enfermedades de origen viral, generan grandes pérdidas en su producción, pues ocasionan reducciones significativas en los rendimientos y en el valor comercial de los tubérculos (Fedepapa, 2019; Kreuze et al. 2020). En el mundo, se han reportado alrededor de 53 especies de virus infectando a la papa, entre los que se destacan: Potato virus B (PVB), Potato virus S (PVS), Potato virus V (PVV), Potato yellow vein virus (PYVV), Potato mop-top virus (PMTV), Potato virus Y (PVY), Potato leafroll virus (PLRV) y Potato virus X (PVX); éstos tres últimos virus son los más restrictivos para los sistemas de producción de papa, a nivel mundial (Salazar, 2006; Chikh Ali et al. 2008; Kerlan, 2009; Kreuze et al. 2020). El PVY puede causar deterioro de los tubérculos (por ejemplo, anillos necróticos) y del tejido foliar, reduciendo los rendimientos en niveles del 40 al 70 % (Nolte et al. 2004); respecto a PLRV, se ha reportado que altos índices de prevalencia pueden ocasionar pérdidas del 50 al 100 % (Kerlan, 2009); para el caso de la infección por PVX, se han registrado reducciones del 15 al 20 % (Cox & Jones, 2010). PVX genera sinergismo con PVY, PVA y PVS, cuyas coinfecciones se manifiestan por mosaicos rugosos severos y reducciones en la producción de tubérculos superiores al 50 % (Beemster & Bokx, 1987; Hameed et al. 2014).
En Colombia, para el manejo de enfermedades virales, se utiliza semilla certificada, la que se genera en dos fases: la inicial, se realiza en laboratorio, invernadero o casa malla, para la producción de semilla súper élite y élite, siendo la primera, derivada de plantas in vitro, que se presumen están libres de virus; la segunda fase, se lleva a cabo en campo e incluye la producción de semilla básica, registrada y certificada (ICA, 2015).
A pesar de la importancia del cultivo de papa en Colombia existen deficiencias en las metodologías de detección viral, utilizadas en los procesos de certificación del material de siembra, pues, usualmente, se fundamentan solo en la observación de síntomas en campo de los lotes destinados a producción de semilla y, eventualmente, en el uso de pruebas de ELISA, para algunos virus (ICA, 2015). El presente trabajo tuvo como principal objetivo evaluar la prevalencia de ocho virus de ARN en material de siembra certificado de papa (Solanum tuberosum cv. Diacol Capiro), procedente de la sabana Cundiboyacense, utilizando pruebas de RT-PCR, en tiempo real (RT-qPCR). También, se obtuvo información sobre los genomas de algunos de los virus, detectados mediante análisis bioinformáticos de las secuencias obtenidas por secuenciación de alto rendimiento (HTS).
MATERIALES Y MÉTODOS
Material vegetal. Las muestras de tubérculos-semilla de papa cv. Diacol Capiro certificados (8 lotes), se obtuvieron en los municipios de Zipaquirá (Cundinamarca) (2 lotes) (5°1’17,4” N, 73°59’27,59” W), Sotaquirá (4 lotes) (5°45’56,16” N, 73°14’50,64” W) y Ventaquemada (2 lotes) (5°22’0,12” N, 73.31’15,6” W) (Boyacá); además, con fines comparativos, se emplearon tres lotes de tubérculos-semilla no certificados, procedentes de los municipios de Villapinzón (5°12’54,72” N, 73°35’40,56” W) (2 lotes) (Cundinamarca) y Sotaquirá (1 lote) (Boyacá). Cada lote de semilla consistió en 10 a 15 tubérculos tomados al azar, que fueron sumergidos en una solución de 50 ppm de ácido giberélico (Sigma-Aldrich, EEUU), para inducir su brotación y luego fueron almacenados en oscuridad, a temperatura ambiente, durante 15 a 20 días. Posteriormente, para la extracción de los ácidos nucleicos, se realizaron mezclas al azar de brotes de 2 cm, recolectados en los tubérculos de cada lote de semilla evaluado (Gallo García et al. 2019; García et al. 2022).
Detección de virus por RT-qPCR. La extracción del ARN total, se realizó a partir de 100 mg de la mezcla de brotes de cada lote de semilla, con el kit GeneJET Plant RNA Purification Mini (Thermo Fisher Scientific, EEUU), previa maceración con nitrógeno líquido y elución en 40 μL de agua tratada con Dietilpirocarbonato (DEPC); la pureza y la concentración del ARN extraído, se determinó por lecturas a 260 nm y 280 nm, en un equipo Nanodrop 2000C (Thermo Fisher Scientific, EEUU). Luego, se sintetizó el ADNc, a través de una reacción de retro-transcripción en 20 µL de volumen, incubándose en un termociclador T3 (Biometra, Alemania), a 65 °C por 5 min, seguido de 42 °C por 1 h y, por último, 70 °C por 10 min, para desnaturalizar la enzima. En las reacciones de ADNc, se utilizaron 200U de la enzima RevertAid Reverse Transcriptase (RT) (Thermo Fisher Scientific, EEUU), 1X de buffer RT, 0,5mM de dNTPs, 100 pmol de cada cebador reverso (Oligo-dt, 123end, PYVV_R_CP y PLVR_R) (Tabla 1), 20U de inhibidor de ARNasas Ribolock (Thermo Fisher Scientific, EEUU) y 100 ng de ARN total (Sierra et al. 2021; García et al. 2022).
Tabla 1 Secuencias de los cebadores empleados en RT-qPCR para la detección de virus en papa cv. Diacol Capiro.
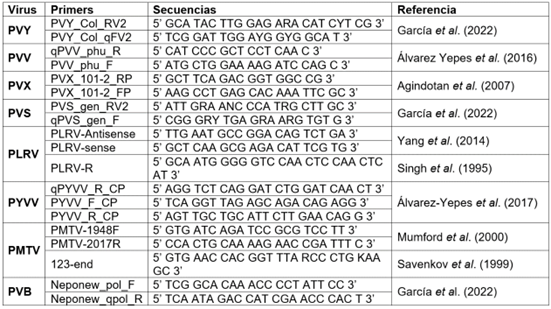
El ADNc sintetizado fue empleado como molde para la amplificación, mediante PCR en tiempo real (qPCR), en un volumen final de 14 μL, conteniendo 6,25 μL del kit Maxima SYBR Green/ROX Master Mix (2X) (Thermo Fisher Scientific, EEUU), 4 μL de agua estéril tratada con DEPC, 50-100 ng de ADNc y 0,3 μM de los cebadores específicos para cada virus (Tabla 1). Las reacciones de RT-qPCR, se realizaron en un equipo Rotor-Gene Q-5plex Platform (Qiagen, Alemania). El programa consistió en 95 °C por 10 min, para la activación de la Taq polimerasa, seguido de 35 ciclos de 15 s a 95 °C y 60 s a 52 °C. Al finalizar las reacciones, se obtuvieron los valores del ciclo umbral (Ct) y temperatura de fusión (Tm), en el rango 50-99 °C. Las muestras que superaron el valor basal de fluorescencia antes del ciclo 35 y presentaron valores de Tm en el rango esperado, fueron consideradas como positivas (Gallo García et al. 2019; García et al. 2022). En todas las reacciones, se incluyó un control positivo y un control negativo, procedentes de tejidos foliares infectados o libres de cada virus evaluado.
Secuenciación de alto rendimiento (HTS). Con el fin de obtener secuencias de algunos de los genomas de los virus encontrados en los tubérculos-semilla de papa cv. Diacol Capiro certificados, se realizó una secuenciación de alto rendimiento del transcriptoma de una muestra compuesta (bulk), derivada de los ARN extraídos de los brotes de todas las muestras. La librería de ADNc, se construyó con el kit TruSeq Stranded Total RNA LT Sample Prep (Illumina, EEUU), con eliminación del ARN ribosomal, utilizando Ribo-Zero (Illumina, EEUU) (Sierra et al. 2021; García et al. 2022); la secuenciación masiva, se realizó en un equipo Illumina Novaseq de la compañía Macrogen (Corea del Sur). Una vez obtenidas las secuencias, se determinó su calidad con el programa FastQC, verificando que no se presentarán bases de baja calidad (Phred <30). La identificación preliminar viral fue realizada con el software Plant Virus Detection Platform, disponible en Internet en: https://biotecnologiamicrobianaunalmed.github.io/Plant-Virus-Detection-Pipeline (Gutiérrez et al. 2021). Posteriormente, se procedió al ensamblaje de novo de contigs con rnaSPAdes (Bushmanova et al. 2019). Los contigs correspondientes a genomas virales se identificaron mediante BlastN contra una base de genomas reportados en GenBank (https://blast.ncbi.nlm.nih.gov/Blast.cgi). Los virus identificados, se verificaron y se ensamblaron por mapeo, utilizando la herramienta MagicBLAST (https://ncbi.github.io/magicblast/). Los alineamientos resultantes, se visualizaron con el programa Tablet (Milne et al. 2010), obteniendo las secuencias consenso para cada virus y, posteriormente, se identificaron los marcos abiertos de lectura (ORFs), con ORF finder (https://www.ncbi.nlm.nih.gov/orffinder/) y BlastX (https://blast.ncbi.nlm.nih.gov/Blast.cgi). Los análisis filogenéticos, se realizaron comparando las secuencias obtenidas mediante HTS con secuencias de referencia, disponibles en la base de datos del GenBank y realizando un alineamiento con la herramienta Muscle del Software Mega-X (Kumar et al. 2018). Posteriormente, se construyeron los árboles filogenéticos, mediante el método de máxima verosimilitud (Maximum Likelihood), con los modelos Tamura-Nei model (PVY) y General Time Reversible model (PLRV), y 1000 réplicas de bootstrap.
RESULTADOS Y DISCUSIÓN
Detección de virus por RT-qPCR. Las muestras presentaron siete de los ocho virus evaluados, siendo los virus de mayor prevalencia: PVS (100 %), PVX (100 %) y PYVV (100 %), seguidos por PLRV (75 %), PVY (50 %), PMTV (37,5 %) y PVB (12,5 %); PVV no fue detectado en ninguna de las muestras en estudio (Figura 1A). Al compararse estos resultados con las muestras derivadas de tubérculos-semilla no certificados, se destaca que los virus PVS y PVX fueron encontrados en la totalidad de muestras certificadas, pero solo en dos de los tres controles no certificados; lo contrario, se observó para los virus PVY y PLRV, pues sus niveles de detección fueron menores en los tubérculos certificados (PVY: 50 %; PLRV: 75 %), que en los controles no certificados (PVY: 66,7 %; PLRV: 100 %). El PYVV fue detectado en todas las muestras certificadas y no certificadas. Por último, el PMTV presentó niveles similares de detección en ambos materiales (Figura 1A).
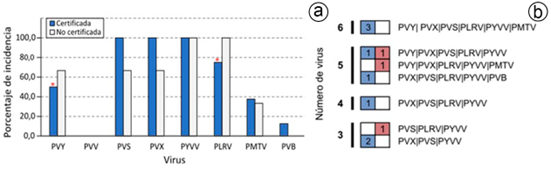
Figura 1 Detección de virus por RT-qPCR en tubérculos-semilla certificados de papa cv. Diacol Capiro, de la sabana Cundiboyacense. a) Gráfica de barras indicando la proporción de virus con resultados positivos en brotes de tubérculos certificados (azul), en comparación con controles de semillas no certificados (gris). Los asteriscos indican los virus detectados en menor proporción en los tubérculos certificados. b) Coinfecciones virales en tubérculos-semilla certificados de papa cv. Diacol Capiro, de la sabana Cundiboyacense. El rango de virus detectados en lotes de tubérculos certificados (azul) fue de tres a seis. Para las muestras no certificadas, empleadas con fines comparativos, el número total de virus osciló entre tres y cinco (rojo).
El virus que presentó mayor carga, definida en términos de valores de Ct, fue PVY (Figura 2A), al presentar un valor promedio de 21,4 (SD=8,1) e, incluso, una de las muestras certificadas presentó un valor de Ct muy bajo (10,7); para los virus PVS, PVX, PLRV, PYVV, PMTV y PVB, los valores promedios de Ct fueron de 27,3 (SD=1,5), 28 (SD=1,1), 22,9 (SD=1,3), 25,9 (SD=4,5), 27,9 (SD=1,8) y 23,1 (SD=0), respectivamente. El promedio de valores de Tm para las muestras que resultaron positivas para los diferentes virus evaluados fue de 79,0 ± 0,8 °C (PVY), 78,4 ± 1,9 °C (PVS), 83,8 ± 0,4 °C (PVX), 78,8 ± 0,6 °C (PLRV), 81,0 ± 2,5 °C (PYVV), 80,9 ± 0,5 °C (PMTV) y 78 °C (PVB). En los controles positivos utilizados en el estudio se amplificaron las regiones objetivo, con valores de Ct inferiores a 25 y de Tm, en los intervalos registrados previamente en el laboratorio.
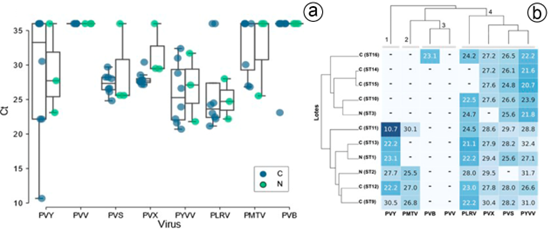
Figura 2 Distribución de los valores de Ct para todos los virus analizados en tubérculos-semilla certificados de papa cv. Diacol Capiro, de la sabana Cundiboyacense. a) Gráfico de cajas ilustrando los valores de Ct para las muestras individuales; cada punto representa un lote de tubérculo-semilla. b) Mapa de calor indicando los valores Ct para cada lote de semilla. La prevalencia de virus, se caracterizó por cuatro grupos: (4) PVS, PVX, PYVV y PLRV, son virus de alta prevalencia en las muestras; (3) PVB y PVV, son los virus con menor nivel de detección o ausentes en los tubérculos-semilla, seguidos por PVY (1) y PMTV (2). Nótese que no se presentó diferenciación de clados entre los materiales certificados y los tres controles no certificados utilizados, con fines comparativos. Las muestras, se representan con C (certificadas) y N (no certificadas).
Análisis de coinfecciones. Los tubérculos-semilla certificados presentaron diferentes tipos de coinfecciones virales, con un promedio de 4,7 virus por muestra. En dos lotes de semilla, se detectaron tres virus por muestra (PVX/PVS/PYVV), cuatro virus en un lote (PVX/PVS/PLRV/PYVV), cinco virus en dos lotes (PVX/PVS/PLRV/PYVV/PVB y PVY/PVX/PVS/PLRV/PYVV) y tres muestras presentaron la infección múltiple de seis virus (PVY/PVX/PVS/PLRV/PYVV/PMTV) (Figura 1B). En los controles no certificados, el promedio de virus por muestra fue de 4,3; dos muestras presentaron coinfección por cinco virus (PVY/PVX/PLRV/PYVV/PMTV y PVY/PVX/PVS/PLRV/PYVV) y el otro lote evaluado tuvo tres virus (PVS/PLRV/PYVV).
Secuenciación de alto rendimiento (HTS). A partir de la secuenciación HTS del bulk de ARN de muestras, se encontraron 156.542 reads (0,57 % del total de las secuencias), asociados a genomas virales: PVY (107.131 reads; 99,4 % similitud), PLRV (47.981 reads; 98,8 % similitud) y PVS (43 reads; 97,8 % similitud). Las secuencias ensambladas a partir de los resultados de HTS, se utilizaron para la realización de análisis filogenéticos para los virus PVY y PLRV, con respecto a secuencias completas de genomas reportadas en el GenBank. Para el caso del PLRV, se presentó un porcentaje de identidad de 97 % con respecto a varios genomas de estos virus reportados sobre S. tuberosum del departamento de Antioquia (por ejemplo, MK613996 y KX712226), mientras que para PVY, la secuencia obtenida en los tubérculos de la sabana Cundiboyacense se situó en el clado correspondiente a la raza PVYNTN, presentando porcentajes de identidad del 99 %, con secuencias reportadas en Antioquia para diferentes aislamientos de esta raza (por ejemplo, MF176827 y MK563993) (Figura 3).
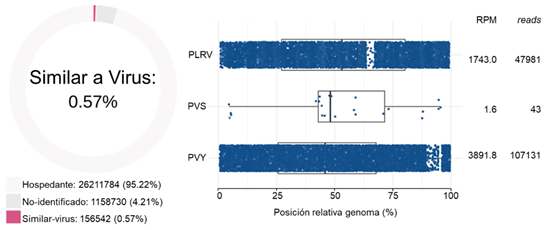
Figura 3 Análisis bioinformático de los datos de secuenciación HTS de virus en tubérculos-semilla certificados de papa cv. Diacol Capiro, de la sabana Cundiboyacense. El gráfico circular indica la proporción de lecturas virales (rosa) detectadas. La gráfica a la derecha ilustra la posición del mapeo de las lecturas a lo largo de cada segmento genómico de los virus detectados. Los virus dominantes en el set de datos fueron PLRV, PVY y PVS.
En términos generales, los resultados de este trabajo indicaron niveles muy altos de infección (> 37,5 %), en semilla certificada de papa cv. Diacol Capiro, procedente de la sabana Cundiboyacense, alcanzando, incluso, valores del 100 %, para los virus PYVV, PVX y PVS. El PVV fue el único virus no detectado en dichos materiales, lo que coincide con el hecho que este virus, hasta ahora, solo se ha encontrado en Colombia sobre cultivos de papa criolla (S. phureja), en el departamento de Antioquia (Riascos Chica et al. 2018).
La implementación de programas de certificación de tubérculos-semilla de papa es uno de los principales aspectos en los que se fundamenta el manejo de enfermedades virales en este y otros cultivos de propagación asexual (Frost et al. 2013). Desde el punto de vista fitosanitario, la certificación del material de siembra de papa tiene como objetivo principal limitar la degeneración de los tubérculos-semilla, dado el aumento progresivo de la carga viral, como resultado del uso sucesivo de dicho material, entre ciclos de siembra (Thomas-Sharma et al. 2016; Forbes et al. 2020). En Colombia, se estima que solo entre el 3 y 5 % del área cultivada con papa, se establece con semilla certificada (Fedepapa, 2017; 2019) y, adicionalmente, para el proceso de certificación solo se consideran evaluaciones de infecciones virales, a través de observaciones visuales de síntomas y, eventualmente, por pruebas de ELISA, para algunos de los virus (Guzmán-Barney et al. 2013; ICA, 2015; Gallo García et al. 2021; Sierra et al. 2021), lo que conduce a la subestimación de los niveles reales de infección de dicho material de siembra. En este sentido, dos trabajos recientes tendientes a evaluar la sanidad viral de los tubérculos-semilla del cultivar de papa Diacol Capiro utilizados en Antioquia, encontraron altos niveles de prevalencia de los virus PVY, PLRV, PYVV y PVS, con niveles que alcanzaron hasta el 70 %, para PYVV y 80 %, para PVY (Gallo García et al. 2021; Sierra et al. 2021). Más preocupante resulta la falta de diferencias en los niveles de prevalencia de virus entre los materiales certificados y no certificados y que, incluso, para un virus tan limitante en Colombia, como PYVV, Sierra et al. (2021) reportaron mayores niveles de infección (73,3 % vs 56,6 %) y menores valores de Ct (31,9 ± 3,5 vs 33,2 ± 3), en los materiales certificados. Dichos resultados son muy similares a los obtenidos en el presente estudio sobre tubérculos-semilla, obtenidos directamente en la sabana Cundiboyacense, la principal región productora de material de siembra de papa en el país y plantean la necesidad urgente de revisar los programas de certificación en este cultivo, a partir de la utilización de técnicas de detección de virus altamente sensibles, como RT-qPCR y secuenciación HTS.
Adicional a los altos niveles de prevalencia de virus, en este trabajo, se identificaron coinfecciones en los materiales certificados con un promedio de 4,7 virus por muestra y casos externos, como la detección en tres lotes de semilla de la infección mixta de seis virus (PVY/PVX/PVS/PLRV/PYVV/PMTV); resultados similares han sido reportados por García et al. (2022), para tubérculos-semilla comercializados en Antioquia. En este caso, en muestras de semilla no certificada del cultivar Diacol Capiro, el promedio de coinfección fue de 4,6 virus por muestra, con un número mínimo de 4 y máximo de 6 virus, mientras que, en material certificado, el promedio de coinfección fue de 4 virus por muestra, con valores mínimos y máximos de 2 y 6 virus, respectivamente. Estos resultados, en su conjunto, aunque resultan muy alarmantes para la agroindustria de papa en Colombia, no son inesperados, por cuanto trabajos previos de detección de virus realizados directamente sobre material foliar de plantas de papa en estado de floración en Antioquia, han registrado niveles de infección del 88,9 %, para PVY, 75 %, para PVX y PYVV, 41,7 %, para PLRV y 25 %, para PVS (Gallo García et al. 2019).
Los altos niveles de infección viral de los materiales de siembra certificados del cultivar Diacol Capiro en Colombia pueden ser uno de los factores responsables de los bajos rendimientos de papa alcanzados en el país (21 t ha-1), si se comparan con los registrados en países, como Estados Unidos (49,02 t ha-1), Países Bajos (41,9 t ha-1) y Reino Unido (38,65 t ha-1), (FAOSTAT, 2018), incluso, son muy distantes al potencial productico de 40 t ha-1, que se ha evaluado experimentalmente para este cultivar en Colombia (Ñustez, 2011; Porras Rodríguez & Herrera Heredia, 2015). En el mundo, diferentes estudios han demostrado que el uso de semilla de papa libre de virus puede conducir a aumentos en los rendimientos superiores al 30 % (Halterman et al. 2012; Frost et al. 2013; Thomas-Sharma et al. 2016) y que en combinación con otras prácticas de manejo, como el control de insectos vectores, eliminación de plantas “voluntarias” de papa y de arvenses hospedantes alternas de virus, además de procesos de selección positiva, exclusión temprana de plantas sintomáticas y sistemas efectivos de rotación de cultivos, pueden conducir a aumentos de rendimientos superiores al 70 % (Gildemacher et al. 2011; Schulte-Geldermann et al. 2012; Thomas-Sharma et al. 2016); un ejemplo de esto es Suiza, donde a partir de los años 1960, se logró un incremento del 70 % en los rendimientos por hectárea de papa, luego de establecer programas universales de siembra de semilla certificada y del establecimiento de otras medidas fitosanitarias, dirigidas a reducir la transmisión horizontal de virus (Schumpp et al. 2021).
Con el propósito de mejorar la calidad de tubérculos-semilla de papa en Colombia, los resultados del presente estudio y de otros recientes (Gallo García et al. 2021; Sierra et al. 2021; García et al. 2022), demuestran la necesidad de incorporar la detección de nuevos virus, como PMTV, PVV y PVB, en los procesos de certificación de semilla de papa del país y en la utilización de herramientas moleculares para su diagnóstico, entre las que se destacan, las derivadas de amplificación de ácidos nucleicos por PCR, como RT-PCR convencional y en tiempo real (RT-qPCR) e isotérmica, como RPA y LAMP (Nie & Singh, 2001; Xu et al. 2004; Raigond et al. 2020; Schumpp et al. 2021). Estas metodologías pueden ser complementadas con secuenciación HTS para monitorear los virus que circulan en los cultivos en diferentes regiones y épocas del año y para evaluar el estado fitosanitario de los materiales utilizados en las diferentes etapas del proceso de certificación de semilla (por ejemplo, súper élite, élite, básica, registrada). De esta forma, sería posible identificar rápidamente fenómenos de emergencia y re-emergencia de virus y de otros fitopatógenos, máxime cuando en los cultivos de papa del mundo se han reportado más de 50 especies de virus, cada uno, de los cuales, puede tener diferentes variantes genotípicas y razas (Marín Montoya & Gutiérrez Sánchez, 2016; Kreuze et al. 2020). En este sentido, en el presente estudio, mediante secuenciación HTS, se confirmó la circulación de tres de los virus detectados por RT-qPCR (PVY, PLRV y PVS), en el bulk del material de siembra evaluado, siendo posible, mediante análisis filogenéticos la identificación del PVY, como asociado a la raza necrosante PVYNTN (Gil et al. 2011; Henao-Díaz et al. 2013; Riascos Chica et al. 2018), considerada como la raza de mayor importancia económica de este virus, a nivel mundial, al inducir la enfermedad denominada Potato tuber necrotic ringspot disease (PTNRD) (Glais et al. 2005), mientras que la secuencia del genoma de PLRV, se ubicó en un clado, que contiene otros aislamientos del virus, previamente reportados, en cultivos de papa del país (Figura 4).
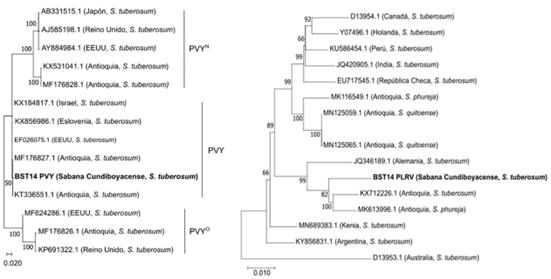
Figura 4 Árboles filogenéticos generados a partir de secuencias de genomas de PVY y PLRV, derivados de secuenciación masiva en tubérculos-semilla certificados de papa cv. Diacol Capiro, de la sabana Cundiboyacense. Los números sobre las ramas indican los valores de bootstrap y los nombres a la derecha indican las denominaciones registradas en la literatura para las razas de PVY. Las secuencias en negrita corresponden a las obtenidas de las muestras del presente estudio.
Se espera que los resultados de este trabajo sirvan de estímulo para que los gremios de productores, semilleristas, organismos de sanidad vegetal y centros de investigación emprendan con prontitud procesos que aumenten la calidad del material de siembra certificado de papa producido en el país y faciliten su distribución y utilización masiva, por parte de los agricultores de este cultivo.















