INTRODUCCIÓN
En Colombia, el interés en la producción de Búfalos (Bubalus bubalis) tiene auge por la calidad de sus productos y su adaptabilidad a las condiciones ambientales (Martínez-Reina et al. 2020). De acuerdo con el censo Pecuario Nacional del 2020, del Instituto Colombiano Agropecuario, ICA, se registró una población de 338.567 búfalos en 3.851 predios, de los cuales, el 91,6 % están concentrados en 10 departamentos, donde Córdoba, se ubicó con la mayor población de búfalos (ICA, 2020a). De acuerdo con Martínez-Reina et al. (2020), la mayoría de las explotaciones de búfalos en el Colombia están dedicadas al doble propósito, con predominio de la raza Murrah y las principales problemáticas en salud corresponden a abortos, asociación de abortos con días abiertos, repetición de celos y retención de placenta.
Los problemas reproductivos en búfalos están asociados a enfermedades infecciosas, como brucelosis y leptospirosis (Ospina-Pinto et al. 2019); sin embargo, la vigilancia y control de estas enfermedades en Colombia, es limitada.
La brucelosis es causada por bacterias de la especie Brucella, una zoonosis de distribución mundial y una problemática de salud pública, por la aparición de casos en humanos (Costa et al. 2015; Álvarez-Hernández et al. 2015); recientemente, en algunos países, se reportan altas tasas de incidencia (Wang & Jiang, 2020). El ICA, en 2016, reportó para Colombia, una seroreactividad del 36,8 %, en predios bufalinos y del 9,4 %, en búfalos, específicamente, para Córdoba, una seroreactividad del 54 %, en los predios evaluados y la seropositividad en bufalinos fue del 11 %.
De igual forma la leptospirosis es una zoonosis de distribución mundial reemergente, donde el número de casos se incrementa con el aumento de lluvias (Faine et al. 1999; Haake & Levett, 2015) y, además, es considerada una enfermedad de exposición ocupacional (Phillips, 2019).
El diagnóstico de laboratorio de la leptospirosis se realiza mediante varios métodos: prueba de aglutinación microscópica (MAT), detección de ADN del patógeno por reacción en cadena de la polimerasa (PCR) y aislamiento del microorganismo mediante cultivo (Musso & La Scola, 2013). La principal prueba serológica es la microaglutinación (MAT), que permite la detección de anticuerpos específicos, que reconocen antígenos de cepas conocidas de Leptospira. Este reconocimiento da como resultado una aglutinación, que es observable por microscopio de campo oscuro. La prueba MAT indica, presuntivamente, el serogrupo circulante, pero no es suficientemente precisa para identificar serovares, debido a la reactividad cruzada que ocurre con frecuencia entre serovares de un mismo serogrupo. Además, esta técnica no discrimina entre anticuerpos derivados de la infección o la vacunación; puede ser negativa, cuando no se incluyen las serovariedades circulantes y en animales con leptospirosis crónica relacionada con insuficiencia reproductiva, se presenta la disminución de los títulos de anticuerpos o la ausencia de títulos de anticuerpos detectables (Marquez et al. 2017).
Como se indicó, en Córdoba no hay estudios recientes de brucelosis y de leptospirosis en búfalos, por lo tanto, el presente trabajo tuvo como propósito determinar la presencia de anticuerpos contra Brucella abortus y Leptospira spp., en una población bufalera, en el municipio de Tierralta (Córdoba).
MATERIALES Y MÉTODOS
Tipo de estudio y localización de las empresas ganaderas. Se implementó un estudio descriptivo de corte transversal, que involucró tres empresas bufaleras, donde se calculó un tamaño de muestra de 144 búfalos, ubicados en Tierralta, municipio del departamento de Córdoba, de la región Caribe colombiano, que pertenece a la microrregión del Alto Sinú, a N 8°10′1″, W 76°4′1″, con una extensión de 472.800 km2, altitud media de 51 m s.n.m. (Figura 1), con una precipitación de 1.922 mm, temperatura media anual que oscila entre los 28 y 31 ºC y con una humedad relativa media anual del 82 %. El área comprendida presenta las siguientes zonas de vida: bosque muy húmedo tropical; bosque muy húmedo pre-montano en transición a bosque muy húmedo tropical y bosque húmedo tropical (Cogollo Lara, 2012).
Figura 1 Demarcación de la zona de estudio en la subregión del Alto Sinú, en el departamento de Córdoba, Colombia.
Cálculo y tamaño de la muestra. Se utilizó la fórmula del tamaño de la muestra para la estimación de una proporción en una población finita, en tres empresas bufaleras, utilizando un margen de error del 0,05, con una confiabilidad del 95 % y para tener la máxima probabilidad de presentar la variable estudiada, se usó una prevalencia esperada del 50 % (Aguilar-Barojas, 2005).
Toma de muestras de sangre. Se tomaron 144 muestras de sangre de la raza Murrah (15 machos y 129 hembras), mayores de un año, en tres empresas bufaleras, dedicadas a la producción de carne y leche. Para la extracción de las muestras de sangre, se procedió a desinfectar con una solución antiséptica (alcohol etílico al 70 %), la región ventral del inicio de la cola, donde la punción se hizo en la vena coccígea. Las muestras obtenidas en tubos al vacío sin anticoagulante y previamente identificadas, se conservaron en neveras de icopor, a temperatura entre 4 y 7 °C. Después fueron llevadas al Instituto de Investigaciones Biológicas del Trópico (IIBT), adscrito a la Facultad de Medicina Veterinaria y Zootecnia, de la Universidad de Córdoba, donde se procedió a extraer el suero, por centrifugación a 3.000 rpm, durante 5 minutos, donde el suero se almacenó en dos viales de fondo cónico a -70 °C, para su conservación y posterior procesamiento.
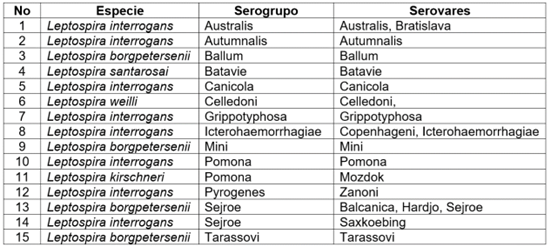
Pruebas serológicas. El diagnóstico para leptospirosis se implementó mediante la prueba de aglutinación microscópica (MAT), utilizando 13 serogrupos y 19 serovares, pertenecientes a cinco especies (Tabla 1). El MAT, se realizó de acuerdo con las normas de la Organización Mundial de la Salud (WHO, 2003) y su implementación se hizo en el IIBT. Los antígenos utilizados tuvieron entre 7 y 10 días de crecimiento; de forma individual, se verificó su viabilidad y densidad celular; en caso de ser necesario fueron diluidos con solución fisiológica tamponada, para obtener una densidad de 1-2x108 Leptospiras/ml. Cada suero que presentó una aglutinación en el 50 % o más de las leptospiras (comparadas con el antígeno control) fue considerado positivo (WHO, 2003). También, a este grupo de los búfalos, se les hizo una inspección clínica, donde se tomaron constantes fisiológicas, coloración de mucosas y se revisaron las tarjetas individuales, para determinar variables de producción zootécnica y evidenciar el reporte de signos clínicos o reportes de enfermedades reproductivas.
Tabla 1 Serogrupos y serovares usados en el MAT, para el diagnóstico de Leptospira spp., en búfalos de agua (Bubalus bubalis) en Tierralta, Córdoba, Colombia.
Para el diagnóstico de anticuerpos contra B. abortus, se implementó la prueba tamiz Rosa de Bengala, siguiendo los procedimientos del fabricante y para confirmar los resultados, se envió una alícuota al ICA en Cereté, donde se implementó Elisa competitiva (Elisa-C).
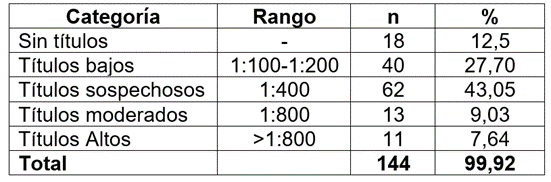
Análisis de resultados. Se hizo estadística descriptiva y las variables dicotómicas se asociaron con la seropositividad; los datos fueron analizados utilizando el programa estadístico SAS (Statistical Analysis System); la seroprevalencia fue calculada por serogrupo. Para la interpretación de los títulos serológicos bajos, sospechosos, moderados y altos (Herrera, 2007), los búfalos fueron clasificados en estas categorías, donde el título serológico fue el más alto, de acuerdo a lo mostrado en la tabla 2.
Tabla 2 Interpretación de títulos de Leptospira spp., en búfalos de agua (Bubalus bubalis), en Tierralta, Córdoba, Colombia, de acuerdo con lo propuesto por Herrera (2007).
Aspectos éticos. La toma de muestras, su manejo y conservación fueron llevadas a cabo por un médico veterinario, siguiendo las normas éticas, técnicas, científicas y administrativas para la investigación en animales, según la ley 84 (Congreso Nacional de Colombia, 1989). El proyecto fue aprobado por el Comité de Ética del IIBT, según acta No 002-2018, del 12 de febrero de 2018.
RESULTADOS Y DISCUSIÓN
La seroprevalencia para Leptospira spp. fue del 87,5 %, donde el 77,77 % (n=112) de las hembras y el 9,73 % (n=14) de los machos resultaron positivos a Leptospira spp. Para la variable sexo no hubo diferencias significativas, porque el mayor número de animales evaluados correspondieron a la categoría de hembras. Igualmente, para la categoría productiva no hubo diferencias significativas.
La seroprevalencia de esta población fue superior a la reportada por Viana et al. (2009), en Brasil y por Motta Giraldo et al. (2014), en Caquetá, empleando la prueba MAT, con 6 serovares.
Otro factor al que se puede atribuir la alta seroprevalencia observada corresponde a las características ambientales de la zona, ya que el territorio de Tierralta, comprende las zonas de vida de Bosque muy húmedo tropical; Bosque muy húmedo pre-montano en transición a bosque muy húmedo tropical y Bosque húmedo tropical, las cuales, se caracterizan por una alta precipitación y una humedad relativa media y, además, a que la región presenta una baja pendiente del terreno, que facilita la presencia de lugares inundables (Cogollo Lara, 2012), favorables para el crecimiento y mantenimiento de Leptospira.
Los búfalos, se revuelcan en lugares inundables o en fuentes de agua, con el fin de controlar la temperatura corporal y la presencia de ectoparásitos (Simón & Galloso, 2011; Napolitano et al. 2013); sin embargo, este hábito los hace propensos a adquirir infecciones con bacterias del género Leptospira, debido a que este patógeno se puede presentar en las fuentes de agua (Cruvinel et al. 2019; Zaki et al. 2020), ya que han sido transportadas en las excretadas de roedores y animales silvestres (Cilia et al. 2020) o animales de interés zootécnico, portadores de este patógeno (Ensuncho-Hoyos et al. 2017). Además, es importante indicar la relación que existe entre las fuertes lluvias o inundaciones y la proximidad a los cuerpos de agua, con un mayor número de casos de leptospirosis humana (Schneider et al. 2015).
La seroprevalencia, se puede incrementar al utilizar un mayor número de serogrupos y serovares en el MAT (Adesiyun et al. 2009), como se muestra en estudios realizados en Brasil y en Venezuela, donde con 27 y 21 serovares, se encuentran seroprevalencias del 80 y 80,51 %, respectivamente (Viana et al. 2009; González Gontofalla & Rivera Pirela, 2015). Otros estudios muestran que el número de serogrupos y serovares no está afectando la seroprevalencia en Brasil; con 16 serovares, se encontró una seroprevalencia del 35,4 % (Rocha et al. 2019) y con 17 serovares, del 28,5 % (Oliveira et al. 2018). En Caquetá (Colombia), con 6 serovares, del 37,3 % (Motta Giraldo et al. 2014). El panel de antígenos utilizados en el MAT debe incluir serovariedades representativas de todos los serogrupos y serovariedades comunes, a nivel local; la utilización de una amplia gama de antígenos es útil para detectar infecciones poco comunes con serovares no detectados previamente (Haake & Levett, 2015).
La frecuencia para cada uno de los serogrupos y serovares se muestran en la tabla 3, donde el serogrupo con mayor frecuencia fue Mini (serogrupo Mini, serovar Mini). Estudios previos encontraron seroreactividad para este serogrupo (Anderson & Rowe, 1998; Viana et al. 2009), en porcinos (Pulido-Villamarín et al. 2019) y en ciervos (Mathias et al. 1999). En la mayoría de los estudios consultados, a la fecha, no se ha determinado este serogrupo, porque no ha sido incluido en el MAT (Langoni et al. 1999; Favero et al. 2002; Hajikolaei et al. 2006; Jacobo et al. 2009; Adesiyun et al. 2009).
Tabla 3 Seroprevalencia por serovar a Leptospira spp., en búfalos de agua (Bubalus bubalis), en el municipio de Tierralta, Córdoba, Colombia.
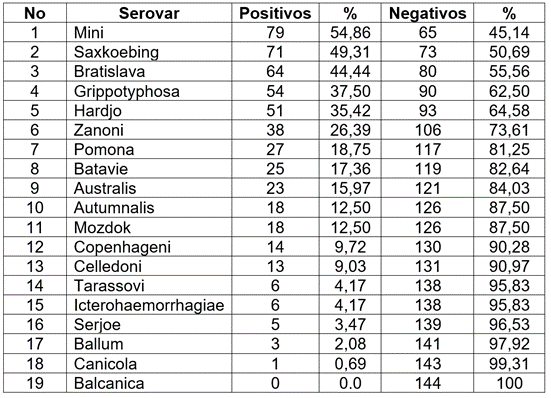
En Colombia, el serogrupo Mini ha sido excluido del MAT en la mayoría de los estudios realizados; sin embargo, en granjas porcícolas del Medio Sinú, se demostró seropositividad en cerdos, en caninos y en humanos (Calderón et al 2014). Este es el primer estudio que detecta este serogrupo en búfalos.
Dentro del serogrupo Sejroe, el serovar Saxkoebing fue la segunda frecuencia en este estudio (Tabla 3); no obstante, poco se conoce su seropositividad en búfalos. Otros serogrupos que presentaron altas seroprevalencias fueron Bratislava, Grippotyphosa, serogrupos que han sido reportados entre los de mayor prevalencia en estudios en Brasil (Langoni et al. 1999). En Colombia, estos serogrupos presentaron altas prevalencias en porcinos (Pulido-Villamarín et al. 2019) y en humanos (Calderón et al. 2014).
Se reportan infecciones de Leptospira spp. en bovinos y bufalinos en Colombia, por los serogrupos Grippotyphosa, Pomona, Icterohaemorrhagiae, y Hardjo subtipos Hardjoprajitno y Hardjobovis (Ochoa et al. 2000; Betancur Hurtado et al. 2013; Motta Giraldo et al. 2014); además de estos serogrupos, se determinaron: Australis, Autumnalis, Ballum, Batavia, Canicola, Celledoni, Mini, Pyrogenes, Sejroe, Tarassovi; solo el serogrupo Balcanica no mostró ninguna reacción seroaglutinante. La seropositividad de este serogrupo en búfalos es desconocida, ya que, en todos los estudios consultados, a la fecha, lo han excluido del MAT. Incorporar más serogrupos y serovares o incluir serovares circulantes de una región dentro del MAT, aumenta la sensibilidad y disminuye el promedio de las reacciones cruzadas, cuando se utilizaron las cepas locales (Gómez et al. 2018). Pérez-García et al. (2019), en una caracterización en Colombia, al incluir una cepa nativa en el panel de la prueba del MAT, observaron un aumentó en el porcentaje de positividad, en un 15 %.
La distribución de las diferentes diluciones por serovares se muestran en la tabla 4, donde el serogrupo que presentó el mayor título (1:12800) fue Grippotyphosa. Grippotyphosa junto a Mini, Pomona y Australis serovar Australis presentaron títulos de 1:6400. El mayor número de búfalos(as) infectados fue con el serogrupo Mini, a una dilución de 1:100. El mayor porcentaje de la seropositividad (86,80 %), se presenta como coaglutinaciones frente a dos o más serovares, teniendo la mayor frecuencia respuesta de anticuerpos frente a seis o más serovares (Tabla 5).
Tabla 4 Distribución de las diferentes diluciones por serovares de Leptospira spp., en búfalos de agua (Bubalus bubalis), en Tierralta, Córdoba, Colombia.
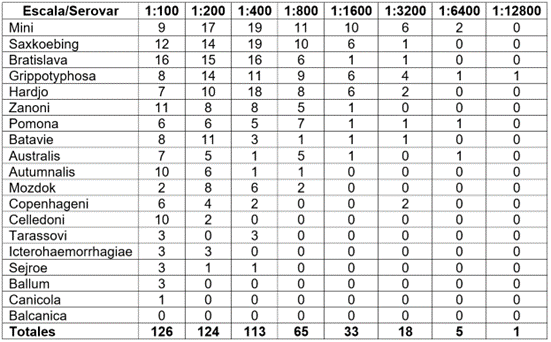
Tabla 5 Seropositividad por número de serovares a Leptospira spp., en búfalos de agua (Bubalus bubalis), en Tierralta, Córdoba, Colombia.

En la población bufalera evaluada, no se estableció ningún plan de vacunación contra la Leptospirosis. Todos los títulos que se detectaron se deben a procesos infecciosos (Tabla 2), títulos bajos (1:100-1:200) y corresponden a infecciones pasadas; títulos sospechosos (1:400) requieren una segunda muestra para su diagnóstico; títulos moderados (1:800) pueden corresponder al inicio de una infección o postinfección o respuesta postvacunal y para establecer su estatus, se requiere un segundo suero; títulos altos (> 800), que corresponden a una infección activa (Herrera, 2007). En los búfalos evaluados, los títulos altos se pueden asociar con infección actual o reciente; en éstos, no se observó ningún signo clínico de enfermedad al momento de la toma de las muestras e, igualmente, por la carencia de registros productivos, no se pudo determinar pérdidas económicas.
La seroprevalencia contra B. abortus en los predios del presente estudio fue del 2,08 % (3/144), por Rosa de Bengala, seroprevalencia que se mantuvo, cuando se confirmó por Elisa-C. Estas empresas bufaleras no tiene un historial de vacunación contra la brucelosis. Al momento de la toma de las muestras, no se detectó ningún signo clínico de enfermedad y los administradores informaron que no se han presentado signos clínicos de enfermedades reproductivas, como abortos o nacimiento de crías débiles. Igualmente, por la precaria información de los registros de producción zootécnica, no se logró comprobar pérdidas económicas para brucelosis.
En Colombia, la brucelosis es una enfermedad de control oficial y conlleva que cualquier serroreactor sea eliminado por ser un alto riesgo de trasmisión (ICA, 2020b). Estos tres búfalos seropositivos fueron eliminados, con el fin de ingresar al programa de saneamiento del predio. En búfalos del Magdalena Medio, por Rosa de Bengala, Fijación de Complemento y Elisa-C, detectaron que la seroprevalencia aumentaba cuando se incrementó la especificidad y sensibilidad de una prueba (Mariño et al. 2004). Búfalos vacunados con RB51, en el bajo Sinú (Lorica, Córdoba), se determinó una seroprevalencia del 12,03 % y cuando se confirmó por Elisa-C, esta seroprevalencia fue del 3,0 % (Calderón et al. 2010). En el Caquetá (Colombia), la seroprevalencia en predios donde hay bovinos y búfalos varió entre el 4,0 y el 16,3 % (Motta Giraldo et al. 2014), a diferencia en el actual estudio, donde las empresas están dedicados a la producción zootécnica de búfalos.
La seroprevalencia de especies de Leptospira patógenas en búfalos de Tierralta fue alta, puesto que se presentan las condiciones agroecológicas para este patógeno. Los títulos determinados corresponden a procesos infecciosos y no se pudo determinar el efecto de la leptospirosis y brucelosis sobre los parámetros reproductivos y las pérdidas económicas. Se hace necesario realizar estudios en empresas que cuenten con información zootécnica, para demostrar pérdidas productivas y económicas.















