INTRODUCCIÓN
Las producciones avícolas, a nivel comercial, vienen creciendo rápidamente, para hacer frente a las altas demandas de proteína de origen animal, como consecuencia del acelerado crecimiento de la población mundial (Roa et al. 2018). Algunas ciencias, como la genética y la nutrición, han sido indispensables para incrementar la eficiencia productiva de las aves. En la actualidad, para la producción de pollo de engorde, se cuenta con aves mejoradas genéticamente, con altas tasas de crecimiento y mayor eficiencia en la acreción muscular (Henchion et al. 2017); sin embargo, la susceptibilidad de las aves al estrés y a las alteraciones del ambiente intestinal causado, principalmente, por desequilibrios en la microbiota normal del intestino (Henchion et al. 2017; Sokale et al. 2019), desencadenan la aparición de procesos inflamatorios, daños en la integridad del intestino y disminución en la capacidad para digerir y absorber los nutrientes del alimento, comprometiendo el rendimiento productivo y la rentabilidad de las granjas (Oviedo-Rondón, 2019).
El suministro de antibióticos en bajas dosis, como promotores de crecimiento (APC), a través del alimento, es una estrategia para mitigar el efecto que tienen los desbalances microbianos intestinales sobre el rendimiento productivo (Salim et al. 2018); no obstante, en los últimos años, ha aumentado la preocupación en los consumidores y en la comunidad científica, sobre la aparición de bacterias resistentes a antibióticos y por la presencia de residuos de estos compuestos en el producto final y el medio ambiente, lo que se ha convertido en un riesgo para la salud pública (Mohammadi Gheisar & Kim, 2018).
En enero de 2006, la Unión Europea prohibió el uso de antibióticos, como medida profiláctica en producciones animales; sin embargo, países como Estados Unidos tiene una regulación más estricta (Dodds, 2017). Actualmente, en Colombia, se adopta la prohibición de algunos antimicrobianos promotores del crecimiento-APC (Colistina, Polimixina B, Furazolidona, Nitrofurazona y Furaltadona), en la alimentación animal (Resolución ICA N° 1082, 1995; Resolución ICA N° 22747, 2018). Así, los investigadores en el área de la nutrición animal, se han dado a la tarea de buscar alternativas biológicamente seguras a los APC´s, que garanticen el bienestar de los animales, el rendimiento productivo y la salud del consumidor (Mehdi et al. 2018).
Entre las alternativas alimenticias más estudiadas, se encuentran probióticos, prebióticos, enzimas, ácidos orgánicos y fitobióticos (Sugiharto, 2016). Por su parte, diversos estudios muestran resultados favorables en la administración de probióticos, específicamente, mediante el uso de B. subtilis, evidenciando efectos favorables sobre la morfometría del epitelio intestinal, disminuyendo el pH y modificando la composición de los ecosistemas microbianos, presentes a lo largo del tracto gastrointestinal-TGI (Chávez et al. 2016; Lokapirnasari et al. 2017; Chowdhury et al. 2018), lo cual, se ve reflejado en un mejor aprovechamiento de los nutrientes y un mayor rendimiento productivo de los animales (Liu et al. 2018; Park et al. 2020). Estas bondades, han hecho de los probióticos, especialmente B. subtilis, una posible alternativa como sustituto al uso de antibióticos, promotores del crecimiento.
Con el fin de aportar resultados frente a la búsqueda de alternativas para disminuir el uso de antibióticos en la alimentación animal, el objetivo de la presente investigación consistió en evaluar el efecto que tiene la inclusión de B. subtilis sobre el desarrollo de órganos digestivos, la morfología del intestino delgado y el rendimiento productivo en pollos de engorde.
MATERIALES Y MÉTODOS
Los procedimientos experimentales llevados a cabo dentro del estudio siguieron los lineamientos estipulados en las guías “The International Guiding Principles for Biomedical Research Involving Animals”. Esta investigación fue avalada por El Comité Institucional para el Cuidado y Uso de los Animales-CICUA, de la Universidad Nacional de Colombia, sede Medellín (CEMED-013. Mayo 04 de 2018).
Para el abordaje de la investigación, se desarrolló en la estación agraria San Pablo, perteneciente a la Universidad Nacional de Colombia, sede Medellín, ubicada en el municipio de Rionegro, a una altitud de 2.100 m s.n.m. y una temperatura que oscila entre los 12 y 18 ºC. Para la investigación, se utilizaron un total de 192 pollos machos de línea COBB500, de un día de nacidos, alojados en corrales en piso, con cama de viruta. La cría, se llevó a cabo siguiendo los procedimientos experimentales de una granja comercial. Cinco horas antes de la llegada de los pollitos, las criadoras fueron encendidas con la finalidad de precalentar el galpón y alcanzar una temperatura promedio de 32 °C, al momento de la recepción. Las aves recibieron agua y alimento a voluntad durante todo el periodo experimental, que tuvo una duración de 42 días.
Dietas. Se elaboró una dieta basal ajustada a los requerimientos nutricionales de los animales sin la adición de antibiótico y probiótico. Los tratamientos utilizados se establecieron de la siguiente manera:
Dieta Control (D1): dieta basal sin la adición de antibiótico y probiótico.
Dieta 2 (D2): dieta basal más la adición de antibiótico (Avilamicina 10 ppm).
Dieta 3 (D3): dieta control más la adición de B. subtilis (en forma de esporas), a razón de 50 ppm.
El plan de alimentación fue dividido en dos etapas, para lo cual, se realizó una dieta de iniciación (1-21 días) y finalización (22-42 días) (Tabla 1), cumpliendo los requerimientos nutricionales establecidos por la distribuidora comercial. La adición del antimicrobiano (avilamicina) en el alimento, se realizó según las indicaciones de la casa productora, a razón de 10 gramos por tonelada (10 ppm). La cantidad de Bacillus subtilis (PB6 ATCC-PTA 6737, ®Kemin Industries, Inc., EEUU) incorporada en la dieta 3, se llevó a cabo atendiendo la recomendación del fabricante; esto es 50 gramos por tonelada de alimento, para garantizar una dosis de 108 UFC.
Tabla 1 Aporte nutricional de la dieta basal (DB) diseñada en dos etapas: iniciación y finalización.
Parámetros Zootécnicos. Dentro de los parámetros zootécnicos se evaluaron: peso acumulado (PA), peso final, ganancia acumulada de peso (GAP) y conversón alimenticia (CA) (Chávez et al. 2016; Madrid-Garcés et al. 2017). Las mediciones se realizaron en un total de 144 aves.
Conversión alimenticia (CA):
Ganancia acumulada de peso (GAP):
Eutanasias humanitarias y toma de muestras. Durante la fase de experimentación, se realizaron eutanasias escalonadas a las aves, de la siguiente forma: los días 21 y 42, se sacrificaron 24 aves (ocho aves por dieta), respectivamente, para un total de 48 aves. Todas las aves fueron sacrificadas 3 horas después de su última comida. Los animales, se sedaron por inhalación de Nitrox y, posteriormente, se les realizó eutanasia humanitaria con dióxido de carbono, durante 3 minutos (Chávez et al. 2016).
Después del sacrificio, se realizó un corte desde la parte anterior del cuello hasta la cloaca, cortando solo la piel. Se realizaron dos pequeños cortes laterales hasta llegar a las costillas y, luego un corte de las costillas en dirección craneal. Se evaluó la presencia de exudados y el estado de sacos aéreos. Posteriormente, se extrajo en un solo paquete los órganos del tracto gastrointestinal y anexos: estómago, hígado, páncreas, bazo, intestino delgado y grueso (Svihus, 2014). Se identificó y se diseccionó cada uno de los segmentos de intestino delgado, utilizando tijeras de disección con punta recta, como se describe a continuación: duodeno (desde el píloro hasta la porción distal de la vuelta duodenal), yeyuno (desde la porción distal del giro duodenal al divertículo de Meckel), íleon (desde el divertículo de Meckel hasta el inicio de los ciegos) y ciegos (Barrera-Barrera et al. 2014). Cada uno de los fragmentos y órganos digestivos fueron lavados con solución salina fría, pesados en una báscula de precisión digital y medidos con un metro convencional (Madrid-Garcés et al. 2017). Los pesos de los órganos fueron convertidos a porcentaje de peso vivo (% P.V) (Ecuación 3). Para determinar la ontogénesis del crecimiento de los diferentes órganos y su relación con el peso corporal, se utilizó el coeficiente de Crecimiento Alométrico (CA) (Ecuación 4) (Chávez et al. 2016).
Donde: On= peso del órgano al día n de la evaluación; Oh= peso al nacimiento; PCn= peso corporal al día de la evaluación y PCh= peso corporal al nacimiento.
Finalmente, cada segmento del intestino delgado fue alineado y medido en una mesa sin ningún tipo de tensión y se tomaron 2 cm del centro de duodeno, yeyuno e íleon. Una vez cortada cada muestra, se hizo un lavado por infusión con solución salina fría de la porción removida para eliminar impurezas y la digesta contenida; posteriormente, cada una de las muestras tomadas fue almacenada en formalina, al 10 % (Madrid-Garcés et al. 2017).
Análisis morfométrico del Intestino delgado. Transcurrido 48 horas después de la colecta, las muestras de las diferentes secciones del intestino fueron almacenadas en formalina al 10 % y enviadas al laboratorio, para ser analizadas por expertos.
Procesamiento histotécnico: Los tejidos, se fijaron en formalina tamponada al 10 %, por 48 horas, a 4 °C, incluidos en parafina, cortados a 4 µm de espesor y coloreados con Hematoxilina-Eosina, para ser lavados y almacenados en etanol:agua (75:25, v:v) (Chávez et al. 2016). Estos cortes fueron microdiseccionados, para determinar el promedio de la altura y ancho de las vellosidades intestinales, así como la profundidad de las criptas adyacentes. En cada lámina se montaron tres cortes transversales.
Evaluación microscópica y análisis morfométrico de imágenes: Los cortes histológicos fueron analizados cuantitativamente, mediante un procesamiento de imágenes digitales computarizadas, así: para la identificación de las zonas tisulares, se hizo uso de un microscopio óptico Leica (Meyer, Houston, TX, USA); luego, se capturaron las imágenes correspondientes, con una cámara para microscopía digital instantánea Motican 2300 (Motic, Hong Kong, China), con una resolución de 3 megapixeles, en un aumento de 200x y se analizaron dichas imágenes con el software para tratamiento de imágenes Motic® Images plus 2.0 (Motic, Hong Kong, China).
Las variables morfométricas que se midieron en cada corte histológico fueron (Chávez et al. 2016):
Altura: una vez se estableció la base de la vellosidad, desde su punto medio, se trazó una línea hasta el ápice.
Ancho: con una línea, se unieron los bordes apicales de las células epiteliales de lados opuestos, ubicadas, aproximadamente, en la mitad de la vellosidad.
Profundidad de la cripta: se obtuvo trazando una línea o segmentos continuos, desde su apertura hasta el fondo de la misma.
El valor promedio para cada variable, se calculó después de realizar mediciones en ocho vellosidades y sus correspondientes criptas intestinales. Debido al hecho de que la altura de las vellosidades puede variar en cada pliegue intestinal (siendo más corta en el ápice), se requería que cada región estuviera igualmente representada en la evaluación. En consecuencia, se eligió un pliegue circular de la mucosa, midiendo dos vellosidades desde la parte inferior, dos a la derecha, dos desde el lado izquierdo y dos desde el vértice (Chávez et al. 2016).
Diseño experimental y análisis estadístico. Para el análisis de las variables productivas, se realizó un modelo de medidas repetidas en el tiempo, bajo un diseño completamente al azar, con tres tratamientos (dieta) y cuatro repeticiones (12 pollos por repetición), para un total de 144 aves. Cada uno de los animales fue asignado aleatoriamente a una de las tres dietas y se registró el peso de los pollos, los días 21 y 42. El análisis estadístico, se realizó según el procedimiento Proc Mixed del SAS®.
Para el análisis de las variables morfométricas y el desarrollo de órganos digestivos, se realizó un modelo de parcelas, divididas bajo un esquema de aleatorización completamente al azar (cuatro repeticiones). Las parcelas grandes estuvieron constituidas por las dietas y las subparcelas por los diferentes días de sacrificio. Cada animal fue asignado aleatoriamente a cada uno de los tratamientos (dieta * edad de sacrificio) y cada tratamiento tuvo un total de ocho repeticiones. El análisis estadístico fue desarrollado usando el procedimiento GLM del SAS®. El procedimiento de comparaciones múltiples, se realizó mediante una prueba de Tukey.
RESULTADOS Y DISCUSIÓN
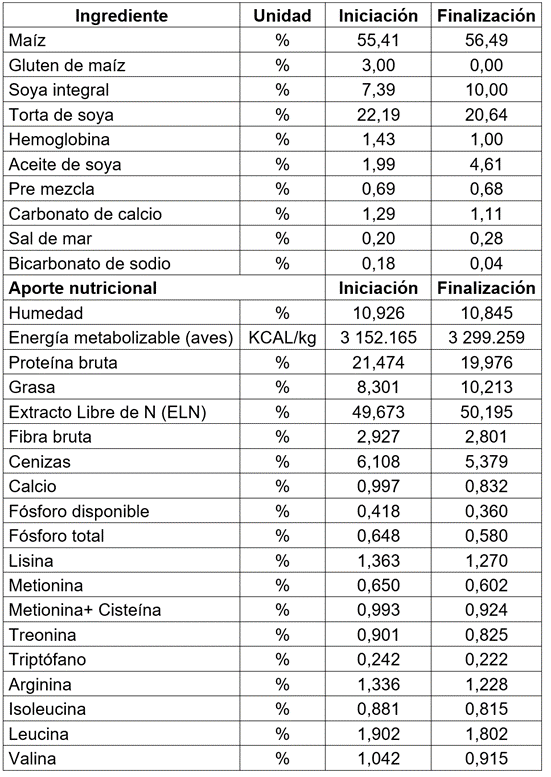
En la tabla 2, se presenta un resumen del rendimiento zootécnico de las aves sometidas a las diferentes dietas. Se puede observar que la ganancia diaria de peso (GDP) incrementó, de manera significativa (p <0,05), en aquellas aves que recibieron B. subtilis (D3), en comparación con las aves que recibieron avilamicina, como promotor de crecimiento (D2). Por su parte, se logró una disminución significativa (p <0,05) en la tasa de conversión alimenticia promedio (CAP), al final del periodo experimental, mediante el uso de B. subtilis (D3) en la dieta, frente a los resultados obtenidos con la dieta control (D1); sin embargo, entre el uso de B. subtilis y avilamicina no se presentaron diferencias estadísticamente significativas (p >0,05).
Tabla 2 Parámetros productivos evaluados los días 21 y 42, en pollos alimentados con una dieta basal o dieta basal suplementada con antibiótico (avilamicina) o probiótico (B. subtilis). Ganancia diaria de peso (GDP); conversión alimenticia promedio (CAP). (D1): dieta sin la adición de antibiótico y probiótico; (D2): dieta control más la adición de antibiótico (Avilamicina 10 ppm); (D3): dieta control más la adición de B. subtilis (en forma de esporas) a razón de 50 ppm. A, B, C dentro de una misma fila, medias con un superíndice común (por variable en estudio), no difieren estadísticamente (P >0,05).
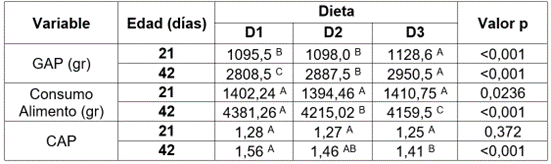
Un resumen del peso medio de los órganos digestivos, como porcentaje del peso vivo del animal (%PV), es presentado en la tabla 3. En general, se puede observar que el uso de B. subtilis (D3) estimula, de manera significativa (p <0,05), el crecimiento de órganos digestivos, en comparación a la dieta control (D1). Además, se encontró un efecto estadísticamente superior (p <0,05) con la adición de B. subtilis respecto al uso de avilamicina (D2) en órganos, como ventrículo, intestino e hígado y un efecto estadísticamente similar (p >0,05), para el crecimiento del proventrículo.
Tabla 3 Efecto de B. subtillis sobre el peso de diferentes órganos, como porcentaje del peso vivo en pollos de engorde. Porcentaje del peso vivo (%PV). (D1): dieta sin la adición de antibiótico y probiótico; (D2): dieta control más la adición de antibiótico (Avilamicina 10 ppm); (D3): dieta control más la adición de B. subtilis (en forma de esporas), a razón de 50 ppm. A, B, C dentro de una misma fila, medias con un superíndice común (por variable en estudio), no difieren estadísticamente (P >0,05). EEM corresponde al error estándar de la media.
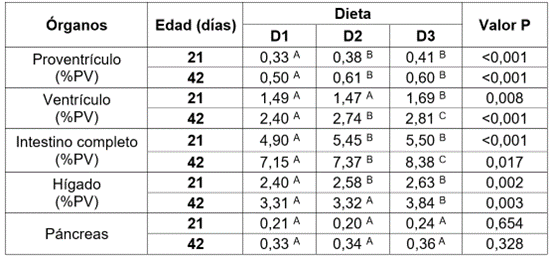
El coeficiente medio de alometría para los diferentes órganos es presentado en la tabla 4. Las dietas D2 y D3 incrementaron, de manera significativa (p <0,05), el desarrollo de órganos, como ventrículo, intestino, hígado y páncreas con respecto a D1; sin embargo, el uso de B. subtilis en el alimento favoreció, de manera significativa, el desarrollo de intestino e hígado, en comparación con los órganos de las aves que recibieron antibiótico, promotor de crecimiento en la dieta.
Tabla 4 Efecto del uso de B. subtilis sobre el coeficiente de alometría, para diferentes órganos digestivos. Coeficiente de alometría por órgano (C.A.O). (D1): dieta sin la adición de antibiótico y probiótico; (D2): dieta control más la adición de antibiótico (Avilamicina 10 ppm); (D3): dieta control más la adición de B. subtilis (en forma de esporas), a razón de 50 ppm. A, B, C dentro de una misma fila, medias con un superíndice común (por variable en estudio). no difieren estadísticamente (P >0,05). EEM corresponde al error estándar de la media.
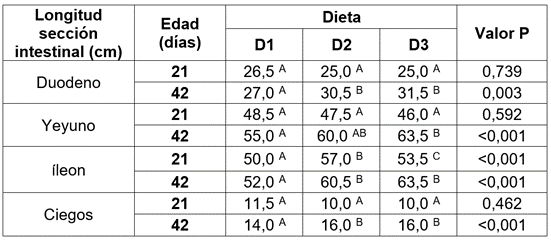
En cuanto a la longitud media de las diferentes secciones del intestino (duodeno, yeyuno, íleon y ciego) presentada en la tabla 5, se puede observar que la adición de B. subtilis incrementó, de manera significativa (p <0,05), la longitud de las diferentes secciones intestinales, en comparación a la dieta control; sin embargo, no se encontraron diferencias estadísticamente significativas (p >0,05) entre el uso de B. subtilis y avilamicina, como promotor de crecimiento, para las variables mencionadas anteriormente.
Tabla 5 Influencia de B. subtilis sobre la longitud de diferentes secciones intestinales en pollos de engorde. (D1): dieta sin la adición de antibiótico y probiótico; (D2): dieta control más la adición de antibiótico (Avilamicina 10 ppm); (D3): dieta control más la adición de B. subtilis (en forma de esporas), a razón de 50 ppm. A, B, C dentro de una misma fila, medias con un superíndice común (por variable en estudio), no difieren estadísticamente (P >0,05). EEM corresponde al error estándar de la media.
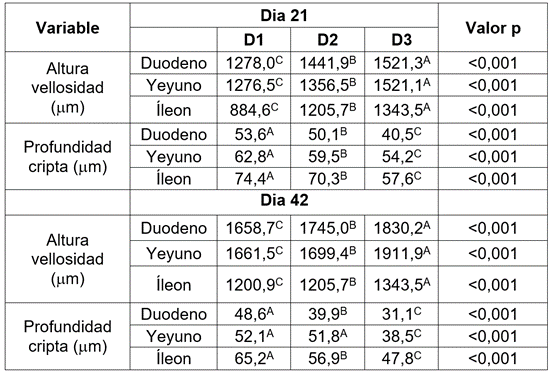
En la tabla 6, se presentan los resultados de las variables relacionadas con la morfometría de duodeno, yeyuno e íleon. Se puede observar, que el uso de B. subtilis incrementó, de manera significativa (p <0,05), la altura de las vellosidades en duodeno, yeyuno e íleon, en comparación al resultado obtenido bajo el uso de avilamicina (D2), en la dieta. Del mismo modo, se puede observar una menor profundidad (p <0,05) de las criptas intestinales en los tres segmentos evaluados, cuando se adicionó B. subtilis, en la dieta de las aves.
Tabla 6 Efecto de B. subtilis sobre la altura de las vellosidades y profundidad de las criptas, en las diferentes secciones del intestino delgado. (D1): dieta sin la adición de antibiótico y probiótico; (D2): dieta control más la adición de antibiótico (Avilamicina 10 ppm); (D3): dieta control más la adición de B. subtilis (en forma de esporas), a razón de 50 ppm. A, B, C dentro de una misma fila, medias con un superíndice común (por variable en estudio), no difieren estadísticamente (P >0,05).
El uso de probióticos en la alimentación animal, como alternativa al uso de antibióticos promotores de crecimiento (APC), ha demostrado resultados favorables sobre la salud del intestino y el rendimiento productivo de los animales. Son diversos los modos de acción, mediante los cuales, los probióticos permiten obtener un mejor aprovechamiento de los nutrientes presentes en la dieta, incrementando, así, la eficiencia productiva de los animales (Sugiharto, 2016; Lokapirnasari et al. 2017).
Un indicador importante en la rentabilidad de las granjas es el rendimiento productivo de los animales. Acorde con los resultados zootécnicos obtenidos en la presente investigación, se ha reportado en la literatura que el uso de B. subtilis tiene un efecto similar o estadísticamente superior sobre la ganancia diaria de peso y la tasa de conversión alimenticia, en comparación al uso de APC´s (Gong et al. 2018). Además, se ha evidenciado la capacidad de B. subtilis para contrarrestar los impactos desfavorables en las diferentes infecciones causadas por Clostridium perfringens o Coccidia sp., sobre el desempeño productivo (Park et al. 2020). Son diversos los estudios realizados en los que se alcanza un mejor desempeño zootécnico en pollos de engorde, mediante el uso de B. subtilis, como alternativa a los APC´s (Goodarzi Boroojeni et al. 2018).
Un mejor rendimiento productivo es estrechamente ligado a una óptima salud intestinal (Li et al. 2017). Los principales mecanismos, mediante los cuales, los probióticos permiten conservar la salud del intestino, son la producción de ácidos orgánicos, bacteriocinas o simplemente por exclusión competitiva de microorganismos. Por lo anterior, la adición de probióticos en el alimento, permite modular los ecosistemas microbianos presentes a lo largo del intestino (Gadde et al. 2017), garantizando la simbiosis estable entre los microorganismos intestinales y el hospedante, disminuyendo el gasto catabólico asociado a la hiperactivación del sistema inmune, protegiendo la integridad del intestino y favoreciendo el buen funcionamiento del epitelio intestinal, para cumplir, con eficiencia, con los procesos de digestión del alimento y la absorción de los nutrientes (Madrid-Garcés et al. 2017; Omonijo et al. 2018).
La importancia en el desarrollo óptimo (CA) de los órganos del tracto gastrointestinal radica en la capacidad para obtener de la dieta los nutrientes necesarios para garantizar las funciones de mantenimiento y crecimiento de los animales (Gao et al. 2019; Modina et al. 2019). Cuando el órgano crece en la misma proporción al peso corporal, CA es de 1; si el crecimiento del órgano es más lento al peso corporal, CA es menor a 1 y cuando CA es mayor a 1, hay un crecimiento rápido con relación a la ganancia total de peso corporal (Chávez et al. 2016). Por lo anterior, estudios realizados en pollos de engorde han reportado que la inclusión de B. subtilis incrementa, de manera significativa, el peso y el coeficiente alométrico (CA) de los órganos digestivos (Chávez et al. 2016), resultados similares a los obtenidos en la presente investigación. Además, B. subtilis tiene la capacidad de contrarrestar el efecto de microorganismos patógenos (como coccidia) y de mejorar el desarrollo y el crecimiento del intestino delgado, en pollos de engorde (Wang et al. 2018).
El óptimo desarrollo y la protección de la superficie del epitelio intestinal permite obtener una mayor área de contacto entre el contenido intestinal y las vellosidades y microvellosidades que albergan a los enterocitos, encargados de la digestión y el transporte de los nutrientes (Thongsong et al. 2019; Wang et al. 2020). Por tanto, un mejor desarrollo del epitelio intestinal, principalmente a nivel de duodeno y yeyuno, está asociado a una mayor eficiencia en la digestión y absorción de nutrientes (Peng et al. 2016), mientras que la disminución en la profundidad de las criptas, se asocia a un menor gasto energético, producto de la disminución en la tasa de mitosis en la base de la cripta, con el fin de reemplazar los enterocitos desprendidos en la parte apical de la vellosidad (M’sadeq, 2019). Estudios realizados en pollos de engorde, incluyendo esta investigación, reportan que el uso de B. subtilis incrementa la altura de las vellosidades y disminuye la profundidad de las criptas intestinales (Wilson et al. 2018; Li et al. 2019).
Los probióticos muestran la capacidad de proteger el epitelio intestinal, ya que disminuyen la tasa de descamación, asociada a la acción de bacterias patógenas (Gadde et al. 2017), mientras mejoran el desarrollo e integridad del intestino e incrementan el metabolismo, por un aumento en la actividad enzimática en los enterocitos (Gong et al. 2018).
La adición de B. subtilis en la dieta de pollos de engorde mejora el desarrollo de órganos digestivos, principalmente, la alometría del intestino delgado y la morfología del epitelio intestinal, además, de una mejor tasa de conversión alimenticia. De esta manera, B. subtilis se considera una alternativa eficaz y biológicamente segura ante el uso de antibióticos, promotores de crecimiento en pollos de engorde.



















