INTRODUCCIÓN
En Colombia, la producción de panela es la segunda agroindustria en importancia social después del café (Contreras Pedraza et al. 2016). La caña de azúcar para producción de panela es sembrada en casi todo el territorio nacional, pero su producción se concentra en los departamentos de Cundinamarca, Boyacá y Santander; en estos dos últimos, se encuentra la región productora conocida como la Hoya del río Suárez (HRS). En esta región, se presentan los mayores rendimientos de cultivo, a nivel nacional, con 100 t ha-1 (González Chavarro et al. 2018), donde actividades, como la preparación de suelo, la fertilización, el uso de variedades mejoradas y el sistema de corte, influyen en la obtención de estos altos rendimientos.
Para la elaboración de un plan integrado de fertilización del cultivo de caña, además de los análisis de suelo, se deben realizan análisis de composición química del tejido vegetal (Calheiros et al. 2018), partiendo del principio que la planta es un sistema dinámico y la demanda de nutrientes varía según su estado fenológico (Prananto et al. 2020). En Colombia, los cultivos de caña destinados a la industria azucarera adoptan tecnologías, que incluyen la realización de análisis foliares, los cuales, se realizan periódicamente, durante el ciclo del cultivo, para ajustar los planes de fertilización (Cenicaña, 2020); sin embargo, en zonas donde este cultivo es destinado para la producción de panela, no es común el uso de esta estrategia; no obstante, se conocen los requerimientos nutricionales de diferentes variedades en las diferentes etapas fenológicas para las condiciones agroclimáticas características de la HRS, gracias a varios estudios, como los de González Chavarro et al. (2018) y Volverás-Mambuscay et al. (2020).
Existen distintas formas de conocer el estado nutricional de los cultivos, siendo la más común, el análisis de nutrientes de los tejidos vegetales, por vía húmeda, los métodos, como la espectrometría de absorción atómica (AAS), la espectrometría de emisión óptica, con plasma de acoplamiento inductivo (ICP-OES) o la espectrometría de masas, con plasma de acoplamiento inductivo (ICP-MS) (Cacuango P. et al. 2016; Padilla-Cuevas et al. 2020); sin embargo, estos métodos presentan algunos inconvenientes, como altos costos para la adquisición y el mantenimiento de equipos, requieren tiempo para el pretratamiento de muestras, generan desechos contaminantes y necesitan mano de obra especializada para su aplicación (Jiménez Heinert et al. 2020). Como alternativa, en los últimos años se viene utilizando la espectroscopía de reflectancia difusa en el segmento visible e infrarrojo cercano, para el análisis de una gran diversidad de características químicas y físicas, asociadas a la calidad de los alimentos, el suelo y los productos agrícolas en general (Nocita et al. 2015; Ge et al. 2019; Galvez-Sola et al. 2015; Menesatti et al. 2010; Rodrigues et al. 2020; Prananto et al. 2021).
La tecnología de espectroscopía de infrarrojo cercano (NIRS, por sus siglas en inglés), se basa en la absorción electromagnética de un haz de luz, comprendido en el rango de longitudes de onda, que va desde los 400 a los 2.500 nm. La energía emitida a la muestra hace que los enlaces entre C-H, O-H y N-H, componentes principales de la estructura básica de las sustancias orgánicas, vibren de una forma característica (Givens & Deaville, 1999) permitiendo que el espectrómetro capture la energía absorbida en longitudes de onda específicas (Cen & He, 2007). En el caso de sustancias inorgánicas, la energía absorbida se puede detectar por su asociación con estructuras orgánicas en forma de óxidos, quelatos o cuando presentan enlaces con hidrógeno, lo que permite su determinación, mediante la construcción de modelos de calibración (Clark et al. 1987; Cozzolino & Moron, 2004; González-Martín et al. 2007).
Para generar un modelo de calibración NIRS, la información espectral se relaciona, mediante algoritmos matemáticos con la información del método de referencia, a través de la aplicación de modelos estadísticos, como la regresión múltiple, el análisis por componentes principales y mínimos cuadrados parciales (PLS, por sus siglas en inglés); luego, se realiza una validación cruzada en el conjunto de calibración, para seleccionar el número óptimo de factores y evitar el sobreajuste y, finalmente, se comprueba la precisión y la exactitud del modelo, mediante un proceso de validación externa, con un conjunto de datos independiente. NIRS es una técnica rápida, no destructiva, ni contaminante y de gran exactitud, siempre que se sigan los procedimientos adecuados para su implementación.
Para el cultivo de caña de azúcar, la tecnología NIRS ha sido implementada por varios autores, entre los que sobresalen Sanseechan et al. (2018), quienes desarrollaron un modelo de calibración usando regresión PLS para estimar la densidad sólida de la caña y obtuvieron un coeficiente de determinación de la calibración (R2)= 0,65; coeficiente de determinación de la predicción (r2)= 0,67; error estándar de la calibración (SEC)= 23,69 kg m-3; error estándar de la predicción (SEP)= 22,17 kg m-3; sesgo= -1,076 kg m-3 y error estándar relativo de la predicción (RSEP)= 2,004 %. En otro estudio, Kuswurjanto & Triantarti (2019), evaluaron la aplicación de NIRS para la determinación de % Brix y % Pol, en jugo de caña de azúcar, reportando: r2 de 0,988 y 0,986, SEP de 0,333 y 0,283 y la desviación predictiva residual (RPD) de 5,441 y 6,125, respectivamente. En jugo de caña, también se ha determinado, con este método, el contenido de algunos nutrientes, como el K, Na, Mg y la relación Na:K, obteniendo una raíz del error cuadrático medio de la predicción (RMSEP) de 27,30; 10,69; 0,57 y 0,03 mg 100 mL-1 y un r2 de 0,78; 0,89; 0,93 y 0,74, respectivamente (Steidle Neto et al. 2017).
Adicionalmente, Abdel-Rahman et al. (2010) correlacionaron diferentes índices de vegetación con el contenido de N en hojas de caña, aplicando derivadas de primer orden, mediante un espectrorradiómetro de campo, reportando r2, entre 0,74 y 0,76 y RMSEP, de 0,084 a 0,09 % N. De la misma manera, Miphokasap et al. (2012), en un estudio similar, concluyeron que el modelo generado por la técnica de regresión lineal múltiple (SMLR) con la primera derivada y las longitudes de onda 410, 426, 720, 754 y 1216 nm, arrojó un r2 de 0,86 y RMSEP de 0,03 % N.
Por otro lado, Adnan et al. (2022) evaluaron el rendimiento de la digestibilidad de la biomasa en caña de azúcar para seleccionar un germoplasma óptimo para la producción de biocombustibles, donde la ecuación con la mayor capacidad predictiva fue la hexosa fermentable, reportando valores de R2, de 0,98, RPD de 6,62 y RMSEP de 4.19 kg t-1.
Este estudio asumió, como objetivo, desarrollar modelos de calibración NIRS para predecir el contenido de los macronutrientes N, P, K, Ca, Mg y S y los micronutrientes (Fe, Cu, Mn, Zn y B), en tejido vegetal de caña para la producción de panel, en la región de la HRS.
MATERIALES Y MÉTODOS
Descripción de la zona de estudio. Los municipios que conformaron la zona de estudio fueron: Chitaraque, Togüi, San José de Pare y Santana, en el departamento de Boyacá y Chipatá, Güepsa, San Benito, Suaita y Vélez, en el departamento de Santander, los cuales, pertenecen a la subregión geográfica de la HRS. Esta área, se ubica sobre la región montañosa de la cordillera oriental, con alturas entre los 1.250 y 2.200 m s.n.m., un clima de tipo bosque seco tropical y monzón tropical, según la clasificación Köppen, caracterizado por temperaturas medias entre 18 y 24 °C, con variaciones entre el día y la noche de 10 y 15 °C, un rango de precipitación de 1.000 a 2.000 mm, en un régimen bimodal, siendo los meses más lluviosos abril, mayo, octubre y noviembre (Departamento de Santander & Universidad Industrial de Santander, 2011; Ramírez Durán et al. 2014; IDEAM, 2014).
Metodología para la toma y análisis de muestras. Fueron recolectadas 416 muestras de caña en el área de estudio (Figura 1). Se tomaron 78 muestras de la planta completa, 83 de hojas, 105 de yagua, 75 de cogollo y 75 de tallo, con el fin de obtener un conjunto de calibración, que represente las características del cultivo, para las condiciones generales, de toda el área de estudio.
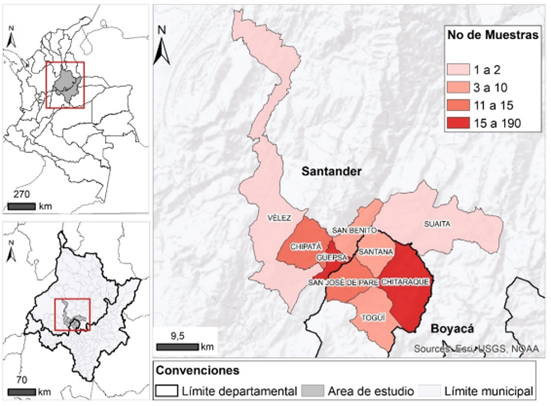
Figura 1 Ubicación de los municipios donde se realizó el muestreo de tejido vegetal de plantas de caña de azúcar para panela.
La preparación de las muestras incluyó un proceso de secado en una estufa con aire forzado a 65 °C, por 48 horas o hasta obtener peso constante; fueron molidas en un molino de martillo y tamizadas en una criba de 1 mm, de acuerdo con la recomendación de Ikoyi & Younge (2020), quienes demostraron que moler y secar las muestras mejora las estadísticas de calibración para la mayoría de los nutrientes. Los métodos de referencia empleados para determinar las variables evaluadas en laboratorio fueron: para N (%), por método Oficial AOAC 960.52 Kjeldahl/Volumetría; para determinación de los nutrientes Ca, P, K, Mg, S (g 100 g-1MS), Fe, Cu, Mn, Zn y B (mg kg-1MS), se usó la técnica de ICP-OES en visión axial, en un equipo iCAP 6500 DUO, utilizando la línea de análisis 283.5 nm y un nebulizador concéntrico K-Type de Thermo Scientific.
Medidas de espectroscopía. Posterior al secado y molienda de las muestras, se escanearon en el espectrómetro VIS/NIR (NIRS DS2500), en el modo de reflectancia difusa en el segmento espectral, comprendido entre los 400 a 2.500 nm, con resolución espectral de 0,5 nm. Las muestras fueron depositadas en una copa circular de 60 mm de diámetro y se registraron siete espectros por cada una de las muestras, usando el software ISIScan V4.8.0.1. El espectro de cada muestra correspondió al promedio de 32 lecturas sucesivas, obteniendo la absorbancia expresada, como resultado del log (1/R), donde R corresponde a la reflectancia.
Calibración y validación de ecuaciones. Los modelos de calibración, se desarrollaron utilizando el software WinISI V4.10.0.15326 de Foss y Infrasoft International, USA. Las muestras fueron divididas aleatoriamente en dos grupos; uno, con el 80 % del conjunto de datos, el cual, fue usado para la calibración de la ecuación de predicción y otro, con el 20 % del conjunto de datos para la validación externa del modelo, similar a los trabajos realizados por Ulissi et al. (2011) y Ancin Murguzur et al. (2019).
Previo al desarrollo del modelo de calibración, a los datos espectrales se les aplicó pretratamientos matemáticos, para corregir la línea base y la dispersión de la luz, mediante los métodos estándar de variación normal y de tendencia (SVN y Detrend, por sus siglas en inglés) (Arana et al. 2005), analizadas por el método de componentes principales (PCA), con el fin de disminuir el ruido y reducir el número de variables latentes. Este proceso, se realizó para dos segmentos espectrales: 1) visible más infrarrojo cercano de 400 a 2.500 nm (Visible+NIR) y 2) infrarrojo, cercano de 1.100 a 2.500 nm (NIR), considerando que se reportan importantes aportes de información en las bandas que comprenden la región visible del espectro (Rodrigues et al. 2020). Las muestras fueron clasificadas, de acuerdo con la distancia de Mahalanobis (H), donde, aquellas con valores de H superiores a 3,0, se consideraron atípicos y se descartaron (Shenk & Westrerhaus, 1991).
Para calibrar el modelo, se usó el método de regresión de mínimos cuadrados parciales modificados (MPLS), para todas las variables estudiadas. Posteriormente, se realizó la validación cruzada para seleccionar el número óptimo de factores y evitar el sobreajuste del modelo y, adicionalmente, para evaluar el poder predictivo de las ecuaciones seleccionadas, se realizó un proceso de validación externa, usando un grupo de muestras independiente al conjunto de calibración. En la calibración de cada componente, se utilizaron los dos segmentos Visible+NIR y NIR y en cada segmento, se evaluaron cuatro tratamientos matemáticos: 1.4.4.1, 1.8.8.1, 2.4.4.1, 2.8.8.1, donde el primer dígito corresponde al orden de la derivada, el segundo dígito es el segmento de derivación, el tercero y cuarto corresponde al suavizado de la señal (Ozaki et al. 2007).
Para evaluar la bondad de ajuste del modelo, se usó el SEC, el R2, el error estándar de validación cruzada (SECV), el coeficiente de determinación de la validación cruzada (R2vc) y RPD, que relaciona la desviación estándar de los datos de referencia y el SECV. Teniendo en cuenta los parámetros anteriores, se seleccionaron las mejores ecuaciones, a partir de los valores más altos de R2vc y RPD, junto con los valores más bajos de SECV, según Williams (2001).
La validación externa fue evaluada por medio del error estándar de la predicción, ajustado por el sesgo (SEPc), el sesgo (diferencia entre los valores predichos de NIR y los valores determinados por la química de referencia), el r2 y RPD (DE/SEPc). Las ecuaciones NIRS generadas con RPD inferiores a 1,9 son consideradas como no adecuadas para su aplicación, entre 2 y 2,9; solo se recomienda para fines de evaluación y con RPD superiores a 3, que pueden ser usadas para control de calidad (Williams, 2014).
RESULTADOS Y DISCUSIÓN
Contenido de nutrientes en caña de azúcar por método de referencia química. El rango de los valores de macro y micronutrientes de las 416 muestras de caña de azúcar analizadas por el método de referencia, se muestran en la tabla 1. Se encontró una amplia gama de valores para todas las variables de estudio, debido al muestreo diferenciado de las partes de la planta, bajo diferentes ubicaciones, lo cual, permite construir y obtener ecuaciones con un mejor poder de predicción.
Tabla 1 Rango de macro y micronutrientes en las muestras analizadas para cada parte de la planta de caña de azúcar, para la producción de panela.
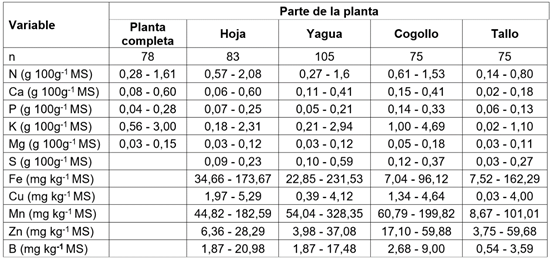
MS: Materia seca, n: Número de muestras.
La planta completa de caña de azúcar presenta contenidos de N de 0,6 ±0,26 g 100 g-1MS, Ca de 0,25±0,11 g 100 g-1MS, P de 0,11±0,04 g 100 g-1MS, K de 1,3±0,53 g 100 g-1MS y Mg de 0,06±0,02 g 100 g-1MS. Las hojas presentan mayores contenidos de N, Ca y B y menores concentraciones de S y Zn, es necesario resaltar que en esta parte de la planta el Ca y B presentan concentraciones con mayor variabilidad, mientras que para el caso de la yagua el S, Fe y Mn son los nutrientes que presentan mayores contenidos y variabilidad. Por otro lado, para el cogollo, se presentaron mayores contenidos de P, K y Zn, así como menores concentraciones de Fe. La parte de la planta con menores concentraciones de N, Ca, P, K, Mn y B es el tallo. Todas las partes de la planta de caña de azúcar analizadas por separado presentaron contenidos similares de Mg y Cu.
El rango de N en este trabajo fue similar a lo reportado por Bastidas et al. (2010), quienes indicaron concentraciones de proteína cruda (PC), entre 1,13 y 9,11 % (0,18 a 1,46 g 100 g-1MS de N), al evaluar diferentes variedades y tiempos de cosecha. Igualmente, en el estudio realizado por López et al. (2003) reportaron contenidos similares de PC, de 4,62 % (0,73 g 100 g-1MS de N), en el cogollo; 1,93 % (0,31 g 100 g-1MS de N), en la planta competa y 0,81 % (0,13 g 100 g-1MS de N), en el tallo.
Los contenidos de Ca y P en la planta completa de este estudio fueron similares a los obtenidos por Bastidas et al. (2010), al evaluar diferentes variedades y tiempos de cosecha, reportando valores para Ca, de 0,18 a 0,64 g 100 g-1MS y P, de 0,02 a 0,21 g 100 g-1MS. Igualmente, las concentraciones de P son congruentes con el estudio de Chen et al. (2002), quienes reporta un rango de 0,055 a 0,345 g 100 g-1MS, en hojas de caña de azúcar.
El contenido de Mg en el tallo encontrado en este estudio presentó rangos inferiores a los reportados por Salgado-García et al. (2008), quienes encontraron valores entre 0,09 y 0,23 g 100 g-1MS, para cultivos de caña de azúcar, en suelos del orden molisol, vertisol y algunos entisoles, en México. De igual manera, los contenidos de Mg y K en hojas fueron inferiores a lo reportado por Da Silva (2009), quien realizó análisis foliar de cultivos de caña, en Brasil, encontrando contenidos de Mg, de 0,1 a 0,3 g 100 g-1MS y K, de 1 a 1,6 g 100 g-1MS.
Los elementos menores encontrados en las hojas fueron similares a los valores reportados por Muchovej et al. (2005), quienes encontraron contenidos de Fe, de 45,6 y 35,2 mg kg-1; Cu, de 5 y 6 mg kg-1; Mn, de 105 y 32,4 mg kg-1 y Zn, de 16,5 y 18,9 mg kg-1, para tejido foliar en cultivos de caña de azúcar, con periodos de desarrollo vegetativo de 4 y 10 meses, respectivamente.
Calibración y validación de ecuaciones NIRS para nutrientes en caña de azúcar. La estadística descriptiva de los conjuntos de datos para la calibración y validación obtenidos de los análisis de macro y micronutrientes para tejido vegetal de caña de azúcar para panela, se muestran en la tabla 2. En todos los casos, la desviación estándar del conjunto de muestras fue menor a la media aritmética y el rango de datos utilizado para la validación externa, no extrapoló los valores mínimos y máximos del rango de datos, usados para la calibración.
A partir del conjunto de muestras de calibración, se seleccionó el mejor tratamiento matemático para cada variable analizada y se evaluaron los segmentos espectrales Visible+NIR y NIR.
Las medidas de bondad de ajuste de los modelos de calibración de nitrógeno, macro y micronutrientes, se muestran en la tabla 3. Para la mayoría de los análisis, el rendimiento de los modelos fue mejor para los tratamientos matemáticos, que contenían la primera derivada; para el Ca, P, Mg, Fe y B, se seleccionó el tratamiento matemático 1.4.4.1 y para el N, K, Mn y Zn, el tratamiento 1.8.8.1. Por otro lado, para el S y Cu se ajustó mejor el tratamiento matemático con la segunda derivada 2.8.8.1.
Tabla 2 Estadística descriptiva de los macro y micronutrientes para las muestras de los conjuntos de calibración y de validación en caña de azúcar, para la producción de panela.
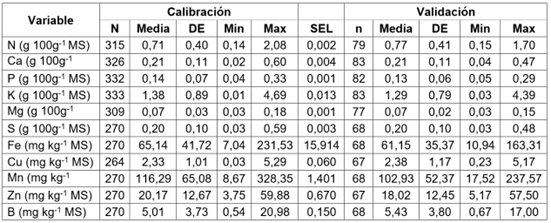
MS: Materia seca, n: Número de muestras, DE: Desviación estándar, Min: Mínimo, Max: Máximo, SEL: Error estándar de laboratorio.
Tabla 3 Parámetros estadísticos de las ecuaciones evaluadas para la predicción de nutrientes en caña de azúcar, para la producción de panela.
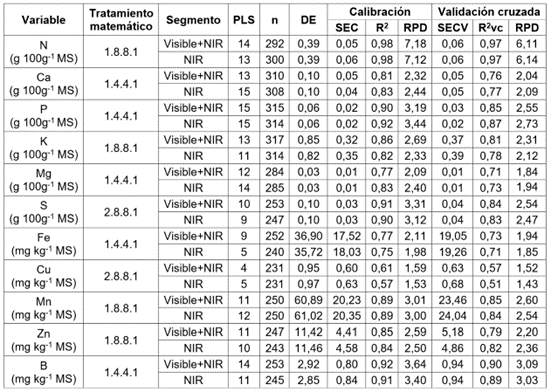
MS: Materia seca, NIR: Infrarrojo cercano, PLS: Número de términos empleados en la regresión, n: Número de muestras, DE: Desviación estándar, SEC: Error estándar de calibración, R2: Coeficiente de determinación de la calibración, SECV: Error estándar de validación cruzada, R2cv: Coeficiente de determinación en la validación cruzada, RPD: Relación del desempeño de la desviación.
En la etapa de calibración y de validación cruzada, el N, Ca, S y B mostraron resultados similares para los dos segmentos espectrales (Visible + NIR y NIR), pues presentaron valores para SECV iguales y para R2vc y RPD, similares. Para los nutrientes P, K, Mg, Fe, Cu, Mn y Zn, se observaron resultados con diferencias leves entre los dos segmentos espectrales, con valores similares de R2vc y de RPD.
Los productos de origen orgánico interaccionan de manera distinta a la radiación electromagnética, debido a su naturaleza (Singh et al. 2022), por lo que no es posible comparar los resultados obtenidos en este estudio con otras especies; sin embargo, Cozzolino & Moron (2004) demostraron la eficiencia del uso de la espectroscopía visible y NIRS, para la predicción de nutrientes en especies de leguminosas.
La evaluación estadística en la etapa de calibración y de validación cruzada permitió identificar que el uso de los segmentos espectrales Visible+NIR y NIR presentan resultados similares en la construcción de ecuaciones de calibración para las variables composicionales. Dado que las curvas de calibración bien correlacionadas no significan resultados altamente predictivos necesarios durante el análisis de rutina, se llevó a cabo la validación externa, utilizando un conjunto de 83 muestras, independientes de aquellas empleadas en la calibración. La precisión y la exactitud de la predicción, se evaluó mediante el cálculo de los métodos estadísticos SEPc, sesgo, r2 y RPD, que se muestran en la tabla 4.
Tabla 4 Parámetros estadísticos de la fase de validación externa utilizando las calibraciones seleccionadas para la predicción de nutrientes en caña de azúcar, para la producción de panela.
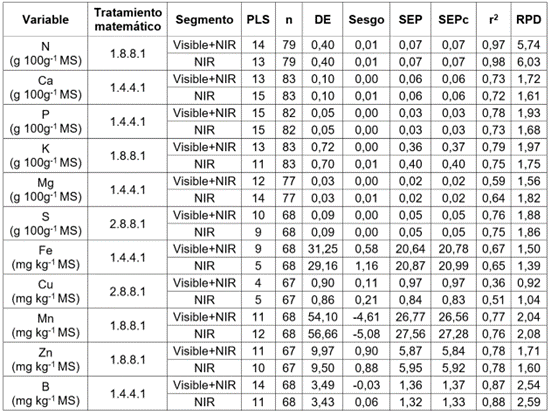
MS: Materia seca, NIR: Infrarrojo cercano, PLS: Número de términos empleados en la regresión, n: Número de muestras, DE: Desviación estándar, SEP: Error estándar de predicción, SEPc: Error estándar de la predicción ajustado por el sesgo, r2: Coeficiente de determinación de la predicción, RPD: Relación del desempeño de la desviación.
Para el N, se seleccionó, como mejor modelo el desarrollado, a partir del segmento espectral NIR, usando el tratamiento matemático 1.8.8.1, ya que presenta un mayor RPD y r2, correspondiente a una correlación alta con el analito; no obstante, los modelos de predicción con los dos segmentos espectrales presentaron un valor igual de SEPc, por lo que ambos segmentos espectrales pueden ser utilizados para la predicción del analito, con una precisión y exactitud semejante.
Con relación al Ca, P y Fe, se eligieron los modelos desarrollados a partir del segmento espectral Visible+NIR, usando el tratamiento matemático 1.4.4.1, debido a que los modelos exhibieron un mayor RPD y r2, indicando una correlación media con el analito, aunque, para Ca y P, los modelos de predicción con los dos segmentos espectrales presentaron un valor igual de SEPc. Chen et al. (2002) desarrollaron modelos de predicción para P en hojas de caña de azúcar con alta precisión, reportando un r2= 0,99, SEP= 0,01 g kg-1 y RPD= 0,49; estos valores fueron obtenidos después de un proceso de eliminación de puntos del segmento espectral innecesarios implementando la Regresión de incertidumbre de Martens, en combinación con PLS.
En cuanto a la predicción de los contenidos de K y Zn, se obtuvo un desempeño mayor para el modelo desarrollado, a partir del segmento espectral Visible+NIR, usando el tratamiento matemático 1.8.8.1, teniendo en cuenta que los modelos presentaron un mayor RPD y r2 y un menor SEPc.
El uso del segmento NIR presentó mejores resultados para los modelos de predicción del Mg y Cu. Para el Mg, se usó el tratamiento matemático 1.4.4.1, dando un mayor RPD y r2. Para el Cu, se empleó el tratamiento matemático 2.8.8.1, presentando un mayor RPD y r2 y menor SEPc; no obstante, el valor r2 corresponde a una correlación baja con el analito, indicando baja precisión del modelo.
Para los nutrientes de S, Mn y B, se observó que los modelos desarrollados a partir de los dos segmentos espectrales analizados en este estudio pueden ser utilizados para la predicción del analito, pues presentaron valores similares para RPD y r2.
De los resultados obtenidos en este estudio, se puede concluir, que se encontraron modelos adecuados para la predicción de los contenidos de N, Ca y P, a través de la firma espectral de tejido vegetal en plantas de caña para la producción de panela, identificándose el potencial de la herramienta NIRS, como una alternativa ágil y amigable con el medio ambiente. De esta forma, esta tecnología permite elaborar o ajustar planes de fertilización, a través de la identificación de deficiencias nutricionales en los cultivos.
Dado el potencial identificado para este estudio, se recomienda ampliar el conjunto de calibración con material vegetal de otras regiones productoras del país, como Antioquia, Cundinamarca y Nariño. Estos departamentos contribuyen significativamente a la producción de panela del país, pero poseen condiciones agroclimáticas diferentes a la HRS y, por lo tanto, el desarrollo vegetativo y la respuesta de los cultivos puede ser diferente.















