INTRODUCCIÓN
Las comunidades microbianas están involucradas en una serie de servicios ecosistémicos modulando el ciclo de nutrientes e interacciones simbióticas y patógenas con las plantas, por lo que su rol en la productividad de los agroecosistemas es esencial (Bahram et al. 2018). Varios tipos de bacterias y hongos mejoran la estructura del suelo al contribuir a la formación de agregados y poros y también juegan un papel clave en el aumento de la fertilidad del suelo (Rashid et al. 2016).
La diversidad microbiana del suelo es extremadamente sensible a la fertilización, que es una de las principales acciones antropogénicas asociadas con los cambios globales (Feng et al. 2022). El uso de fertilizantes es uno de los aspectos importantes para el logro de una agricultura sostenible, por lo que se presta mucha atención a la reacción de los parámetros del suelo y su componente microbiológico (Megyes et al. 2021).
La fertilización se ha utilizado ampliamente como una práctica de manejo común, para mantener la fertilidad del suelo y la productividad de los cultivos. El uso de fertilizantes minerales, en combinación con fertilizantes orgánicos a largo plazo, de fertilizantes minerales, en combinación con fertilizantes orgánicos, enriquece y diversifica el microbioma del suelo y aumenta la actividad de las enzimas del suelo (Li et al. 2018); sin embargo, hay informes sobre cambios en la diversidad de los microorganismos involucrados en el ciclo del nitrógeno (N) después de la fertilización a largo plazo con fertilizantes minerales y orgánicos de origen animal y vegetal (Lin et al. 2021).
La caña de azúcar es uno de los cultivos más rentables para la producción de azúcar y biomasa con altos requerimientos de nutrientes y un largo período de crecimiento. La aplicación adecuada de fertilizantes nitrogenados promueve el macollamiento, el crecimiento, el metabolismo del nitrógeno, la distribución de la materia seca y la acumulación de azúcar y, por lo tanto, mejora significativamente la productividad de caña y azúcar. En este contexto, el uso a largo plazo de diferentes sistemas de fertilización puede generar disímiles condiciones sobre la actividad vital de los principales grupos taxonómicos y fisiológicos de los microorganismos del suelo (Puzniak et al. 2022), sin que existan evidencias sobre este particular para agroecosistemas tropicales insulares.
La microbiota del suelo, especialmente, aquella que habita en la rizosfera y coloniza los tejidos vegetales son objeto de numerosas investigaciones científicas, con el fin de tener un mejor entendimiento de los procesos ecosistémicos y, de esta forma, desarrollar sistemas de agricultura sostenible. Por lo tanto, el objetivo de este estudio fue analizar la influencia de diferentes regímenes de fertilización mineral sobre la estructura y la composición de la comunidad microbiana rizosférica en un experimento de larga duración, en cultivos de la caña de azúcar.
MATERIALES Y MÉTODOS
Perfil natural del sitio experimental. El experimento de larga duración con diferentes dosis de fertilización mineral se estableció en 1998, en la Estación Experimental del Instituto de Investigaciones de la Caña de Azúcar en Santiago de Cuba (20° 22’06,97” N; -76°01’89,31” W), sobre suelo Pardo Sialítico (Hernández et al. 1999). El estudio reprodujo el sistema de cultivo tradicional de caña de azúcar utilizado en Cuba, con plantación y cosecha manual, así como ciclos de reposición, luego de cinco cortes. Al momento del presente estudio se encontraba en su tercer ciclo y cepa de segundo retoño, plantado en primavera con el cultivar C86-12.
Diseño experimental. El experimento de bloques completamente al azar incluyó cinco tratamientos: (i) N0P25K50 nula aplicación de nitrógeno, (ii) N50P25K50 baja aplicación de N, (iii) N100P25K50 media aplicación de N, (iv) N150P25K50, alta aplicación de N, (v) N200P25K50 muy alta aplicación de N, en Kg/ha-1de N. Cada tratamiento se repitió tres veces y cada réplica contó con 48 m2. Los fertilizantes químicos aplicados fueron urea (46 % N), superfosfato de calcio (12 % P2O5) y cloruro de potasio (60 % K2O). Todos Los fertilizantes se aplicaron en el fondo del surco previo a la plantación y en retoño 20 días post-cosecha, manualmente y sin fraccionar dosis (INICA, 1990).
Muestreo de suelos. La recolección de muestras de suelo rizosférico se realizó en los días de cosecha, según Edwards et al. (2015). Se extrajeron tres plantas con raíces, por tratamiento, el suelo en exceso se retiró manualmente y las plantas se colocaron sobre bandejas esterilizadas. Se tomó 1 g, del suelo rizosférico, sin raíces, pero lo más cercano posible a este, aproximadamente, 1mm y se depositó en tubos estériles de 15 ml, que se almacenaron en contenedor a -20°C, para su traslado al laboratorio. Las muestras se almacenaron a -80 °C, para la extracción de ADN.
Extracción de ADN, PCR y secuenciación. Para cada muestra, se extrajo el ADN genómico total de 0,5 g de suelo fresco, utilizando el kit de aislamiento de ADN DNeasy Powersoil® (Qiagen, Hilden, Alemania), de acuerdo con las instrucciones del fabricante. La concentración y la pureza del ADN se comprobó con un kit Qubit dsDNA HS Assay y fluorómetro Qubit 3.0 (Thermo Fisher Scientific). Se usó una alícuota de ADN (50 ng) de cada muestra, como molde para la amplificación.
Las regiones hipervariables V3-V4 de los ARNr 16S bacterianos se amplificaron usando los cebadores 5′-CCTACGGGNGGCWGCAG-3' y 5'-GACTACHVGGGTATCTAATCC-3', mientras que para las regiones ITS1 e ITS2 fúngicas se utilizaron 5'-CTTGGTCATTTAGAGGAAGTAA-3' y 5'-GCTGCGTTCTTCATCGATGC-3' (Klindworth et al. 2013). La amplificación y la secuenciación masiva fueron realizadas con tecnología Illumina Miseq, servicio brindado en Austral-Omics, Universidad Austral de Chile. El proceso de secuenciación se realizó con el Kit Miseq Reagent v3 600-cycles (2x250 pair-end). Las secuencias fueron importadas mediante archivo “fastq”, considerando dos archivos por muestra, según Orgiazzi et al. (2012).
Análisis bioinformático. Se aplicaron filtros de control de calidad, a los archivos fastqs procesados en DADA2, de 240 pb (Callahan et al. 2016), con lecturas establecidas, en PHRED 20. El alineamiento múltiple de las nuevas secuencias unificadas (ASV) se realizó, según Katoh & Standley (2013). El árbol filogenético de máxima verosimilitud (ML) se infirió con el FastTree (Price et al. 2010). Las abundancias, la taxonomía, la filogenia y los metadatos de ASV se integraron en un objeto Phyloseq y se analizaron con el paquete Phyloseq v1.38.0 (McMurdie & Holmes, 2013). La disimilitud de la diversidad-β (Jaccard, Bray-Curtis y UniFrac filogenético ponderado y no ponderado) para las muestras, se evaluó mediante el análisis de coordenadas componentes principales (ACP), para revelar las diferencias entre los diferentes tratamientos estudiados.
Cada índice se comparó mediante un análisis de varianza multivariante permutacional (PERMANOVA), en el paquete "vegan" v2.5-7 en R (Oksanen et al. 2007), mediante la función adonis2 basada en el algoritmo de Anderson (2001). Se determinó la importancia para 10,000 permutaciones.
Las asignaciones taxonómicas a nivel de 16S e ITS se realizaron para las categorías taxonómicas de Reino, Phylum, Clase, Orden, Familia y Género (100,0 %). La clasificación por Phylum bacterianos se realizó, según los criterios de Brenner et al. (2005), Goodfellow et al. (2009) y Krieg et al. (2010) y la clasificación de los hongos se realizó, según Corsaro et al. (2014), Tedersoo et al. (2015) y Tedersoo et al. (2016).
RESULTADOS Y DISCUSIÓN
Microbiota bacteriana. En el análisis de las secuencias obtenidas a partir de ARNr 16S, se obtuvieron 2,722 ASVs identificadas post-filtros en 21 muestras, un promedio de 10,426 lecturas por muestra. La microbiota bacteriana de la rizosfera de la caña de azúcar estuvo principalmente compuesta por los Phylum, con abundancias relativas >1,0 %: Acidobacteriota (26,7 %), Actinobacteriota (19,1 %), Proteobacteria (16,2 %), Firmicutes (15,1 %), Myxococcota (5,3 %), Plantomycetota (4,7 %), Methylomirabilota (3,0 %), Gemmatimonadota (2,3 %), Chloroflexi (2,0 %) y Bacteroidota (1,6 %) (Figura 1), con abundancias relativas >1,0 %. Los cuatro primeros filos (>15,0 %) fueron dominantes en todas las muestras y representaron más del 70 % de la abundancia relativa de las comunidades bacterianas.
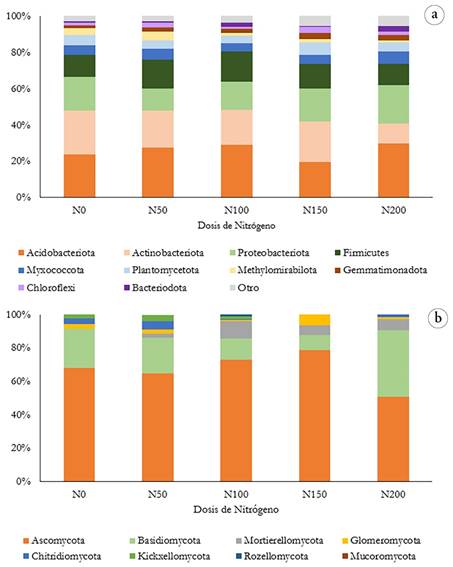
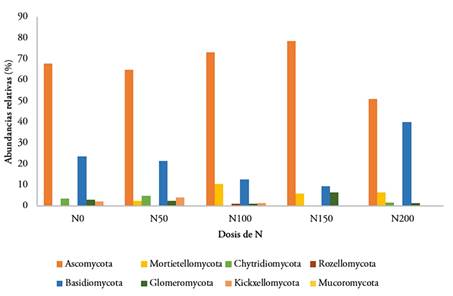
Figura 1 a) Composición de la microbiota bacteriana por Phylum asociada con a) Cada tratamiento (n= 5, con variación de las concentraciones de nitrógeno en el rango de 0 a 200 Kg/ ha ̶1. El gráfico de barras muestra los 10 Phylum bacterianos más abundantes y sus respectivas abundancias relativas; b) Composición de la micobiota de la caña de azúcar asociada a diferentes dosis de nitrógeno (n= 5, con variación de las concentraciones de nitrógeno en el rango de 0 a 200 Kg/ha -1).
En estudio realizado por Pedrinho et al. (2021), explica que las proteobacterias, acidobacterias y actinobacterias fueron los Phylum bacterianos más abundantes encontrados en suelos de campos de caña de azúcar, con quema previa a la cosecha y de bosques adyacentes, tanto en estaciones secas como húmedas, en el sureste de Brasil. El predominio de Proteobacteria en dichos ambientes se puede explicar por el hecho de que este Phylum comprende el grupo filogenéticamente más diverso en el dominio Bacteria, reconocido por ser metabólicamente versátil, incluyendo las bacterias aeróbicas y facultativas (Marin, 2014).
Según De Chaves et al. (2019), la presencia de Acidobacterias en el suelo puede indicar la presencia de genes relacionados con la síntesis de celulosa y proteínas y de la degradación del carbono, lo que sugiere características de resistencia a la desecación y potencial metabólico para degradación de carbono en suelo de caña de azúcar. Russo et al. (2012) explican que Actinobacteria es una clase dominante en suelo arenoso, siendo la humedad un factor determinante para la abundancia de este filo, que aumenta en suelos áridos, debido a la resistencia de varias especies al estrés por sequía.
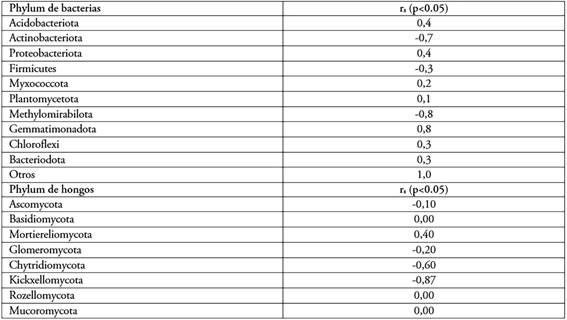
El análisis de correlación permitió constatar que a concentraciones crecientes de nitrógeno existe una tendencia a la disminución de los Phylum Actinobacteriota y Methylomirabilota, así como un aumento de Gemmatimonadota y otros Phylum de menor representación (Tabla 1). De manera similar, Gu et al. (2021) encontraron un aumento en la abundancia relativa de Proteobacterias y Gemmatimonadetes, así como la disminución de Actinobacterias (P < 0,05), en el suelo rizosférico de caña de azúcar, en la provincia de Guangdong, China, con la aplicación de fertilizantes nitrogenados, en un rango de dosis entre 375 y 560 kg/ha-1.
Tabla 1 Coeficiente correlación de Spearman entre diferentes concentraciones de nitrógeno y los Phylum de bacteria y hongos asociados a caña de azúcar (p<0,05).
Los aportes de nitrógeno tienen múltiples efectos sobre el crecimiento, la composición y la función microbiana del suelo. Por una parte, se reducen las capacidades metabólicas de las comunidades bacterianas del suelo. El carbono de la biomasa microbiana disminuye después de la fertilización con nitrógeno, debido a la disminución del pH del suelo, lo que resulta en un mayor potencial osmótico y una mayor solubilidad del aluminio, que es tóxico para los microbios del suelo (Kearns et al. 2016).
Por otra parte, la aplicación de urea a largo plazo incrementa la diversidad de bacterias oxidantes de amoníaco (AOB), con un aumento significativo en la tasa de nitrificación potencial del suelo, por el enriquecimiento de los géneros con alta capacidad de oxidación de amoníaco (Pester et al. 2013). Además, se reduce significativamente la diversidad y la riqueza de las bacterias portadoras de nitrito oxidoreuctasa (nxr) subunidad-alfa (nxrA), pero aumenta significativamente la diversidad y uniformidad de las bacterias portadoras de nxrB (subunidad-beta) (Zhang et al. 2023).
El análisis de componentes principales indica que existe un 72,2 % de la variación de los datos, en los dos componentes principales, de lo que se infiere, que los diferentes tratamientos de fertilización modifican la abundancia relativa de los grupos microbianos (Figura 2a); particularmente, en la dosis de N, correspondiente a 100 kg/ha-1, existe una mayor asociación con los Phylum Acidobacteria y Firmicutes. Esta dosis es la recomendada para obtener rendimientos agrícolas entre 90 - 100 ton ha-1, bajo las condiciones de Cuba (De León et al. 2013).
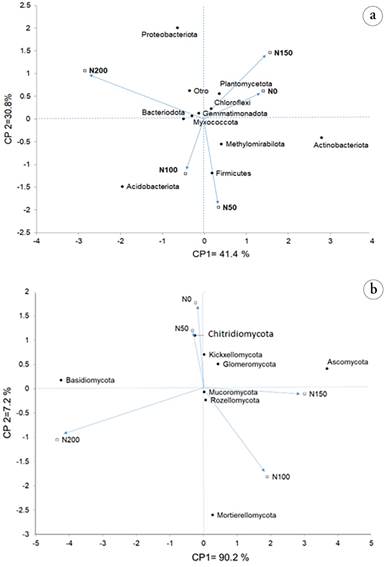
Figura 2 Análisis de componentes principales de muestras por tipo de tratamiento amplicon 16 S. Análisis de varianza permutacional multivariado (Adonis) pr ((> F) = 0.941; 10.000 permutaciones. a) Phylum de bacterias; b) Phylum de hongos.
La rizosfera de la caña de azúcar es rica en actinobacterias, que promueven el crecimiento de las plantas y la mayoría tiene el potencial de antagonizar los patógenos de las plantas (Wang et al. 2021). Los firmicutes tienen capacidades metabólicas de amplio rango, capaces de usar varios azúcares, como únicas fuentes de carbono; algunos de ellos están asociados con el proceso de promoción del crecimiento en plantas, como los géneros Bacillus y Rhizobium (Patel et al. 2019); otros tienen rasgos específicos, como la fijación de nitrógeno (Liu et al. 2019), tolerancia a la salinidad (Vaishnav et al. 2020), producción de bioestimulantes, como péptidos de bajo peso molecular (Yakhin et al. 2017), fitohormonas y compuestos volátiles con actividad antimicrobiana (Cordovez et al. 2018) e incremento de biomasa (Wang et al. 2016).
Micobiota. Para ITS, se obtuvieron 931 ASVs identificados con post filtros en 21 muestras, para un promedio de 3,147 lecturas por muestra. Fueron identificados ocho Phylum de hongos con abundancias relativas superior al 1 % (Figura 1b). Se observó predominio de Ascomycota (66,2 %) y Basidiomycota (21,9 %), resultados que confirman los obtenidos por Liu et al. (2019). Los ocho Phylum asociados a caña de azúcar fueron informados anteriormente en suelos.
Autores, como Huang et al. (2021), mostraron predominio de los Phylum Ascomycota, Basidiomycota y Mucoromycota y reportan otros Phylum menos abundantes, tales como Mortierellomycota, Chytridiomycota, Glomeromycota, Rozellomycota, y Kickxellomycota, en caña de azúcar, además de presentar variaciones en composición y en abundancias, cuando se aplican insecticidas y mezclas de fertilizantes.
Existe una ligera disminución en la abundancia relativa de Ascomycota en las condiciones naturales del cultivo de la caña de azúcar, sin fertilización, con relación a la dosis de 50 kg/ha-1 de nitrógeno. Este Phylum es más abundante con incrementos en las dosis del elemento, hasta la aplicación de 150 kg/ha-1. Existe disminución en composición y abundancia al aplicar dosis de N, entre 150- 200 kg/ha-1; no existe la presencia de Kickxellomycota, Rozellomycota y Mucoromycota; se aprecia la sensibilidad de estos Phylum, a mayores concentraciones del elemento.
El Phylum Mortierellomycota se observa con la aplicación de 50 kg/ha -1 de N, la abundancia relativa de este se favorece con la aplicación de dosis de 100 kg/ha -1 y es precisamente, en esta dosis, donde se observa la mayor diversidad. Mucoromycota solo se muestra cuando se aplican 100 kg/ha-1de N; de forma general, los ocho Phylum fungosos presentes se observaron con la aplicación de esta dosis (Figura 3).
Liu et al. (2019) estudiaron la dinámica de la comunidad de hongos del suelo en caña de azúcar durante diferentes etapas fenológicas del cultivo y encontraron que la micobiota estaba dominada por los Phylum Basidiomycota y Ascomycota, los que, a su vez, mostraron asociaciones más fuertes, cuando se presentaba un pH más alto, disponibilidad de nitrógeno y temperatura del suelo moderada.
Existieron variaciones en cuanto a composición y abundancias relativas de los Phylum respecto a las dosis de nitrógeno aplicadas. En la medida que se incrementan las dosis del elemento aumenta el número de Phylum presentes (composición), hasta la dosis de N100P25K50. A partir de la dosis de N150P25K50 se observa una disminución en la composición. El análisis de correlación permitió constatar que a concentraciones crecientes de nitrógeno existe una tendencia a la disminución de los Phylum Kickxellomycota y Chytridiomycota, así como un aumento de Mortierellomycota (Tabla 1). El aumento de nitrógeno reduce la biomasa fúngica, a través de cambios en los exudados específicos de la planta y alteraciones en la competencia de nutrientes entre las plantas y los microbios de la rizosfera o directamente al inhibir el crecimiento de los hongos (Waldrop & Zak, 2006).
A nivel de género y familia se detectó abundancia diferencial, estadísticamente significativa, en el Phylum Ascomycota (Figura 4). La familia Saccharomycetaceae género Issatchenkia y se encontró enriquecida en el tratamiento con muy alta fertilización de nitrógeno (N200P25K50), con relación al control sin fertilización nitrogenada (N0P25K50). Los géneros Groenewaldozyma y Zygoascus, familia Trichomonascaceae, se encontraron en mayor abundancia en el tratamiento N0P25K50.
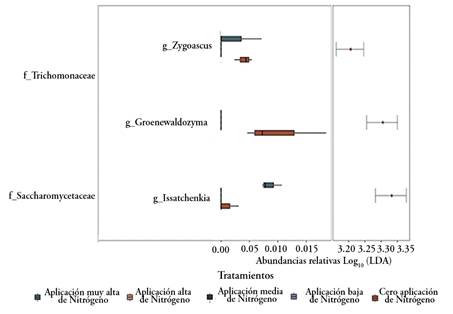
Figura 4 Hongos con abundancia diferencial entre tratamientos. Resultados de las pruebas a nivel de género y familia (Kruskal-Wallis; p > 0,01).
De manera general, se aprecia que en las parcelas no tratadas existen géneros que no se detectan con el incremento de las dosis de nitrógeno o solo se detectan en la concentración más alta evaluada. Consistente con este resultado, la mayoría de los hongos microscópicos son saprofíticos y su tasa de crecimiento se correlaciona con la disponibilidad de Nitrógeno. Paungfoo-Lonhienne et al. (2015), al estudiar la relación entre las dosis de N y la comunidad fúngica en muestras de suelo y rizosfera de caña de azúcar, demostraron que los géneros afectados positivamente incluyeron fitopatógenos, mientras que los de relación negativa fueron relacionados con la salud del suelo y las plantas (biocontralodores, descomponedores).
El género Issatchenkia ha sido aislado de una variedad de ambientes que incluyen: granos de cacao, tallo de maíz y sorgo dulce, así como paja de arroz (Matsushika et al. 2016). Buddiwong et al. (2014) identificaron 19 aislados de levadura de los géneros Candida sp., Pichia sp. e Issatchenkia sp. a partir del suelo, hojas y bagazo de caña de azúcar. Estos autores seleccionaron estas cepas por su capacidad para producir altas concentraciones de etanol a elevadas temperaturas, entre 37 y 45 °C. Además, utilizaron azúcares de hexosa (glucosa, fructosa y sacarosa) y pentosa (xilosa y arabinosa), como fuentes de carbono. La presencia de este género de hongos se relaciona con enfermedades en humanos y ganado (Centeno-Martínez et al. 2023), pero no se encuentra información como patógeno de plantas; sin embargo, Issatchenkia terrícola se propone como potencial probiótico agrícola para promover la salud y el crecimiento de las plantas (Bright et al. 2022).
Shrestha et al. (2011) demostraron que 71 aislados fúngicos asociados a caña de azúcar, entre los que se encuentra Zygoascus sp., participan en la biodegradación de las paredes celulares de la planta huésped. Este proceso conduce a la liberación de oligosacarinas que, en bajas concentraciones, tienen actividad biológica y están involucradas en varios procesos de desarrollo en las plantas, como bioestimulantes o elicitores (Lara Acosta et al. 2018).
El género Groenewaldozyma fue uno de los propuestos a partir del reconocimiento de la fase telomorfa de algunas especies de Candida. Se ha identificado como parte de la flora intestinal de artrópodos y en frutales con efectos beneficiosos in vitro con actividades probióticas y antioxidantes (Stefanini, 2018; Zullo & Ciafardini, 2020).
El análisis de componentes principales explicó que hay un 97,4 % de la variación de los datos, en las dos componentes, uno y dos. Estos resultados confirmaron que los diferentes tratamientos de fertilización alteran influyen sobre la abundancia relativa de la comunidad fúngica (Figura 2b). Particularmente, en la dosis de N 100 kg/ha-1, correspondiente a la recomendada para obtener rendimientos agrícolas entre 90 - 100 ton ha-1, bajo las condiciones de Cuba (De León et al. 2013), existe una mayor asociación con el Phylum Mortierellomycota.
El Phylum Mortierellomycota incluye, principalmente, microorganismos saprotrofitos ectomicorrízicos y ubicuos, con la capacidad de crecer en los suelos agrícolas y aumentar el rendimiento de los cultivos, al mejorar la disponibilidad de fósforo soluble y establecer simbiosis con las plantas (Grządziel & Gałązka, 2019). Wang et al. (2020) encontraron que pueden disolver el fósforo mineral en el suelo y aumentar el contenido de nutrientes al sintetizar y secretar ácido oxálico; este ácido orgánico también es un factor de patogenicidad potencial para los fitopatógenos, que inhibe el estallido oxidativo del hospedante y debilita las respuestas de defensa dependientes de Ca2+ (Sun et al. 2019). El Phylum Mortierellomycota también se ha identificado como Phylum predominante en suelos cultivados con pastos y caña de azúcar (Bahadori et al. 2022).
Las comunidades microbianas del suelo juegan un papel clave en la sostenibilidad del ecosistema al mantener funciones esenciales, a través de la renovación de carbono y nutrientes. Los resultados de este estudio se pueden utilizar para desarrollar prácticas de manejo más específicas, para mejorar la fertilidad biológica del suelo. Se requiere más investigación para profundizar en la evaluación de los efectos de las características geoquímicas y de la materia orgánica en la composición y estructura de la comunidad microbiana del suelo, en el funcionamiento y en la estabilidad del ecosistema, como respuesta a los cambios ambientales.
Este estudio demostró que la fertilización nitrogenada en caña de azúcar, en el rango estudiado, no induce diferencias significativas en la composición y en la estructura de la comunidad bacteriana, entre diferentes niveles de fertilización nitrogenada en caña de azúcar. Las Acidobacterias, Firmicutes y Mortierellomycota estuvieron más relacionados con las dosis de nitrógeno recomendadas, para obtener altos rendimientos agrícolas, bajo las condiciones de Cuba.
Respecto a la micobiota, existieron variaciones en cuanto a la composición y abundancias relativas de los Phylum de la micobiota presentes, en relación con las dosis de nitrógeno aplicadas, con predominio de los Phylum Ascomycota y Basidiomycota, detectándose diferencias significativas, a nivel de género y familia, dadas por la presencia de organismos probióticos en las parcelas no tratadas.