INTRODUCCIÓN
La resistencia bacteriana es la capacidad de las bacterias de multiplicarse en presencia de concentraciones de fármaco durante su uso terapéutico (Patini et al. 2020). El aumento de bacterias resistentes es un problema de salud pública creciente que se relaciona, principalmente, con el uso incorrecto y excesivo de antibióticos, así como la prescripción excesiva o incorrecta, tratamientos no terminados, el uso excesivo de antibióticos en ganadería, porcicultura y piscicultura, la baja disponibilidad de antibióticos nuevos y la limitación en la aprobación reglamentaria (Ventola, 2015a).
En la actualidad, la medicina se desarrolla en medio de una crisis global de resistencia a los antimicrobianos descrita para patógenos, tanto en el ambiente hospitalario como ambulatorio (Ventola, 2015b). Las bacterias, por su gran capacidad de adaptación, han desarrollado mecanismos de resistencia frente a los antibióticos disponibles (Munita & Arias, 2016). Esta resistencia a los antimicrobianos es un problema creciente para la salud pública (Frieri et al. 2017).
Sin duda, el uso excesivo y con frecuencia empírico de los antibióticos para el tratamiento de diferentes condiciones clínicas, condujo a modificaciones de la ecología bacteriana, cambiando las funciones ecológicas y magnificando la resistencia (Ding & Jianzhong, 2010). Desarrollar un nuevo antimicrobiano tiene un alto costo, el cual, se estima de 800 millones a 1.2 billones de dólares por agente aprobado y, en general, un bajo retorno a diferencia de otros fármacos, sumado a los bajos precios de estas moléculas, la pérdida de la efectividad con su frecuente uso y la creciente presión en la restricción de estas nuevas moléculas (Rello et al. 2016).
La Infectious Diseases Society of America (IDSA, 2018) definió seis microorganismos como especies patogénicas, conocidas como ESKAPE, que son de alta prioridad, por representar problemas clínicos o de salud pública relevantes y no contar con nuevas moléculas en desarrollo para su tratamiento; entre estos agentes, se incluyen Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Enterobacter sp., Acinetobacter baumanni y Pseudomonas aeruginosa (Meeker et al. 2016). La preocupación más grande es la creciente y rápida resistencia a antimicrobianos en comparación con las limitadas opciones terapéuticas que se tienen; sin embargo, como los pacientes deben ser tratados es necesario desarrollar nuevos antibacterianos que aporten solución al problema de resistencia, quizás, el principal problema actual y probablemente la crisis del futuro, en especial, en países en vías de desarrollo, como el nuestro (Founou et al. 2016). Con base en lo anterior, el organismo animal y humano se ha encargado de desarrollar y evolucionar mecanismos para tratar de defenderse produciendo moléculas con la capacidad de atacar las bacterias que, a diario, afectan a los diferentes sistemas de los seres vivos (Yvon, 2018).
Una de estas estrategias es el uso de fluidos corporales con alto contenido proteico e inmunológico, entre los que se incluye, saliva, orina, lágrimas, leche materna y calostro. La leche materna es un fluido con gran valor nutricional, inmunológico y microbiológico (Toscano et al. 2017); su composición basada en inmunoglobulinas, oligosacáridos prebióticos, proteínas antimicrobianas, tales como lisozimas, lactoperoxidasa, lactoferrina y citoquinas inmunomoduladoras como IL-10 y TGF-β, la hacen un atractivo terapéutico en el control de infecciones gastrointestinales y respiratorias (Ulfman et al. 2018).
El calostro es la leche temprana producida por las hembras de mamíferos inmediatamente después de dar a luz, único en composición y función que, además de ser la principal fuente nutricional para el recién nacido, brinda protección frente a infecciones, mientras el sistema inmunológico se va desarrollando (Conte & Scarantino, 2013). El calostro es considerado un fluido corporal de gran valor inmunológico, debido a la presencia de factores de crecimiento, proteínas, carbohidratos, lípidos, vitaminas, minerales, moléculas antioxidantes, citocinas, nucleótidos (McGrath et al. 2015). Este líquido contiene una mayor concentración de anticuerpos que la leche madura, siendo la única fuente de inmunoglobulinas para el neonato, durante el primer mes de vida (Ruiz-Diaz et al. 2019), demostrándose su importancia en la protección frente a infecciones bacterianas (Nolan et al. 2019) y procesos inflamatorios e infecciosos gastrointestinales (Gao et al. 2020).
Es tal la importancia de estos fluidos corporales que es posible encontrar varios productos comerciales de leches inmunes con anticuerpos específicos o moléculas activas usados en la salud animal y humana, destinados a la prevención de enfermedades gastrointestinales (Vega et al. 2020; Villamil et al. 2020).
Por lo tanto, el presente trabajo evaluó la capacidad antibacteriana de leche materna y calostro, obtenida a partir de las especies caprina, bovina, bufalina y humana, con el fin de sugerir opciones terapéuticas de fácil acceso, efectivas y de bajo costo, ante el creciente panorama actual de resistencia antimicrobiana.
MATERIALES Y MÉTODOS
Aspectos bioéticos: El presente estudio fue aprobado por el Comité de Bioética para el Cuidado y Uso de los Animales de la Institución Universitaria Visión de las Américas, bajo el acta # 29 del 19/05/2020. Las muestras fueron tomadas por personal calificado previo revisión y firma de consentimiento informado del propietario del animal o de la persona donadora de la muestra.
Ubicación: Fue realizado el muestreo de leche en hatos de la región del Eje Cafetero y norte del Valle del Cauca y procesadas en el Laboratorio Multifuncional del Programa de Medicina Veterinaria y Zootecnia de la Facultad de Ciencias de la Salud, de la Universidad Tecnológica de Pereira.
Toma de muestras de animales: De cada especie fueron tomadas muestras de seis animales diferentes, en buen estado de salud. En el caso del calostro, las muestras fueron tomadas durante las primeras horas postparto y para la toma de muestras de leche, fueron tenidos en cuenta los períodos de producción leche madura, según la especie, así: fueron muestreadas búfalas adultas, entre el mes 1,5 y 2 de lactancia; vacas adultas, entre el mes 2 y 2,5 de lactancia; cabras adultas, entre el mes 1,5 y 2 de lactancia y donantes mujeres adultas, entre el mes 3 y 4 de lactancia. Estas muestras que, según las especies, son los meses aproximados en los que se presenta el mayor pico de producción de leche madura y en que estarían los periodos estandarizados para asegurar que estén en la misma etapa y condiciones de lactancia.
Las muestras de leche y calostro fueron tomadas por ordeño manual, previa limpieza y desinfección de las glándulas mamarias, se tomó un volumen de 2 mL de muestra y por duplicado. Las muestras se transportaron refrigeradas a 4 °C y se almacenaron a -20 °C, con el fin de no perder las proteínas y las células inmunes implicadas en el estudio. Se excluyeron animales con presencia de mastitis, para prevenir cualquier posible riesgo de infecciones en las muestras y animales en tratamiento con antibióticos.
Recolección de muestras en mujeres lactantes: Posterior a la firma del consentimiento informado, la toma de muestra de mujeres en etapa de lactancia fue tomada por la misma donante y obtenida por ordeño manual previa asepsia de las manos y limpieza de la zona, con solución salina normal y gasa estéril; la muestra se tomó en un sitio que garantizó la privacidad y la integridad de la madre, según previas indicaciones dadas por el personal del proyecto y bajo supervisión de un personal de salud. Fue tomado un volumen de 5 mL para leche y de 2 mL de calostro. La participación de los sujetos de investigación fue activa hasta la toma de la muestra; una vez se concluyó la toma, el sujeto de investigación quedó sin ningún tipo de vínculo al proyecto. Las donantes de las muestras de leche y calostro fueron mujeres lactantes sanas, sin medicación de tipo antibiótico y sin ningún compromiso infeccioso de la glándula mamaria.
Procesamiento de las muestras: Fueron tomadas un total de 48 muestras (24 muestras de leche y 24 muestras de calostro). Las muestras se filtraron, empleando filtros de jeringa 0,45 µm; a partir de las muestras filtradas, se realizaron 4 diluciones, de la siguiente manera: leche sin dilución, 100 %; leche diluida, 75 %; leche diluida, 50 %; leche diluida, 25 %; calostro sin dilución, 100 %; calostro diluido, 75 %; calostro diluido, 50 %; calostro diluido, 25 %. Estas diluciones fueron impregnadas en discos para antibiogramas en blanco (OXOIDTM), por un tiempo de dos horas; las diluciones se realizaron con solución de agua peptonada estéril al 0,1% p/v, garantizando que no se alteren las características iniciales de las muestras.
Se emplearon cepas ATCC de P. aeruginosa (27853), K. pneumoniae (13883), S. aureus (25923) y E. coli (25922), las cuales, fueron reactivadas, según las especificaciones del fabricante. Se sembraron por siembra masiva en cajas de agar Mueller Hinton, a una concentración de 0,5, en la escala de Mac Farland, corroborada por espectrofotometría. Se emplearon discos para antibiogramas en blanco (OXOIDTM), impregnados con diferentes concentraciones del leche y calostro en cada una de las cajas inoculadas con la cepa ATCC de interés. Como control positivo, se emplearon sensidiscos comerciales de Ciprofloxacina (OXOIDTM), a una concentración de 5 μg y discos para antibiogramas en blanco, como control negativo, impregnados con solución salina peptonada. Los ensayos se incubaron en incubadora a 35 °C y leídos entre las 18-24 horas, posterior a su siembra. Todos los montajes se realizaron por duplicado; los halos de inhibición obtenidos se midieron en mm y se compararon con los obtenidos por los sensidiscos de Ciprofloxacina, con el fin de determinar la especie bacteriana más sensible y el tipo de muestra con la mayor capacidad antibacteriana. De igual manera, se determinó el porcentaje, en el cual, se alcanzó algún tipo de inhibición bacteriana. Finalmente, se determinó la especie con mayor actividad antibacteriana frente a alguna de las bacterias testeadas.
Análisis de datos
Leche: A partir de los resultados obtenidos se realizaron análisis de homogeneidad y homocedasticidad; una vez cumplidas las premisas fue realizado análisis de varianza One-Way-ANOVA y test post hoc de Duncan, para comparación de medias con significancia de p <0,05.
Calostro: Para determinar las diferencias del efecto inhibitorio del calostro de las especies caprina, humana, bufalina y bovina frente a los agentes infecciosos de importancia en salud humana y animal, P. aeruginosa, S. aureus, K. pneumoniae y E. coli, todos los datos obtenidos fueron sometidos análisis de homogeneidad y homocedasticidad; para los datos de Pseudomonas y Klebsiella con calostros al 100 %, se realizó transformación de datos en (Log10). Una vez cumplidas las premisas se procedió a realizar Análisis de varianza ANOVA por cada microorganismo estudiado, así: para el análisis de Pseudomonas, se realizó un ANOVA Factorial (3*3), siendo tres diluciones de calostro (100, 75 y 50 %) y tres especies animales (caprino, humano y bufalino); en el caso, de S. aureus, se realizó un ANOVA (1*2), siendo una dilución (100 %) * dos especies animales (humana y bovina) y, finalmente, para K. pneumoniae, se realizó un ANOVA (1*2), siendo una dilución (100 %) y las cuatro especies estudiadas. Todos los datos están representados por el promedio ± la desviación estándar y fueron analizados con el programa StatisticAnalysisSystem 9.2.
RESULTADOS Y DISCUSIÓN
Capacidad antibacteriana de la leche. Las muestras de leche analizadas, correspondientes a las especies caprina, bufalina y humana, solo mostraron actividad antibacteriana contra P. aeruginosa; por su parte, la leche bovina, no mostró actividad frente ninguno de los microorganismos estudiados.
No se observó diferencia significativa entre la capacidad antibacteriana de las leches de las especies caprina, humana y bufalina contra P. aeruginosa y sus halos inhibitorios se observaron próximos a los 9,0 mm (Figura 1). Las muestras de leche que mostraron actividad contra P. aeruginosa fueron analizadas en diferentes concentraciones, 100, 75 y 50 %, así como comparadas contra grupo control positivo (discos de ciprofloxacina) y negativo (solución salina peptonada); sin embargo, aunque la dilución a 75 % mostró algunos resultados importantes y similares a lo presentado por las muestras al 100 %, el n para estos resultados, no permitió una comparación estadística representativa, por lo tanto, solo se presentan estos datos como ilustrativos de la tendencia de estas leches, las cuales, a pesar de su dilución a 75 %, mostraron capacidad de inhibir el crecimiento de este agente infeccioso (Figura 1a).
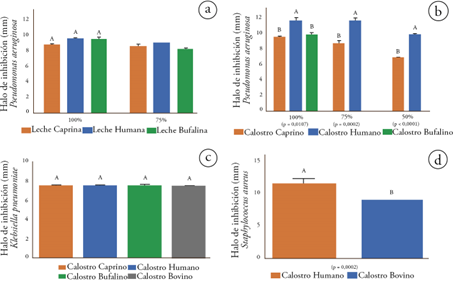
Figura 1 Capacidad antibacteriana de leche y calostro de las especies caprina, bovina, bufalina y humana, contra microorganismos de interés en salud humana y animal. Letras mayúsculas indican diferencia estadística entre las especies (significancia p ≤ 0,05). a) muestras de leche en diferentes diluciones; b) muestras de calostro en diferentes diluciones; c) muestras de calostro entero al 100%; d) muestras de calostro entero al 100%.
Capacidad antibacteriana del calostro frente a Pseudomonas aeruginosa. Este fue el microorganismo más sensible a la acción inhibitoria de los diferentes calostros, mostrando efecto inhibidor generado por los calostros de las especies caprina, bufalina y humana, siendo esta última especie, la que más efecto inhibitorio mostró en todas las diluciones estudiadas, seguida del calostro de las especies caprina que, a pesar de ser menor que el calostro humano, mostró actividad inhibitoria en las tres diluciones realizadas. El calostro bufalino solo mostró actividad antibacteriana al 100 % de su concentración y, finalmente, el calostro bovino presentó actividad antibacteriana contra P. aeruginosa (Figuras 1b y 2).
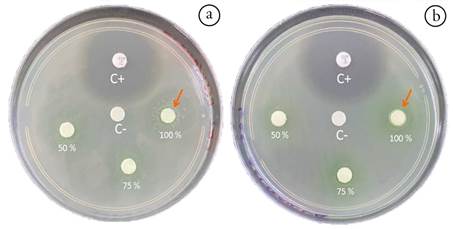
Figura 2 Prueba de sensibilidad de muestras de calostro frente a Pseudomonas aeruginosa. a) Calostro humano; b) Calostro caprino. Los porcentajes indican las diluciones de calostro utilizadas. C+ indica control positivo con sensidisco de Ciprofloxacina 5 μg. C- indica control negativo con sensidisco impregnado en solución salina. Las flechas naranjas muestran el halo de inhibición generado por los sensidiscos impregnados con calostro sin diluir, indicando el efecto antimicrobiano de las muestras.
Las muestras, tanto de leche como de calostro de las especies caprina, bufalina y humana, tuvieron actividad antibacteriana frente a P. aeruginosa, siendo el calostro humano la especie que reportó el mayor efecto inhibitorio en todas las diluciones estudiadas. Estos resultados son congruentes con lo reportado por autores, como Fasse et al. (2021) y constituyen una herramienta terapéutica prometedora frente a un patógeno oportunista virulento que afecta animales y humanos, de difícil erradicación, debido a la producción de biopelículas y resistente a múltiples medicamentos antimicrobianos (Diggle & Whiteley, 2020).
Se ha demostrado que las leches de diferentes mamíferos, como humanos, alpacas, yeguas, búfalos y monos, lograron bloquear la adhesión celular de P. aeruginosa (Zinger-Yosovich et al. 2010), considerado uno de los patógenos más importantes causantes de enfermedades nosocomiales, en especial, en pacientes con fibrosis quística, cáncer, SIDA, enfermedades granulomatosas crónicas, quemaduras, trasplantes, anemia aplásica provocando daños severos en órganos vitales y llevando al paciente a una sepsis letal. Chegini et al. (2020), Ray et al. (2019) y Piotrowski et al. (2021) demostraron que oligosacáridos obtenidos a partir de la leche materna, inhibieron la adhesión celular de P. aeruginosa, demostrándose sus propiedades antimicrobianas in vitro.
Capacidad antibacteriana frente a Klebsiella pneumoniae. Este microorganismo mostró sensibilidad a todos los calostros estudiados cuando estaban al 100 % de su concentración. De manera interesante, el tamaño halo de inhibición no mostró diferencias significativas entre las especies estudiadas, generando un efecto inhibitorio uniforme sobre el crecimiento de K. pneumoniae (Figuras 1c y 3).

Figura 3 Prueba de sensibilidad de muestras de calostro frente a Klebsiella pneumoniae. a) Calostro humano; b) Calostro caprino. Los porcentajes indican las diluciones de calostro utilizadas. C+ indica control positivo con sensidisco de Ciprofloxacina 5 μg. C- indica control negativo con sensidisco impregnado en solución salina. Las flechas naranjas muestran el halo de inhibición generado por los sensidiscos impregnados con calostro sin diluir, indicando el efecto antimicrobiano de las muestras.
Estudios, como los de Ulfman et al. (2018), demostraron que el calostro bovino inhibió el crecimiento de patógenos de importancia clínica, tales como Yersinia enterocolitica, Campylobacter jejuni, E. coli, K. pneumoniae, Serratia marcescens, Salmonella typhimurium, Staphylococcus, Streptococcus, Cryptosporidium, Helicobacter, E. coli EHEC O157:H7, Pseudomonas y Rotavirus. De igual manera, Windayani (2020) demostró que el calostro fermentado tiene propiedades antimicrobianas frente a K. pneumoniae y que estas propiedades se aumentan con la acidez y la disminución del pH. Dzik et al. (2017) indican que, tanto la leche como el calostro, presentan efectos terapéuticos frente a procesos infecciosos y sus propiedades antibacterianas y antivirales promueven la inmunidad pasiva en neonatos y refuerzan su sistema inmune, mientras se va desarrollando. Productos comerciales basados en leche y calostro bovino no inmune son usados como suplemento alimentario en animales y humanos adultos, para mejorar el sistema inmune, balancear la flora intestinal y promover la regeneración tisular (Silva et al. 2019).
Capacidad antibacteriana frente a Staphylococcus aureus. Se evidenció efecto antibacteriano de las muestras de calostro bovino y humano, siendo esta última especie la que mostró mayor efecto inhibitorio sobre el crecimiento de S. aureusFiguras 1d y 4).

Figura 4 Pruebas de sensibilidad de muestras de calostro frente a Staphylococcus aureus. a) Calostro humano; b) Calostro bovino. Los porcentajes indican las diluciones de calostro utilizadas. C+ indica control positivo con sensidisco de Ciprofloxacina 5 μg. C- indica control negativo con sensidisco impregnado en solución salina. Las flechas naranjas muestran el halo de inhibición generado por los sensidiscos impregnados con calostro sin diluir, indicando el efecto antimicrobiano de las muestras.
S. aureus es una bacteria Gram positiva causante de numerosas infecciones clínicas en animales y humanos, de gran importancia médica, debido a la creciente resistencia que presenta frente a antibióticos. Srivastava et al. (2015) y Pandey et al. (2011) reportaron que el calostro y sus componentes son efectivos frente a un amplio rango de patógenos comunes, incluyendo Rotavirus, Cryptosporidium spp., S. aureus, Candida spp., Clostridium spp., virus de inmunodeficiencia felina (VIF), Shigella spp., Streptococcus spp. y E. coli. De igual manera, Zhang et al. (2017) indican propiedades antimicrobianas frente a S. aureus, atribuibles a fracciones peptídicas derivadas de la leche humana, lo cual, se soporta con los hallazgos de Mohanty et al. (2016), quienes demostraron que los componentes peptídicos aislados de la leche, como α-lactoalbúmina, glicomacropéptidos, β-lactoglobulina, inmunoglobulinas y caseínas, son potentes inhibidores de organismos patogénicos, incluyendo S. aureus.
Capacidad antibacteriana frente a Escherichia coli. Por otro lado, en este estudio, las muestras, tanto de leche como de calostro de las especies analizadas, no presentaron actividad antibacteriana frente a E. coli, un microorganismo comensal y patógeno de importancia clínica, debido a su capacidad para propagar la resistencia frente a antimicrobianos (Jarrige et al. 2020). Contrario a lo reportado por otros estudios donde se demuestra el efecto inhibitorio de calostro bovino hiperinmune comercial frente a aislados de E. coli serovariedad enterotoxigénica, esta capacidad se puede atribuir a una mayor concentración de anticuerpos específicos, factores de crecimiento y lactoferrina, usados para prevenir infecciones gastrointestinales (Sears et al. 2017).
Estudios, como los de Borad & Singh (2018) demostraron que preparaciones de leche y de calostro, ricas en inmunoglobulinas, pueden ser efectivas frente a patógenos, como Rotavirus, C. albicans, C. difficile, S. flexneri, Streptococcus mutans, Cryptosporidium parvum, Helicobacter pylori e, incluso, E. coli, pero la eficacia terapéutica de estas preparaciones es bastante limitada. Componentes de la leche y calostro, como la lactoferrina, han demostrado efectos bacteriostáticos frente a E. coli, atribuidos a su capacidad de secuestrar el hierro que la bacteria necesita para su crecimiento (Rascón-Cruz et al. 2021) así como componentes bioactivos tales como factores de crecimiento, lactoferrina, lisozimas, lactoperoxidasa e inmunoglobulinas que son activos frente a patógenos, como E. coli, S. typhimurium, Shigella dysenteriae, Listeria monocytogenes, S. mutans, Bacillus stearothermophilus, y Bacillus subtilis (Tripathi & Vashishtha, 2006).
Se demostró que muestras de calostro y de leche de las especies caprina, bufalina, bovina y humana presentaron actividad antibacteriana contra algunos microorganismos de interés clínico en la salud animal y humana; sin embargo, los mayores efectos son atribuidos al calostro, probablemente, debido a la mayor cantidad de moléculas bioactivas, que lo hacen ser una excelente fuente nutricional e inmunológica (Borad & Singh 2018). Tanto la leche como el calostro humano demostraron tener la mejor capacidad antibacteriana, confirmándose su importancia en la salud del neonato. Los resultados de este estudio demuestran que, tanto la leche como el calostro, constituyen una herramienta inmunológica que refuerza el sistema inmune del neonato y una posible alternativa terapéutica, en el tratamiento de procesos infecciosos de origen bacteriano.















