INTRODUCCIÓN
Los erizos de mar comprenden un grupo de invertebrados marinos pertenecientes a la clase Echinoidea dentro del phylum Echinodermata y están representados por alrededor de 1.000 especies vivas (Appeltans et al. 2012). Los equinoideos no solo son importantes por su riqueza, sino también por su papel dentro de las redes tróficas y su capacidad para modificar las condiciones del bentos (Bronstein & Loya, 2014; Elmasry et al. 2013).
En los distintos ambientes marinos, los erizos constituyen uno de los grupos más importantes, debido a su ubicuidad, su alta abundancia y sus hábitos alimenticios (Glynn & Enochs, 2011); sin embargo, desde hace varias décadas, presiones antropogénicas, como la sobrepesca, las tasas de sedimentación y el calentamiento global, han venido causando disminuciones importantes en sus poblaciones, afectando, significativamente, su diversidad y distribución (Crain et al. 2008; Burke et al. 2011). La distribución de los equinoideos en los ambientes costeros es influenciada por aspectos físicos y químicos, como por ejemplo, las mareas, el asentamiento larvario, la disponibilidad de alimento, la competencia, la depredación y la heterogeneidad y complejidad del hábitat (Cameron & Schroeter, 1980; Bernstein et al. 1981; Schroeter et al. 1996; Metaxas & Young, 1998; Segovia et al. 2017).
A lo largo del Mar Caribe se han realizado diferentes estudios de índole taxonómico y ecológicos en equinoideos, entre los que se destacan los de Alvarado et al. (2008), Alvarado (2011) y Morales-Quijano et al. (2017). Para el Caribe colombiano se resaltan los trabajos de Borrero-Pérez et al. (2002), González et al. (2002), Borrero-Pérez et al. (2012) y Benavides-Serrato et al. (2013), los cuales, se centraron en la realización de inventarios y notas taxonómicas, por lo tanto, hay un gran potencial para la investigación en áreas, como la ecología, la genética, la bioprospección, la acuicultura, entre otras. Por otro lado, la información científica en ecosistemas insulares es limitada en comparación con aquellas áreas ubicadas en zonas costeras continentales, en especial, para la Isla Fuerte, que carece de investigación básica y aplicada.
Teniendo en cuenta el papel ecológico que cumplen los equinoideos y la falta de información ecológica, en este sentido, se evaluó la diversidad, la densidad poblacional y la distribución espacial de erizos regulares de Isla Fuerte. Los resultados de esta investigación representan una línea base y proporcionan datos importantes, que puede ayudar a los gestores ambientales, para sustentar herramientas y estrategias de manejo que permitan conocer el estado actual, la dinámica y la evolución de este grupo de invertebrados.
MATERIALES Y MÉTODOS
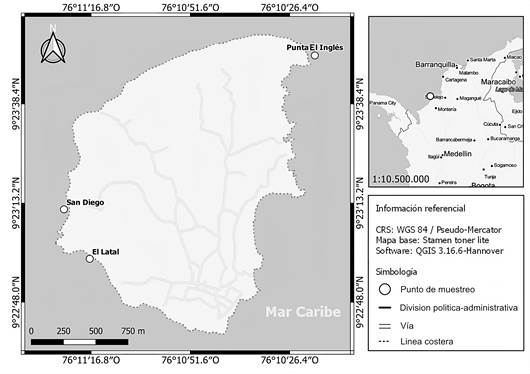
Área de estudio. La presente investigación se realizó en Isla Fuerte, localizada a 11 km del continente (9°23’N, 76°11’O para Puerto Limón), sobre la plataforma continental al suroeste del Caribe colombiano (INVEMAR, 2009). Para viajar hasta la Isla, una de las opciones es tomar transporte acuático en Paso Nuevo, San Bernardo del viento (Córdoba) y la duración del viaje es 30 min. La isla tiene 3,25 km2 de superficie emergida y una elevación máxima de 12 m (Figura 1) y se caracteriza por poseer una variedad de ecosistemas de gran relevancia (Díaz et al. 2000). El clima de la isla es semiseco y corresponde al ecosistema de Bosque seco Tropical (Bs-T) (Etter, 1993). Posee una precipitación promedio mensual entre los 900 y 1.400 mm de lluvia, con una tendencia unimodal, separado por una época con menor precipitación, conocida como el veranillo de San Juan, entre junio y julio, donde las lluvias caen cerca de 50 mm en promedio (Estela, 2006). La temperatura superficial del mar es aproximadamente 28 °C y la salinidad de 36% (Díaz et al. 1996).
Metodología de muestreo. Se escogieron tres localidades de estudio, teniendo en cuenta la exposición al oleaje y la disponibilidad de acceso: Punta El Inglés (9°23’N, 76°10’O), que se encuentra ubicada en el barlovento de la isla, presenta un arrecife litoral y una heterogeneidad de sustratos y hábitats con profundidades no mayores a 2 m. El Latal (9°22’N, 76°11’O) y San Diego (9°23’N, 76°11’O), ambas ubicadas en el sotavento de la isla; la primera presenta sustratos rocosos, pastos marinos y fondos arenosos, con oleajes débiles. Por su parte, San Diego cuenta con un embate de olas fuertes en algunos meses y se caracteriza por poseer un sustrato conformado por rocas de diferentes tamaños y morfologías.
En cada localidad se llevaron a cabo siete muestreos entre noviembre del 2018 y septiembre de 2019, con el fin de abarcar distintas épocas climáticas. Se utilizó la metodología de transecto en banda, propuesta por Rogers et al. (1994), estableciendo tres transectos lineales de 10 m de largo por 2 m de ancho, a una profundidad no superior a 2,5 m, separados cada uno por una distancia de 5 m. En cada uno de los transectos se realizaron censos visuales, sobre los cuales, se registraron las especies y la abundancia de cada una en los distintos hábitats disponibles del área delimitada. El proceso de identificación se realizó in situ, con la ayuda de fichas de identificación sumergibles.
Fase de laboratorio. Los organismos que no lograron ser identificados a simple vista, fueron capturados, anestesiados y luego preservados para su transporte al Laboratorio de Zoología de la Universidad de Córdoba (LZUC), donde se realizó su respectiva determinación taxonómica, empleando las claves y descripciones, propuestas por Caso (1977; 1978), Hendler et al. (1995) y Borrero-Pérez et al. (2012). Posteriormente, los especímenes fueron depositados en la Colección Zoológica de la Universidad de Córdoba (CZU: Echino: 0004- 0009).
Análisis de datos. La información recolectada en campo y laboratorio se organizó en matrices de datos en una hoja de cálculo de Microsoft Excel ® 2016. La riqueza fue representada con el número total de especies por localidades y para el área de estudio (Torreblanca-Ramírez et al. 2012). Posteriormente, se construyeron curvas de rango-abundancia (Log (X+1)) para comparar las abundancias relativas de las especies de equinoideos, empleando el software GraphPad Prism 6; la densidad poblacional fue expresada como el número de individuos por metro cuadrado (ind/m2). Con el fin de determinar la estructura comunitaria de los equinoideos, se calcularon los índices de diversidad de Shannon-Wiener (H’), uniformidad de Pielou (U), dominancia de Simpson (λ) y el Índice de distintividad taxonómica promedio (Δ+). Para comparar cada uno de los índices ecológicos entre localidades, se utilizó la prueba no paramétrica de Kruskal-Wallis (Zar, 1999); estas, se realizaron utilizando los paquetes vegan y BiodiversityR en el programa R ver. 3.1.3. (Dessau & Pipper, 2008). Para comparar la afinidad entre las localidades, se utilizó la técnica de ligamiento promedio no ponderado (UPGMA) con las abundancias de las especies de erizos, utilizando la matriz de similaridad de Bray-Curtis. Las pruebas se realizaron en el programa estadístico PRIMER® v 6.1 (Anderson et al. 2008).
RESULTADOS Y DISCUSIÓN
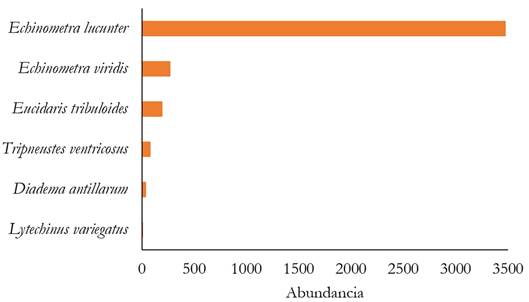
Se registraron 4.061 organismos que correspondieron a seis especies, cinco géneros, cuatro familias y tres órdenes. La especie con el mayor valor de abundancia poblacional fue Echinometra lucunter (n= 3.475), seguido de E. viridis (n=269); por otra parte, Lytechinus variegatus presentó el menor número de individuos (n=9) (Figura 2). A nivel espacial, San Diego y Punta El Inglés presentaron los mayores y menores valores, con 2.052 y 911 individuos, respectivamente. En las tres localidades, el género Echinometra mostró el mayor porcentaje de individuos, con dominancia de E. lucunter, representando el 85,57 % de los individuos contabilizados.
El número de especies identificados en este estudio representan el 7,89 % de los equinoideos para el Caribe y el 11,7 % de las reportadas para el Caribe colombiano (Alvarado, 2011; Benavides-Serrato et al. 2013). Así mismo, estas corresponden al 19,35 % de las presentes en el complejo de archipiélagos de Islas del Rosario y San Bernardo (Zarza-González, 2011). Al comparar la riqueza de especies de erizos regulares encontradas con otras investigaciones realizadas en diversas áreas del Caribe y en Colombia, se observa que los valores reportados son similares a los encontrados por Quinn-Lampson et al. (2015) en Corn Island- Nicaragua y a los de Gaitán-Espitia (2008) y Urrego-Salinas et al. (2016) con siete y ocho especies en Santa Marta y el Cabo de la Vela-Colombia, respectivamente.
Las especies reportadas en esta investigación figuran como las más frecuentes dentro de trabajos de estructura comunitaria de equinodermos en el Caribe (Laguarda-Figueras et al. 2005; Gaitán-Espitia, 2008; Quinn-Lampson et al. 2015; Urrego-Salinas et al. 2016). Por otro lado, Morgan & Cowles (1997) y Reyes Bonilla et al. (2005) mencionan que en zonas arrecifales donde se presenten variedad de tipos de fondo y alta productividad local pueden permitir el establecimiento de comunidades de erizos.
En cuanto a los valores de abundancia reportados para E. lucunter y E. viridis, Lawrence (2001) manifiesta que las especies de este género son los más ubicuos y abundantes en la zona tropical, lo que se le atribuye al pequeño tamaño corporal, forma de cuerpo oblongo, comportamiento y dieta flexible, altas tasas de reproducción y reclutamiento y bajos requisitos de recursos; todas estas características de su historia de vida les permiten sobrevivir en ambientes crípticos y estresantes. Las altas abundancias de estas especies concuerdan con lo reportado por González-Gándara et al. (2015), donde E. lucunter fue la más abundante en zonas de sustrato duro del Sistema Arrecifal Veracruzano, con densidades de hasta 20 ind/m2 y con la información obtenida por Morales-Quijano et al. (2017), para E. viridis, en los arrecifes de Lobos-Tuxpan, México. Celaya-Hernández et al. (2008) sugieren que ambas especies cohabitan y muestran las mismas preferencias por el tipo de sustrato.
Por otra parte, las bajas abundancias de L. variegatus pueden ser el resultado de factores bióticos o abióticos episódicos (Watts et al. 2007). Beddingfield & McClintock (2001) manifiestan que una de las variables que incide directamente sobre la abundancia de L. variegatus es la depredación por parte de peces y aves playeras, además, la exposición a la desecación puede ser fatal para su sobrevivencia. La presencia exclusiva de L. variegatus en Punta El Inglés puede estar relacionada con las extensiones de praderas de Thalassia testudinum Banks ex König, 1805, que se encuentra en el sector, el cual, es su hábitat más frecuente, por sus hábitos alimenticios.
La forma de las curvas de rango abundancia en los sectores de Punta El Inglés y El Latal pone en evidencia que las comunidades de equinoideos son más equitativas, debido a que las pendientes son más suaves, lo que indica que existe poca diferencia entre las especies más abundantes y las que les siguen, contrario a San Diego, donde las disimilitudes en la abundancia forman una curva inclinada (Figura 3).
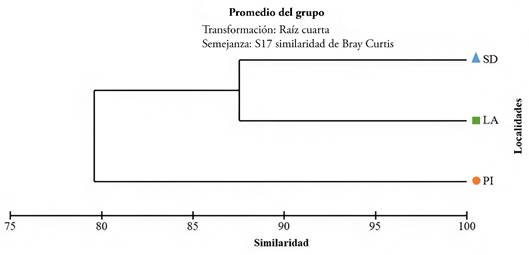
Figura 3 Curvas de rango-abundancia de las especies de equinoideos regulares en las tres localidades de Isla Fuerte, Colombia.
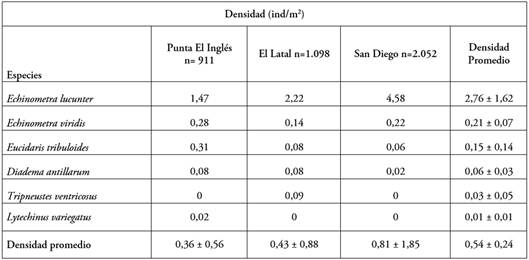
La densidad media de equinoideos en el área de estudio fue de 0,54 ± 0,24 ind/m2, donde San Diego presentó la mayor densidad promedio del estudio, seguida de El Latal y Punta El Inglés, con el menor valor. E. lucunter mostró predominancia en las tres localidades, con valores de densidades máximas en San Diego; por su parte, las menores densidades las presentó Diadema antillarum, en San Diego y L. variegatus, que estuvo restringida en Punta El Inglés (Tabla 1). De acuerdo con el ANOVA-F se presentaron diferencias estadísticamente significativas entre los valores de densidad de E. lucunter de las distintas localidades (p < 0,05), al igual que las densidades de Eucidaris tribuloides (Lamarck, 1816) (p < 0,05).
Respecto al valor de densidad general de E. lucunter, éste se encuentra por debajo de lo reportado por Monroy López & Solano (2005), quienes muestran una densidad de 46 ± 8,66 ind/m2 en ocho localidades del Caribe colombiano; sin embargo, si se compara con respecto a otras regiones del Atlántico, las densidades promedio registradas en el estudio son mayores, lo que hace suponer que en el Caribe colombiano se presentan condiciones favorables para el desarrollo de este erizo (Abbott et al. 1974). En general, las zonas intermareales con sustrato rocoso y oleaje intenso favorecen el establecimiento de las poblaciones de E. lucunter (Celaya-Hernández et al. 2008). Asimismo, las densidades reportadas en el sector San Diego, se explican a que este sitio se caracteriza por la presencia de rocas de diferentes tamaños y corales que puede brindar a los erizos, espacios de refugio, debido a los hábitos ramoneadores sobre sustratos vivos o muertos (Pompa et al. 1989). Las bajas densidades reportadas para D. antillarum, T. ventricosus y L. variegatus pueden estar determinada por varios procesos y factores, donde el tipo de sustrato, la disponibilidad de alimento y los atributos del oleaje pueden ser determinantes (Noriega et al. 2006).
Las bajas densidades de D. antillarum son comunes en el Caribe y en el Atlántico occidental. Los datos obtenidos en este trabajo se ajustan a lo reportado por Edmunds & Carpenter (2001), en la costa norte de Jamaica, por Noriega et al. (2006), en la costa de Venezuela y por González-Gaviria & García-Urueña (2011), en el Parque Nacional Natural Tayrona en Colombia, donde D. antillarum alcanza densidades inferiores a 1,16 ind/m2. A pesar de tener bajas densidades, la presencia de esta especie es un buen indicativo de la salud de los arrecifes coralinos (Lessios et al. 2001). Por su parte, T. ventricosus y L. variegatus se relacionan con áreas donde se desarrollan pastos marinos (Watts et al. 2013), lo cual, podría explicar su presencia en Punta El Inglés y El Latal.
Respecto a la diversidad alfa, se determinó la misma riqueza de especies (S= 5) para las tres localidades; sin embargo, Punta El Inglés presentó mayor diversidad, uniformidad y distintividad taxonómica promedio, al compararlo con los valores obtenidos en El Latal y San Diego (Tabla 2). San Diego obtuvo mayores valores en cuanto al índice de Dominancia de Simpson, en comparación con las demás localidades. De acuerdo con la prueba de Kruskal-Wallis, el índice de distintividad taxonómica promedio fue el único que no presentó diferencias estadísticamente significativas entre las tres localidades de estudio (p>0,05). El análisis de similitud de Bray-Curtis muestra una asociación entre San Diego y El Latal (87,58), mientras que Punta El Inglés forma una agrupación independiente (Figura 4).
Tabla 2 Índices de diversidad y abundancia de equinoideos regulares en Isla Fuerte, Colombia. S: número de especies; n: número de organismos; H': diversidad de Shannon-Wiener; J': Uniformidad de Pielou; ʎ: Dominancia de Simpson; ∆+: Índice de distintividad taxonómica promedio.
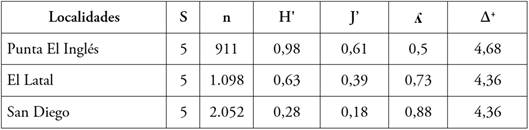
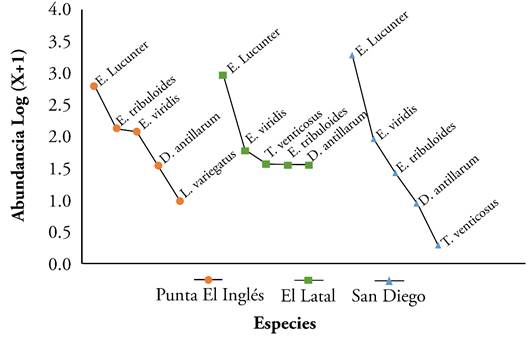
Figura 4 Dendrograma de clasificación según el índice de simililaridad de Bray- Curtis, que muestra las asociaciones entre los sectores de Isla Fuerte. Abreviaturas: SD: San Diego, LA: Latal, PI: Punta El Inglés.
La diversidad de erizos puede estar determinada por las condiciones estructurales y ambientales del hábitat (Bronstein & Loya, 2014), por lo que sitios con mayor heterogeneidad de sustratos presentaran mayor diversidad, como es el caso de Punta El Inglés. En cuanto al índice de Pielou, sus valores son interpretados como probabilidades, por lo que, en este estudio, a nivel general, se presentó una probabilidad moderada (0,39), de que las especies de equinoideos sean igualmente abundantes. Una comparación entre los valores por sitio, indica que San Diego es más heterogéneo que El Latal y Punta El Inglés.
En este trabajo se incluyó el índice de distintividad taxonómica promedio (∆ +). De acuerdo con Tucker et al. (2017), la incorporación de información filogenética en la evaluación de la biodiversidad se utiliza con mayor frecuencia en macroecología, ecología de comunidades y sus principales aplicaciones están enfocadas a la conservación biológica y evaluación de impacto ambiental (Leonard et al. 2006). Teniendo en cuenta este enfoque, los ensambles más diversos serán los que presenten un valor más alto de ∆ +, ya que eso implicaría una mayor separación filogenética entre los indivi duos o especies de un ensamble (Moreno et al. 2009). Por lo tanto, a pesar de que no existieron diferencias marcadas de este índice entre las localidades estudiadas, se registraron claramente valores más altos de dicho índice en Punta El Inglés, al igual que los índices de estructura comunitaria tradicionales.
El análisis de similaridad de Bray-Curtis mostró la conformación de dos grupos. El Latal y San Diego, ambas ubicadas en el sotavento, estuvieron asociadas, debido a que presentan igual riqueza específica; por su parte, Punta El Inglés forma un grupo independiente. Esta última localidad se encuentra en el Barlovento de la isla, presentó la menor abundancia general y con la presencia exclusiva de L. variegatus. De acuerdo con Gladstone (2007) existe una relación directa entre la riqueza de especies y la heterogeneidad ambiental. Adicionalmente, la complejidad estructural determina el comportamiento de los organismos bentónicos que, a su vez, influye en la dinámica de las poblaciones y la estructura comunitaria del ecosistema (Kostylev et al. 2003).
En conclusión, Isla fuerte constituye un área relativamente heterogénea, donde la fisiografía y la presencia de ecosistemas estratégicos ofrecen condiciones para la supervivencia y el establecimiento de equinoideos regulares. La diversidad y abundancia de estos organismos responden a las condiciones ecológicas, propias de cada localidad, en el que las especies pueden ser afectadas por el tipo de sustrato, el oleaje y la complejidad del microhábitat. La información presentada en este trabajo puede ser una referencia útil para evaluar cualquier cambio físico a corto o largo plazo, en la fauna de equinoideos en Isla Fuerte y contribuye a ampliar el conocimiento ecológico de este grupo en Colombia.