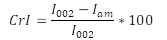INTRODUCCIÓN
Los plásticos de origen petroquímico representan una de las mayores problemáticas socioambientales, debido a su uso indiscriminado y su lenta biodegradabilidad, que afectan el medio ambiente, lo que ha incrementado la búsqueda de alternativas, que cada día están tomando más fuerza. Según la Organización de Naciones Unidas - ONU (2018), se estima que para el 2030, la producción de plástico será, aproximadamente, de 619 millones de toneladas anuales, datos inquietantes, pero que, a su vez, causan mayor interés hacia la creación de materiales biodegradables, que no contaminen el medio ambiente y beneficien el entorno.
En este sentido, es importante resaltar que el proceso de biodegradabilidad de los materiales depende de características esenciales, tal como la velocidad de degradación, donde se debe tener en cuenta las condiciones del medio, la estructura polimérica, la tipología del componente de descomposición, además de las propiedades mecánicas, físicas y químicas, como el pH, la cristalinidad, el peso molecular y la temperatura (Rodriguez, 2012; Meneses et al. 2007). Un material es catalogado como biodegradable, de acuerdo con la norma ASTM D5488-944 (ASTM, 1994), por su capacidad de descomposición, transformándose en dióxido de carbono, metano, agua y componentes orgánicos o biomasa, por medio de procesos aeróbicos o anaeróbicos (Meneses et al. 2007).
En este sentido, dentro de la naturaleza se encuentran elementos orgánicos con la característica esencial de biodegradabilidad, dentro de los cuales, se destacan los polímeros naturales, que permiten una fácil transformación en procesos agroindustriales, debido a que cuentan con una cadena orgánica (hidrocarbonada) lineal o ramificada, conformada por la unión de diversos monómeros, para formar copolímeros (Acquavia et al. 2021).
Entre los materiales poliméricos que se encuentran en la corteza terrestre se destacan el almidón y la celulosa, provenientes de diferentes partes de las plantas, como microfibras, maderas y semillas. La celulosa es considerada como uno de los polímeros naturales más abundante de la naturaleza; estructuralmente, se caracteriza por ser un polímero de elevado peso molecular y compuesto por largas cadenas de unidades de D-glucosa unidas entre sí, por enlaces β-1, 4-glucosídicos (Zielińska et al. 2021). Adicional, este polímero presenta adecuadas propiedades de gran interés tecnológico, como son la biocompatibilidad, la biodegradabilidad y la capacidad de renovación (Amalraj et al. 2018; Bahloul et al. 2021). En cuanto a su clasificación se encuentra la celulosa tipo I o nativa de origen natural, con estructura ordenada e insoluble al agua, que se subdivide en tipo monoclínica, proveniente de plantas superiores y el tipo triclínica característica de algas y bacterias. Cabe resaltar, que a partir de la celulosa nativa y por medio de tratamientos químicos, se obtienen otras clases de celulosas, como las denominadas tipo II o celulosa regenerada (Seddiqi et al. 2021).
Una de las mayores fuentes de polímeros naturales son las biomasas lignocelulósicas provenientes de la madera (Froschauer et al. 2013) y otros productos de origen vegetal, como el bagazo de caña de azúcar (Nkosivele et al. 2018), la cascarilla de arroz (Yunus, 2019), el pseudotallo de plátano (Thi Thuy Van et al. 2022), las hojas de la corona de la piña (Tanpichai et al. 2019), las cáscaras del coco (Rosa et al. 2010) o el tallo de la planta de tomate (Kassab et al. 2020b). Estos materiales son ricos en celulosa, hemicelulosa y lignina y son utilizados en una variedad de aplicaciones, como la fabricación de papel, cartón, paneles de fibra de madera y productos biodegradables.
En este punto, es significativo resaltar que algunas características de estos polímeros se pueden modificar, luego de aplicar diferentes tratamientos, como el índice de cristianización en el pseudotallo del plátano, que pasó del 57,87 al 82,14 %, después del tratamiento alcalino con hidróxido de sodio (NaOH) (Thi Thuy Van et al. 2022), o el porcentaje de cristalización de las hojas de la corona de la piña, el cual, pasó del 64,48 al 81,3 %, con tratamientos (Tanpichai et al. 2019), o el índice de cristalinidad del tallo de la planta tomate, donde el material crudo exhibió un índice de cristalinidad del 37 % y fue posible obtener microfibras de celulosa, con el 64 % de cristalinidad (Kassab et al. 2020b).
En este sentido, este artículo hace énfasis en la caracterización del epicarpio del fruto del árbol de Crescentia cujete (Bignoniaceae), con el objetivo de evaluar su uso, como polímero biodegradable. Este árbol se caracteriza por tener un aspecto leñoso y de poco follaje, una especie característica de climas tropicales (Balogun & Sabiu, 2021). Con relación a su fruto, crece directamente del tallo y puede alcanzar un diámetro que oscila entre los 5 y 35 cm, con un epicarpio duro y leñoso y un mesocarpio gelatinoso que, generalmente, se usa en aplicaciones de medicina alternativa (Espitia-Baena et al. 2011). En Colombia, el fruto de C. cujete es conocido como “totumo” y se encuentra en las regiones Andina, Amazónica, Caribe, Orinoquia y Pacífica, entre los 20 y 1.500 m s.n.m., con temperatura medias anuales, que oscilan entre los 21 y 28 °C y en diferentes ecosistemas, como bosque seco, bosque húmedo, bosque subhúmedo, parcialmente inundados, piedemonte y sabanas (Arango-Ulloa et al. 2009).
En este estudio, se presenta la caracterización estructural y morfológica del epicarpio del fruto de C. cujete, a través de difracción de rayos-X (DRX) y espectroscopia infrarroja con transformada de Fourier (FTIR), así como su comportamiento térmico, a través de calorimetría diferencial de barrido (DSC) y termogravimetría (TGA). Adicionalmente, se evalúa, bajo el desprendimiento de dióxido de carbono (CO2) y monóxido de carbono (CO), la biodegradación cualitativa del material, en condiciones controladas.
MATERIALES Y MÉTODOS
Para este estudio, el fruto del totumo fue recolectado en el municipio de Patía, de la región Pacífica colombiana. Se procedió con la extracción de la pulpa y de sus semillas, a fin de obtener el epicarpio totalmente limpio. El epicarpio, al presentar una contextura dura y quebradiza, fue sometido a un proceso de triturado manual, con el fin de disminuir su tamaño; posteriormente, se sometió a una trituración en un molino manual casero, obteniendo una muestra en polvo. Se tamizó el material, con el objetivo de obtener un particulado homogéneo y con menores dimensiones. Este proceso se realizó con tamices de malla para partículas, de 850, 600 y 425 µm. El material particulado resultante se sometió a un nuevo proceso de molienda, esta vez, en un molino de bolas de zirconio (U.S STONEWARE - OR 11413), operando a una frecuencia de 70 Hz, durante 24 h, obteniéndose un material particulado, pasante en tamiz de 106 µm.
El material en polvo del totumo fue sometido a análisis químico, a través de un espectrómetro de fluorescencia de rayos-X (FRX), por energía dispersiva marca Shimadzu EDX - 720. Para el análisis estructural, se usó un difractómetro de rayos-X marca Bruker D8 Advance ECO, usando radiación Kα de Cu (1,54 A), con paso de 0,02 º/min, en el rango de 5 a 90 en 2θ. La intensidad de los picos de difracción de los planos (002) y (100) fueron usados para determinar el índice de cristalinidad, de acuerdo con Ahvenainen et al. (2016) y por medio de medio de la ecuación 1.
Donde, I 002 es la intensidad máxima del plano de difracción (002), aproximadamente, entre 22 a 23 ° en 2θ y 𝐼 𝑎𝑚 es el pico de difracción mínimo, asociado a la parte amorfa, que se ubica en 2θ entre 18 a 19 °.
Con el fin de identificar los grupos funcionales del material se usó espectroscopia infrarroja con transformada de Fourier (FTIR), utilizando un equipo Nicolet TM IS TM 10 de Termo Fisher Scientific. Los espectros fueron tomados en el rango de 500 a 4000 cm-1, siendo las muestras preparadas en combinación con bromuro de potasio (KBr). En cuanto a la caracterización térmica se utilizó termogravimetría (TGA), usando un equipo TGA Q5000 TA Instruments. La medida se realizó en un rango de temperatura 25 a 900 ºC, con una velocidad de calentamiento de 10 ºC/min, en flujo de argón (Ar), de 25 mL/min. Adicionalmente, se realizaron medidas de calorimetría diferencial de barrido (DSC), en un equipo Netzsch DSC 200 F3 Maia, con flujo constante de Ar y a una velocidad de calentamiento de 10 oC/min. La morfología del material fue estudiada usando un microscopio electrónico de barrido SHIMADZU modelo SSX - 550.
Por otro lado, es de conocimiento que, para determinar la biodegradabilidad de un material de forma cualitativa, es importante tener en cuenta que el desprendimiento de carbono, por parte del material de estudio, es convertido en dióxido de carbono (CO2), por la actividad microbiana del inóculo. De esta forma, se implementó una cámara de observación monitoreada por un sistema de adquisición basado en Arduino, donde se realizó la medición, en partes por millón (ppm), de CO2 y CO, así como la variación de temperatura dentro de la cámara, durante un tiempo de 480 horas (20 días). Esta medición se realizó sobre muestras del polvo del epicarpio de la C. cujete, con las cuales, se conformaron, por medio de compactación uniaxial, discos de 30mm de diámetro y 5mm de altura.
RESULTADOS Y DISCUSIÓN
Caracterización morfológica. La figura 1 presenta la caracterización morfológica, a través de microscopia electrónica de barrido, del material de partida. Aquí, es posible observar el material después del proceso de molienda húmeda a temperatura ambiente en etanol, que produce un polvo altamente deformado e irregular, con una distribución de tamaño no homogénea y de morfología similar a escamas, lo cual, se asume puede ser debido al proceso previo de triturado manual.
Análisis composicional. En el análisis cuantitativo, a través de fluorescencia de rayos-X (FRX) por energía dispersiva, se evidenciaron los diferentes elementos que componen el material, notando que entre los materiales de mayor concentración están el potasio (K), con un 32,2 %; calcio (Ca), con el 25,2 % y sodio (Na), con un 15,9 %, seguidos de los materiales intermedios, como el hierro (Fe), cloro (Cl), azufre (S) y el estaño (Sn), con porcentajes del 7,2 - 6,6 - 4,3 - 3,8 %, respectivamente y, además, se encontraron algunos elementos químicos, con porcentajes menores al 2 %, como el fósforo (P), cobre (Cu), zinc (Zn) y silicio (Si).
Caracterización estructural. La figura 2a presenta el difractograma de rayos-X (DRX) del material de estudio, donde se pueden observar tres picos característicos, ubicados en los valores de 2θ alrededor de 15,7, 22,2 y 34,5 °, correspondientes a las reflexiones de los planos cristalográficos (002), (110) y (004), respectivamente. De acuerdo con Bahloul et al. (2021), estos picos son característicos de la celulosa tipo I, donde los picos alrededor de 15 ° y 34 ° son característicos de la parte amorfa del polímero, donde se encuentran la lignina y la hemicelulosa, además de la celulosa amorfa (De Dios Naranjo et al. 2017; Sandoval Arreola et al. 2022). Por otro lado, la parte cristalina de la celulosa es representada por el pico que se encuentra alrededor de los 22 ° (Ilyas et al. 2018). Con énfasis en lo anterior, se puede afirmar que el epicarpio de la C. cujete es un material semicristalino, con un porcentaje de cristalinidad del 29 %, determinado a partir de la ecuación 1, utilizando las intensidades de los picos en valores de 2θ = 22,28 y 15,76 °.
En la figura 2b, se observa el espectro FTIR realizado al polvo del totumo, exhibiendo una banda alrededor de 3452 cm-1, atribuida a la flexión O-H del agua adsorbida (Long, 2004; De Oliveira et al. 2019), así como un pico alrededor de 2922 cm-1, relacionado con las vibraciones de C-H presentes en la celulosa (De Oliveira et al. 2019). Se observa, también, una banda en 1.732 cm-1, asociada a las vibraciones de estiramiento del C=O en el acetato de la celulosa, presentes en la hemicelulosa y la lignina, que corresponden a la parte amorfa del material (Kassab et al. 2020a; Kassab et al. 2020c). La banda alrededor de 1.510 cm-1 es asociada con la hemicelulosa, por el estiramiento de C=O en acetonas no conjugadas y la lignina por el estiramiento del C=C en el anillo aromático, de acuerdo con los trabajos realizados por Shafawati & Siddiquee (2013), Lam et al. (2017), Debiagi et al. (2020) y Lin et al. (2020). La banda alrededor de 1.450 cm-1 se asocia a la flexión de CH de la celulosa y estiramiento simétrico dentro de los anillos aromáticos de polisacáridos de celulosa, además de la flexión C-H de celulosa (Zhang et al. 2017; El Achaby et al. 2018; Kassab et al. 2020a). En cuanto a la banda de 1.237 cm-1 es atribuida a las vibraciones de los estiramientos de los grupos CO de la lignina (Alemdar & Sain, 2008; Johari et al. 2016).
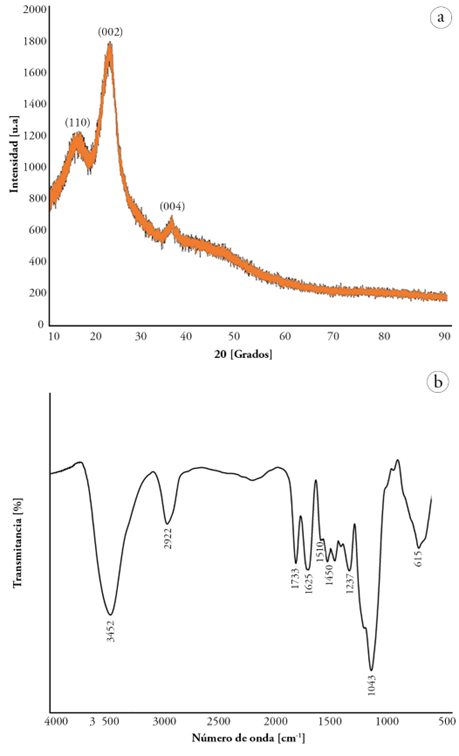
Figura 2 a) Difractograma de rayos -X del epicarpio de Crescentia cujete, mostrando los picos en 15.76 °, 22.28 ° y 34.55°, asociados a los planos (110), (002) y (004), respectivamente; b) Espectro de infrarrojo (FTIR) del epicarpio de Crescentia cujete.
Caracterización térmica. El termograma de la figura 3a está dividido en tres etapas, siendo la primera asociada a la pérdida de agua; la segunda, a la disminución de peso por medio de carbohidratos y pectinas de bajo peso molecular; la tercera etapa, a la descomposición de los polisacáridos de alto peso molecular (Araújo et al. 2020).
De esta forma, se puede evidenciar una primera pérdida de masa de alrededor de 6,88 %, entre 25-125 °C, asociada a la pérdida intermolecular de agua (Álzate Carvajal et al. 2013; Bahloul et al. 2021). A seguir, es observado un punto de estabilidad térmica entre 125-175°C, evidenciando la estabilidad térmica de procesos, en este rango de temperaturas. Para temperaturas mayores se presenta una representativa pérdida de masa, divida en tres etapas, así: entre 175 - 225 °C, una disminución del 4,73 %, seguido de 26,43 % entre 225 - 289 °C y, finalmente, una pérdida del 37,82 %, entre 290 - 375 °C.
Pelissari et al. (2014) reportan que en la región comprendida entre 220 y 300 °C ocurre la despolimerización de la hemicelulosa y la descomposición de las unidades glucosídicas de la celulosa; adicionalmente, en la región de 200 a 400 °C, se presenta la degradación de la celulosa. En este sentido, según Herrera et al. (2019), en la obtención de nanocristales de celulosa, a partir de puntas de abacá, se logró determinar que la descomposición de la celulosa se da entre 280 - 380 °C, debido a que se descomponen los enlaces β 1-4 glucosídicos, formando residuos de carbón; de la misma manera, Puttaswamy et al. (2017) presentaron la descomposición de la celulosa entre 280 - 360 °C, a partir de residuos de la cáscara de café.
Finalmente, ocurre una disminución del 23,67 % a temperaturas por encima de 385 hasta 525 °C, asociada a la degradación de la lignina (Ovalle-Serrano et al. 2018), así como la oxidación y la descomposición del residuo carbonizado (Herrera et al. 2019; Araújo et al. 2020).
En la curva de calorimetría diferencial de la figura 3b, se observa un primer proceso endotérmico, en 89,1 °C, que se extiende desde 57 hasta 106 °C, asociado la evaporación de agua. Cabe destacar que análisis sobre residuos de cascarilla de arroz (Hafid et al. 2021) y cáscara de soya (Debiagi et al. 2020) destacan que, a estas temperaturas, se presenta la evaporación de sustancias volátiles de bajo peso molecular y el agua, debido al carácter hidrofílico de los residuos lignocelulósicos. El amplio proceso endotérmico alrededor de 225 °C está relacionado con la descomposición de la hemicelulosa, presente en el material (Debiagi et al. 2020; Hafid et al. 2021). En este sentido, es reportado que la hemicelulosa es formada por varios sacáridos dispuestos en una estructura amorfa aleatoria, rica en ramificaciones, que se pueden desprender de su estructura principal, generando volátiles, tales como CO, CO2 y algunos hidrocarburos, en temperaturas entre 240 a 345 ° C (Pelissari et al. 2014).
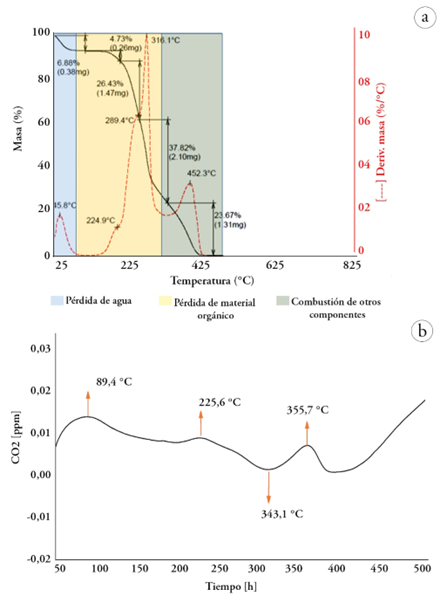
Figura 3 (a) Curva del análisis termogravimétrico y (b) Curva del análisis calorimétrico del epicarpio de la Crescentia cujete.
Por otro lado, es reportado que la celulosa está compuesta de largas cadenas de glucosa sin ramificaciones, que constituye una estructura fuerte y ordenada con mayor estabilidad térmica, razón por la cual, su temperatura de descomposición es más alta con relación a la hemicelulosa (Pelissari et al. 2014). Así, el proceso endotérmico entre 343 a 370 °C, centrado en 355 °C, se relaciona con la descomposición de la celulosa, una vez que, como es reportado en la literatura, entre 290 a 375 °C, ocurre la reducción de tamaño de las cadena de glucosa, debido a la reducción de enlaces glicosídicos, es decir, se presenta la despolimerización de la celulosa por la ruptura de las unidades glucosídicas y seguida de la formación de levoglucosano, producto de la pirólisis de la celulosa (De Dios Naranjo et al. 2017; Pech-Cohuo et al. 2018). El incremento final en la curva de DSC, para temperaturas mayores a 400 °C, puede estar asociado al proceso de descomposición y de carbonización del residuo. Se destaca que todas las reacciones están en concordancia con lo observado en los resultados de TGA/DTG.
Evaluación cualitativa de biodegradabilidad. El ensayo para evaluar la biodegradabilidad del material de forma cualitativa se realizó en cuadruplicado, en la cámara de monitoreo de gases (CO y CO2) implementada. Las figuras 4 y 5 muestran el estado de la superficie de las muestras en función del tiempo, así como la evolución de los gases (CO y CO2), en la cámara de monitoreo, respectivamente.
Durante el proceso de monitoreo del CO2 se observó variación en sus valores, mostrando que en las primeras 4 horas hay un desprendimiento de alrededor de 2315 ppm, que se le atribuye al material que sirve como inóculo (tierra + abono) y al material conformado dentro de la cámara. Estos materiales en conjunto aportan gran cantidad de dióxido de carbono, en esta primera fase, a lo que se le conoce como efecto priming; de acuerdo con García et al. (2023) es dado por el cambio de la fisiología de la comunidad microbiana, a corto plazo, en la producción de CO2. Transcurridas 60 horas del ensayo se presentó un descenso hasta 425 ppm de CO2, decrecimiento atribuible al inicio de la aparición del hongo en la superficie de las muestras; pasadas 72 horas del ensayo, todas las pastillas del totumo tienen presencia evidente de hongo (Figura 4), salvo algunas diferencias entre las pastillas del totumo conformadas, lo que se puede atribuir a su porosidad, debido a la no uniformidad del tamaño de partícula del material compactado.

Figura 4 Proceso de evolución de la superficie de las muestras de Crescentia cujete durante el proceso de biodegradación.
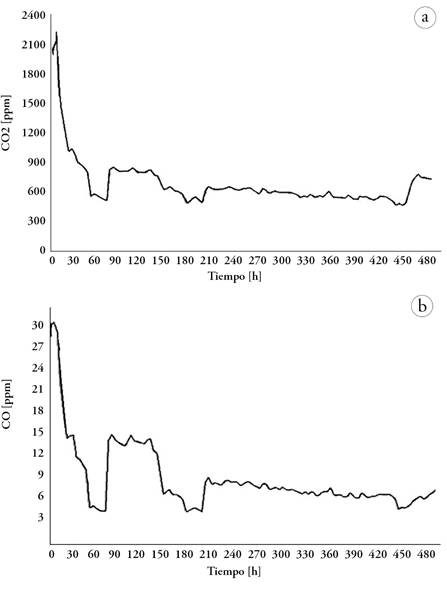
Figura 5 Evolución de la emisión de (a) CO2 y (b) CO durante el ensayo de biodegradación de la Crescentia cujete.
Posteriormente, en 96 horas, el hongo tuvo una tonalidad gris y la emisión de CO2 se mantuvo casi estable hasta las 120 horas, con un valor que varió desde 730 hasta 750 ppm, pero a diferencia que el hongo presentó una tonalidad más clara; a partir de ahí, se nota que la intensidad del hongo aumenta visualmente, siendo más blanco, como se observa al cabo de 144 horas. Siguiendo el ensayo de monitoreo de emisión de CO2 en el proceso de biodegradación, se evidenció que en 148 horas hubo una disminución de 570 ppm de CO2, conservando la tonalidad del hongo.
Posteriormente, alrededor de 190 horas, la emanación de CO2 fue de 395 ppm, aumentando hasta llegar a 200 horas, con un valor de 550 ppm. En este punto, se observa una disminución del volumen del hongo, el cual, puede ser asociado a su esparcimiento al interior del material. A partir de este momento, la emisión de CO2 presentó una variación mínima hasta llegar a las 420 horas, con una emisión de CO2 de 460 ppm, que ocurrió en paralelo con la aparición de puntos negros en la superficie de las muestras, lo cual, se prolongó hasta el fin del ensayo. La emisión del monóxido de carbono (CO), en el ensayo de biodegradación del material, presentó un comportamiento similar a la del dióxido de carbono (CO2), por lo que sus variaciones se atribuyeron al contacto inicial del material y el inóculo, así como al surgimiento del hongo en la superficie de las muestras en las primeras 180 horas de monitoreo, seguido de la presencia de puntos negros de degradación en la superficie.
En este sentido, la C. cujete, al ser considerada una biomasa lignocelulósica, que tiene una estructura semicristalina, se tiene que las enzimas del inóculo atacan, en primera instancia, la región amorfa externa, considerada una estructura débil, en comparación con la región cristalina (interna), estimada como una estructura fuerte. De esta forma, dado que esta estructura interna es menos accesible a la acción de los microorganismos, se puede dificultar su interacción; sin embargo, dado el intervalo de tiempo del estudio de biodegradación, se puede considerar que la velocidad de degradación se encuentra dentro de los intervalos iniciales conocidos de otros residuos lignocelulósicos no maderables, tales como el maíz (3-6 meses) (Pescod et al. 2010), la caña de azúcar (2-6 meses) (Prabhavathi & Ramakrishna Parama, 2019), el banano (1-2 meses) (Shafawati & Siddiquee, 2013) y el café (6-12 meses) (Campos de Bomfim et al. 2022).
Como conclusión, con base en la caracterización por medio de DRX y FTIR realizada a la C. cujete fue posible evidenciar, tanto picos asociados a planos de difracción de la parte cristalina del material como bandas de absorción asociadas a vibraciones de lignina, de hemicelulosa y de celulosa, por lo cual, es posible concluir que se trata de un material lignocelulósico semicristalino, compuesto de celulosa tipo I, con un porcentaje de cristalinidad del 29 %.
Los análisis térmicos muestran que la C. cujete presenta una estabilidad térmica hasta los 175 °C, pues hasta esta temperatura solo se evidencia pérdida de humedad del material. En temperaturas superiores, se confirman la presencia y la descomposición de la hemicelulosa y la celulosa, cuyas reacciones se encuentran en 225 y 355 °C, respectivamente.
El estudio cualitativo de biodegradabilidad del material mostró variaciones en la emisión de CO2 y CO, a partir de las 72 horas de monitoreo, tiempo que coincide con el ataque microbiano, evidenciado por la aparición del hongo en la superficie del material. Pasadas 200 horas se evidenció una disminución del volumen del hongo, asociado a su esparcimiento al interior del material, con subsecuente aparición de puntos negros en la superficie de las muestras.
De esta forma, el fruto del totumo puede ser considerado un residuo lignocelulósico, que presenta un proceso de biodegradación dentro del intervalo de inicio de otros residuos lignocelulósicos no maderables, lo que lo hace atractivo como alternativa para la extracción de celulosa y que podría llevar a la síntesis de materiales poliméricos biodegradables.