Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
TecnoLógicas
Print version ISSN 0123-7799On-line version ISSN 2256-5337
TecnoL. no.28 Medellín Jan./June 2012
Artículo de Investigación/Research Article
Efecto In Vitro del Extracto Vegetal de Ananas Comosus sobre Espermatozoides Humanos
In Vitro Effect of Ananas Comosus Extract on Human Sperm
Mélany Uribe-Clavijo1, Ángela M. Álvarez-Gómez2, Víctor Arango3, Fabian M. Cortes-Mancera4, Ángela P. Cadavid-Jaramillo5, Walter D. Cardona-Maya6
1Grupo Reproducción, Facultad de Medicina, Universidad de Antioquia, Medellín-Colombia, melany.uc@gmail.com
2Grupo Reproducción, Facultad de Medicina, Universidad de Antioquia, Medellín-Colombia, alelamaria@gmail.com
3Grupo Productos Marinos, Universidad de Antioquia, Medellín-Colombia, victorarango@msn.com
4Grupo de Investigación en Innovación Biomédica SINERGIA, Facultad de Ciencias Exactas y Aplicadas, Instituto Tecnológico Metropolitano (ITM), Medellín-Colombia, fabiancortes@itm.edu.co
5Grupo Reproducción, Facultad de Medicina, Universidad de Antioquia, Medellín-Colombia, angelap.cadavid@gmail.com
6Grupo Reproducción, Facultad de Medicina, Universidad de Antioquia, Medellín-Colombia, wdcmaya@medicina.udea.edu.co
Fecha de recepción: 19 de julio de 2011 / Fecha de aceptación: 10 de abril de 2012
Resumen
Los espermicidas se han usado para el control de la natalidad, sin embargo sus componentes químicos son nocivos para el epitelio vaginal, por lo que se han realizado estudios planteando la posibilidad del uso de extractos de diferentes plantas como agentes espermicidas que eviten un daño en el tejido vaginal. El objetivo del presente estudio fue evaluar el efecto del extracto dela piña (Ananas comosus) sobre espermatozoides humanos.Las muestras de semen se incubaron con los extractos de piña y se evaluó el efecto sobre la movilidad y la viabilidad espermática. Adicionalmente, la citotoxicidad del extracto fue determinada mediante el ensayo de MTS sobre la línea celular epitelial HeLa. La movilidad (p<0,001) y la viabilidad (p<0,001) disminuyeron después del contacto con el extracto en una dilución del 50%, sin embargo el extracto presentó un efecto citotóxico sobre la línea celular epitelial. En conclusión, a pesar del efecto citotóxico del extracto observado a las concentraciones con efecto espermicida, más estudios que determinen las fracciones del extracto que tienen propiedades espermicidas son necesarios.
Palabras clave: Espermatozoide; espermicida; Ananas comosus; anticoncepción; hiperactivación.
Abstract
Spermicides has been used for birth control, but its chemical components are harmful for the vaginal epithelium, thus other studies have been done, given the possibility to use different extracts from plants as spermicidal agents that avoid vaginal tissue damages. The aim of this study was to evaluate the Ananas comosus extract as spermicidal. Semen samples were incubated with pineapple extract, and motility and viability was evaluated after contact. In addition the cytotoxic effect was evaluated using MTS assay on HeLa cells. Motility (p<0.001) and viability (p<0.001) decreased after treatment with 50% dilution. However, extract had a cytotoxic effect on epithelial cell line. In conclusion, despite the cytotoxic effect in the same concentrations that spermicidal activity was observed, further studies determining the fractions of the extract have spermicidal properties are necessary.
Keywords: Spermatozoa; spermicides; Ananas comosus; contraception; hyperactivation.
1. Introducción
Según informa la Encuesta Nacional de Demografía y Salud del año 2005, ENDS-2005, realizada por Profamilia, Colombia tendría una tasa global de fecundidad de 1,7 hijos, en lugar de la observada de 2,4 si todos los nacimientos no deseados se hubieran evitado (Profamilia, 2005). Esto puede explicarse por los múltiples factores que inducen a no usar algún método anticonceptivo: temor a subir de peso, vergüenza al comprarlos, el desconocimiento, o la falta de dinero para adquirirlos (Baeza, 2007 et al., 2007). La decisión de seleccionar un anticonceptivo depende de una serie de mitos, del entorno familiar, económico y de la información que se tenga sobre cada uno de los métodos disponibles (Zuleta, 2008). Es importante recalcar que los métodos anticonceptivos reducen la mortalidad materna y mejoran la salud de las mujeres al prevenir tanto los embarazos no deseados como los de alto riesgo, reduciendo la necesidad de abortos practicados sin garantía de inocuidad (OMS, 1995).
Los espermicidas son un método anticonceptivo de barrera química que evitan la entrada de los espermatozoides al cérvix, evitando la fecundación mediante su inmovilización o muerte mientras ascienden por el tracto reproductivo femenino en busca del oocito (Grimes et al., 2005). Los diferentes componentes de los espermicidas actuales carecen de especificidad celular, lo que significa que no sólo afecta a las células espermáticas sino también a las células superficiales del tejido (Aitken et al., 2011). Es por esto que en diferentes investigaciones se plantea la posibilidad del uso de extractos de plantas como agentes espermicidas incluyendo extractos de maracuyá (Alvarez-Gómez et al., 2010), jugo de limón (Clarke et al., 2006), piña (Alvarez-Gomez et al., 2007), extractos de Sapindus saponaria (Ospina et al., sometido), el colorante extraído de la cúrcuma (Naz, 2011) y extractos de hojas de neem (Khillare & Shrivastav, 2003) cuya finalidad sería la misma de los espermicidas existentes: evitar la concepción por medio de la muerte o inmovilización de los espermatozoides, pero evitando el daño en el epitelio vaginal.
La piña o Ananas comosus es un fruto perteneciente a la familia Bromeliaceae; esta familia está constituida por aproximadamente 2794 especies y 56 géneros que se han adaptado a un amplio rango de hábitats: desde la sombra al sol, desde trópicos húmedos y calientes hasta los fríos y secos subtrópicos (Australian Government, 2008). Todas las bromelias son originarias de Sur América, más específicamente de Brasil, Paraguay, Argentina, Colombia y Guyanas (León, 1968). El objetivo de este estudio fue evaluar la capacidad del extracto de Ananas comosus para inmovilizar o matar los espermatozoides humanos.
2. Materiales y métodos
2.1 Muestras de semen
Las muestras de semen de 15 voluntarios aparentemente sanos, fueron colectadas mediante masturbación después de 3-5 días de abstinencia sexual. Las muestras se evaluaron entre 30 y 60 minutos después de colectadas, luego de la licuefacción, para determinar la viabilidad, la movilidad, el pH y la concentración espermática de acuerdo a lo establecido en el manual para el análisis seminal de la Organización Mundial de la Salud (WHO, 2010). Este estudio fue aprobado por el comité de ética de la Sede de Investigación Universitaria de la Universidad de Antioquia.
Inicialmente, 10 µL de la muestra de semen fueron usados para evaluar la movilidad utilizando un objetivo de 40X en un microscopio Eclipse Nikon® E200MV. Los espermatozoides fueron clasificados según su movilidad en movilidad tipo I: movimiento progresivo; movilidad tipo II: movimiento no progresivo y movilidad tipo III: inmóviles. Para evaluar la viabilidad, otros 10 µL de semen se mezclaron con 10 µL de eosina-Y al 0,5% (IHR Diagnóstica®, Colombia) y se analizaron 100 espermatozoides, los espermatozoides vivos quedaron incoloros y los muertos se tiñeron de rojo. Adicionalmente se determinó la concentración espermática por conteo en la cámara de Makler (Cardona-Maya et al., 2008).
Para el estudio, se seleccionaron muestras de semen con una movilidad Tipo I mayor al 50% y una viabilidad mayor del 70%.
2.2 Extracto de Ananas Comosus
A la fruta de Ananas comosus (piña) obtenida en un mercado local de la ciudad de Medellín (Fig. 1), se le removió la cáscara, el tallo y el corazón para ser procesada posteriormente en una licuadora. El extracto obtenido fue filtrado seis veces en gasa y algodón estériles. Una parte del extracto total se guardó en viales de 1,5 mL y la otra mitad del extracto se centrifugó a 2800rpm/15min; el sobrenadante se filtró nuevamente con un filtro de poros de 2,2µm de diámetro (Advantec®, Japón) y se guardó también en viales de 1,5 mL. Todos los viales obtenidos se almacenaron a -20°C, protegidos de la luz hasta su uso.
2.3 Efecto del extracto total y del sobrenadante de A.comosus
Las muestras de semen de los individuos fueron mezcladas con el extracto total, previa medición del pH, iniciando con una concentración del 50% v/v (35 µL semen + 35 µL extracto total). El efecto del extracto o del sobrenandate fue medido en función del tiempo (20 segundos, 3 y 5 minutos) cuantificando la movilidad y la viabilidad en cada tiempo de exposición. Después de cada evaluación se realizó un control de la movilidad y la viabilidad inicial de espermatozoides sin extracto.
2.4 Concentración mínima efectiva (CME)
Se realizaron diluciones con el sobrenadante en solución salina de manera que las concentraciones fueran del 50%, 25% y 12,5% para incubarlas con las muestras de semen. Posteriormente, se determinó el efecto de cada dilución sobre la movilidad y la viabilidad de espermatozoides humanos en cada tiempo de exposición (20 segundos, 3 y 5 minutos). El efecto final se determinó en una proporción 1:1 con cada dilución y la muestra de semen, quedando así a una concentración final real del 25%, 12,5% y 6,25% en cada mezcla, respectivamente.
2.5 Marcha fitoquímica
Esta prueba permitió determinar cualitativamente la presencia de diferentes compuestos en el extracto del fruto de piña: flavonoides, aminoácidos, compuestos fenólicos, taninos, compuestos cardiotónicos, saponinas y alcaloides mediante protocolos establecidos previamente en el Laboratorio de Productos Marinos de la Universidad de Antioquia. Brevemente, para la realización de las pruebas, 50 mL del extracto se llevaron a un rotaevaporador con el fin de evaporar el agua contenida y obtener el extracto concentrado. Para la detección de: 1) flavonoides, se redisolvió una porción del concentrado en etanol puro más magnesio y ácido clorhídrico; 2) aminoácidos, se impregnó papel filtro con el concentrado del extracto, se le adicionó ninhidrina y se llevó a una plancha de calentamiento; 3) compuestos fenólicos, se utilizó FeCl3; 4) cardiotónicos, se evaluaron mediante el ensayo de Kedde; 5) saponinas, se realizó mediante agitación del tubo; 6) alcaloides, se redisolvió en HCL y se adicionó una gota de los reactivos de Dragendorff, Mayer, Valser y Reineckato (1 reactivo por tubo). Para la realización de las identificaciones, cada ensayo tuvo sus respectivos controles positivos y negativos.
2.6 Evaluación de la citotoxicidad celular del extracto de A.comosus
El efecto citotóxico del sobrenadante del extracto del fruto se determinó mediante el ensayo colorimétrico MTS para determinar la viabilidad celular. Éste está basado en la biorreducción de tetrazolio a formazán (Promega Cell Titer 96® AQueous Non- Radioactive Cell Proliferation Assay) y la cantidad de compuesto biorreducido se mide en un lector universal de microplatos (Elx800 NB, Bio-Tek Instruments, Inc., Winooski, VT, USA) a 490nm. Brevemente, se sembraron 3 x 103 células/por pozo de la línea celular epitelial HeLa en un plato de 96 pozos de fondo plano, en medio RPMI-1640 (Invitrogen Gibco, USA) con L-glutamina, suplementado con Suero Bovino Fetal (SBF, Invitrogen Gibco, USA) al 10%, penicilina-estreptomicina al 1% y gentamicina al 1% (Invitrogen Gibco, USA). Después de una incubación a 37ºC/5% CO2 de 12h, se retiró el medio de cultivo y se agregaron 100µL de cada estímulo por triplicado utilizando PBS como control positivo, medio enriquecido con SBF 10% como control negativo, RPMI sin SBF como blanco y el sobrenadante del extracto de A. Comosus a una concentración del 50% diluido con RPMI sin SBF. Los platos se incubaron durante 6, 12 y 24 horas a 37°C/CO2 al 5%, posteriormente se agregaron 20µl de MTS, se incubó por tres horas y fue leído.
El porcentaje de la viabilidad celular se calculó usando (1) previamente reportada por Shadeghi et al. (2008):

2.7 Análisis estadístico
Para evaluar el efecto del extracto de Ananas comosus sobre los espermatozoides humanos, se realizó una comparación entre grupos, utilizando una ANOVA no paramétrica (Kruskal-Wallis) y el post-test de Dunn mediante el software Prism 5,0.
3. Resultados
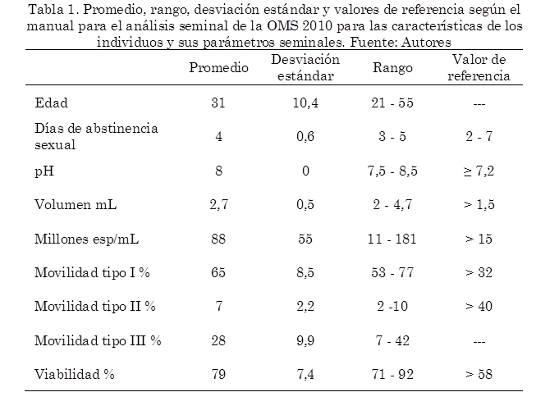
Previo al análisis del efecto del extracto de piña sobre los espermatozoides humanos de cada muestra, se determinó el pH, el volumen, la concentración espermática, la viabilidad, la movilidad para establecer los valores iniciales de cada muestra y ser considerados como los controles. Paralelamente, la edad en años y los días de abstinencia de cada individuo fueron incluidos. La Tabla 1 muestra los valores iniciales para cada uno de estos parámetros.
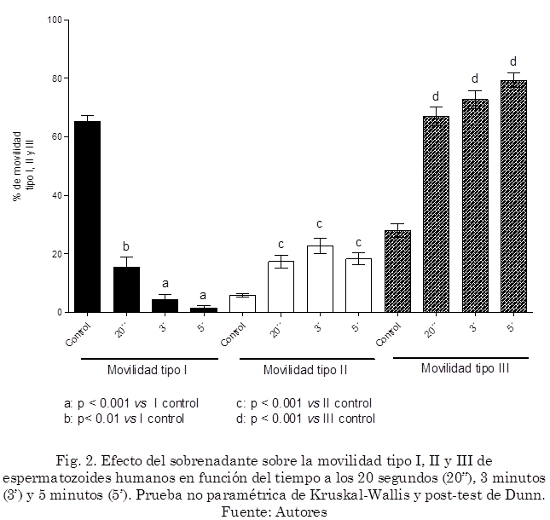
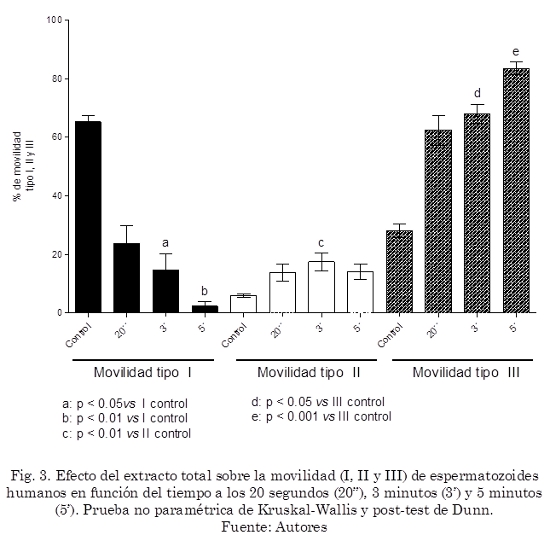
Al incubar los espermatozoides humanos con el extracto total y el sobrenadante de Ananas comosus a una concentración del 50% v/v (proporción 1:1), se detectó una marcada disminución en la movilidad desde la primera observación a los 20 segundos que continuó hasta los 5 minutos, lo que se ve reflejado en un aumento de los espermatozoides con movilidad tipo III (p< 0.001), (Fig. 2 y 3).
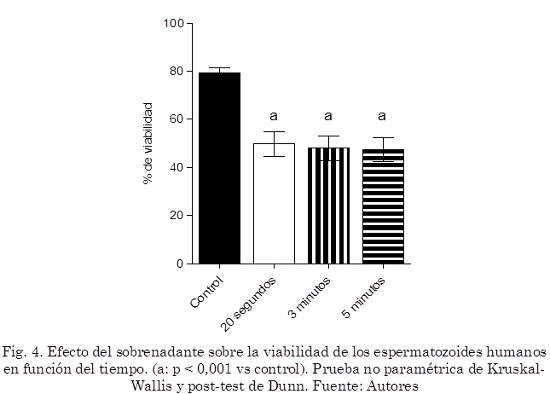
La viabilidad disminuyó notablemente al incubar los espermatozoides con el sobrenadante (p< 0,001, Fig. 4). La viabilidad no se evaluó con el extracto total debido a la presencia de grumos al agregar la eosina-Y lo que imposibilitó la visualización adecuada del colorante en los espermatozoides.
Las diluciones al 50% y al 25% del extracto no alteraron los patrones de movilidad ni viabilidad. La dilución al 12,5% mostró una tendencia a la hiperactivación espermática 20 minutos después de contacto con el extracto.
La marcha fitoquímica utilizada para la detección de los metabolitos presentes, sólo identificó la presencia de aminoácidos. Las pruebas para flavonoides, compuestos fenólicos, taninos, compuestos cardiotónicos, saponinas y alcaloides fueron negativas.
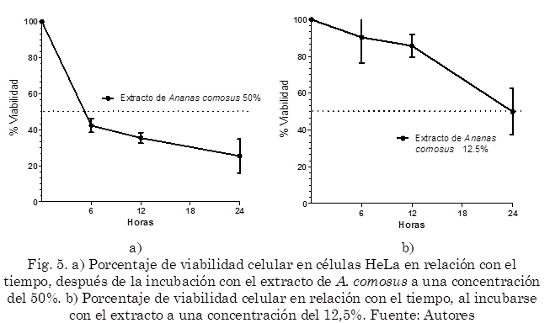
Respecto a la prueba de citotoxicidad celular, el extracto disminuyó el número de células viables a menos del 50% después de 6 horas de incubación, y continuó disminuyendo hasta aproximadamente el 25% a las 24 horas (Fig. 5a). En contraste, la concentración al 12,5% disminuyó la viabilidad al 50% al cabo de 24 horas. (Fig. 5g).
4. Discusión
La piña es una fuente de manganeso y calcio, contiene cantidades significativas de vitaminas (Australian Government, 2008) y tiene como componente característico, la bromelina, una enzima proteolítica utilizada en la industria alimenticia (García & Serrano, 2005). Además se le han atribuido otras propiedades como inmunomodulación (Hale & Haynes, 1992); inhibición de la agregación plaquetaria, actividad antitrombótica y fibrinolítica; uso medicinal en bronquitis, sinusitis, traumas quirúrgicos, tromboflebitis y pielonefritis (Maurer, 2001). Los hallazgos del presente estudio indican que la viabilidad espermática a pesar de verse afectada no disminuye totalmente en función del tiempo y podría ser debido a que el pH del extracto no es lo suficientemente bajo para destruir la membrana de los espermatozoides ya que éstos son células con una membrana especial que deben estar preparados para enfrentar condiciones adversas como el pH ácido de la vagina. Los demás componentes del extracto son similares a los iones a los que el espermatozoide está expuesto durante su viaje por el tracto reproductivo femenino (Aranha et al., 2008) y al parecer este medio ácido y rico en moléculas no es nocivo para la célula espermática. En contraste, esta ligera disminución del pH parece ser suficiente para inhibir la actividad de la dineína ATPasa, enzima que se define como el motor intracelular de la movilidad espermática (Vivenes et al., 2009), permitiendo así observar una disminución de la movilidad en los espermatozoides humanos tratados con el extracto total de piña y el sobrenadante.
De otro lado, la evaluación de la actividad citotóxica en la línea celular HeLa evidenció que el extracto al 50% disminuye su viabilidad a menos de la mitad en las primeras 6 horas de contacto con el extracto y que en contraste, a la concentración de 12,5% el efecto deletéreo no se presentó. Este resultado reafirma la importancia que tiene evaluar el posible efecto citotóxico que tengan los compuestos candidatos a ser productos espermicidas, pues en este caso, aunque el extracto de A. comosus tiene actividad espermicida por reducir la movilidad espermática, su efecto debe ser selectivo para que pueda considerarse como una propuesta para un espermicida de origen vegetal. En contraste, este efecto no se observó con el extracto al 12,5%, además el uso de esta concentración del extracto permitió observar un efecto muy interesante de activación en los espermatozoides, que si bien no hacía parte del objetivo inicial del estudio es un valioso hallazgo.
La hiperactivación espermática hace parte del proceso de capacitación y está caracterizada por un aumento en el bateo de la cola que le permite abrirse paso más fácilmente para poder penetrar la zona pelúcida (Suarez, 2008); este fenómeno es necesario para la fertilización exitosa e involucra algunos iones entre los que se encuentra el calcio como uno de los más importantes (Darszon, 2008). En un estudio se reportó hiperactivación en los espermatozoides del lagarto Mabuya carinata al ponerlos en contacto con bajas concentraciones de calcio, sodio y potasio indicando que estos iones a concentraciones óptimas tienen un efecto estimulatorio en la movilidad espermática (Aranha et al., 2008). En nuestro estudio, con la dilución del extracto al 12,5% se observó una tendencia a la hiperactivación de los espermatozoides después de una incubación de 20 minutos; es probable que algunos iones que se hallan diluidos en la piña puedan estar implicados en este evento celular y sus propiedades puedan ser exploradas en otro contexto reproductivo.
5. Conclusiones
En conclusión, el extracto del fruto total y del sobrenadante presentaron un efecto espermicida, aunque el extracto de A.comosus inmoviliza los espermatozoides, mostró un efecto citotóxico en las células de la línea celular epitelial HeLa disminuyendo su viabilidad a menos del 50% en las primeras 6 horas de contacto con el extracto. En contraste, a la concentración de 12,5% el efecto deletéreo no se presentó lo cual permite plantear la posibilidad que, a diferencia de nuestra hipótesis, la piña no pueda ser vista como un agente espermicida pero si como un activador espermático, aunque nuevas aproximaciones metodológicas son necesarias para corroborar este proceso, con el fin de poder activar los espermatozoides durante los procesos de reproducción asistida y aumentar la probabilidad de obtener embarazos.
6. Agradecimientos
Por el apoyo económico a la Universidad de Antioquia (Sostenibilidad 2011-2012) y al INSTITUTO TECNOLÓGICO METROPOLITANO (ITM) (Proyecto código P10241). Ángela María Álvarez y Walter Cardona Maya fueron becarios de Colciencias.
Referencias
Aitken, R. J., Carey, A. J., & Beagley, K. W. (2011). Dual purpose contraceptives: targeting fertility and sexually transmitted disease. J Reprod Immunol. 88(2):228-32 [ Links ]
Álvarez-Gómez, A. M., Cardona-Maya, W. D., Castro-Alvarez, J. F., Jimenez, S., & Cadavid, A. (2007). Colombian plants with spermicidal activity, new options in anticonception: brief review. Actas Urol Esp, 31(4), 372-381. [ Links ]
Álvarez-Gómez, A. M., Cardona-Maya, W., Forero, J., & Cadavid, A. P. (2010). Human Spermicidal Activity of Passiflora edulis Extract. Journal of Reproduction and Contraception, 21(2), 95-100. [ Links ]
Aranha, I., Bhagya, M., & Yajurvedi, H. N. (2008). Concentration of cations in different parts of male reproductive system and their influence on in vitro sperm motility in lizard, Mabuya carinata Schneider. Indian J Exp Biol, 46(10), 720-724. [ Links ]
Australian Government, Departament of Health and AgeingOffice of the Gene Technology Regulator. (2008). The Biology of Ananas comosus var. comosus (Pineapple). http://www.ogtr.gov.au/internet/ogtr/publishing.nsf/content/pineapple-3/$FILE/biologypineapple08_2.pdf [ Links ]
Baeza, B., Poo, A. M., Vásquez, O., Muñoz, S., & Vallejos, C. (2007). Identificación de factores de riesgo y factores protectores del embarazo en adolescentes de la novena región. Rev Chil Obstet Ginecol, 72(2), 76-81. [ Links ]
Cardona-Maya, W., Berdugo, J., Cadavid A. (2008) Comparación de la concentración espermática usando la cámara de Makler y la cámara de Neubauer. Actas Urol Esp, 32(4), 443-445. [ Links ]
Clarke, G. N., McCoombe, S. G., & Short, R. V. (2006). Sperm immobilizing properties of lemon juice. Fertil Steril, 85(5), 1529-1530. [ Links ]
Darszon, A. (2008). Canales, iones y cómo el espermatozoide interpreta los mensajes del óvulo. In c. Instituto de Biotecnología de la UNAM 25 aniversario (Ed.), Una ventana al quehacer científico (pp. 29-42). México, DF: UNAM. [ Links ]
García, M. D., & Serrano, H. (2005). La piña, Ananas comosus (L.) Merr. (Bromeliaceae), algo más que un fruto dulce y jugoso. ContactoS, 56, 55-61. [ Links ]
Grimes, D. A., Lopez, L., Raymond, E. G., Halpern, V., Nanda, K., & Schulz, K. F. (2005). Spermicide used alone for contraception. Cochrane Database Syst Rev(4), CD005218. [ Links ]
Hale, L. P., & Haynes, B. F. (1992). Bromelain treatment of human T cells removes CD44, CD45RA, E2/MIC2, CD6, CD7, CD8, and Leu 8/LAM1 surface molecules and markedly enhances CD2-mediated T cell activation. J Immunol, 149(12), 3809-3816. [ Links ]
Khillare, B., & Shrivastav, T. G. (2003). Spermicidal activity of Azadirachta indica (neem) leaf extract. Contraception, 68(3), 225-229. [ Links ]
León, J. (1968). Fundamentos Botánicos de los Cultivos Tropicales (1 ed.). Lima, Peru: Instituto Interamericano de Ciencias Agrícolas de la O.E.A. [ Links ]
Maurer, H. R. (2001). Bromelain: biochemistry, pharmacology and medical use. Cell Mol Life Sci, 58(9), 1234-1245. [ Links ]
Naz, R. K. (2011). Can Curcumin Provide an Ideal Contraceptive? Molecular Reproduction & Development, 78, 116-123. [ Links ]
OMS, (1995). Beneficios de la planificación familiar para la salud. Ginebra. [ Links ]
ONU. (2010). Objetivos de Desarrollo del Milenio, Informe 2010. [ Links ]
Ospina, L., Alvarez-Gomez, A. M., Arango, V., Cadavid, A., & Cardona-Maya, W. D. (Sometido). Evaluación de la actividad espermicida del extracto de la planta Sapindus saponaria. [ Links ]
Profamilia, (2005). Encuesta Nacional de Demografía y Salud. 111-140. [ Links ]
Shadeghi A, Ghasemi N, Kohi M. Cytotoxic effect of Convolvus arvensis extracts on human cancerous cell line. Research in Pharmaceutical Sciences. 2008;3(1):31-4. [ Links ]
Suarez, S. (2008). Control of hyperactivation in sperm. Human Reproduction Update, 14(6), 647-657. [ Links ]
Vivenes, C. Y., Peralta-Arias, R. D., Camejo, M. I., Guerrero, K., Fernandez, V. H., Pinero, S., et al. (2009). Biochemical identification of dynein-ATPase activity in human sperm. Z Naturforsch C, 64(9-10), 747-753. [ Links ]
WHO, (2010). WHO Laboratory Manual for the Examination and Processing of Human Semen, 5th ed. Geneva: World Health Organization. [ Links ]
Zuleta Tobón, J. J. (2008). Anticoncepción: ¿Cuál método seleccionar? IATREIA, 21, 280-291. [ Links ]