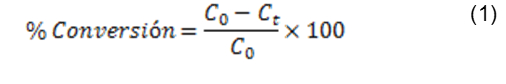Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
TecnoLógicas
Print version ISSN 0123-7799On-line version ISSN 2256-5337
TecnoL. vol.19 no.37 Medellín July/Dec. 2016
Artículo de investigación/Research article
Catalizadores homogéneos y heterogéneos de Fe3+, Co2+ y Cu2+ para la degradación de metilparatión en medio acuoso diluido
Homogeneous and heterogeneous catalysts of Fe3+, Co2+ and Cu2+ for the degradation of methyl parathion in diluted aqueous medium
Cindy A. Vela-Monroy1, Martha J. Saavedra-Alemán2, José G. Carriazo-Baños3
1Química, M. Sc. Ingeniería Física Industrial. Universidad Autónoma de Nuevo León, Nuevo León- México, alexa.vela31@gmail.com
2M.Sc. Química. Departamento de Química, Facultad de Ciencia y Tecnología, Universidad Pedagógica Nacional, Bogotá-Colombia, msaavedra@pedagogica.edu.co
3Ph.D. en Química del Estado Sólido y Catálisis Heterogénea. Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá-Colombia, jcarriazog@unal.edu.co
Fecha de recepción: 21 de septiembre de 2015/ Fecha de aceptación: 4 de mayo de 2016
Como citar / How to cite
C.A. Vela-Monroy, M.J. Saavedra-Alemán y J.G. Carriazo-Baños, "Catalizadores homogéneos y heterogéneos de Fe3+, Co2+ y Cu2+ para la degradación de metilparatión en medio acuoso diluido",Tecno Lógicas, vol. 19, no. 37, pp. 13-28, 2016.
Resumen
La degradación de pesticidas (plaguicidas, herbicidas, fungicidas, entre otros) en medio acuoso constituye un tema de enorme importancia que contribuye a asegurar la calidad del agua de numerosas fuentes hídricas. En el presente trabajo se realizó la evaluación de sistemas catalíticos homogéneos (iones metálicos en solución) y heterogéneos (óxidos soportados en alúmina), basados en Fe3+, Co2+ y Cu2+, en la oxidación (degradación) del plaguicida metilparatión en medio acuoso, empleando peróxido de hidrógeno como oxidante bajo condiciones suaves de reacción (25 ºC y presión atmosférica). Los sólidos se caracterizaron por difracción de rayos X y microscopía electrónica de barrido (SEM). El sistema Fe3+/H2O2 (sistema Fenton) constituye el catalizador homogéneo más activo, en comparación con los sistemas Co2+/H2O2 y Cu2+/H2O2. Los sólidos conformados por óxidos de cobalto, cobre o hierro y óxidos mixtos soportados en alúmina mostraron actividad catalítica a pH muy cercano a la neutralidad. Los sistemas mixtos Fe-Co-Cu/Al2O3, Co-Cu/Al2O3 y Fe-Co/Al2O3 fueron los sólidos de máxima actividad catalítica. Adicionalmente, se observó la influencia del soporte (d-Al2O3) en el pH del medio de reacción, permitiendo el acercamiento de dichos valores a la neutralidad y con ello favoreciendo la actividad catalítica de los óxidos de cobalto y de cobre. Los resultados del presente estudio permiten avanzar en una nueva ruta de búsqueda de catalizadores para la eliminación de pesticidas organofosforados contaminantes de aguas residuales.
Palabras clave: Degradación de metilparatión, óxido de hierro, óxido de cobalto, óxido de cobre, catalizadores heterogéneos.
Abstract
Degradation of pesticides (plaguicides, herbicides, fungicides, among others) in aqueous media is a subject of great importance for ensuring the water quality into numerous hydric sources. This work reports the assessment of homogeneous (metal ion solutions) and heterogeneous (oxides supported on alumina) systems that are based on Fe3+, Co2+ y Cu2+, which were used as catalysts for oxidation (degradation) of methyl parathion (a plaguicide) in aqueous solution. Hydrogen peroxide was herein used as oxidizing molecule under mild condition of reaction (25 ºC and atmospheric pressure). The solids were characterized by X-ray diffraction (XRD) and scanning electron microscopy (SEM). Fe3+/H2O2 (Fenton system) was the most active homogeneous catalyst compared to Co2+/H2O2 and Cu2+/H2O2 systems. Solids catalysts such as cobalt, copper or iron oxides as well as mixed oxides supported on alumina were active at pH close to neutrality. Fe-Co-Cu/Al2O3, Co-Cu/Al2O3 and Fe-Co/Al2O3 mixed systems were solids with the highest catalytic activity. In addition, an important effect of the support (d-Al2O3) on the reaction pH was observed, allowing to reach values close to that of the neutrality, and thus increasing the catalytic activity of both cobalt oxide and copper oxide species. These results allow advancing on a new pathway for searching catalysts to remove organophosphorous pesticides from residual waters.
Keywords: Methyl parathion degradation, iron oxide, cobalt oxide, copper oxide, heterogeneous catalysts.
1. Introducción
El desarrollo de industrias de tipo agroquímico se ha incrementado drásticamente en las últimas décadas, como resultado de la intensificación mundial de las actividades agrícolas, incrementado también el uso generalizado de pesticidas y la disposición inadecuada o tratamiento incipiente de los residuos [1]. Las industrias agroquímicas de pesticidas producen aguas residuales que contienen compuestos altamente tóxicos y no biodegradables que son persistentes, aún después de tratamientos convencionales de purificación. Las diferentes categorías de pesticidas incluyen, insecticidas, fungicidas, herbicidas y bactericidas [2], [3]. La generación de desechos acuosos durante la formulación, distribución y aplicación de plaguicidas, muchas veces es inevitable. Desde hace más de tres décadas se han realizado diferentes aportes para degradar contaminantes orgánicos que afectan tanto los efluentes superficiales como los subterráneos, pero la contaminación ambiental debida a la permanencia de plaguicidas en los sistemas acuíferos es un problema generalizado con importantes consecuencias ecológicas y en la salud humana de las poblaciones expuestas a las fuentes de agua contaminadas por actividades agrícolas, como cultivos y aguas de vertimiento de agroindustrias o de industrias agroquímicas. Es por ello que diversos países han implementado programas enfocados hacia el desarrollo de tecnologías útiles para reducir el vertimiento de pesticidas en aguas residuales [4], [5].
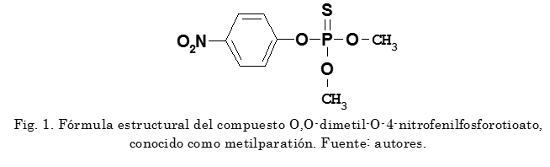
Los pesticidas organofosforados han sido y aún son ampliamente producidos y usados en todo el mundo [6]-[8]. El metilparatión (Fig. 1) es un pesticida organofosforado introducido en el mercado agrícola a principio de los años cincuenta (1950) y es utilizado en el control de insectos que atacan un amplio sector de los cultivos vegetales [9]. Es un compuesto muy tóxico, clasificado como un pesticida "extremadamente peligroso" por la Organización Mundial de la Salud y que podría llegar a constituir un problema de salud pública [9], [10]. El efecto tóxico del metilparatión sobre los animales ocurre debido a la inhibición de la enzima acetilcolinesterasa (enzima que hidroliza la acetilcolina, un neurotransmisor) en los tejidos nerviosos, por lo que también presenta una alta toxicidad para los seres humanos [9], [11], [12]. Cuando este insecticida organofosforado es liberado en el suelo, genera efectos adversos sobre la diversidad funcional de la microflora existente, afectando su fertilidad. Además, presenta movilidad poco apreciable, aumentando el riesgo de contaminación y su persistencia en los suelos y en los mantos acuíferos.
En la actualidad, los métodos empleados para la remoción de contaminantes orgánicos en medio acuoso incluyen procedimientos como la adsorción sobre carbón activado u otro tipo de adsorbentes [13], [14], filtración en membrana [15], oxidación húmeda [16], ozonación [17], floculación [18], fotocatálisis [19] o métodos biológicos [20], los cuales presentan grandes limitaciones puesto que se ven afectados por varios factores como la concentración, la presencia de compuestos nocivos para microorganismos degradadores y costos elevados en algunos casos [21], [22]. Todos estos métodos se han experimentado con el objeto de alcanzar la remoción de metilparatión de aguas residuales y suelos [12], [18], [19], [23]. Específicamente, la degradación de metilparatión (destrucción oxidativa) ha sido ampliamente estudiada por diversos métodos de oxidación que han mostrado su difícil mineralización, entre ellos los métodos de oxidación húmeda y de degradación fotoquímica. Se destacan los procesos avanzados de oxidación (PAOs), en los que se incluyen los procesos Fenton, tipo Fenton y procesos catalíticos y fotocatalíticos empleando moléculas oxidantes como O3 o H2O2 [3], [5], [9], [24]. Los PAOs se caracterizan por la generación in situ de radical hidroxilo (•OH) y perhidroxilo (HO2•), que atacan las moléculas orgánicas para oxidarlas a CO2 y H2O [9], [21], [22], [25]. En este proceso, estos radicales libres son muy poco selectivos y reaccionan con la gran mayoría de compuestos orgánicos en solución. En los últimos años se han estudiado intensamente los procesos avanzados de oxidación, dado que constituyen una alternativa muy promisoria para el tratamiento de aguas residuales [4], [25]. Debido a la elevada dificultad para degradar las moléculas de pesticidas organofosforados en medio acuoso, se han empleado varias combinaciones de métodos químicos y físicos que inducen el aumento en la producción de radicales libres activos en los PAOs. Por ello, en algunos trabajos científicos enmarcados en este contexto, se combinan los procesos Fenton y tipo Fenton con radiación UV (foto-Fenton) o asisten dichos procesos con ultrasonido (sono-Fenton), microondas o corrientes eléctricas (electro-Fenton). Trabajos recientes muestran diversos esfuerzos para degradar pesticidas organofosforados por esta vía; así, Kouraichi et al. [26] estudiaron la oxidación catalítica heterogénea de metilparatión empleando arcillas pilarizadas y H2O2 (proceso tipo Fenton), asistiendo dicho proceso con una fuente de ultrasonido. Otros autores [27] han empleado procesos electro-Fenton para degradar metilazinfós y procesos foto-Fenton asistidos con radiación de microondas para eliminar el plaguicida clorfenvinfós en medio acuoso [28]. Sin embargo, aunque estos procesos son alternativas promisorias, la mineralización del pesticida sigue siendo incompleta o las condiciones de oxidación son muy drásticas, lo cual genera un incremento en los costos debido al uso adicional de energía o de concentraciones de peróxido de hidrógeno muy elevadas.
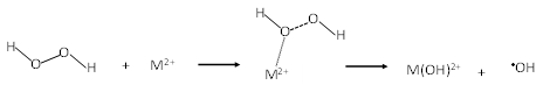
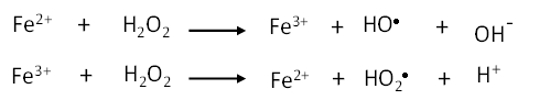
La reacción Fenton clásica, para las especies Fe(II)/Fe(III), o tipo Fenton para iones metálicos diferentes (M2+, como es el caso de Cu2+ y Co2+), presenta el siguiente mecanismo de activación (en forma resumida) del peróxido de hidrógeno, en el que inicialmente la molécula de H2O2 se polariza y finalmente se disocia homolíticamente como consecuencia de la fuerte atracción con el ion metálico, con posterior transferencia electrónica desde el ion metálico hacia una fracción de la molécula:
M2+ representa el ion metálico. Para el caso del hierro:
En la primera etapa de la reacción, típicamente se forma el radical hidroxilo (HO•), y en una etapa posterior el peróxido de hidrógeno reduce al ion metálico (a su carga inicial), completando el ciclo de la especie catiónica y permitiendo la formación del radical perhidroxilo (HO2•).
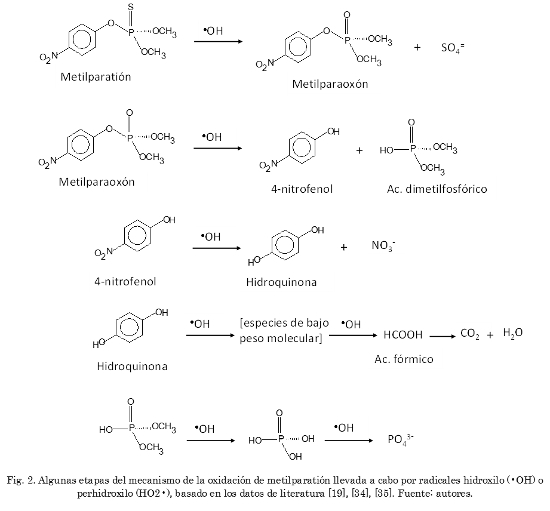
La degradación específica de metilparatión ha sido estudiada mediante diferentes procesos de oxidación. Pignatello et al. [29] estudiaron la oxidación de este compuesto en solución acuosa empleando la reacción Fenton fotoasistida por UV, encontrando que bajo ciertas condiciones la oxidación de metilparatión conduce a la formación de H3PO4, HNO3 y H2SO4, identificando algunos intermediarios como ácido oxálico, 4-nitrofenol (4NF) y ácido dimetilfosfórico. O'Shea et al. [30] demostraron que la degradación fotocatalítica de componentes organofosforados tipo insecticida, dimetil o dietil metilfosfonato, empleando TiO2 como catalizador, se puede llevar a cabo cuando se emplean soluciones bien oxigenadas, obteniéndose como productos finales ácido fosfórico, ácido metilfosfónico, formaldehido, ácido fórmico y dióxido de carbono, en un tiempo inferior a 30 horas. Konstantinou et al. [31], estudiaron la oxidación de los varios compuestos organofosforados (etilparatión, metilparatión, diclorofentión y etilbromofós) en suspensiones acuosas de TiO2 e identificaron la mayor parte de los productos intermediarios de la fotodegradación mediante espectrometría de masas. En estudios más recientes, Sakkas et al. [32] reportaron el estudio de la fotodegradación de etilparatión mediante TiO2 y posterior análisis mediante cromatografía de gases acoplada a espectrometría de masas. Sanjuán et al. [33] estudiaron la fotodegradación del metilparatión en fase acuosa mediante el empleo de 2,4,6-trifenilpirilium en su forma iónica encapsulado dentro de una zeolita Y, obteniendo eficiencias muy similares a las obtenidas mediante la fotodegradación con el empleo de TiO2. Adicionalmente, Moctezuma et al. [34] realizaron un estudio completo sobre la oxidación fotocatalítica de metilparatión en suspensiones acuosas de TiO2, identificando una gran cantidad de intermediarios (metilparaoxón, 4-nitrofenol, hidroquinona, 1,2,4-bencenotriol, ácidos alifáticos de bajo peso molecular y productos inorgánicos como aniones sulfato, fosfato, nitrito y nitrato), con lo cual propusieron la posible ruta de oxidación que sufre dicho compuesto (Fig. 2). Otros autores han confirmado algunos subproductos intermediarios similares en la oxidación de metilparatión catalizada heterogéneamente con MnO2 (sin empleo de ninguna radiación) y han propuesto una ruta, menos detallada, de la descomposición de esta molécula sobre dicho óxido a diferentes valores de pH [35]. Finalmente, autores como Henych et al. [36] y Janoš et al. [37] han estudiado la descomposición de metilparatión sobre la superficie de óxidos mixtos de titanio-hierro y de materiales compuestos en polvo tipo óxidos de CeO2/g-Fe2O3, respectivamente, empleados como adsorbentes reactivos. La Fig. 2 muestra algunas etapas importantes del mecanismo de reacción correspondiente a la oxidación de metilparatión, llevada a cabo mediante el ataque de radicales libres (hidroxilo o perhidroxilo) previamente generados a partir de peróxido de hidrógeno activado por los iones metálicos en solución o por óxidos metálicos. En trabajos anteriores se ha observado la habilidad favorable de los óxidos de cobalto, de cobre y de hierro soportados sobre alúmina para descomponer el peróxido de hidrógeno vía radicales libres, destacándose un fuerte efecto cooperativo en los sistemas mixtos de estos metales [38]. Adicionalmente, entre los diferentes soportes catalíticos disponibles en catálisis heterogénea, la d-alúmina ha mostrado proveer buena dispersión y estabilidad a las fases activas de óxidos metálicos, generando estructuras sólidas estables en soluciones acuosas con peróxido de hidrógeno, además de ejercer cierto control favorable del pH. Estas propiedades del soporte seleccionado permiten la obtención de sitios activos (partículas de óxidos metálicos) de menor tamaño y con interacción fuerte con la superficie, lo cual favorece el diseño de catalizadores activos con niveles reducidos de lixiviación de especies metálicas. De este modo, en el presente trabajo se evalúa el proceso de oxidación catalítica del plaguicida metilparatión en medio acuoso diluido, usando peróxido de hidrógeno como oxidante, mediante el empleo de catalizadores sólidos preparados a partir de óxidos de cobalto, de cobre y de hierro, y sistemas mixtos de dos y tres metales, soportados sobre alúmina (d-Al2O3). Adicionalmente, se evalúa la oxidación de este plaguicida mediante el proceso Fenton homogéneo (Fe3+/H2O2) y mediante el uso de los sistemas Cu2+/H2O2 y Co2+/H2O2 en medio homogéneo. El objetivo principal de este trabajo es avanzar en el diseño y la preparación de nuevos catalizadores heterogéneos basados en óxidos metálicos de bajo costo e inocuos para los ecosistemas acuáticos, capaces de degradar la molécula de metilparatión mediante procesos oxidativos en condiciones suaves de temperatura y presión. Se trabajó sobre la hipótesis de que los óxidos mixtos de los metales Co-Cu, Fe-Co o Fe-Co-Cu soportados sobre d-Al2O3 podrían presentar un efecto cooperativo similar al observado en trabajos anteriores y que conduciría a elevar los niveles de degradación oxidativa de metilparatión en medio acuoso diluido.
2. Materiales y métodos
2.1 Reactivos
Se empleó metilparatión grado técnico (pureza de 80,1%), suministrado por la empresa Agrociense Ltda. S.A (Colombia), previamente purificado mediante recristalización en frío. Se emplearon sales inorgánicas (tipo reactivo analítico) de los correspondientes metales a estudiar: Fe(NO3)3·9H2O (Merck, 99,5%), Co(NO3)2.6H2O (Panreac, 99,9%) y Cu(NO3)2.3H2O (Panreac, 99,0%). Se usó peróxido de hidrógeno 30% suministrado por Panreac. Como soporte de los catalizadores heterogéneos se empleó una alúmina comercial proveída por Sigma-Aldrich, de área superficial: 155 m2/g.
Tanto en la preparación de los catalizadores como en las soluciones de los ensayos catalíticos se empleó agua destilada y luego desionizada (resistividad de 14,2 MΩ.cm).
2.2 Catalizadores
Los catalizadores homogéneos fueron iones metálicos (Fe3+, Co2+ o Cu2+) en concentración de 4 ppm. Para ello, se emplearon las sales Fe(NO3)3∙9H2O, Co(NO3)2.6H2O y Cu(NO3)2.3H2O, a partir de las cuales se prepararon soluciones patrones de 400 ppm de Fe3+, 400 ppm de Co2+ y 400 ppm de Cu2+, respectivamente, de tal manera que al adicionar 1 mL de una de estas soluciones a la mezcla de reacción (100 mL) se obtuviera una concentración final de aproximadamente 4 ppm del ión metálico en cada caso. Se emplearon soluciones frescas de iones metálicos, mantenidas en recipientes de color ámbar y en un medio refrigerado para evitar su alteración.
Los catalizadores sólidos (óxidos metálicos) se prepararon mediante impregnación húmeda de Fe3+, Co2+ y Cu2+ (nitratos) sobre la alúmina comercial, para obtener una concentración de 0,01 milimoles de metal por gramo de catalizador (mayores detalles sobre la preparación de los catalizadores pueden localizarse en la referencia [38]). Para ello, se adicionó 10 mL de solución acuosa 0,01 M de cada ion metálico a una masa cercana a 10 g de Al2O3 y se sometió a agitación constante por media hora [38]. Los sólidos se secaron a 60 ºC toda una noche y luego se calcinaron a 500 ºC durante 3 h, en atmósfera estática de aire. Por otra parte, se prepararon (también por impregnación húmeda) sistemas sólidos mixtos (óxidos) en composición metálica (Fe-Co-Cu, Fe-Cu, Fe-Co y Co-Cu), usando relaciones equimolares de los iones metálicos, con el objeto de obtener concentraciones de 0,01 milimoles totales de metal por cada gramo de catalizador. En el caso del sistema Fe-Cu-Co se emplearon 0,033 milimoles de cada metal para 10 g de catalizador; para Fe-Cu, Fe-Co y Co Cu se usaron 0,050 milimoles de cada metal para 10 g de catalizador [38].
2.3 Caracterización de los sólidos
Los sólidos se caracterizaron por difracción de rayos X y por microscopía electrónica de barrido (SEM). Los análisis de difracción de rayos X se realizaron en un equipo X-Pert Pro MPD PANalitical (radiación Ka de Cu = 1,54060 Å), con geometría 2θ y conFig.ción Bragg-Brentano, a temperatura ambiente, empleando un tamaño de paso de 0,01 y un tiempo de paso de 10 s. Las imágenes de SEM se tomaron en un equipo FEI Quanta 200, capturando 4 micrografías en diferentes sitios sobre la superficie de las muestras, las cuales se metalizaron con oro-paladio mediante la técnica de sputtering, previo a la toma de imágenes.
2.4 Ensayos catalíticos
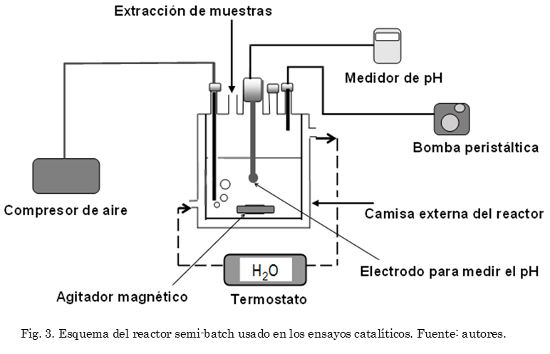
Los ensayos catalíticos para la oxidación de metilparatión en fase acuosa se llevaron a cabo en un reactor de vidrio tipo semibatch (Fig. 3), termostatado a 25ºC, abierto a la atmósfera, con agitación constante (600 rpm) y con un electrodo de vidrio para realizar un control constante del pH del medio de reacción (potenciómetro OAKTON Serie 510). La adición de la solución de H2O2 (molécula oxidante) se realizó con una bomba peristáltica, la cual permitió controlar el flujo de esta solución desde un reservorio, aislado de la luz, hacia el reactor. Para cada ensayo se adicionó un volumen de 100 mL de una solución de 80 ppm de metilparatión, 0,5 g del catalizador (para el caso de catalizadores homogéneos se adicionó 1 mL de la solución patrón de 400 ppm del ión metálico a evaluar) y se introdujo un flujo de aire seco de 2 L/h. La reacción se inicia (tiempo cero) con la adición de peróxido de hidrógeno (0,1 M) a un flujo continuo de 2 mL/h y se extiende durante 7 horas. El pH del medio de reacción se ajustó continuamente a 3,7 usando jeringas con soluciones diluidas (0,1M) de H2SO4 y de NaOH. La degradación de metilparatión se siguió mediante espectrofotometría UV-VIS, midiendo la absorbancia de metilparatión a una longitud de onda de 274 nm en un espectrofotómetro Jenway 7305 UV/visible. En otros ensayos catalíticos se permitió el desarrollo de la reacción sin control de pH (pH espontáneo) con el fin de registrar la tendencia natural de cada sistema catalítico sin forzar el equilibrio mediante controles externos de esta variable. La actividad de los catalizadores en la reacción de oxidación de metilparatión se expresó en términos de la conversión (transformación) catalítica de esta molécula orgánica (Ec. 1):
C0 es la concentración inicial de metilparatión y Ct es la concentración de metilparatión en un tiempo t.
3. Resultados y discusión
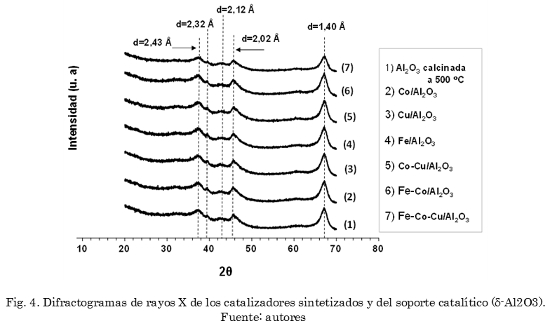
Los difractogramas obtenidos, tanto para el soporte (alúmina calcinada a 500 ºC) como para los catalizadores sólidos (sistemas simples y mixtos) (Fig. 4), muestran las señales características de la fase d-alúmina [38]. Este resultado muestra que durante la preparación de los sólidos no ocurrieron cambios estructurales importantes sobre el soporte. De otro lado, en ningún caso el análisis por difracción de rayos X muestra la presencia de las fases correspondientes a óxidos metálicos de los elementos impregnados, debido a las cantidades menores incorporadas (0,01 milimoles de metal por gramo de catalizador) y/o a la posible formación de fases amorfas. Sin embargo, desde el punto de vista químico es evidente que las especies de cationes metálicos deben conducir a la formación de óxidos como consecuencia de la calcinación en presencia de aire. Es importante destacar que, ni en el presente trabajo ni en el trabajo anterior [38] sobre la preparación de estos catalizadores se observaron desplazamientos de los parámetros de celda de la alúmina empleada, lo cual descarta cualquier posible substitución isomórfica de los iones metálicos incorporados en este soporte. Este resultado es concordante con la formación de óxidos de los metales incorporados sobre la superficie del soporte (alúmina).
El análisis por microscopía electrónica de barrido (SEM) (Fig. 5) muestra que, tanto el soporte como los catalizadores sintetizados presentan morfología granular, cuyos granos están conformados por aglomeraciones de partículas con geometría bastante rectangular. En todos los casos los aglomerados se forman como resultado de la unión de microcristales de alúmina. Las imágenes de SEM para los catalizadores muestran deterioro parcial en la morfología de los aglomerados, en comparación con el soporte, probablemente como resultado de la destrucción de los aglomerados iniciales durante el proceso de impregnación húmeda y el posterior reagrupamiento después del secado y la calcinación. La morfología de las partículas tiene importancia en catálisis heterogénea, toda vez que tiene influencia en la porosidad y en los fenómenos difusionales. La destrucción parcial de la morfología compacta inicial de las partículas podría llegar a ser favorable debido al posible aumento de la porosidad.
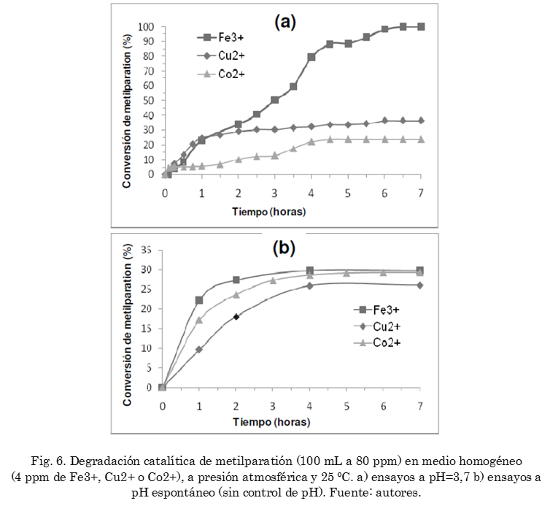
La Fig. 6a muestra los resultados de actividad catalítica de los cationes metálicos estudiados en medio homogéneo a pH 3,7 y bajo condiciones suaves de temperatura y presión (25 ºC y presión atmosférica). Se observa claramente que el sistema Fe3+/H2O2 presenta conversión de 100% en 7 horas, transformando la totalidad del plaguicida, seguida por los sistemas Cu2+/H2O2 y Co2+/H2O2 con conversiones de 35 y 22%, respectivamente. Esta misma tendencia se había observado previamente para la descomposición catalítica del peróxido de hidrógeno [38], lo cual pone en evidencia la influencia directa del proceso de generación de radicales libres (•OH y •O2H) en la oxidación posterior de la molécula de metilparatión. En este sentido, se observa que el paso de generación de estos radicales en el medio de reacción es trascendental y determinante en el proceso oxidativo estudiado. Por otra parte, los ensayos catalíticos en regímenes de pH espontáneo (sin control de pH), mostraron la caída drástica en la actividad catalítica del ion Fe3+ en la degradación de metilparatión, alcanzando solo el 30% de conversión (Fig. 6b). Esta disminución en la actividad catalítica del sistema Fe3+/H2O2 es consecuencia de la precipitación parcial de las especies Fe3+ como hidróxidos de hierro (véase un diagrama de distribución de especies en función del pH para el catión Fe3+ [25]), poco activos en la reacción Fenton, lo cual sucede porque el pH (no controlado) del medio de reacción que se mantuvo durante el inicio y gran parte del tiempo de la reacción por encima de 4. Las conversiones de metilparatión empleando los iones Cu2+ y Co2+ siguen siendo bajas, 26 y 30%, con mayor conversión para el Co2+ en este caso. El pH registrado (no controlado) al inicio de la reacción fue de 6,2 y lentamente fue tendiendo a valores menores, hasta alcanzar 3,5 para la reacción catalizada con Fe3+, 5,1 para la reacción con cobalto y 5,7 para la reacción con iones Cu2+, al final de la reacción. La disminución de la actividad catalítica del sistema Fe3+/H2O2 es consecuencia de las condiciones de pH superiores al pH óptimo durante gran parte del tiempo de la reacción. El pH óptimo para el sistema Fe3+/H2O2 está alrededor de 3,7 [25], [39], mientras que para los iones Cu2+ y Co2+ está cercano a 5,0 [38], lo que explica el menor efecto del pH inicial del medio de reacción (6,2) sobre la actividad catalítica de estos dos iones. Sin embargo, es evidente que la liberación del pH (espontáneo) favoreció un poco la actividad catalítica del ion Co2+. En este punto, es necesario recordar que los potenciales de óxido-reducción de estos iones metálicos son dependientes del valor de pH, lo cual tiene fuerte influencia en su capacidad para descomponer el peróxido de hidrógeno y producir los radicales hidroxilo y perhidroxilo, como se evidenció en el trabajo anterior [38].
El sistema catalítico homogéneo Fe3+/H2O2 en medio ácido (pH=3,7) es conocido como reactivo Fenton y frecuentemente constituye uno de los catalizadores más eficientes en la degradación de compuestos orgánicos en solución acuosa [38], [39]. Estos resultados ponen en evidencia la potencialidad del sistema Fenton frente a los iones Cu2+ y Co2+ en la degradación de metilparatión en medio homogéneo. Sin embargo, los catalizadores homogéneos son poco promisorios debido a la gran dificultad para su separación del medio acuoso, de tal manera que dichos iones metálicos terminan convirtiéndose en elementos contaminantes de las aguas residuales.
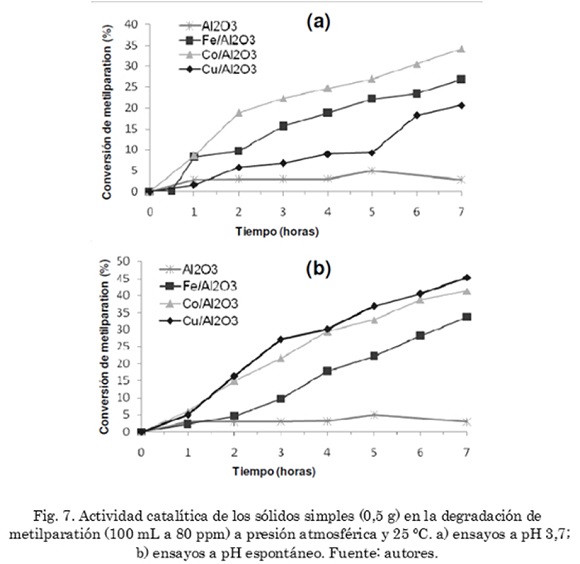
La degradación catalítica heterogénea del metilparatión es una alternativa viable debido a la facilidad de separación de los catalizadores del medio de reacción, lo que potencializa el uso de especies sólidas activas para la oxidación del contaminante. La actividad catalítica de los sólidos simples (Fe/Al2O3, Cu/Al2O3, Co/Al2O3) a pH 3,7 (Fig. 7a) muestra un mejor desempeño para el catalizador de cobalto (34% de conversión), superando a los catalizadores de hierro y de cobre. En condiciones ácidas, este tipo de sólidos permite la lixiviación de iones metálicos que se convierten en especies contaminantes en posibles procesos de tratamiento. Por otra parte, a pH espontáneo (Fig. 7b) se observa que los sólidos de cobre y de cobalto presentan actividades similares (45 y 41% de degradación del plaguicida), pero superiores a las conversiones alcanzadas a pH 3,7. Adicionalmente, la actividad catalítica de estos sólidos fue mayor que la del catalizador de hierro soportado en la alúmina. Los valores de pH registrados fueron cercanos al valor generado en el ensayo con el soporte (alúmina como catalizador), el cual fue de 6,9. En todos los casos el pH se mantuvo dentro del intervalo de 6,8 a 7,3, lo que indica que el pH del medio de reacción es auto-controlado por la superficie del soporte. De esta manera, es posible que los óxidos de cobalto y de cobre (especies activas soportadas sobre la alúmina) se sitúen en un valor de pH favorable para una mejor actividad catalítica de estas especies, en comparación con el óxido de hierro. Nuevamente, un efecto similar fue encontrado en el trabajo previo sobre la descomposición catalítica de peróxido de hidrógeno sobre estos sólidos [38], lo cual pone en evidencia la influencia del pH sobre las capacidades oxido-reductivas de estos óxidos y la predominancia de la formación de radicales libres en el proceso de oxidación de metilparatión en medio acuoso diluido. En dicho trabajo, también se observó una fuerte influencia de la d-Al2O3 sobre el pH de la reacción. Vale la pena resaltar el mejor desempeño de los óxidos de cobre y de cobalto en condiciones próximas a la neutralidad, lo cual es importante para posibles aplicaciones futuras debido a que las aguas de vertimientos deben llevarse a valores de pH cercanos a la neutralidad antes de ser liberadas a los medios naturales. Adicionalmente, a valores de pH cercanos a la neutralidad no se detectan iones metálicos como producto de la lixiviación de estos sólidos, como se encontró también en estudios previos [26], lo que representa una ventaja al no incorporar especies metálicas solubles como contaminantes.
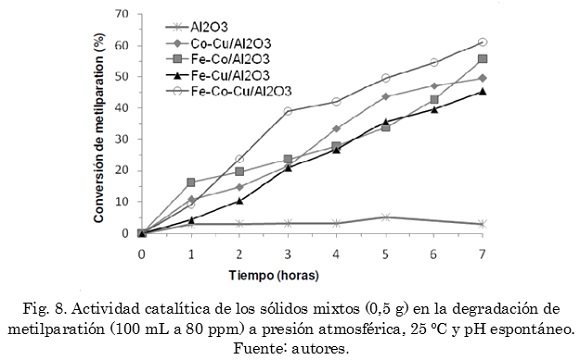
La Fig. 8 muestra la degradación catalítica de metilparatión empleando los catalizadores mixtos a pH espontáneo (el pH registrado estuvo entre 6,7 y 7,0), en la que puede apreciarse un incremento en el desempeño de todos los catalizadores (entre 56 y 61%) con respecto a los sólidos simples. El sólido mixto con mayor actividad catalítica en la degradación de metilparatión bajo estas condiciones fue el sistema ternario Fe-Co-Cu/Al2O3. El hecho de observarse una mayor actividad catalítica en los sólidos mixtos, los cuales poseen cantidades iguales de metal (0,01 milimoles de metal por gramo de catalizador) con respecto a los sólidos simples, es considerado un resultado del efecto cooperativo encontrado previamente para estas especies metálicas [22][38]. Estos sistemas ternarios con buenos resultados operativos a valores de pH cercanos a la neutralidad constituyen un avance importante en la búsqueda de sólidos catalíticamente activos en la degradación de plaguicidas organofosforados. Teniendo en cuenta que se emplean iguales cantidades de iones metálicos tanto para los sólidos simples como para los mixtos, es probable que la mejora en actividad catalítica de los sistemas ternarios sea una consecuencia de la formación de nuevas fases sólidas con estructuras moleculares más eficientes en los mecanismos de oxidación involucrados [40]. Dado que existe la posibilidad de la formación de nuevas fases de estos óxidos mixtos por substitución de iones metálicos (por ejemplo Fe3+ y Cu2+ en el óxido de cobalto), tal como se observó en un trabajo anterior [40], es posible que se obtengan microestructuras substituidas con valores diferentes en potenciales de óxido-reducción favoreciendo la descomposición del peróxido de hidrógeno en radicales hidroxilo y perhidroxilo [38].
4. Conclusiones
Se prepararon catalizadores homogéneos (iones en medio acuoso) y catalizadores sólidos (óxidos soportados sobre Al2O3) de los metales Fe, Co y Cu, que fueron evaluados en la reacción de oxidación o degradación de metilparatión en medio acuoso diluido y bajo condiciones suaves de reacción (25ºC y presión atmosférica). El análisis de los sólidos por difracción de rayos X y microscopía electrónica de barrido permitió verificar las características estructurales y morfológicas predominantes del soporte, confirmando la fase d-Al2O3. El sistema Fe3+/H2O2 (sistema Fenton) constituye el catalizador homogéneo más activo, en comparación con los sistemas Co2+/H2O2 y Cu2+/H2O2. Todos los catalizadores sólidos (óxidos de cobalto, de cobre y de hierro soportados en d-Al2O3) mostraron actividad catalítica a valores de pH cercanos a la neutralidad (valores de pH autogenerados en la reacción). Los sólidos Cu/Al2O3 y Co/Al2O3 son los catalizadores heterogéneos simples más importantes, mientras que los sistemas mixtos Fe-Co-Cu/Al2O3, Co-Cu/Al2O3 y Fe-Co/Al2O3 son los sólidos de máxima actividad catalítica en la degradación de metilparatión. La conformación de sistemas sólidos de óxidos mixtos permitió mejorar el desempeño de los catalizadores, como consecuencia del efecto cooperativo de las especies metálicas descubierto previamente. Dicho efecto, probablemente, es el resultado de nuevas fases oxídicas y es posible que dichas fases sean el resultado de substituciones de cationes metálicos (por ejemplo, Fe3+ y Cu2+ en el óxido de cobalto) que conducen a la conformación de microestructuras con potenciales de óxido-reducción apropiados. También es evidente la fuerte influencia del soporte (d-Al2O3) en el control de pH, favoreciendo las capacidades óxido-reductivas de las fases de óxidos metálicos obtenidas en los catalizadores.
5. Agradecimientos
A la Universidad Nacional de Colombia, sede Bogotá, por el apoyo logístico. Este trabajo se desarrolló en el Laboratorio de Diseño y Reactividad de Estructuras Sólidas (Lab-DRES), Lab-125 del Departamento de Química de La Universidad Nacional de Colombia.
Referencias
[1] M. Abdennouri, M. Baâlala, A. Galadi, M. El Makhfouk, M. Bensitel, K. Nohair, M. Sadiq, A. Boussaoud, and N. Barka, “Photocatalytic degradation of pesticides by titanium dioxide and titanium pillared purified clays,” Arab. J. Chem., vol. 9, pp. S313-S318, Sep. 2016. [ Links ]
[2] K. Ikehata and M. G. M. El-din, “Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and Fenton-type advanced oxidation processes: a review,” J. Environ. Eng. Sci., vol. 5, no. 2, pp. 81-135, 2006. [ Links ]
[3] M. I. Badawy, M. Y. Ghaly, and T. A. Gad-Allah, “Advanced oxidation processes for the removal of organophosphorus pesticides from wastewater,” Desalination, vol. 194, no. 1-3, pp. 166-175, 2006. [ Links ]
[4] E. Evgenidou, I. Konstantinou, K. Fytianos, and I. Poulios, “Oxidation of two organophosphorous insecticides by the photo-assisted Fenton reaction,” Water Res., vol. 41, no. 9, pp. 2015-2027, 2007. [ Links ]
[5] S. Chiron, A. Fernandez-Alba, A. Rodriguez, and E. Garcia-Calvo, “Pesticide chemical oxidation: State-of-the-art,” Water Res., vol. 34, no. 2, pp. 366-377, 2000. [ Links ]
[6] M. Segal-Rosenheimer and Y. Dubowski, “Photolysis of methyl-parathion thin films: Products, kinetics and quantum yields under different atmospheric conditions,” J. Photochem. Photobiol. A Chem., vol. 209, no. 2-3, pp. 193-202, 2010. [ Links ]
[7] E. C. Wanamaker, G. C. Chingas, and O. M. McDougal, “Parathion hydrolysis revisited: In situ aqueous kinetics by 1H NMR,” Environ. Sci. Technol., vol. 47, no. 16, pp. 9267-9273, 2013. [ Links ]
[8] R. Thota and V. Ganesh, “Selective and sensitive electrochemical detection of methyl parathion using chemically modified overhead projector sheets as flexible electrodes,” Sensors Actuators, B Chem., vol. 227, pp. 169-177, 2016. [ Links ]
[9] M. Diagne, N. Oturan, and M. A. Oturan, “Removal of methyl parathion from water by electrochemically generated Fenton's reagent,” Chemosphere, vol. 66, no. 5, pp. 841-848, 2007. [ Links ]
[10] C. Chávez-López, A. Blanco-Jarvio, M. Luna-Guido, L. Dendooven, and N. Cabirol, “Removal of methyl parathion from a chinampa agricultural soil of Xochimilco Mexico: A laboratory study,” Eur. J. Soil Biol., vol. 47, no. 4, pp. 264-269, 2011. [ Links ]
[11] J. M. Pisani, W. E. Grant, and M. A. Mora, “Simulating the impact of cholinesterase-inhibiting pesticides on non-target wildlife in irrigated crops,” Ecol. Modell., vol. 210, no. 1-2, pp. 179-192, 2008. [ Links ]
[12] T. Gong, R. Liu, Z. Zuo, Y. Che, H.-L. Yu, C. Song, and C. Yang, “Metabolic Engineering of Pseudomonas putida KT2440 for Complete Mineralization of Methyl Parathion and y-Hexachlorocyclohexane,” ACS Synth. Biol., vol. 5, no. 5, pp. 434-442, May 2016. [ Links ]
[13] G. Moussavi, H. Hosseini, and A. Alahabadi, “The investigation of diazinon pesticide removal from contaminated water by adsorption onto NH4Cl-induced activated carbon,” Chem. Eng. J., vol. 214, pp. 172-179, 2013. [ Links ]
[14] H. El Bakouri, J. Usero, J. Morillo, R. Rojas, and A. Ouassini, “Drin pesticides removal from aqueous solutions using acid-treated date stones,” Bioresour. Technol., vol. 100, no. 10, pp. 2676-2684, 2009. [ Links ]
[15] K. V Plakas and A. J. Karabelas, “Removal of pesticides from water by NF and RO membranes - A review,” Desalination, vol. 287, pp. 255-265, 2012. [ Links ]
[16] S. K. Bhargava, J. Tardio, J. Prasad, K. Föger, D. B. Akolekar, and S. C. Grocott, “Wet Oxidation and Catalytic Wet Oxidation,” Ind. Eng. Chem. Res., vol. 45, no. 4, pp. 1221-1258, 2006. [ Links ]
[17] E. Kusvuran, D. Yildirim, F. Mavruk, and M. Ceyhan, “Removal of chloropyrifos ethyl, tetradifon and chlorothalonil pesticide residues from citrus by using ozone,” J. Hazard. Mater., vol. 241-242, pp. 287-300, 2012. [ Links ]
[18] R. Saini and P. Kumar, “Simultaneous removal of methyl parathion and chlorpyrifos pesticides from model wastewater using coagulation/flocculation: Central composite design,” J. Environ. Chem. Eng., vol. 4, no. 1, pp. 673-680, 2016. [ Links ]
[19] L. Zheng, F. Pi, Y. Wang, H. Xu, Y. Zhang, and X. Sun, “Photocatalytic degradation of Acephate, Omethoate, and Methyl parathion by Fe3O4@SiO2@mTiO2 nanomicrospheres,” J. Hazard. Mater., vol. 315, pp. 11-22, Sep. 2016. [ Links ]
[20] F. I. Hai, O. Modin, K. Yamamoto, K. Fukushi, F. Nakajima, and L. D. Nghiem, “Pesticide removal by a mixed culture of bacteria and white-rot fungi,” J. Taiwan Inst. Chem. Eng., vol. 43, no. 3, pp. 459-462, 2012. [ Links ]
[21] J. G. Carriazo, M. Moreno-Forero, R. A. Molina, and S. Moreno, “Incorporation of titanium and titanium-iron species inside a smectite-type mineral for photocatalysis,” Appl. Clay Sci., vol. 50, no. 3, pp. 401-408, 2010. [ Links ]
[22] J. Carriazo, E. Guélou, J. Barrault, J. M. Tatibouët, R. Molina, and S. Moreno, “Catalytic wet peroxide oxidation of phenol by pillared clays containing Al-Ce-Fe,” Water Res., vol. 39, no. 16, pp. 3891-3899, 2005. [ Links ]
[23] G. N. Rodrigues, N. Alvarenga, B. Vacondio, S. P. de Vasconcellos, M. R. Z. Passarini, M. H. R. Seleghim, and A. L. M. Porto, “Biotransformation of methyl parathion by marine-derived fungi isolated from ascidian Didemnum ligulum,” Biocatal. Agric. Biotechnol., vol. 7, pp. 24-30, 2016. [ Links ]
[24] R. Li, C. Yang, H. Chen, G. Zeng, G. Yu, and J. Guo, “Removal of triazophos pesticide from wastewater with Fenton reagent,” J. Hazard. Mater., vol. 167, no. 1-3, pp. 1028-1032, 2009. [ Links ]
[25] A. D. Bokare and W. Choi, “Review of iron-free Fenton-like systems for activating H2O2 in advanced oxidation processes,” J. Hazard. Mater., vol. 275, pp. 121-135, 2014. [ Links ]
[26] S. Kouraichi, M. El-Hadi Samar, M. Abbessi, H. Boudouh, and A. Balaska, “Pillared clays as catalysts for methyl parathion removal by advanced oxidation processes,” Catal. Sci. Technol., vol. 5, no. 2, pp. 1052-1064, 2015. [ Links ]
[27] A. Özcan, Y. Şahin, and M. A. Oturan, “Complete removal of the insecticide azinphos-methyl from water by the electro-Fenton method - A kinetic and mechanistic study,” Water Res., vol. 47, no. 3, pp. 1470-1479, Mar. 2013. [ Links ]
[28] C. F. Gromboni, M. Y. Kamogawa, A. G. Ferreira, J. A. Nóbrega, and A. R. A. Nogueira, “Microwave-assisted photo-Fenton decomposition of chlorfenvinphos and cypermethrin in residual water,” J. Photochem. Photobiol. A Chem., vol. 185, no. 1, pp. 32-37, 2007. [ Links ]
[29] J. J. Pignatello and Y. Sun, “Complete oxidation of metolachlor and methyl parathion in water by the photoassisted Fenton reaction,” Water Res., vol. 29, no. 8, pp. 1837-1844, 1995. [ Links ]
[30] K. E. O'Shea, S. Beightol, I. García, M. Aguilar, D. V Kalen, and W. J. Cooper, “Photocatalytic decomposition of organophosphonates in irradiated TiO2 suspensions,” J. Photochem. Photobiol. A Chem., vol. 107, no. 1-3, pp. 221-226, 1997. [ Links ]
[31] I. K. Konstantinou, T. M. Sakellarides, V. A. Sakkas, and T. A. Albanis, “Photocatalytic Degradation of Selected s-Triazine Herbicides and Organophosphorus Insecticides over Aqueous TiO 2 Suspensions,” Environ. Sci. Technol., vol. 35, no. 2, pp. 398-405, 2001. [ Links ]
[32] T. M. Sakellarides, V. a. Sakkas, D. a. Lambropoulou, and T. a. Albanis, “Application of solid-phase microextraction (spme) for photocatalytic studies of fenitrothion and methyl parathion in aqueous TiO 2 suspensions,” Int. J. Environ. Anal. Chem., vol. 84, no. 1-3, pp. 161-172, 2004. [ Links ]
[33] A. Sanjuan, G. Aguirre, M. Alvaro, and H. García, “2, 4, 6-Triphenylpyrylium ion encapsulated within Y zeolite as photocatalyst for the degradation of methyl parathion,” Water Res., vol. 34, no. 1, pp. 320-326, 2000. [ Links ]
[34] E. Moctezuma, E. Leyva, G. Palestino, and H. de Lasa, “Photocatalytic degradation of methyl parathion: Reaction pathways and intermediate reaction products,” J. Photochem. Photobiol. A Chem., vol. 186, no. 1, pp. 71-84, 2007. [ Links ]
[35] X. Liao, C. Zhang, Y. Liu, Y. Luo, S. Wu, S. Yuan, and Z. Zhu, “Abiotic degradation of methyl parathion by manganese dioxide: Kinetics and transformation pathway,” Chemosphere, vol. 150, pp. 90-96, 2016. [ Links ]
[36] M. Henych, J., Štengl, V., Slušná, M., Grygar, T. M., Janoš, P., Kuráň, P., & Štastný, “Degradation of organophosphorus pesticide parathion methyl on nanostructured titania-iron mixed oxides,” Appl. Surf. Sci., vol. 344, pp. 9-16, 2015. [ Links ]
[37] P. Janoš, P. Kuráň, V. Pilařová, J. Trögl, M. Šťastnň, O. Pelant, J. Henych, S. Bakardjieva, O. Životskň, M. Kormunda, K. Mazanec, and M. Skoumal, “Magnetically separable reactive sorbent based on the CeO2/y-Fe2O3 composite and its utilization for rapid degradation of the organophosphate pesticide parathion methyl and certain nerve agents,” Chem. Eng. J., vol. 262, pp. 747-755, Feb. 2015. [ Links ]
[38] J. G. Carriazo, L. F. Bossa-Benavides, and E. Castillo, “Actividad catalítica de metales de transición en la descomposición de peróxido de hidrógeno,” Quim. Nova, vol. 35, no. 6, pp. 1101-1106, 2012. [ Links ]
[39] J. M. Tatibouēt, E. Guélou, and J. Fournier, “Catalytic oxidation of phenol by hydrogen peroxide over a pillared clay containing iron. Active species and pH effect,” Top. Catal., vol. 33, no. 1-4, pp. 225-232, 2005. [ Links ]
[40] A. M. Carrillo and J. G. Carriazo, “Cu and Co oxides supported on halloysite for the total oxidation of toluene,” Appl. Catal. B Environ., vol. 164, pp. 443-452, 2015. [ Links ]