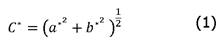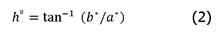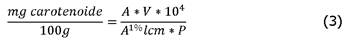1. INTRODUCCIÓN
Los cítricos son uno de los cultivos frutales más importantes del mundo, con una producción anual de aproximadamente 102 millones de toneladas [1]. Estas frutas son originarias de las zonas tropicales y subtropicales del Sureste Asiático, el noreste de la India, el Sur de China, y el Archipiélago Malayo [2]. La mandarina es una especie subtropical de clima templado perteneciente a la familia Rutaceae y al género Citrus L., es un fruto globoso, de color anaranjado uniforme, sabor dulce, corteza granulada y de tamaño mediano [3].
El procesamiento de los cítricos genera subproductos que pueden alcanzar hasta el 50 % del peso original de la fruta, siendo el epicarpio el subproducto principal [4], [5].
Estos subproductos son fuentes importantes de aceite esencial, carotenoides y compuestos fenólicos, que los convierte en recursos atractivos en la valoración agroindustrial como fuente importante de aditivos en la industria alimentaria, cosmética y farmacéutica [6], [7]. Estudios previos reconocen a los cítricos como frutas que promueven la salud, debido a la presencia de estos compuestos bioactivos [8]. Las dietas ricas en fitoquímicos como los carotenoides y los compuestos fenólicos se han asociado con la reducción de enfermedades como ciertos tipos de cáncer, inflamación, problemas cardiovasculares, cataratas, degeneración macular y enfermedades neurodegenerativas [9]. Los carotenoides presentes en los cítricos amarillos y verdes, están ganando importancia en los productos alimenticios, debido a sus beneficios relacionados a la salud (ricos en provitamina A y efecto anticancerígeno) [10].
Se han realizado varios estudios sobre la caracterización de frutas cítricas, como los llevados a cabo por [4], los autores caracterizaron cuatro especies de Citrus cultivadas en Brasil (C. sinensis, cvs. Pera y Lima; C. latifolia tanaka cv. Tahiti; C. limettioides tanaka cv. Sweet lime y C. reticulate, cv. Ponkan) en relación con el contenido de minerales, ácido ascórbico, polifenoles totales y capacidad antioxidante de pulpas y epicarpio. Los autores encontraron que la mandarina Ponkan presentó mayor capacidad antioxidante y, en general, el epicarpio de las variedades estudiadas presentó un contenido estadísticamente mayor de todos los compuestos evaluados en comparación de la pulpa; [10] determinó el contenido total de carotenoides, vitamina C y capacidad antioxidante de tres variedades de cítricos cultivados en la parte sur de Corea, tales son Yuza (Citrus junos sieb ex tabaka), Kjool (Citrus unshiu marcow) y Dangyooja (Citrus grandisosbeck). Los autores identificaron siete carotenoides de los cuales predominan la β-criptoxantina, astaxantina y zeaxantina, además, encontraron que la variedad Yuza contiene cantidades más altas de carotenoides y vitamina C; [11] estimó los polifenoles y flavonoides presentes en la pulpa y epicarpio de limón de Bhopal e India, también determinó el poder reductor, la actividad antioxidante y la inhibición del peróxido de lípidos. Los autores encontraron que el epicarpio de limón presentó valores estadísticamente mayores de los análisis realizados en comparación con la pulpa; [12] estudiaron el perfil fisicoquímico y fitoquímico, así como las propiedades antioxidantes en cítricos como la naranja 'Valencia' (Citrus sinensis, cv.), pomelo (Citrus paradisi, cvs. 'White Marsh', 'Star Ruby', 'Rio Red') y un híbrido 'Mandora' (Citrus reticulata x Citrus sinensis, cv). Los autores hallaron que la fruta de ‘Valencia’ presentó un mayor contenido de ácido fenólico, flavonoide y ascórbico, así como una mayor capacidad antioxidante.
Se han adelantado varios estudios sobre el uso de harinas de epicarpio y mesocarpio de frutas en productos horneados. [13] evaluaron los parámetros fisicoquímicos y sensoriales del uso de harina de epicarpio de chontaduro en torta dulce. [14] determinó las propiedades fisicoquímicas y morfológicas y la viscosidad de la harina de castaña de agua india en la preparación de galletas. [15] caracterizó la harina de epicarpio de naranja y maracuyá y su uso en pan y torta dulce. [16] evaluó las propiedades reológicas, químicas y sensoriales y el perfil de textura del uso de harina de granos de café en galletas.
En la actualidad son limitados los estudios en la valoración de los subproductos generados en el procesamiento de críticos en Colombia que permitan identificar el potencial agroindustrial del epicarpio de mandarina como fuente de aditivos naturales en la industria alimentaria, cosmética y farmacéutica. En razón a esto, el objetivo de la presente investigación fue evaluar el potencial agroindustrial de la harina de epicarpio de mandarina Oneco (Citrus reticulata) como posible colorante natural en el pan.
2. MATERIALES Y MÉTODOS
2.1 Acondicionamiento de material primo
De un supermercado ubicado en la galería Alameda en la ciudad de Santiago de Cali (Valle del Cauca), se adquirieron 20 kg de mandarina Oneco (Citrus reticulata) en estado de madurez de consumo, de los cuales se obtuvieron 4kg de epicarpio aproximadamente. La mandarina fue lavada en una solución jabonosa 1:4, desinfectada con hipoclorito a 100ppm durante 5 min y pelada manualmente. El epicarpio (cáscara) de la mandarina fue troceado en julianas de 2,8 mm de espesor y 6,5 cm de longitud aproximadamente, sumergido en una solución de metasulfito a 100ppm durante 5 min, escaldado durante 2 min a 85 ºC y congelado con el fin de reducir el tiempo de secado. El epicarpio fue tratado durante 4 horas aproximadamente en un secador de bandejas convectivo a 40 ºC y velocidad de flujo a 3m/s, hasta obtener una humedad constante de 8 %. Se redujo el tamaño del epicarpio deshidratado en un molino de cuchillas IKA Labortchnik M hasta que el 98 % de la harina pasó por una malla US 200. Posteriormente, la harina de epicarpio de mandarina fue almacenada en un frasco de vidrio bajo refrigeración a una temperatura de 4 ºC [17].
2.2 Aplicación de la harina de epicarpio de mandarina en el pan
El pan se elaboró siguiendo la metodología de [18] con algunas modificaciones; los ingredientes fueron:150 g de harina de trigo, 54 g de agua, 37 g de margarina, 15 g de azúcar, 15 g de huevos, 3 g de sal y 3 g de levadura fresca; los ingredientes fueron amasados de forma manual durante 10 min, pasado este tiempo se dejó reposar la masa durante 15 min a temperatura ambiente, posteriormente se dividió la masa en porciones de 22 g y se leudó a 32 °C y 54 % humedad durante 40 min hasta triplicar su tamaño. Por último, se horneó la masa en un horno Óster a 180 °C durante 20 min.
Se realizaron cuatro tratamientos, el primer tratamiento fue el control con 0,03 g de tartrazina y los otros tres tratamientos fueron sustituciones de harina de trigo por harina de epicarpio de mandarina a 2 %, 3 % y 4 %.
2.3 Determinaciones fisicoquímicas
A las muestras de estudio se le hicieron mediciones de materia seca siguiendo el protocolo [19], en una balanza de humedad Precisa XM60, e= 0,01, Suiza; de actividad de agua siguiendo el protocolo [19] en el equipo AQUALAB, 4TE, México; de pH siguiendo el protocolo [20], en el pH-metro SI Analytics, Lab 855; de porcentaje de acidez referido a ácido cítrico siguiendo el protocolo [21].
2.4 Determinación del color superficial CIEL*a*b*
Se les determinó el color a las muestras de estudio mediante la lectura de las coordenadas L*, a* y b* en un colorímetro Konica Minolta CR-400. El colorímetro se estandarizó con una baldosa negra y una blanca (Y= 89,5; x= 0,3176; y y= 0,3347) usando el iluminante D65 y un observador 2º. Los valores numéricos de L*, a* y b* se convirtieron en croma (C*), y ángulo de matiz (hº) según [22], mediante (1) y (2):
2.5 Determinación del contenido de carotenoides
Los carotenoides se cuantificaron siguiendo la metodología de [22]. Se pesaron 0,1 g de muestra triturada en un tubo de ensayo, se adicionaron 7 ml de una solución de etanol/hexano a una relación 4:3. Los tubos de ensayo se pusieron en un matraz con agua helada y se cubrieron con una bolsa negra para protegerlos de la luz.
Posteriormente, se sometieron a agitación a 140 rpm en una plancha de agitación durante 1 h. Transcurrido el tiempo se adicionó 1 ml de agua destilada y se sometieron a agitación durante 10 min más.
Se visualizó una separación de fases; en la parte superior el hexano y en la parte inferior el etanol y agua. Se leyó en el espectrofotómetro Spectrophotometer Jenway 6320D, USA la fase orgánica (hexano) a 450, 444, 451 y 472 nm para β-caroteno, α-caroteno, β-criptoxantina, zeaxantina y licopeno respectivamente. El contenido de carotenoides disueltos en hexano se calculó mediante (3):
Donde A es la absorbancia, V el volumen de la capa de hexano, P es el peso de la muestra (g), y A 1% lcm es el coeficiente de extinción: 2560, 2800, 2460, 2480 y 3540 para β-caroteno, α-caroteno, β-criptoxantina, zeaxantina y licopeno respectivamente.
2.6 Determinación de compuestos fenólicos totales
La concentración de fenoles totales se determinó siguiendo la metodología de [22]. Se pesaron 0,25 g de muestra en un tubo de ensayo forrado con papel aluminio y se adicionaron 10 ml de etanol-agua a una relación de 80:20 %v/v. Se agitó en una plancha de agitación a 150 rpm durante tres minutos y posteriormente se sonificó la mezcla durante 20 minutos a 25 ºC.
Pasado este tiempo se filtró el extracto y se tomaron y mezclaron 0,5 ml del extracto con 5 ml de agua destilada y 0,5 ml de reactivo de Folin-Ciocalteu; entonces, se dejó que la mezcla reaccionara durante 2 min a temperatura ambiente.
Pasado el tiempo, se adicionó 1 ml de carbonato de sodio anhídrido al 20 % y se sometieron los tubos a baño térmico durante 15 min a 45 ºC. Se dejó enfriar a temperatura ambiente las muestras. La absorbancia de las muestras se midió a 765 nm usando el espectrofotómetro Spectrophotometer Jenway 6320D, USA.
Para la determinación de fenoles totales, se hizo una curva de calibración (0,002 a 0,017 mg de ácido gálico (AG) por ml de solución, con una correlación de 99,55 %). Los valores fueron expresados en mg de ácido gálico /100 g de muestra b.s
2.7 Determinación de la capacidad antioxidante (% dpph)
La capacidad antioxidante expresada como porcentaje de inhibición del radical dpph 2,2-diphenyl-1-picrylhydrazyl, se determina siguiendo la metodología de[23]. Se pesó 0,1 g de muestra en un tubo de ensayo forrado con papel aluminio y se adicionaron 10 ml de metanol. Se agitó en una plancha de agitación a 150 rpm durante tres minutos y posteriormente se sonificó la mezcla durante 20 min a 25 ºC.
Pasado este tiempo, se filtró el extracto y se tomó 1 ml de este para mezclarlo con 2 ml del reactivo dpph 0,1 mM recién preparado. Se elaboró un control con 1 ml de metanol y 2 ml de dpph recién preparado. Se dejaron en reposo durante 1 h en la oscuridad la muestra y el control.
Luego se midió la absorbancia de la muestra y el control usando el espectrofotómetro Spectrophotometer Jenway 6320D, USA a una longitud de onda de 517 nm.
El porcentaje de actividad antioxidante en términos de inhibición del radical dpph se determinó mediante (4):
Donde A517= lectura de la absorbancia a una longitud de onda de 517 nm.
2.8 Análisis estadístico
La comparación de medias de los tratamientos fresco y deshidratado y la diferencia entre ellos se determinó mediante una prueba T-Student, y el efecto de la inclusión del epicarpio de mandarina en el pan se estableció por medio de un diseño experimental aleatorizado simple con cuatro tratamientos (control, 2 %, 3 % y 4 %) y una prueba Tukey para observar las diferencias entre los tratamientos. El tratamiento de datos es evaluado en el paquete estadístico minitab V17 con un nivel de confianza del 95 %. La experimentación de todos los tratamientos se hizo por triplicado y se llevó a cabo en el laboratorio de Frutas y Hortalizas de la Universidad Nacional de Colombia sede Palmira.
3. RESULTADOS Y DISCUSIÓN
3.1 Propiedades fisicoquímicas en la harina de epicarpio de mandarina
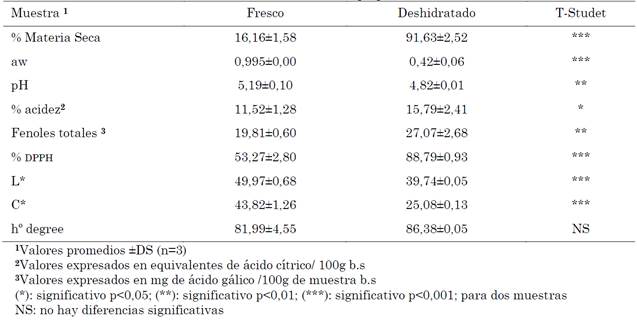
En la Tabla 1 se presentan los valores medios evaluados de los parámetros fisicoquímicos: color superficial CIEL*a*b*, fenoles totales y capacidad antioxidante (% dpph), evaluada en el epicarpio de mandarina en fresco y deshidratado. El análisis estadístico evidencia un efecto significativo en las variables de estudio después del proceso de deshidratación, excepto en la variable de color h°.
Los valores de porcentaje materia seca (% materia seca), aw, pH, L*, y C* del material en fresco superan significativamente los valores obtenidos en el material deshidratado, por el contrario, la acidez (% acidez), los fenoles totales y la actividad antioxidante son significativamente mayores en el material deshidratado (Tabla 1).
Tabla 1 Parámetros fisicoquímicos del epicarpio de mandarina en fresco y deshidratado
Fuente: elaboración propia.
El epicarpio de mandarina es deshidratado hasta alcanzar un porcentaje de materia seca de 91,63±2,52 % y una actividad de agua de 0,42±0,06. El decrecimiento del agua disponible permite prolongar la vida útil de la misma, disminuyendo la proliferación de bacterias, hongos, mohos y reacciones enzimáticas de deterioro.
El epicarpio de mandarina en fresco presenta un pH de 5,19±0,10 y un porcentaje de acidez de 11,52±1,28, mientras que el epicarpio de mandarina deshidratada registró un pH de 4,82±0,01 y un porcentaje de acidez de 15,79±2,41.
Estos cambios en las muestras evaluadas después del tratamiento térmico pueden estar asociados a los procesos de lixiviación y oxidación de los compuestos orgánicos cuando la matriz biológica es afectada por la temperatura [24].
El epicarpio de mandarina presenta bajos niveles de compuestos fenólicos totales; 19,81±0,60 y 27,07±2,68 mg de ácido gálico/100 g de muestra, en fresco y deshidratado respectivamente. De acuerdo con la clasificación propuesta por [25], la mandarina se clasifica como una fruta de bajo contenido de compuestos fenólicos, ya que el epicarpio presenta valores inferiores a 500 mg de ácido gálico/100 g de muestra.
Esto concuerda con los resultados obtenidos por [26], que clasifica las variedades de mandarina clementina y mandarín Fairchild, Dancy, Beleza, Suhugan y Fizu como una fruta de bajo contenido de compuestos fenólicos, ya que estas presentan concentraciones menores a 75 mg de ácido gálico/100 g de muestra. El aumento significativo en la cantidad de contenido de compuestos fenólicos en la muestra deshidratada puede ser causado por la aceleración de las reacciones de escisión de sustancias fenólicas reunidas en las células por el calentamiento [27].
Los compuestos fenólicos son sustancias que poseen un anillo aromático y un anillo de benceno con uno o más grupos de hidróxido, que incluyen derivados funcionales (como ésteres, ésteres metílicos, glucósidos, etc.) [28] que pueden actuar como agentes protectores contra la acción de la radiación UV, patógenos y depredadores en frutas y verduras [4], además, estos compuestos desactivan las moléculas de pro-carcinógenos y propician el mantenimiento de la reparación del adn, la supresión de la formación de N-nitrosamina y el cambio del metabolismo del estrógeno, entre otros [8].
El 1,1-difenil-2-picrilhidrazilo (radical dpph) es un radical libre estable centrado en nitrógeno, al aceptar un radical de hidrógeno o un electrón, el dpph se convierte en una molécula diamagnética estable que desempeña el papel de un antioxidante [11]. El porcentaje de actividad de captación de dpph en la muestra deshidratada (88,79±0,93 %) fue significativamente mayor al de la muestra en fresco (53,27±2,80 %). Este resultado concuerda con lo encontrado por [29], en cuyo trabajo se observó un aumento del porcentaje de actividad de eliminación de dpph del 48 % en flavedo de pomelo, después del tratamiento de secado en horno a 50 ºC, el autor obtuvo valores de % dpph de 45,8 % y 87,92 % en fresco y deshidratado respectivamente.
La capacidad antioxidante de los extractos está influenciada por su composición química y actúa como agente protector reduciendo el daño oxidativo causado en el cuerpo, inhibiendo la peroxidación de los lípidos y retardando el progreso de muchas enfermedades [11].
Según [1], la capacidad antioxidante de los cítricos está asociada a compuestos como las vitaminas; entre estos se encuentran la vitamina A, que puede reaccionar con los radicales libres, especialmente con el oxígeno singlete (1O2) y los radicales peroxilo; la vitamina C, que puede eliminar eficazmente una variedad de especies reactivas de oxígeno (ros) y desprender ácido semideshidroascórbico, eliminando 1O2 y reduciendo los radicales de azufre; la vitamina E, que puede proteger las membranas celulares contra el daño por la peroxidación de lípidos; minerales como el Mn, Fe, Cu, Zn y Se; compuestos fenólicos como los flavonoides, que pueden eliminar especies reactivas de oxígeno y disminuir la formación de peróxido in vivo; ácidos fenólicos, a través de la deshidrogenación de los grupos hidroxilo; el efecto de la ortosustitución en un anillo de benceno y las curcuminas debido a sus grupos hidroxilo-fenólicos; y compuestos terpenoides como los limonoides, la pectina a través de la mejora de las enzimas antioxidantes endógenas y la eliminación de radicales libres y los carotenoides debido a la eliminación de radicales libres y 1O2.
La reducción de los valores de color superficial L* y C* en las muestras deshidratadas concuerdan con los resultados obtenidos por [30] y [31] al deshidratar los subproductos generados en el procesamiento de frutos cítricos.
La reducción de estos parámetros de color durante el proceso de deshidratación pueden ser consecuencia de la isomeración de los carotenoides, polimerización y degradación de flavonoides o de las reacciones de pardeamiento no enzimático, tales como condensación de hexosas y componentes de aminoácidos, y la oxidación del ácido ascórbico, tal como lo expresó previamente [24].
3.2 Concentración de carotenoides en la harina de epicarpio de mandarina
Los carotenoides son tetraterenoides responsables principalmente del color rojo, naranja o amarillo de las frutas y son importantes precursores de la vitamina A [9]. También poseen varias propiedades funcionales, como el estímulo de la actividad cardiovascular, capacidad antioxidante y anticancerígeno [10].
En la Tabla 2 se presentan los valores de la concentración del contenido de carotenoides evaluados en el epicarpio de la mandarina en fresco y deshidratado. El análisis estadístico revela una diferencia significativa entre las muestras evaluadas.
Tabla 2 Contenido de carotenoides presentes en el epicarpio de mandarina en fresco y deshidratado

Fuente: elaboración propia.
La retención del contenido de carotenoides obtenidos del epicarpio de mandarina en la muestra deshidratada fue significativamente mayor al material en fresco. Este aumento en la concentración de carotenoides se le atribuye al tratamiento térmico al que fue sometido el material en fresco durante el proceso de deshidratación [23], ya que este aumenta la biodisponibilidad de los carotenoides, al destruir la integridad de la pared celular y las membranas de los orgánulos en los que se encuentran retenidos. Además, el calor desnaturaliza los complejos proteína-carotenoides, favoreciendo su liberación de la matriz alimentaria [32], [33].
Tratamientos térmicos como el escaldado están asociados con la inhibición de la enzima lipoxigenasa (lox), la cual está relacionada con la destrucción o blanqueado de pigmentos carotenoides [34].
Se obtiene una concentración significativamente mayor de los carotenoides α- caroteno y β-criptoxantina en el material en fresco, mientras que en el material deshidratado se obtienen concentraciones mayores en los carotenoides β-criptoxantina y zeaxantina.
El carotenoide β-criptoxantina es el responsable de la coloración naranja del epicarpio de mandarina [35], razón por la cual es uno de los carotenoides predominantes en las dos muestras evaluadas.
El licopeno fue el pigmento que presentó menor concentración tanto en fresco como deshidratado, se presentan concentraciones de 16,58±0,62 mg/100 g de muestra seca y 67,76±2,74 mg/100 g de muestra seca respectivamente.
Este carotenoide es considerado el pigmento con mayor capacidad para eliminar el oxígeno singlete. Los estudios han demostrado que el licopeno protege las moléculas lipídicas, las lipoproteínas de baja densidad, las proteínas y el adn contra los ataques de radicales libres, desempeñando un papel esencial en la protección contra enfermedades [9].
La concentración obtenida del epicarpio de mandarina deshidratada de β- caroteno y licopeno fue muy elevada comparada con los reportados por [36] en subproductos deshidratados derivados del procesamiento industrial de naranja y maracuyá; el autor reporta concentraciones de β-caroteno 39,14µg/g y licopeno 18,51µg/g para naranja y β- caroteno 56,07 µg/g y licopeno 28,57µg/g para maracuyá.
La concentración obtenida β-criptoxantina en el epicarpio de mandarina fresca fue mayor que la reportada por [37].
El autor reporta valores de 13,4µg/g en mandarina clementina, 11,4 µg/g en naranja china, 11,3 µg/g en pomelo y 19,9µg/g en limón. Las variaciones de la concentración de carotenoides pueden atribuirse a: las prácticas agrícolas, exposición al sol, el área de producción, la etapa de maduración, el manejo pos cosecha y la metodología utilizada para el análisis [38].
3.3 Valoración de la harina de epicarpio de mandarina como colorante natural en el pan
Las propiedades fisicoquímicas del pan formulado con las diferentes concentraciones de harina de epicarpio de mandarina se representan en la Tabla 3.
Tabla 3 Concentración de carotenoides y color superficial con diferentes concentraciones de epicarpio de mandarina
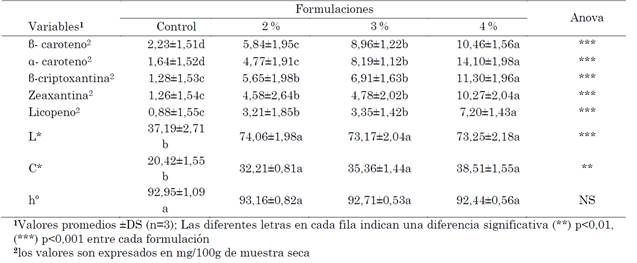
Fuente: elaboración propia.
El análisis de Anova revela que existen diferencias significativas entre el control y las formulaciones con el subproducto de la mandarina, excepto en el parámetro de color hº (Tabla 3). En el caso de los carotenoides, se observa un aumento significativo de estos pigmentos en el pan al incrementar la harina de epicarpio de mandarina (Tabla 3). [13], [18] y [39], [40], [41] concuerdan con nuestros resultados al utilizar subproductos de frutas en la formulación de productos horneados.
Por otra parte, al comparar las concentraciones presentes de estos pigmentos en el epicarpio deshidratado y el pan, se observa una reducción de carotenoides (Tabla 2, y 3). Autores como [42] afirman que estas pérdidas pueden estar asociadas a los procesos de amasado y horneado, a la incorporación de agua, y al oxígeno en la masa, que permite la activación de la lipoxigenasa (lox), responsable de la oxidación enzimática de los ácidos grasos poliinsaturados, que a su vez desencadena la oxidación de los carotenoides, que, a su vez, durante temperaturas de cocción pueden iniciar procesos de oxidación e isomerización en los carotenoides. Las pérdidas de carotenoides durante la producción de alimentos horneados han sido reportadas previamente por [13], [18], [39]-[41].
En el pan, los atributos de color (L*) y cromaticidad (C*) aumentan significativamente al incrementar el epicarpio de mandarina en la formulación (Tabla 3). Los resultados de L* y C* no se ajustan a los registrados previamente por [13]. Por otra parte, el hecho de que no existan diferencias significativas del tono (hº) entre el control y las formulaciones propuestas en el presente estudio indica que los productos evaluados (control y formulaciones con subproducto) generan una percepción de color amarillo al ser revisados con las coordenadas ciel*a*b*, evidenciando el potencial agroindustrial de este residuo como una alternativa de aditivo colorante en la elaboración del pan.
La explicación de esta propiedad en el pan elaborado con epicarpio de mandarina está asociada a la presencia de carotenoides en este subproducto, tal como se ha registrado previamente en la Tabla 2.
4. CONCLUSIONES
En el presente estudio se puede concluir que el epicarpio deshidratado de mandarina de variedad Oneco es una importante fuente de carotenoides y compuestos antioxidantes que podrían ser utilizados como aditivos naturales en la industria alimentaria, farmacéutica y cosmética. Por otra parte, el proceso de deshidratación reduce significativamente la intensidad del color amarillo en el epicarpio de mandarina; sin embargo, este subproducto podría ser una importante alternativa de aditivo colorante natural en la elaboración de pan.
Se recomienda desarrollar estudios sobre estabilidad, calidad y análisis sensorial del pan formulado con la harina de epicapio de mandarina durante el almacenamiento.