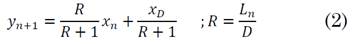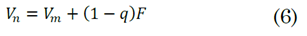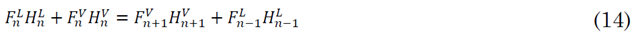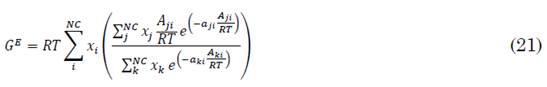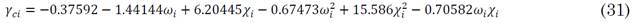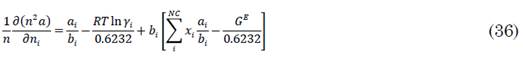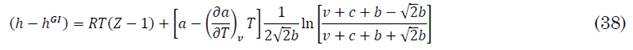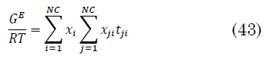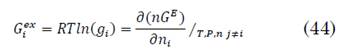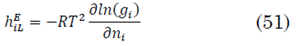1. INTRODUCCIÓN
La destilación es la operación de separación más antigua y la operación unitaria más ampliamente utilizada en la industria [1]. Esta utiliza principios de separación: transferencia de calor y masa, equilibrio termodinámico; poniendo como criterio la temperatura de ebullición de la sustancia más volátil. En el proceso de separación hay tres etapas: 1) Formación de dos fases, 2) transferencia de calor y masa entre las fases y 3) separación de fases. La destilación es una técnica comúnmente utilizada para la separación de mínimo un componente de una corriente líquida con puntos de ebullición relativamente diferentes. Este proceso permite fraccionar los componentes de la mezcla de acuerdo con su volatilidad relativa para así obtener una corriente con el producto más volátil y otra rica en el menos volátil. Para la separación del etanol se utiliza la destilación convencional, generalmente en dos fases, para obtener una mezcla cercana a la azeotrópica (mezcla líquida cuyo punto de ebullición es constante). En el punto azeotrópico la composición en el vapor es idéntica a la composición en el líquido.
Para su deshidratación y purificación, esta mezcla debe ser tratada mediante operaciones de separación no convencionales: destilación azeotrópica, destilación extractiva y destilación a vacío, y así obtener purezas superiores a 95⁄5 vol.% etanol/agua, que son las utilizadas en la mezcla con gasolina [2] .
La simulación de una columna de destilación binaria representa un problema interesante en el diseño de control no lineal, como resultado de la dinámica compleja que involucra en el sistema interacciones termodinámicas presentes en cada etapa, la interacción entre las corrientes internas y externas del sistema, alta no linealidad y la distribución de composición y temperatura en la columna de destilación [3]. Normalmente los equipos utilizados para este proceso son ineficientes debido a que solo se usa una pequeña porción de la columna, es decir, las etapas inferiores para la separación principal, mientras que las otras etapas son las responsables del refinado de los productos [4].
Los ingenieros químicos emplean diversos modelos termodinámicos con el fin de dar precisión y exactitud a los balances de materia y energía con el cálculo de propiedades físicas y termodinámicas.
Uno de esos modelos es las ecuaciones de estado (EoS - Equation of State) [5].
Las EoS son consideradas como el fundamento de los modelos termodinámicos porque son utilizadas para realizar cálculos de equilibrio de fase y al mismo tiempo para calcular propiedades térmicas y volumétricas en amplios rangos de temperatura y presión. Además, se emplean modelos de actividad con el fin de modelar el equilibrio que involucre fases líquidas de sistemas no ideales, y el coeficiente de actividad se puede utilizar como una medida de la desviación de una solución con respecto a la solución, como si fuera ideal a la misma temperatura y presión. En general, una EoS se puede clasificar como ecuaciones de referencia, cúbicas o de base molecular. En la literatura [6]. se encuentran EoS cúbicas disponibles, como Soave-Redlich-Kwong, ecuación que puede extenderse con éxito a los cálculos de equilibrio vapor-líquido de múltiples componentes, y para mezclas de sustancias no polares; y Peng-Robinson para predecir la presión de vapor y el comportamiento volumétrico de los sistemas de componentes individuales, el comportamiento de la fase y el comportamiento volumétrico de los sistemas binarios, ternarios y multicomponentes. Dicha ecuación propuesta combina simplicidad y precisión.
Básicamente un modelo de actividad es una expresión para la energía libre de Gibbs en exceso de una solución no ideal.
En la literatura existen múltiples modelos de actividad como Margules, Wilson, Renon y Prausnitz [5], [6].
El modelo de Margules surge del análisis de la forma de la gráfica de Gexceso en función de la composición para mezclas binarias de líquidos simples [6]. El modelo de actividad Non-Random Two Liquid (NRTL) parte de la idea básica del modelo de Wilson, Renon y Prausnitz, este desarrolló la ecuación que se basa en el concepto de composición molar local y estos definen las fracciones molares similares a Wilson, pero introducen un parámetro de interacción binaria adicional característico de la condición de no azar de la mezcla [7].
Algunas investigaciones trabajan destilación de estos compuestos por membrana utilizado modelos matemáticos integrales considerando tres soluciones de transferencia de masa en el modelo [8].
Carey y Lewis utilizaron el método Othmer para obtener resultados precisos de mezclas alcohol etílico y agua a 1 atm con el propósito de obtener un buen cálculo de la eficiencia de una torre de platos [9].
Otros autores, tales como Ravagnani y col., se interesaron en la destilación extractiva de alcoholes, en especial utilizando solventes convencionales [10].
Por otra parte, la destilación por lotes o discontinua es de gran interés en algunos procesos de recuperación de alcoholes (foreshoots y fintas) [11].
En este trabajo se analiza el funcionamiento y modelamiento de una torre de destilación continua (TDC) y una torre de destilación discontinua (TDD), ubicadas en el laboratorio de Operaciones Unitarias (OO.UU.) de la Universidad Pontificia Bolivariana sede Medellín. La simulación de la TDC se realizó mediante cálculos matemáticos y métodos de McCabe-Thiele y riguroso para el cálculo de número de etapas teóricas, razón de reflujo total y mínimo, mediante la EoS modificada FVHV y un modelo de actividad Non-Random Two Liquid (NRTL).
La exigencia y precisión de los resultados en la simulación dependen del cálculo de las propiedades. Por tal motivo, se optó por calcular las propiedades con la ecuación FVHV ya que esta tiene la ventaja con respecto a otros modelos de predecir propiedades a baja presión [12].
En el caso de la torre discontinua, se utilizó como método de solución el método de Euler para la evaluación de un proceso discontinuo y la efectividad de la destilación en una columna con empaque y sin empaque. En la EoS modificada FVHV [12] se calcularon los parámetros de mezcla binaria con datos de equilibrio líquido vapor y entalpía de exceso y así obtener una mejor aproximación. Normalmente estos parámetros solo se calculan con los datos de equilibrio líquido vapor.
2. METODOLOGÍA
La concentración de la solución de alimentación se estableció entre 10 % y 15 %, ya que en los procesos de fermentación no se alcanza un porcentaje mayor al 20 % [11]. A continuación, se describen las dos torres utilizadas, los balances de materia y energía, y los modelos matemáticos utilizados para la operación del proceso en continuo y en discontinuo.
2.1 Descripción de equipos
2.1.1 Torre de destilación continua (TDC)
La TDC piloto es una columna de destilación marca GUNT, que cuenta con ocho etapas de equilibrio, platos perforados de acero inoxidable, un diámetro externo de 6 cm, altura de la columna de 78 cm y altura total de 130 cm hasta el condensador total de 0.04 m2. Además, cuenta con un rehervidor con resistencia eléctrica con potencia máxima de 4000 W y capacidad máxima de 10 litros. La torre tiene opciones de alimentación en los platos 1, 3, 5 y 7, la cual se puede precalentar con un intercambiador de calor de 0.03 m2. Además de opciones de operación a vacío y reflujo. La alimentación a la columna se hace por la etapa más próxima al rehervidor, en este caso es el séptimo plato, debido a que la corriente alimentada se encuentra a baja temperatura y concentración.
En la Fig. 1 se presenta una fotografía de la torre de destilación continua de platos perforados marca GUNT con las partes más importantes (A: Condensador total, B: Recipiente receptor del destilado (Tanque IV), C: Válvulas magnéticas para relación de reflujo (L/D), la primera válvula de izquierda a derecha corresponde a la válvula 10 y la segunda corresponde a la válvula 7, D: Rotámetro para agua de entrada al condensador, E: Columna de platos, F: Rehervidor, G: Medidor de nivel del rehervidor, H: Intercambiador de calor, I: Bomba peristáltica para alimentar la torre, J: Tanque de almacenamiento de las colas (Tanques VIII A y B), K: Tanque depósito de alimentación (Tanque VI A y B), L: Panel de control, M: Tanque de producto (Tanque V), N: Sistema para vacío de la columna, Ñ: Tanque para solvente extractor.
2.1.2 Torre de destilación discontinua (TDD)
La sección recuperación de solventes de una planta piloto marca Didacontrol se adecuó como una torre de destilación discontinua (TDD). La torre está rellena con anillos tipo pall, con una altura de 120 cm y un diámetro externo de 9 cm, rehervidor con resistencia eléctrica con una potencia suministrada máxima de 1000 W y capacidad máxima de 15 L, y un condensador total adaptado a un chiller.
En la Fig. 2 se presenta una fotografía de la torre empacada de destilación discontinua (TDD) con las partes más importantes (A: Condensador total, B: Recipiente receptor del destilado, C: Columna empaca, D: Tanque rehervidor, E: Medidor de nivel del rehervidor, F: Indicador de temperatura rehervidor, G: Indicador de temperatura torre). La planta tiene la opción de operar la torre a vacío y con reflujo, control de potencia o temperatura en el rehervidor. En la Fig. 3 se presenta una fotografía de los anillos tipo pall de acero inoxidable de 1”.
Las propiedades termodinámicas del etanol y el agua se obtuvieron por medio del complemento en Ms. Excel para consulta de propiedades termodinámicas de sustancias puras desarrollado por Luis A. Forero y Jorge Alberto Velázquez [12].
Esta información es necesaria para el planteamiento de las propiedades de la mezcla en los balances de equilibrio y de energía. Los balances que se deben plantear para la destilación continua están dados por el análisis de grados de libertad, teniendo en cuenta las suposiciones hechas por el modelo continuo tales como, derrame molar constante para un proceso en estado estacionario, torre adiabática [13] y las suposiciones hechas para la simulación discontinua como equilibrio entre el vapor y el líquido en todo el proceso, y la inexistencia de líquidos a la entrada del condensador [14].
2.2 Modelos matemáticos y simulación
2.2.1 Método McCabe-Thiele y destilación con reflujo
McCabe y Thiele han desarrollado un método matemático gráfico para determinar el número de platos o etapas teóricas necesarios para la separación de una mezcla binaria. Este método usa balances de materia con respecto a ciertas partes de la torre, que producen líneas de operación y la curva de equilibrio y-x para el sistema. Cabe destacar que la principal suposición del método de McCabe-Thiele consiste en que debe haber un derrame equimolar a través de la torre, entre la entrada de la alimentación y el plato superior y la entrada de la alimentación y el plato inferior [15].
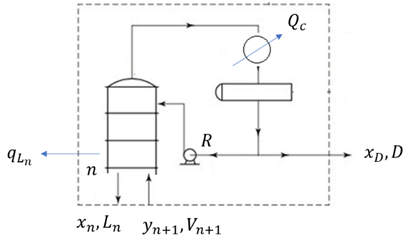
La parte superior de la torre por encima de la entrada de la alimentación recibe el nombre de sección de enriquecimiento (Fig. 4), debido a que la alimentación de entrada de la mezcla binaria de componentes A y B se enriquece en esta sección, por lo que el destilado es más rico en A que en la alimentación.
Realizando un balance total de materia con en la sección de enriquecimiento, respecto al componente A y despejando la composición del vapor en el plato n+1 (yn+1), se obtiene (1):
Donde L n es el flujo de la corriente líquida que sale del plato n, x n es la composición del líquido en el plato n, D es la corriente del producto destilado, x D la composición del destilado, y V n+1 es la corriente de vapor proveniente del plato n+1. Reorganizando esta ecuación en términos de la razón de reflujo interno (R) se relacionan las composiciones de dos corrientes en contacto (2):
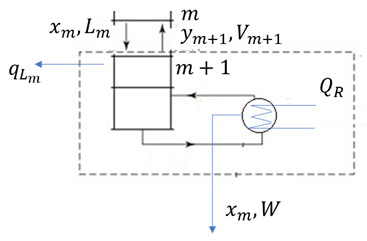
La parte inferior de la torre, por debajo de la entrada de la alimentación, se conoce como la sección de despojo (Fig. 5).
Planteando un balance total de materia en la sección de empobrecimiento, del componente A y despejando la composición del vapor en el plato m+1 (V m+1 ) se obtiene (3):
Donde L m es el flujo de la corriente líquida que sale del plato m, x m es la composición del líquido en el plato m, V m+1 es la corriente de vapor que entra al plato m, W es la corriente del producto residual, y x w la composición de corriente del producto residual. Se debe tener en cuenta que se supone un flujo equimolar, por lo tanto, L m =L n y V m =V n .
Para facilidad del cálculo, las condiciones de alimentación se presentan con la cantidad q (4), y esta se define como el calor necesario para vaporizar 1 mol de alimentación en las condiciones de entrada sobre el calor latente molar de vaporización de la alimentación.
Donde H V es la entalpía de la alimentación a las condiciones del punto de rocío, H L es la entalpía de la alimentación a las condiciones del punto de ebullición (punto de burbuja), y H F es la entalpía de la alimentación a las condiciones de entrada. Si la mezcla entra en su punto de ebullición el valor de q es 1 y si la mezcla entra en su punto de rocío el valor de q será 0. Para valores de q>1 es una mezcla líquida en frío y para valores <0 es un vapor sobrecalentado. También se puede considerar a q como el número de moles de líquido saturado producido en el plato de alimentación por cada mol de alimentación que penetra a la torre en la corriente de alimentación F. Con base en la definición de q, se pueden establecer (5) y (6) que son la relación entre los flujos por encima y por debajo de la entrada de alimentación, respectivamente.
Al realizar tratamientos matemáticos de las ecuaciones se puede llegar a la expresión de la línea q (7), que establece la intersección de ambas líneas de operación, la intersección de la línea q con la línea de 45°, en donde x = y x F , donde xF es la composición total de la alimentación [16].
2.2.2 Modelo torre de destilación continua
La destilación por etapas con reflujo se puede considerar desde un punto de vista simplificado como un proceso en el cual se lleva a cabo una serie de etapas de vaporización instantánea, de manera que los productos gaseosos y líquidos de cada etapa fluyen a contracorriente. El líquido de una etapa se conduce o fluye a la etapa inferior y el vapor de una etapa fluye hacia arriba, a la etapa superior.
Por consiguiente, en cada etapa entra una corriente de vapor V y una corriente líquida L, que se mezclan y alcanzan su equilibrio. Las propiedades de la torre deben llegar a un punto en el cual no cambien, ya que se llega a un estado estacionario y se habla de un sistema estacionario cuando las variables que definen un proceso permanecen invariantes en el tiempo, matemáticamente para todas las propiedades p del sistema la derivada parcial es nula para toda t. Se plantea un balance de materia para cada plato de la torre, (8) a (11) plato superior, plato de alimentación, plato inferior y torre, respectivamente, donde el plato inferior, superior y el de alimentación tienen un tratamiento especial [15].
En el plato inferior se suministra energía con el fin de vaporizar la mezcla y en el plato superior se retira energía con el fin de condensar los vapores que dan cabida al destilado.
En este balance de energía se puede conocer la temperatura a la cual se encuentra el plato, y eso con el fin de llevar un buen control en la torre, el perfil de temperatura también debería llegar a un estado estacionario, (12) a (14), plato superior, plato inferior y torre respectivamente. Se debe tener en cuenta que en el plato superior se tiene un condensador total, el cual no lleva a tener una restricción y en el plato inferior se busca que la potencia suministrada por la resistencia sea igual en la simulación y en la experimentación.
2.2.3 Modelo torre destilación discontinua
En este tipo de destilación se tiene un líquido y este se vaporiza lentamente, los vapores formados por calentamiento se extraen con la misma rapidez con que se forman, condensándolos posteriormente (destilado). La primera porción de destilado es más rica en la sustancia más volátil y a medida que se procede con la vaporización el líquido es más pobre en la sustancia A. La composición del recipiente varía con el tiempo, por lo tanto, se supone que ésta vaporiza una porción de volumen diferencial (dV) en un tiempo diferencial (dt) (15). Se realiza un balance de materia, donde el flujo de vapor que sale (F V sal ), es equivalente a la diferencia entre el volumen inicial de líquido (V L t ), y el volumen remanente de líquido (V L t+dt ) en un tiempo t.
Por consiguiente, se debe plantear el balance de energía para este sistema, con el fin de calcular la temperatura del equilibrio (16).
Donde H L t y H L t+dt son las entalpias del líquido en un tiempo t y t+dt, U V o es la energía interna del líquido en t=0.
2.2.4 Ecuación de estado cúbica
La ecuación de estado de Peng-Robinson (17) que relaciona la presión (P), la temperatura (T) y el volumen (v) fue modificada por Luis Forero y Jorge Velásquez [17].
Donde a, b y c en la ecuación de Peng-Robinson son los parámetros de la mezcla que están en términos de temperatura crítica, presión crítica y la constante de los gases ideales.
Esta ecuación de estado modificada tiene varias ventajas sobre las existentes.
Debido a que todos los parámetros de las sustancias puras están generalizados en términos de propiedades críticas, la ecuación tiene un buen ajuste tanto para sustancias polares como no polares.
Su extrapolación a mezclas muestra resultados muy satisfactorios utilizando la regla de mezclado Huron-Vidal con el modelo de actividad NRTL. El modelo de actividad NRTL se ha elegido por su versatilidad en el trabajo de varias fases con sustancias polares [18].
Los parámetros Aij, Bij, Cij y (ij de la mezcla se pueden calcular a partir de las reglas de mezcla (Tabla 1). Se presenta un nuevo tipo de reglas de mezcla que combinan las fortalezas de los modelos de actividad con la EoS cúbica. El punto de arranque para derivar la mayoría de estas reglas de mezcla viene de igualar la energía libre de Gibss en exceso (GE) que se obtiene a partir de la EoS cúbica con el modelo de actividad a una presión dada.
Tabla 1 Parámetros de interacción para la ecuación de estado cubica FVHV

Fuente: elaboración propia.
La regla de mezcla de Huron-Vidal fue la primera de este tipo (1979), y utiliza como referencia una presión infinita.
Utilizando el modelo de actividad NRTL el cálculo de los parámetros a (18), b (19) y c (20) de la mezcla con esta regla se plantea una expresión para GE (21) y en los factores Aij que corresponden a una matriz de interacciones moleculares de los compuestos consigo mismos y con los demás compuestos (22).
Los parámetros de las sustancias puras se calculan a partir de la temperatura del sistema y las propiedades críticas de cada componente (TCi, PCi) y los factores acéntricos (i y polar ci mediante las siguientes (23) a (31).
Para el cálculo del volumen conviene expresar la ecuación como una ecuación cúbica adimensional en el factor de compresibilidad y resolviendo de forma analítica se obtienen tres raíces reales, la raíz de mayor valor corresponderá al factor de compresibilidad del vapor y la de menor al factor de compresibilidad del líquido.
Utilizando el factor de compresibilidad (Z) se puede calcular el volumen molar (32).
Sustituyendo en la ecuación cúbica modificada se obtiene la siguiente expresión para el cálculo del coeficiente de fugacidad por (33) a (36).
Para el cálculo de la entalpía conviene reconocer que la entalpía de una mezcla de gases ideales h GI a (T, P) está dada por (37).
La diferencia entre la entalpía real de la mezcla (h) y la entalpía del gas ideal se calcula utilizando la ecuación de estado modificada, tal como se representa en (38).
Esta expresión es válida para cualquier regla de mezcla, la que fija el valor de la derivada de a. Para las reglas de mezclado de Huron-Vidal se obtienen (39) a (41).
Existe una variedad de modelos para las capacidades caloríficas de gas ideal (C GI pi ). Se prefiere el uso del modelo de Bures [12], ya que este utiliza tan solo tres parámetros y además es adecuado para extrapolar a altas y bajas temperaturas, donde las constantes B1i, B2i y B3i son características de cada sustancia (42):
2.2.5 Modelo de actividad
Para modelar el equilibrio L-V, se usó la ley de Raoult modificada y para ello es necesario un modelo para calcular los coeficientes de actividad (gi). Se utilizó la ecuación NRTL, la cual tiene ventajas sobre otros modelos, este modelo se fundamenta en el uso de las llamadas “Composiciones Locales”, las cuales están influenciadas por las diferencias de tamaño molecular y las fuerzas intermoleculares [19]. Las composiciones locales generalmente son diferentes a las composiciones globales o medibles del sistema. La ecuación NRTL para la energía libre de Gibbs en exceso se representa en (43):
Los coeficientes de actividad se calculan a partir de la definición de la energía libre de Gibbs en exceso parcial (44):
Para la ecuación NRTL se obtiene (45):
Donde Gji = e-∝ ji t ji. Los parámetros (ij están dados por (46).
Las g representan energías de interacción entre las moléculas, estos parámetros varían con la temperatura. Para el caso se supone una dependencia lineal de acuerdo con (47).
El parámetro α ji =α ij , caracteriza la tendencia de la especie j y la especie i a no distribuirse al azar. Cuando α ji =0 las fracciones molares locales son iguales a las fracciones molares de la solución global.
Este parámetro es una propiedad de la mezcla y se toma el valor de este de acuerdo con ciertas reglas. En la Tabla 2 se presentan los parámetros de interacción, Aij, Bij y (ij, para el modelo de actividad NRTL.
En este caso, como se trabaja con un modelo de actividad y no una ecuación de estado, el criterio de equilibrio se trasladará a la ley de Raoult modificada, dicha ecuación involucra el coeficiente de actividad g i . Este método es conocido como el modelo de equilibrio en sistemas ideales (48), donde el sistema se puede considerar a presiones lo suficientemente bajas para aceptar la definición de idealidad en el vapor y toma en cuenta que los componentes en la fase líquida son muy similares y no interactúan de forma apreciable entre sí [20].
Para el cálculo de la entalpía es necesario reconocer un estado de referencia de sustancias elementales (C, N, O) a 25°C, 101.325 kPa y por medio de las capacidades caloríficas de Bures, la ecuación de presión de vapor de Wagner y el modelo NRTL se obtiene la entalpía de la mezcla líquida (hL). Para la mezcla en vapor se asume un vapor ideal (49) a (52).
Para el cálculo del volumen de la mezcla en estado líquido (V L ) (se usó la ecuación de Rackett (53) y para el vapor se asume como gas ideal, por las razones anteriormente mencionadas.
Donde VC, ZC y TR son el volumen crítico, factor de compresibilidad y temperatura critica respectivamente.
3. RESULTADOS
3.1 Simulación y experimentación en torre de destilación continua
Mediante el uso de Ms Excel®, se procedió a realizar la simulación del proceso suponiendo estado estacionario y utilizando como método el modelo matemático de McCabe-Thiele, que es útil para determinar el número de etapas teóricas gráficamente para la destilación binaria. Las variables de alimentación, flujo volumétrico y concentración de la mezcla a alimentar fueron previamente establecidas haciendo uso de los valores reportados en investigaciones.
A partir de los métodos matemáticos previamente mencionados se encontraron las demás variables involucradas en el proceso de destilación como: potencia en el rehervidor, flujo de agua en el condensador, flujo de destilado (D), flujo de colas (B) y relación de reflujo (R). En la Tabla 3 se resumen las condiciones a las cuales se realizó la simulación para el método gráfico con la ecuación de estado y el modelo de actividad, respectivamente.
Tabla 3 Resumen de condiciones operacionales de simulación por método gráfico

Fuente: elaboración propia.
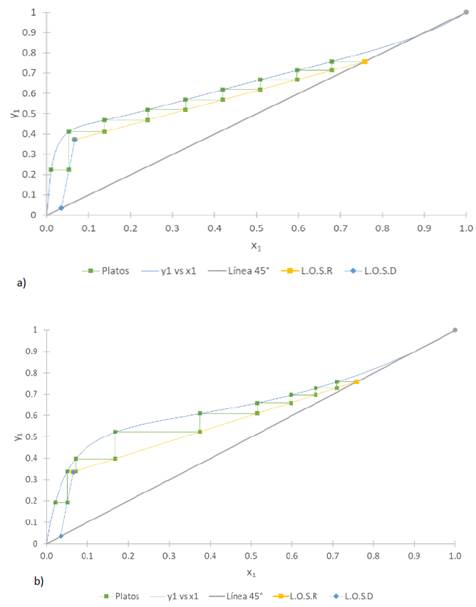
En la Fig. 6 se representa el número de etapas teóricas calculadas a partir del modelo McCabe-Thiele para la ecuación de estado y el modelo de actividad.
Fuente: elaboración propia.
Fig. 6 Número de platos teóricos para una mezcla etanol-agua por el modelo McCabe-Thiele a) ecuación de estado y b) modelo de actividad
La simulación que se realiza con la ecuación de estado y con el modelo de actividad es un método más complejo que el método de McCabe-Thiele, ya que, para un sistema de 2 compuestos, con 9 etapas de equilibrio y un condensador total se obtiene un sistema de 49 ecuaciones no lineales, las cuales se resolvieron en Ms.
Excel utilizando el complemento Homosolver® [21]
Como se observa en la Fig. 6 la relación de reflujo mínima en ambos casos está dada por corte y no por tangencia y la relación de reflujo se definió como 1.4 veces el Rmin. Los platos teóricos calculados son nueve tanto para la ecuación de estado como para el modelo de actividad. Entre la línea de operación para la sección de rectificación (L.O.S.R.) y la línea de operación para la sección de despojo (L.O.S.D) se puede encontrar el plato de alimentación óptimo que en este caso sería el plato ocho para ambos casos dado que la alimentación está poco concentrada en etanol.
Ahora con el fin de contrastar los valores de la experimentación con la modelación, se realizaron simulaciones sobre cada etapa. A partir de estos datos se obtuvieron los perfiles tanto de concentración como de temperaturas de la torre, en la que se tuvieron en cuenta las interacciones moleculares y los equilibrios dados por el criterio de isofugacidad y ley de Raoult modificada, según el caso.
La experimentación en la torre de destilación continua comenzó con el arranque de ésta como un sistema cerrado, fijando la potencia entregada al rehervidor en 430 W, la cual fue determinada a partir del método McCabe-Thiele con un balance de energía (Tabla 3). Después de que se da el primer retorno se enciende la bomba de alimentación a razón de 55.25 ml/min (25 %) y concentración másica de 10.7 % w/w de etanol y cuando se da una estabilidad en el perfil de temperatura se procede a obtener el flujo de destilado ajustando la relación de retorno al 45 %.
Al realizar la alimentación de la solución líquida, ésta fluye hacia la parte inferior de la torre hasta el rehervidor, donde se empieza a generar vapor.
Posteriormente, éste llega a la alimentación en contacto con líquido a partir de la alimentación empieza a ascender solo vapor hasta llegar al condensador donde se forma el líquido y allí cuando el líquido empieza a descender hasta llegar al rehervidor es donde termina la iniciación, luego se toma como un conjunto de ecuaciones y no plato por plato, como se hacía anteriormente.
La alimentación a la columna se sugiere que se realice en la etapa más próxima ya que no afecta en gran proporción el calentamiento y el refinado de la torre, y a su vez la eficiencia de la torre [17].
Las variables de arranque serían la potencia, el flujo retirado del condensador y el flujo de agua que pasa a través del condensador (asegurando que no se esté subenfriado el líquido ya que esto puede generar un gran error en el cálculo de platos), la relación de reflujo se calcula como L/D [14].
Las variables de operación de mayor interés en el proceso son la concentración del destilado y las colas a las cuales se les hizo un seguimiento para asegurar el estado estacionario. El comportamiento de temperaturas se hizo en cada una de las etapas de equilibrio y la composición se monitoreó solamente evaluando el cambio de la concentración del destilado en el tiempo.
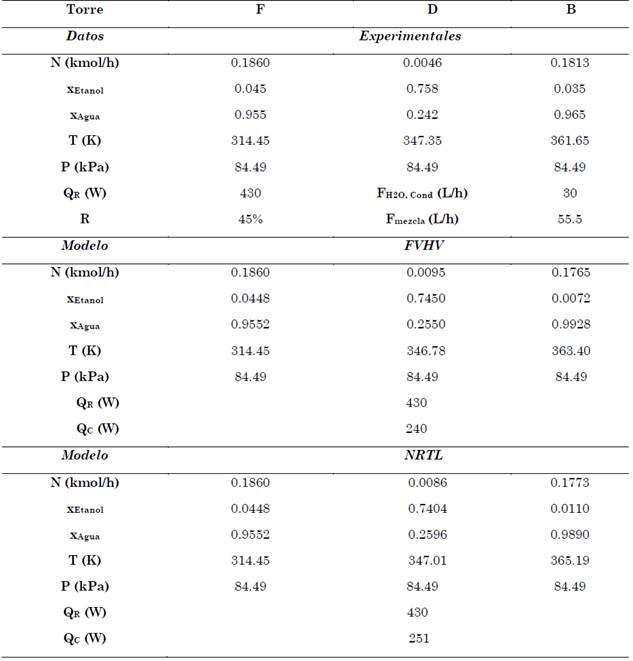
En la Tabla 4 se presentan los valores de flujo másico, composición, temperatura y presión para cada una de las corrientes.
Adicionalmente, se presenta el flujo de calor del rehervidor y del condensador del proceso de destilación obtenido por los modelos FVHV, NRTL y experimentalmente. En las condiciones de operación experimental de la TDC en estado estacionario se puede observar que la fracción molar del etanol de alimentación fue de 0.045 y en la corriente del destilado (D) fue de 0.758. El valor de R es la relación de retorno de destilado expresado por el controlador del equipo en porcentaje (%) y se debe entender como la relación entre el tiempo de apertura de la válvula de conmutación 10 y la suma de tiempos de apertura de las válvulas de conmutación 7 y 10 (C en Fig. 1).
A partir del método gráfico de McCabe-Thiele se encontró que las etapas mínimas de equilibrio para este proceso son 9 y la torre en la cual se trabajó solo consta de 8 etapas de equilibrio (Fig. 1). De acuerdo con los referentes teóricos, la etapa de alimentación debe estar en un plato por encima del rehervidor, es decir, en la simulación se realizaron 9 etapas de equilibrio más un condensador total y la alimentación quedó en la etapa 7, en la experimentación se tienen 8 etapas de equilibrio y condensador total y la alimentación se realizó en la etapa 6.
La etapa de alimentación apropiada es la etapa 8 según el modelo de McCabe-Thiele con la EoS, sin embargo, con el modelo de actividad no se cumple la teoría ya que con este modelo la etapa de alimentación sería la etapa 7.
Se podría decir que, si solo se considera el cálculo del plato de alimentación, la EoS tiene una mejor aproximación a la experimentación respecto al modelo NRTL.
Los valores de temperatura en cada etapa y composición del destilado se registraron cada 5 min después de alcanzadas las condiciones de estado estacionario. En la Fig. 7 se presenta el perfil de concentraciones en función de las fracciones molares en cada etapa de equilibrio (eje izquierdo) calculadas por medio de los modelos NRTL y FVHV, y el perfil de temperaturas experimental y las temperaturas calculadas por medio de los modelos (eje derecho). En la Fig. 7 se puede observar que los valores de la temperatura experimental son muy similares a los dos modelos entre las etapas 1 y 4, pero en la etapa 5 los valores experimentales son menores que los obtenidos por ambos modelos. A etapas mayores, las temperaturas experimentales son menores que las del modelo NRTL, pero mayores para el modelo FVHV. Respecto a los valores de composición obtenidos por los modelos, son bastante similares, aunque al no tener datos experimentales no se puede decir cual tendencia se aproxima más.
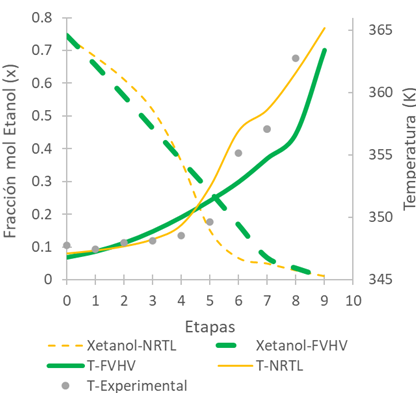
Fuente: elaboración propia.
Fig. 7 Perfil de fracciones molares y temperaturas para la TDC y solución etanol-agua
En la Tabla 5 se presentan los porcentajes de desviación absoluta promedio (AADT por sus siglas en inglés - Average Absolute Deviation Temperature) en términos de la temperatura experimental con el modelo de actividad NRTL y la ecuación de estado FHVH).
Tabla 5 Desviación absoluta promedio de la temperatura (AADT) para la TDC

Fuente: elaboración propia.
Los valores de AADT para ambos modelos presentan una desviación considerablemente baja (< 1 %), por tal motivo se podría decir que el modelo NRTL tiene un mejor ajuste, sin embargo, no concuerda con la teoría expuesta por Geankolis [13] referente al plato de alimentación.
3.2 Simulación y experimentación en torre de destilación discontinua con empaque y sin empaque
Mediante el uso de Ms Excel®, se procedió a realizar la simulación del proceso utilizando como modelo matemático el método numérico de Euler que predice un nuevo valor usando la pendiente que es igual a la primera derivada en el valor original de la variable dependiente para extrapolar linealmente sobre un tamaño de paso h [22], proceso propuesto por Distefano [23]. Por otra parte, Chapra y Canale sugieren que es posible reducir el error usando un tamaño de paso pequeño [24]. En el caso de la TDD, luego de realizar varios ensayos preliminares, se encontró que el tamaño de paso más apropiado era de 2 min para disminuir los tiempos de convergencia y a su vez los errores.
Mediante los métodos matemáticos previamente mencionados se encontraron las demás variables involucradas en el proceso de destilación como: potencia en el rehervidor, flujo de agua en el condensador y flujo de destilado, suponiendo la inexistencia de líquidos en la torre empacada. Al realizar la simulación se obtiene el perfil de concentración y de volumen del destilado en el tiempo. En la Tabla 6 se resumen las condiciones a las cuales se realizó la simulación para el estado transitorio en la torre con empaque y sin empaque respectivamente.
Tabla 6 Condiciones operacionales de la TDD con empaque y sin empaque para simulación

Fuente: Fuente: elaboración propia.
El proceso de destilación discontinuo se inició con la adecuación de la torre empacada de la zona recuperación de solventes realizándole un aislamiento adecuado, con el propósito de disminuir cualquier enfriamiento o condensación del vapor antes de que entre en el condensador. Las pérdidas hacia los alrededores por convección de la torre sin el aislante se calcularon en 90 W.
El rehervidor se llenó con 12 litros de una solución de etanol al 12 % w/w, se fijó una potencia en el rehervidor de 790 W mediante un balance de energía que se le realiza a la solución, la estabilidad de la torre se alcanza cuando la temperatura en el rehervidor es aproximadamente igual a la temperatura de la salida de la torre, la torre se operó a presión atmosférica y sin reflujo. Experimentalmente, en la TDD con el empaque se obtuvo el primer destilado después de 6 min de operación, mientras que con el empaque se obtuvo a los 8 min.
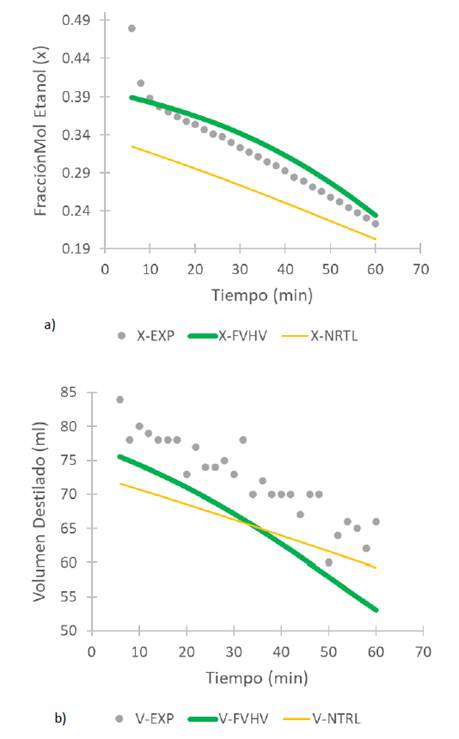
En la Fig. 8 se contrastan los valores de fracción molar y volumen del destilado, experimental y calculado con los modelos FVHV y NRTL en función del tiempo de una solución etanol-agua en la torre sin empaque, y en la Fig. 9 para la torre empacada.

Fuente: elaboración propia.
Fig. 8 Perfil de a) concentración y b) volumen del destilado en función del tiempo para la TDD sin empaque de una solución etanol-agua
Fuente: elaboración propia.
Fig. 9 Perfil de a) concentración y b) volumen del destilado en función del tiempo para la TDD con empaque de una solución etanol-agua
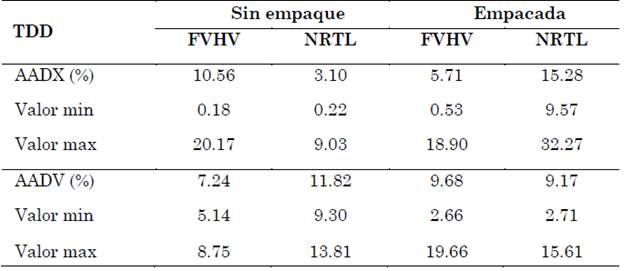
En el caso de la fracción molar se puede decir que el modelo NRTL tiene un mejor ajuste para la torre sin empaque, mientras que el FVHV se ajusta mejor para la torre empacada. En el caso del volumen de destilado, no se observa un buen ajuste con los dos modelos, aunque los valores simulados a los experimentales se acercan más para la torre empacada. En la Tabla 7 se presentan el porcentaje de la desviación absoluta promedio para el volumen (AADV) y para la concentración (AADX) de la TDD con la EoS y el modelo NRTL, respectivamente, para la torre sin y con empaque. Los errores obtenidos son relativamente considerables ya que superan el 5 %.
4. ANÁLISIS Y DISCUSIÓN
Thor Mejdell y Sigurd Skogestad en su investigación indicaron que para columnas de destilación piloto, con bajo diámetro de columna y menor a 12 etapas de equilibrio, se suelen trabajar con alimentaciones entre los 50 y 85 ml/min ya que se garantiza un correcto funcionamiento del proceso de destilación y a su vez evita posibles problemas de operación como inundación de la columna [25].
Estos resultados son consistentes con el comportamiento de la TDC y los resultados experimentales, ya que al escoger un flujo volumétrico de 55.25 ml/min se alcanzaron en un tiempo corto las condiciones de estado estacionario y valores de composición del destilado altas ((88 % wt).
La selección de la potencia del rehervidor es un parámetro importante ya que influye en la velocidad de transferencia de masa del proceso de destilado. Gomis y col. [26] evaluaron varias mezclas de etanol, agua e hidrocarburos, concluyendo que en todas las mezclas estudiadas se recomienda trabajar con potencias inferiores a los 600 W. Además, los experimentos se realizaron utilizando bajas potencias suficientes para generar un caudal de condensado, pero, también se concluyeron que a medida que la potencia aumenta la corriente de condensado o destilado es más rica en composición de etanol.
Johsen comparó los resultados experimentales de un proceso de destilación con un modelo no lineal [27].
A partir de las experimentaciones encontró que para disminuir el tiempo de estabilización y para que la columna llegue al estado estacionario es necesario establecer el valor de la resistencia eléctrica presente en el rehervidor en su valor máximo para agilizar la evaporación de la solución, y en el momento en que la columna esté a temperatura constante, reducir el valor de la potencia entre un 45 y un 60 % de su valor máximo.
En contraste con este resultado, Vidal [28] encontró en su experimentación que aumentar o disminuir la potencia del rehervidor no afecta de manera directa el perfil de temperaturas a lo largo de la columna de destilación, pero sí afecta la velocidad del proceso de destilado debido al cambio de los movimientos de los flujos internos que influyen directamente en el fenómeno de trasferencia de masa.
Además, argumentó que trabajar con la máxima potencia podría degradar la mezcla y a su vez provocar daños en las paredes internas de la columna y deteriorar el rehervidor. La separación de mezclas de agua y etanol mediante destilación continua está restringida por el punto azeotrópico [29].
A partir de la simulación del proceso de destilación en continuo y en condición de estado estacionario y de acuerdo con las condiciones presentadas en la Tabla 1, se definió como potencia del rehervidor un valor cercano a 430 W. A partir de los resultados obtenidos experimentalmente en la TDC, se puede decir que después de 3 horas de operación la torre alcanzó su estado estable en temperaturas y composición, lo cual concuerda con lo planteado por [26] y [28]. Al comparar en la Fig. 7 los valores medidos de la temperatura en cada plato respecto a los calculados en la simulación, se observó que los valores simulados eran similares a los experimentales, tanto por NRTL como por FVHV, especialmente en la zona de rectificación, mientras que en la sección de despojo se aproxima más el modelo NRTL.
Esto se puede corroborar de acuerdo con los porcentajes de desviación de la Tabla 5, donde los porcentajes son menores al 1%. Al comparar las simulaciones en función de la concentración, dichas curvas son muy similares entre sí, lo cual sugiere un buen desarrollo del modelo utilizando los parámetros por medio del modelo FVHV, sin embargo, no es posible su comparación cuantitativa debido a que experimentalmente no se tiene la opción de toma de muestra.
En el momento de encontrar las etapas teóricas por el método de McCabe-Thiele se encontró que para el sistema con la ecuación de estado se requiere una torre de destilación con 8 etapas de equilibrio (Fig. 6), indicando una eficiencia de la torre como etapas teóricas sobre etapas reales del 100 %, y con una eficiencia de la columna de destilación del 66 % [30].
Los ensayos en la TDC se realizaron varias veces obteniendo los mismo resultados, por lo que se buscó una causa raíz desde los términos de diseño y se encontró que la tubería que está conectada desde el primer plato hasta el condensador tiene una longitud de 86 cm y según lo expresado por Henao [22], la longitud de este tramo de tubería no debería sobrepasar los 30 centímetros, debido a esto se podría deducir un error en términos de diseño de procesos, ya que el tramo de tubería podría estar operando como platos de rectificación adicionales. Entre menor sea la distancia de este tramo de tubería la simulación podría ser más asertiva y con unos cálculos de eficiencias más acordes con la realidad.
En el caso de los resultados obtenidos para el proceso de destilación discontinua, experimentalmente se observó que la primera porción del destilado es la más rica en la sustancia más volátil, tanto para la torre sin y con empaque. En las Fig. 8 y Fig. 9 se puede observar que las simulaciones de ambas torres, con ambos modelos, presentaban tendencias similares. Al simular la fracción molar de etanol en la torre sin empaque, los valores simulados obtenidos por el modelo NRTL presentaron un mejor ajuste que el modelo FVHV, sin embargo, en el caso de la torre empacada se observó un mejor ajuste con el modelo FVHV. Esto concuerda con los valores de AADX y AADV presentados en la Tabla 7.
El volumen de destilado experimentalmente, con y sin empaque (Fig. 8 y Fig. 9), fue mayor que el predicho por ambos modelos. En la Tabla 7 se presentan los errores para la TDD, los errores superan el 5 % lo cual puede llegar a ser considerable en este tipo de procesos, por lo tanto, se puede decir que ninguno de los dos modelos representa el proceso de destilación discontinua. Las diferencias encontradas pueden estar relacionadas con los tiempos de registro del cambio de volumen y composición, los cuales tendrían que realizarse en forma infinitamente lenta, para que el vapor desprendido del líquido esté en cualquier momento en equilibrio con dicho líquido y además por las suposiciones de ambos modelos.
Por otra parte, al realizar los experimentos en la torre discontinua se nota una gran diferencia con respecto a la torre con empaque y sin empaque, tanto en los valores de concentración como de volumen, debido a que en la torre con empaque el vapor necesita más energía para recorrer la torre, lo cual puede generar condensación en el tramo entre el rehervidor y el condensador. Además, en la simulación realizada se supone que inmediatamente el vapor se genera este va al condensador, esta puede ser la razón para la discrepancia entre los datos de la experimentación y la simulación.
5. CONCLUSIONES
Los modelos presentados son altamente robustos para predecir el comportamiento de una torre de destilación continua, ya que los porcentajes de desviación promedio fueron menores a 1 %. Sin embargo, al comparar con los resultados obtenidos por el método de McCabe-Thile, el modelo NRTL no se ajusta completamente a la teoría, ya que los platos reales no deberían ser iguales a los platos teóricos.
La EoS es una herramienta bastante útil, puesto que se asemeja bastante a la realidad ya que los errores son relativamente bajos en la TDC y aceptables para la iniciación de una TDD. Estos resultados podrían ser considerados como un punto de partida para futuras investigaciones, por ejemplo, en las que se determine la incidencia de los datos de entalpía de exceso sobre los parámetros utilizados para la EoS, ya que el valor de es altamente crítico en los coeficientes de fugacidad.