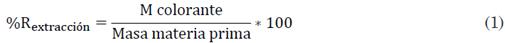1. INTRODUCCIÓN
El árbol de totumo, de nombre científico Crescentia cujete L. [1], es también nombrado “en diferentes regiones de Colombia como calabazo, candongo, calabazo de pico, cuya, mate totumo, mate, pilche, puro, zumbo, totuma, totumillo, totumo candongo, totumo cimarrón, totumo cucharo, totumo grande, totumo mate, totumo, táparo o tapara” [2], [3].
Según [4], es un árbol de copa abierta, con ramas largas y hojas caducifolias. Puede alcanzar alturas entre los 4 y los 14 metros y posee una corteza escamosa. El fruto pasa por formas cilíndricas y ovoides de corteza verde brillante y contiene una pulpa blanca con gran cantidad de semillas elipsoideas. Para [1], se encuentra en regiones tropicales y es una especie semicultivada a todo lo largo de América Tropical. Suele hallarse junto con árboles frutales en casas de campo.
No se tienen datos exactos sobre su producción anual en el país, ya que ha sido un cultivo naturalizado y no se produce a gran escala; sin embargo, con respecto a este, y a muchos otros productos agrícolas, es oportuno mencionar algunas cifras que se conocen sobre el desaprovechamiento de frutas en el país: según el Departamento Nacional de Planeación (DNP), Colombia tiene una oferta nacional disponible de alimentos de 28,5 millones de toneladas; de estas se pierden y desperdician un total de 9,76 millones de toneladas, de las cuales 6,1 millones de toneladas corresponden a frutas [5]. El totumo es una de las frutas menos industrializadas que se desaprovechan en el país, y por esta razón cuenta con poca investigación sobre aplicaciones agroindustriales.
El producto ha demostrado tener propiedades de sanación en enfermedades del aparato respiratorio, por lo cual, en 2008, el Ministerio de Salud y Protección Social añadió el fruto al listado de plantas medicinales aprobadas, con fines terapéuticos, del Instituto Nacional de Vigilancia de Alimentos y Medicamentos (Invima) [6]. También ha tenido incidencia en la producción de vasijas para su venta, así como para uso doméstico y hasta ahora sus aplicaciones han sido principalmente culturales y artísticas. La parte de interés en la presente investigación es el fruto, específicamente el mesocarpio, debido al cambio de color que presenta, para la elaboración de un colorante natural a partir del mismo.
El desarrollo de esta idea involucra tecnologías de producción que tienen un impacto social y económico positivo. Se requiere la creación de nuevas alternativas para la industria, que respondan al cambio y a la resolución de necesidades que el mundo actual está demandando.
Sin embargo, ello presenta inconvenientes diversos, y que, en el caso que nos ocupa, uno de los que surgen en la producción de colorantes artificiales es que al proceder de reacciones sintéticas no enzimáticas dichos colorantes “son altamente resistentes a la acción de sustancias químicas, a algunos procesos físicos y son poco biodegradables” [7].
La metodología con la que se desarrolló la investigación consta de cuatro partes: recolección, extracción, pruebas de estabilidad y determinación de metabolitos secundarios por espectrofotometría, con base en la técnica desarrollada por el INTI (Instituto Nacional de Tecnología Industrial) en el año 2019 para extraer y conservar colorantes a partir de desechos agroindustriales como la cáscara de maní [8].
Por lo anterior, la investigación tuvo el propósito de extraer y analizar el colorante de la pulpa del fruto del totumo, empleando tres diferentes solventes: agua, etanol e hidróxido de sodio. Para tal fin se determinó el solvente que tenía mayor rendimiento de extracción, se midió la estabilidad del color en un textil mediante colorimetría y finalmente se estableció el contenido de pigmentos orgánicos utilizando para ello la espectrofotometría.
2. MATERIALES Y MÉTODOS
2.1 Área de estudio
El trabajo de investigación se desarrolló en los laboratorios del programa de Ingeniería Agroindustrial de la Facultad de Ciencias Agropecuarias y Recursos Naturales, de la Universidad de los Llanos, sede Barcelona, en Villavicencio, Meta (km 12, Vía Puerto López, con coordenadas: 4° 4′ 30″ N, 73° 35′ 7” W. Su precipitación es de 3856 mm al año, tiene una temperatura promedio de 25,5 °C y su humedad media anual es de 83 % (Figura 1).
2.2 Recolección de la muestra
La recolección del material se llevó a cabo en el municipio de Granada (3° 32′ 40″ Norte, 73° 42′ 23″ Oeste), situado en la región del piedemonte llanero; presenta un clima cálido tropical, con una temperatura promedio de 25,6 °C; la precipitación está entre 2400 mm y 2800 mm por año y la elevación es de 410 m. Los frutos de totumo (Crescentia cujete L.) fueron colectados y almacenados en la zona rural de la localidad en un período de cosecha de seis meses y se cosechó en el segundo mes. Los frutos seleccionados para llevar a cabo la investigación se muestran en la (Figura 2). El fruto utilizado es el (a) en estado inmaduro, estos de acuerdo con [9], [10] presentan un índice de madurez en un rango de °brix de 10-20.
Debe tenerse en cuenta, además, que el lugar de procedencia del fruto puede incidir en estas características.
También influye en el proceso el tiempo que haya transcurrido desde el momento de la cosecha. Esto significa que a medida que el fruto va madurando, su composición química va cambiando a causa del contenido de azúcares como glucosa, sacarosa y fructosa, que inician un proceso de reducción. [11], [12].

Fuente: [9].
Figura 2 Frutos de Crescentia cujete L con diferentes estados de madurez: a: fruto inmaduro, b: fruto premaduro y c: fruto maduro
2.3 Extracción por el método de digestión
Los frutos seleccionados se lavaron con 1 litro de agua destilada, se secaron con papel absorbente y se pesaron en una balanza analítica; se obtuvo un total de 1,50 kg de pulpa de totumo. La extracción del colorante se llevó a cabo siguiendo la metodología indicada en [13].
Se procedió a llevar la pulpa previamente macerada a un vaso de precipitado de 500 ml y se adicionaron 300 ml de solvente (agua, etanol al 98 % e hidróxido de sodio al 48,5 % a 0,5 N). Luego se llevaron los vasos de precipitado a una plancha de calentamiento a una temperatura de 75 °C con agitación constante a una potencia de 450 rpm durante 20 minutos para el agua, 30 minutos para el etanol y 1 hora para el hidróxido de sodio (Tabla 1).
Se dejaron enfriar los extractos a temperatura ambiente y se filtraron utilizando papel filtro Whatman No. 2. Se pesó el remanente sólido con la finalidad de calcular el rendimiento de extracción; los extractos obtenidos se pesaron y se envasaron en frascos ámbar, y luego se almacenaron a temperatura ambiente en un lugar oscuro. Los cálculos del rendimiento de extracción se efectuaron mediante (1):
2.4 Pruebas de estabilidad del colorante en un textil
Las pruebas de solidez del color se llevaron a cabo con la metodología de [14], [15]. La muestra de textil se cortó en cuadros de 2 x 2 cm, obteniendo nueve trozos de tela de algodón; estos se tiñeron con cada uno de los colorantes obtenidos y luego se llevaron a un recipiente con solución de agua desionizada a valores de pH 5 y 9; los valores de pH se ajustaron mediante el uso de soluciones diluidas de hidróxido de sodio y ácido acético a una concentración de 0,5 N y 0,1 N, respectivamente. Después se adicionaron allí las telas por un tiempo de 30 minutos, finalmente fueron secadas y planchadas para la medición del color.
Posteriormente se hizo la prueba de estabilidad a altas temperaturas a los trozos previamente teñidos, se adicionaron en un recipiente con agua a una temperatura de 87 °C durante un tiempo de 15 minutos y después se analizó el color en el colorímetro. Finalmente se efectuó la prueba de resistencia a detergentes. Al efecto se sometieron a contacto directo los trozos de tela teñidos con una solución compuesta por 30 ml de agua y 5,3 g de detergente biodegradable al 0,5 % a concentración de 5000 ppm, a una relación de 3,0 g de detergente por cada gramo de tela, con una agitación de 200 rpm por un tiempo de 30 minutos; se empleó un agitador vortex para facilitar el proceso de lavado, posteriormente las telas fueron secadas y se sometieron a planchado con vapor. A las muestras ya secas se les analizó el color mediante el colorímetro [16], [17].
2.5 Determinación del color en la escala CIEL a* b*
Se determinó el color a las muestras de estudio mediante la lectura de las coordenadas L*, a* y b* en un colorímetro Konica Minolta CR-5 utilizando el iluminante estándar D65 y el observador 2º [18], [19]. El colorímetro se estandarizó con un blanco utilizando agua destilada y el patrón de referencia de la muestra con etanol (L* = 9,80; a* = 1,80; y b* = 3,23).
Se utilizaron los valores numéricos de L*, a* y b* para poder obtener la diferencia total en las muestras de color; asimismo se determinó ΔE, calculándose la diferencia entre las muestras de color mediante (2):
Donde ∆E es la diferencia total de color en la escala CIELAB, ΔL* = diferencia en luz y oscuridad, Δa* = diferencia en rojo y verde, Δb* = diferencia en amarillo y azul.
2.6 Determinación de los metabolitos secundarios por espectrofotometría
La determinación de los metabolitos secundarios de cada extracto obtenido se llevó a cabo mediante la metodología de [16]-[19]. Primero se hizo la calibración del blanco usando agua destilada y empleando un Spectrophotometer RIGOL Ultra-3660, USA; una vez efectuada la calibración, se procedió a medir la absorbancia de cada uno de los extractos obtenidos en el apartado anterior; las mediciones se hicieron en un rango de longitud de onda de 400 nm a 700 nm.
2.7 Análisis estadístico
El diseño experimental factorial elegido para obtener los resultados de investigación tuvo dos factores y tres niveles (2 x 3), con tres repeticiones balanceadas, con un total de dieciocho ensayos para determinar el rendimiento de extracción y pruebas de solidez del color de los extractos en muestras de algodón.
Para interpretación de los resultados obtenidos en la determinación del rendimiento de extracción y las pruebas de solidez del color se utilizó una estadística descriptiva que permite establecer los valores encontrados en términos de sus medidas de tendencia central; se determinaron aquellas de dispersión de cada una de las variables estipuladas. Por otro lado, para la determinación cualitativa de los metabolitos secundarios por espectrofotometría, se compararon estudios realizados a metabolitos secundarios en donde se les midió su absorción de luz en la longitud de onda estudiada, a fin de hacer un análisis cualitativo de estos extractos.
3. RESULTADOS Y DISCUSIÓN
3.1 Rendimientos de extracción
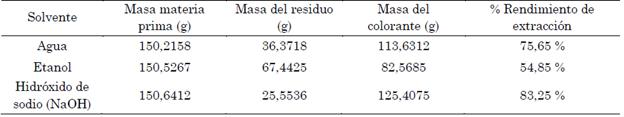
En la Tabla 2 se presentan los valores evaluados de la extracción (solvente utilizado, masa de colorante, masa de materia prima y porcentaje de rendimiento de extracción).
Tabla 2 Porcentajes de rendimiento de extracción con los diferentes solventes
Fuente: elaboración propia.
Como se observa en la Tabla 2, el colorante que obtuvo un mayor rendimiento de extracción fue el obtenido con hidróxido de sodio, que tuvo 83,03 %, seguido del extraído con agua, el cual tuvo 75,75 %, y, finalmente, el extraído con etanol, que tuvo 55,04 %. Se evaluó la extracción de los dos solventes iniciales para extraer un colorante natural que no contaminara al medio ambiente, pero se hizo la inclusión y comparación con un solvente contaminante como lo es el NaOH, de acuerdo con [13], [20], donde se menciona que con este solvente se pueden obtener mejores rendimientos, aunque por literatura se conoce que es un precursor que contamina el medio ambiente. Se comparó cómo se comporta este con respecto a otros que no son contaminantes [21], [22].
Una variable que influyó notablemente en que el NaOH obtuviera un rendimiento mayor que los otros solventes fue el tiempo de extracción del colorante, ya que se evidenció una relación directamente proporcional: a mayor exposición al reactivo, mayor rendimiento de extracción de colorante se obtendrá, por lo que se generan distintos resultados en comparación con la investigación de [23], donde el solvente que tuvo menor tiempo fue el que obtuvo mejor rendimiento.
El porcentaje de rendimiento del extracto no solamente varía en función del tiempo y del solvente, sino que también lo hace de manera directa y proporcional a la polaridad del mismo. Estos resultados difieren en nuestra investigación, donde el solvente menos polar y contaminante fue el que presentó mejor rendimiento de extracción. De acuerdo con [24], se recomienda extraer con etanol ya que este solvente tiene la capacidad de extraer compuestos de una amplia gama de polaridades, además de ser menos costoso y tóxico que otros solventes orgánicos.
De acuerdo con la (Figura 3), a partir de la extracción con cada solvente se identificaron diferentes tonalidades, siendo etanol y agua de color negro azulado, y el hidróxido de sodio de color amarillo-anaranjado; de acuerdo con [25], estas coloraciones ocurren debido a la presencia de taninos, saponinas y fenoles dentro de la composición del fruto, y van cambiando según el estado de madurez en que esté el fruto. Por esto se puede inferir que estas sustancias son las responsables de dichas tonalidades, indicando que los compuestos orgánicos que componen la pulpa del fruto reaccionan dependiendo del tipo de solvente que se utilice. En este estudio, de acuerdo con [26], las enzimas que catalizan el pardeamiento enzimático corresponden a las oxidorreductasas. Estas catalizan el paso inicial de la oxidación de compuestos fenólicos presentes en frutas y verduras a quinonas, las cuales más adelante sufrirán polimerización para producir pigmentos insolubles y oscuros denominados melaninas, que les darán a estas un color café, haciéndolas inaceptables para el consumo [27].

Fuente: elaboración propia.
Figura 3 Extracción de colorantes de la pulpa de totumo (Crescentia cujete L.) mediante el método de digestión
En el proceso de maduración, la temperatura también es una variable crítica en el fruto ya que acelera este proceso; una vez el fruto esté expuesto al medio ambiente, comienzan las reacciones de oxidación [26].
Estos cambios en las muestras evaluadas después del tratamiento térmico pueden estar asociados a los procesos de lixiviación y oxidación de los compuestos orgánicos cuando la matriz biológica es afectada por un solvente a alta temperatura [26].
3.2 Estabilidad del color y diferencia total en las muestras de color
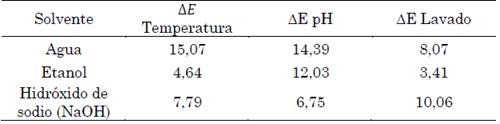
Los resultados de estabilidad concuerdan con los resultados referenciados en [28], [29], en donde se menciona que una de las fibras que obtienen mejor fijación con el colorante es el algodón, además la estabilidad de este depende de qué tanta afinidad química tenga con el extracto colorante. Una vez efectuadas las pruebas de estabilidad del colorante en un textil, los datos fueron tabulados de acuerdo con la muestra. Los resultados se observan en la (Tabla 3). De acuerdo con la norma UNE-ISO 12647-2:2016 [30], la cual establece los estándares de impresión del color y define los umbrales de tolerancia para ΔE, el valor máximo que se recomienda para un ΔE es 5, lo cual significa que valores superiores a 5 se proponen como inaceptables en la mayoría de procesos, ya que indican que la diferencia de color empieza a perderse y por ende el colorante no tendrá una buena fijación del color.
Tabla 3 Variaciones de color de las muestras sometidas a las pruebas de resistencia ∆E
Fuente: elaboración propia.
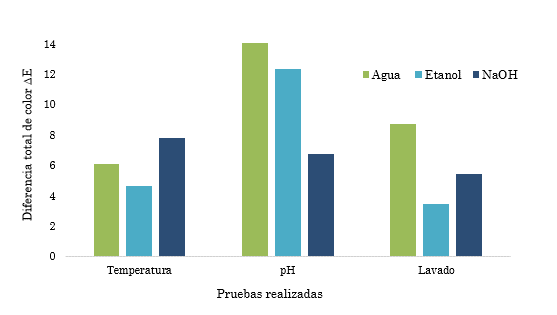
De acuerdo con la investigación referenciada en [31], las condiciones que más afectan a las muestras teñidas son “las pruebas de lavado doméstico como las altas temperaturas por observarse un desprendimiento notable del colorante”; sin embargo, estas pueden variar de acuerdo con la naturaleza del precursor de los colorantes, condiciones ambientales y naturaleza de los mismos. En los resultados obtenidos en el laboratorio se observó que la muestra extraída con etanol tuvo un buen rendimiento en cuanto a fijación; una vez efectuada la prueba de lavado presentó pocos cambios en las valoraciones de color. Ya que se encuentran valores de ΔE inferiores a 5, la muestra tomada presentó una diferencia de color estable y perceptible por el ojo humano; además, no perdió su fijación de manera abrupta con el paso del tiempo. Por otra parte, la muestra extraída con agua es más susceptible a cambios significativos de ΔE, tanto en las pruebas de temperatura como en la de lavado; aunque su valor de ΔE inicial disminuyó en comparación con el valor final, este sigue siendo inaceptable porque es un valor superior al permitido por la norma. Para controlar estos aspectos se sugiere utilizar fijadores del color para evitar que pierda su intensidad.
A continuación, se muestra gráficamente la interacción de las muestras de color en las diferentes pruebas efectuadas y sus medias de variación de color de acuerdo con los valores indicados en la (Tabla 3).
A partir de la Figura 4 se puede concluir que la muestra más susceptible a variación de diferencia total de color final en la prueba de lavado es la muestra extraída con agua, que presenta un valor de ΔE = 8,47, seguida de la del hidróxido de sodio, ΔE = 1,6, y por último la de etanol, con ΔE = 3,41. Esta se considera la mejor, presentando un valor de ΔE más estable, por tanto mantiene la fijación de color percibida por el ojo humano en un mayor período de tiempo sin modificaciones notables [32].
3.3 Espectrofotometría UV-VIS
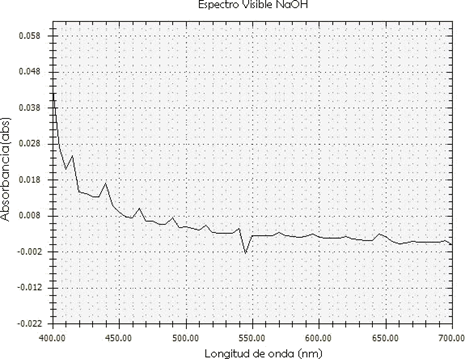
Con base en los resultados obtenidos sobre las muestras de colorante del mesocarpio del fruto de Crescentia cujete L que se observan en la Figura 5, y de acuerdo con [25], [33], en el estudio se evidencia la presencia de grupos de metabolitos secundarios como carotenoides, glucósidos, saponinas y taninos. Se puede observar, además, el espectro visible de la muestra extraída con hidróxido de sodio, encontrando similitud con el espectro de los flavonoides, según [34], los cuales, compuestos, se encuentran en un rango de 270 nm a 370 nm.
Estos pigmentos están relacionados con los colores obtenidos de manera experimental de acuerdo con [25], ya que la muestra obtenida, usando hidróxido de sodio, presentó una coloración amarilla-anaranjada. También estos metabolitos influyeron en el colorante final debido a la presencia de cromóforos en su estructura, al cambio de pH y, en algunos casos, cuando está en presencia de metales o en solución de etanol e hidróxido de sodio, todos los flavonoides experimentan una absorción de intensidad fuerte en la región de 200-270 nm y, a mayor longitud de onda en la zona de 300-400 nm, aparecen otras bandas de mayor intensidad.
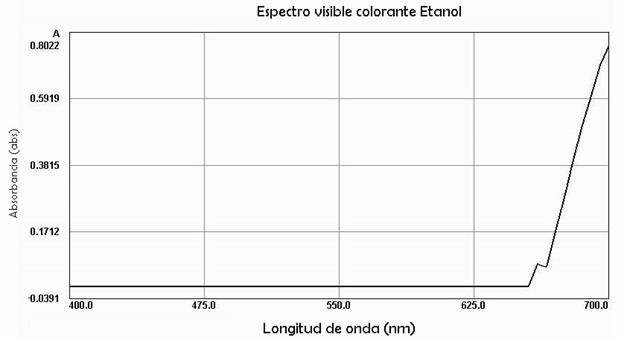
De acuerdo con [35], en el mesocarpio del totumo hay presencia de 68 grupos de metabolitos secundarios como flavonoides, carotenoides, glucósidos iridioides, grupos fenólicos, derivados benzoilos y cinamolios. Como se muestra en la Figura 6, aparece una longitud de onda en un rango de 665-700 nm, lo que indica que el color de luz absorbido por el metabolito secundario tuvo un tono café y textura espumosa, lo cual corresponde a presencia de cardenolidos y saponinas; esto difiere de los resultados de [36], donde se señala que, normalmente, en medios con etanol, se inhibe el índice de espuma y se extraen otras moléculas que presenten absorbancia a la longitud de onda de 528 nm, interfiriendo de esta manera con las lecturas para las pruebas cuantitativas. La absorbancia superior a este rango se debe a que el contenido de saponinas en Crescentia cujete L. es muy bajo.
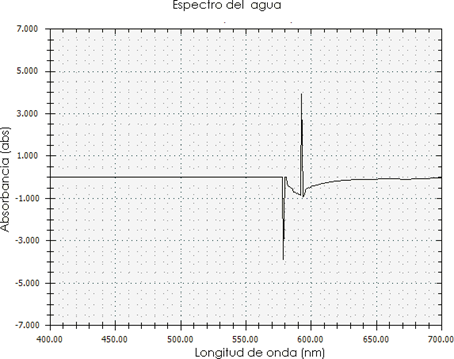
En la Figura 7, inicialmente el rayo de luz del espectrofotómetro incidió perpendicularmente sobre la extracción con agua del colorante del totumo, este absorbió la luz arrojando una longitud de onda de 580 nm y 590 nm debido a un compuesto químico que absorbe la luz llamado cromóforo. La cantidad de luz absorbida dependerá de la distancia que recorre la luz a través de la solución del cromóforo y de la concentración de este; además, la longitud de onda en ese rango absorbe el color amarillo y refleja el azul. Luego se observa una absorbancia negativa de la radiación incidente, es decir, dispersará el 100 % de una radiación incidente de baja potencia, indicando que está por debajo del nivel del espectrofotómetro que trabajó entre 400 nm y 700 nm. Este fenómeno ocurre debido al alto contenido de sedimentos presentes en la muestra [37].
4. CONCLUSIONES
Se llevó a cabo una extracción exitosa de colorante presente en la pulpa del totumo, allí se evidenció que el solvente que tuvo mayor rendimiento en la extracción fue el hidróxido de sodio (NaOH), con un valor aproximado de 83 %. El tiempo de extracción de cada solvente fue directamente proporcional a su rendimiento de extracción, por lo que se infiere que un factor importante en el proceso es el tiempo de contacto con los solventes. Aunque el NaOH fue el solvente de mayor rendimiento, su uso no se recomienda debido a la alta toxicidad que genera al medio ambiente. Por el contrario, se sugiere utilizar agua como precursor de materiales tintóreos, o incluso etanol, que es menos contaminante y presentó un rendimiento de extracción que fue favorable.
Las pruebas de resistencia efectuadas fueron fundamentales para analizar el comportamiento de los colorantes aplicados en un textil. En estas se observaron variaciones en las diferencias de color de los tres tratamientos. Por su parte, la muestra de algodón teñida con etanol presentó mayor estabilidad porque su ΔE fue el que mostró tener menor diferencia con relación a los otros dos solventes, produciendo un color que tuvo mayor intensidad y fue menos propenso a cambios.
Los colorantes extraídos con las diferentes muestras de solvente evidenciaron en el espectrofotómetro para la muestra con NaOH un rango de 270-370 nm, lo que indica presencia de flavonoides, y, para el extracto con etanol, un rango de 665-700 nm, lo que apunta a la presencia de saponinas, sustancias que se considera son las responsables de las coloraciones obtenidas. Finalmente, la muestra extraída con agua presentó mayor cantidad de sólidos en suspensión, lo que incidió negativamente en la absorbancia. Según los resultados obtenidos, el colorante extraído a partir de la pulpa del totumo es un producto que al ser aplicado en una fibra textil mantiene su permanencia en la misma, lo cual lo convierte en una materia prima de gran potencial agroindustrial. Se recomienda efectuar análisis en profundidad sobre la incidencia del índice de madurez del fruto y su efecto en la lectura del colorímetro.