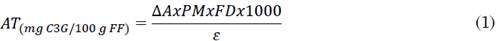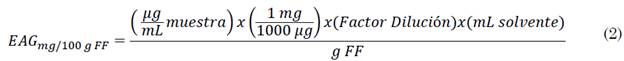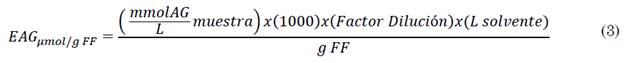1. INTRODUCCIÓN
Los arándanos son frutos conocidos por sus beneficios para la salud, alto valor nutricional y una buena evaluación sensorial [1]. Gran parte de estos beneficios son debido a que los arándanos contienen compuestos fenólicos los cuales son un grupo de metabolitos bioactivos reconocidos como uno de los principales fitoquímicos de la naturaleza [2], [3]. Los compuestos fenólicos presentan un sin número de variedades estructurales que pueden diferir entre sí según el número de grupos aromáticos dentro de su configuración estructural, y el número de grupos reactivos hidroxilo dentro de ellos que les permite usualmente distinguirse como antioxidantes alimenticios [4].
Los derivados polifenólicos se clasifican en dos principales grupos: flavonoides (isoflavonoides, antocianidinas, flavanoles, flavonoles, flavanonas y flavonas), presentes con mayor frecuencia en recursos naturales como las frutas, hortalizas y otros alimentos [5], y no flavonoides [6], que cumplen funciones biológicas de gran importancia debido a sus propiedades de asimilación de radicales libres, que les confiere su rol antioxidante, poseen beneficios antialérgicos y antiinflamatorios, previenen el cáncer, previenen el desarrollo de trastornos neurodegenerativos, retrasa el paso del envejecimiento celular, favorecen la actividad cardiovascular, disminuyen la incidencia de enfermedades alimentarias, entre otras [7], [4], [8].
Los arándanos contienen principalmente flavonoles como la quercetina y derivados, antocianinas, flavan-3-ol y proantocianidinas. Adicionalmente, contiene no flavonoides como los ácidos benzoico e hidroxicinámico y sus derivados como ácidos gálico, caféico, clorogénico, p-coumarico, ferúlico y vanílico [1]. Específicamente, para la especie Vaccinium corymbosum, las principales antocianinas identificadas ha sido delfinidina-3-O-galactósido [9] y quercetina-3-O-β-glucósido [10].
La capacidad antioxidante de los arándanos se ha evaluado mediante alternativas analíticas que se agrupan según su fenómeno de reacción, destacando así los ensayos basados en fenómenos de radicales libres, DPPH´ (2,2 difenil-1-picrilhidrazilo) y ABTS´+ (ácido 2,2'-azino-bis-3etilbenzotiazolina-6-sulfónico), ensayos que tienen como principio la reducción de iones metálicos, FRAP (Poder de Reducción Antioxidante de ion Férrico), Folin Ciocalteu (reducción de sales de molibdeno y wolframio), CUPRAC (Capacidad Antioxidante Reductora Cúprica), el método ORAC (capacidad de absorción de radicales de oxígeno), son los más comunes [1], [11], [12], [13].
Adicional a los estudios usados anteriormente, hay un auge en las técnicas electroquímicas para la caracterización de especies electroactivas, permitiendo evaluar su capacidad antioxidante y favorecer el reconocimiento de modelos de comportamiento y fenómenos de transferencia de electrones, empleados en la identificación de matrices de gran complejidad [7]. Técnicas como voltamperometría cíclica y de onda cuadrada han empezado a tomar una relevancia en los últimos años y se han empleado para evaluar la capacidad antioxidante de los arándanos [14], [15].
Para la determinación de la capacidad antioxidante, un factor importante es la técnica de extracción de los polifenoles, entre las cuales se encuentra la extracción por solventes, la cual es una técnica ampliamente conocida y tiene como ventaja que se puede reproducir fácilmente a escala industrial. Los solventes más utilizados para la extracción de antioxidantes de los frutos rojos en general, han sido metanol [15], acetona, etil acetato [12], etanol y agua, estos dos últimos reconocidos como solventes verdes por la sociedad europea promotora de metodologías biológicas y químicas sostenibles - CHEM21, según criterios de seguridad, salud y medio ambiente [16]. Adicional a los solventes, se han usado ácido cítrico [17], clorhídrico y acético [18] con el fin de acidular la mezcla de solventes y mejorar la extracción debido a que las antocianinas son estables a pH ácidos.
En la búsqueda de procesos amigables con el medioambiente, el uso de solventes verdes se convierte en una parte importante en la extracción de polifenoles para un acercamiento a procesos más limpios en consonancia con los Objetivos de Desarrollo Sostenible [19], [20], [21]. De hecho, la introducción del concepto de extracción verde de fuentes naturales ofrece nuevas perspectivas sustentables que promueven el desarrollo de procesos ecológicos, económicos e innovadores [22].
Aunque los arándanos se han abordado ampliamente en la literatura, hacen falta estudios en los que se evalúe el efecto de solventes verdes en la extracción de polifenoles. Por esto, este trabajo tiene como objetivo evaluar el efecto de solventes verdes como el etanol/agua (EtOH/H2O), ácido acético/agua (CH3COOH/H2O) y la mezcla etanol/ácido acético/agua (EtOH/CH3COOH/H2O) para la extracción de polifenoles, específicamente antocianinas provenientes de la especie Vaccinium corymbosum, con el fin de determinar su capacidad antioxidante mediante el comportamiento electroquímico.
2. METODOLOGÍA
2.1. Reactivos
Para el desarrollo experimental, se empleó Etanol comercial (EtOH) al 70 %, Ácido acético comercial (CH3COOH) al 5 %, Agua desionizada, reactivo Folin Ciocalteu (Merk), Ácido gálico (Merk), Buffer acetato de sodio/ácido acético pH 4.5 (0.995 M) y pH 3.0 (0,1 M), Buffer de cloruro de potasio ajustado con HCl pH 1.0 (0.0625 M), hipoclorito de sodio comercial (NaClO) al 5.25 %, y Ácido nítrico HNO3 (0.1 M).
2.2. Preparación preliminar de la muestra
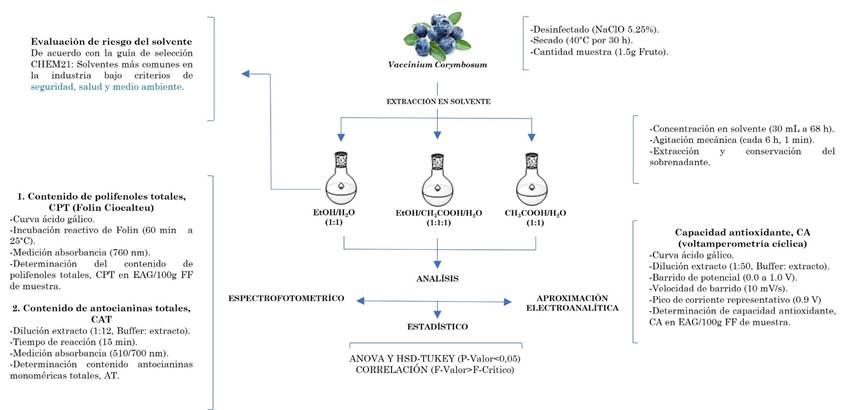
Se obtuvieron tres unidades experimentales independientes de arándano Vaccinium corymbosum de marca comercial (Fructífera S.A.S, Cundinamarca-Colombia). Las muestras se desinfectaron con hipoclorito de sodio, NaClO al 5.25 % y se dejaron secar durante 12 horas a temperatura ambiente. Luego, se secaron a 40 °C durante 30 h. Finalmente, se redujo el tamaño del fruto completo (pulpa y cáscara) y se pasaron por un tamiz de 1 mm.
2.3. Obtención de extractos
El proceso de extracción del arándano Vaccinium corymbosum, se realizó a través de la inmersión en tres sistemas de solventes. El primero, consistió en la mezcla (1:1) de etanol y agua (EtOH/H2O). La segunda, conformada por ácido acético y agua (CH3COOH/H2O) en relación (1:1). Por último, una mezcla de etanol, ácido acético y agua (EtOH/CH3COOH/H20), en relación (1:1:1).
Para la extracción, se tomaron 1.5 g del fruto en polvo de cada unidad experimental a los cuales le añadió un volumen de 30 mL de la mezcla de solvente a evaluar, alcanzando así una concentración de 0.05 gmuestra /mLsolvente, se dejó en contacto durante 68 h, protegidas de la luz, manteniendo agitación mecánica cada 6 h durante 1 min. Finalmente, se filtró, se extrajo el sobrenadante y se conservó en congelación hasta el análisis químico. Este procedimiento se realizó con cada sistema de solvente evaluado y por triplicado.
2.4. Determinación del Contenido de Antocianinas Totales (CAT)
Para cuantificar el contenido de antocianinas totales del arándano Vaccinium corymbosum, se llevó a cabo el método de pH diferencial [23]. Para ello, se emplearon dos soluciones con pH diferente, cloruro de potasio a pH 1.0 (0.0625 M), se ajustó el pH con HCl concentrado) y buffer de acetatos a pH 4.5 (0.995 M). Con el extracto, se prepararon diluciones en relación 1:12 en Buffer y se midió por triplicado la absorbancia a 510 y 700 nm en un espectrofotómetro Agilent 8453 UV-Visible Spectroscopy System.
Finalmente, la concentración total de antocianinas monoméricas (AT) se expresó en términos de miligramo equivalente de cianidina-3-glucosido, mg C3G/100 g de Fruto Fresco (FF), de acuerdo a la ecuación (1) [24].
Donde ∆A (antocianinas totales)=(A máx 510nm-A 700nm)pH1.0-(A máx 510nm-A 700nm) pH 4.5, PM (peso molecular de la cianidina-3-glucosido, 449.2 g/mol), FD (factor de dilución), y ε (coeficiente de extinción molar, 26900 L/mol.cm).
2.5 Determinación del Contenido de Polifenoles Totales (CPT)
Para cuantificar el contenido de compuestos fenólicos del extracto de arándano se realizó por el método de Folin Ciocalteu. Para ello, se preparó una curva de calibración de ácido gálico de 10, 20, 40, 60, 80 y 100 μg/mL con R2 de 0.9937.
Con el extracto de Vaccinium corymbosum se prepararon diluciones de las 3 muestras de solventes en relación 1:100. Además, se adicionó en recipientes 2250 μL de agua destilada, 450 μL de agua destilada adicional para el blanco, 300 μL de la muestra, 300 μL de Na2CO3 al 10 % y 150 μL del reactivo de Folin a 25 °C incubando durante 60 minutos en completa oscuridad. Luego, se midió la absorbancia en un espectrofotómetro Agilent 8453 UV-Visible a 760 nm realizando las mediciones por triplicado.
Finalmente, se expresa la concentración total de antioxidantes en equivalentes en miligramos de ácido gálico por cada cien gramos de fruto fresco (FF) (mg EAG/100 g FF) según (2) [25].
2.6 Determinación de la Capacidad Antioxidante (CA)
2.6.1 Método voltamperometría cíclica (CV)
Para evaluar la capacidad antioxidante de los extractos del arándano Vaccinium corymbosum, se desarrolló a través del método electroquímico de voltamperometría cíclica (CV). Se utilizó un potenciostato PSTrace Sensit Smart y una configuración de celda de tres electrodos: electrodo de trabajo de Au de 3 mm de diámetro, un contraelectrodo de grafito y un electrodo de referencia de Calomel en KCl 3 M.
Como pretratamiento, se pulió la superficie del electrodo de trabajo con polvo de alúmina de 3 μm y se lavó con alcohol etílico al 70 % por ultrasonido durante 5 min [26], [27]; finalmente, realizaron barridos cíclicos entre -1.0 y 1.0 V en HNO3 0.1 M.
Se realizó una curva de calibración de ácido gálico con soluciones en 0.1, 0.3, 0.5, 0.8 y 1.0 mM por voltamperometría cíclica usando 1 mL de solución de ácido gálico y 10 mL de una solución buffer de acetato de sodio/ácido acético 0.1 M a pH 3.0. Se realizaron barridos de potencial de 0 a 1.0 V y una velocidad 10 mV/s.
Para los extractos de arándanos, se tomaron alícuotas de 200 μL y 10 ml de electrolito soporte, se realizó la voltamperometría cíclica por triplicado y se expresaron los resultados en equivalentes en µmol de ácido gálico por gramos de fruto fresco (µmol EAG/g FF) según (3).
2.7 Evaluación de riesgo de los solventes
Con el propósito de evaluar el nivel de riesgo de cada uno de los solventes empleados, se desarrolló a través de la metodología propuesta por [28]. La evaluación se sustentó de acuerdo con la guía de selección CHEM21 que da cuenta de los solventes más comunes en la industria.
Esta guía propuesta por sociedad europea promotora de metodologías biológicas y químicas sostenibles relaciona un conjunto de criterios de seguridad, salud y medio ambiente en base a referencias de las guías existentes que están alineados con el Sistema Globalmente Armonizado y la normativa europea [16].
Adicionalmente, se complementó de acuerdo a la introducción del concepto de extracción verde en los procesos de obtención de compuestos naturales y la importancia de la aplicación de análisis de ciclos de vida, además de la orientación de las propuestas verdes con respecto el empleo de solventes [29][22].
2.8 Análisis estadístico
La evaluación de las diferencias entre los tres sistemas de solventes se llevó a cabo mediante un Análisis de Varianza, ANOVA donde la variable respuesta fue el contenido total de polifenoles (CPT), contenido de antocianinas totales (CAT) y capacidad antioxidante (CA).
Se empleó una prueba de Tukey para determinar si existían diferencias entre los tratamientos evaluados por pares, con una significancia P-valor<0.05 mediante el software RStudio. Los datos fueron presentados como el promedio y la desviación estándar. Tres muestras (n=3) de cada unidad comercial fue analizada y todos los análisis fueron presentados por triplicado.
Además, se evaluó la matriz de correlaciones (r) y regresión lineal (R2) entre la capacidad antioxidante asociada al contenido de polifenoles y antocianinas totales, para medir la relación entre pares de variables, a través de la herramienta de análisis de Microsoft Excel® con F-valor calculado > F crítico.
En la Figura 1 se presenta un esquema resumen del desarrollo metodológico empleado.
3. RESULTADOS Y ANÁLISIS
3.1 Determinación del contenido de polifenoles y antocianinas totales
La caracterización del contenido de polifenoles totales en el proceso de extracción de antioxidantes de pulpa y cáscara de arándano Vaccinium corymbosum, se presenta en la Tabla 1.
Tabla 1 Contenido de polifenoles y antocianinas totales extracto de Vaccinium corymbosum obtenido con etanol (EtOH/H2O), ácido acético (CH3COOH/H2O) y etanol ácido acético (EtOH/CH3COOH/H2O)
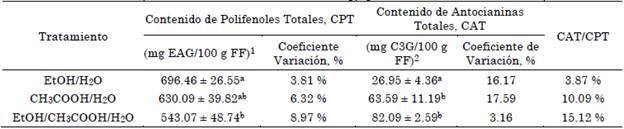
Fuente: elaboración propia.
Los valores están expresados en base húmeda o fruto fresco (FF) y reportados como valor medio y desviación estándar (SD), n = 3. Las letras superíndice diferentes en la misma columna, indican diferencias significativas (p < 0.05 por la prueba de Tukey). 1 Resultados expresados como EAG (equivalente a ácido gálico). 2 Resultados expresados como equivalentes a cianidin-3-glucosido.
Los resultados del CPT y CAT permiten evidenciar, como la variación del sistema de solventes empleados tienen una efectividad que difieren estadísticamente. Desde el punto de vista del contenido de compuestos funcionales presentes en el extracto de arándanos, se identificó que los valores promedios del CPT obtenidos mediante la extracción realizada con EtOH/H2O difieren significativamente de la realizada con la mezcla de EtOH/CH3COOH/H2O, siendo superior la capacidad de extracción del sistema binario de solventes próticos en un 22 %, debido probablemente a las características de polaridad de ambos solventes, ya que el agua es el solvente más polar conocido, sumado a la capacidad de penetración y solvatación que se logra con el balance que aporta el etanol, al tener una densidad menor que el agua (detanol=0.789 g/mL, dagua=1.000 g/mL). Por otra parte, se ha relacionado que la capacidad de extracción de compuestos polares, como los polifenoles puede favorecerse en presencia de solventes con un alta constante dieléctrica, pero que tiene como limitante la temperatura, ya que este comportamiento puede darse de forma óptima a bajas temperaturas y, por el contrario, afectar la estabilidad de algunos compuestos fenólicos termolábiles, al aumentarla.
Por esta razón, se proyectó una mezcla que tuviera un balance en cuanto el aporte de la constante dieléctrica con ambos solventes (ketanol=24.625ºC, kagua=77.4625ºC) a la temperatura de análisis (18 ºC), de manera que conservara la capacidad para disminuir la energía intermolecular y mantener aún niveles altos de polaridad. Esta propiedad, pudo verse afectada de manera negativa en la mezcla EtOH/CH3COOH/H2O, considerando que esta relación en presencia del CH3COOH, el cual posee la kacético=6.225ºC [30], logró afectar la capacidad para extraer más polifenoles del fruto del arándano, haciendo que se generaran estas diferencias significativas.
En contraste, el análisis del CAT muestra un comportamiento diferente al que se presentó con el CPT, ya que el mayor contenido de antocianinas monoméricas se alcanzó justo con el sistema EtOH/CH3COOH/H2O y, por el contrario, el menor contenido se relaciona al tratamiento de extracción con EtOH/H2O, lo que conllevó a que este último difiriera significativamente del promedio reportado para los dos CAT reportados para ambos sistemas en presencia de CH3COOH, como se muestra en la Figura 2.
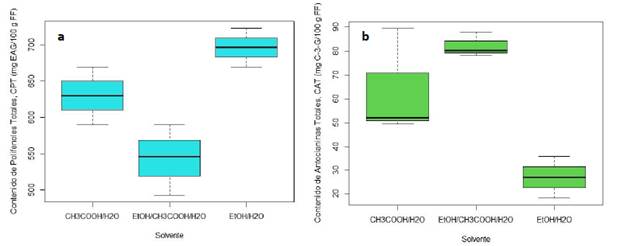
Fuente: elaboración propia.
Figura 2 Boxplot del CPT (a) y del CAT (b) obtenidos del método de extracción a partir del arándano con EtOH/H2O, CH3COOH/H2O y EtOH/CH3COOH/H2O.
El comportamiento diferente en la capacidad de extracción de las antocianinas con cada uno de los sistemas de solventes evaluados, puede deberse a la estabilidad de las antocianinas a bajos pH [31]. En la Tabla 2, se han compilado algunos resultados correspondientes a diversos estudios acerca del contenido de polifenoles totales, antocianinas o capacidad antioxidante presentes en distintos genotipos de arándano, en los cuales se evidenció como en la mayor parte de los estudios reportan métodos de extracción de este grupo de polifenoles, empleando solventes acidificados, obteniendo valores aún más altos a los reportados en este, que van desde 40.62 hasta 344 mg C3G/100 g FF, expresadas en cianidin-3-glucósido [24], [32], [33], [34], valores superiores al presente estudio. Sumado a este comportamiento dependiente del solvente, se observa un efecto asociado a la especie del fruto, evidenciado en el estudio realizado por [32], en el cual se reporta un valor máximo para CAT con V.ashei Reade (240.50 mg C-3-G/100 mg FF), seis (6) veces más que el reportado con V. corymbosum, esta última, especie que coincide con la reportada en este estudio, aunque se resalta que los valores de ambos tratamientos acidificados con ácido acético listados en la Tabla 1, los superan aún sin realizar la extenuación de la muestra. También, se puede inferir que la sinergia entre el solvente prótico empleado y el tipo de acidulante, así como la extenuación de la muestra tienen un influencia importante en los rendimiento del CAT, como se muestra con el estudio realizado por [34] donde usan un sistema EtOH/HCl(0.3 % v/v), que funciona de forma más eficiente, debido probablemente al tratarse de un ácido fuerte que puede tener la capacidad de mantener el pH del medio en condiciones favorables para la estabilidad de la antocianina, que en comparación con el ácido acético que es débil y tiene una constante dieléctrica baja [30], puede tener un desempeño menor, aunque se resalta que el CH3COOH, no es una sustancia controlada por estupefacientes y de menor costo, en contraste con el HCl, que en varios países está regulado su uso [35].
Tabla 2 Valores de CAT, CPT y CA (DDPH, ABTS, FRAP, ORAC).
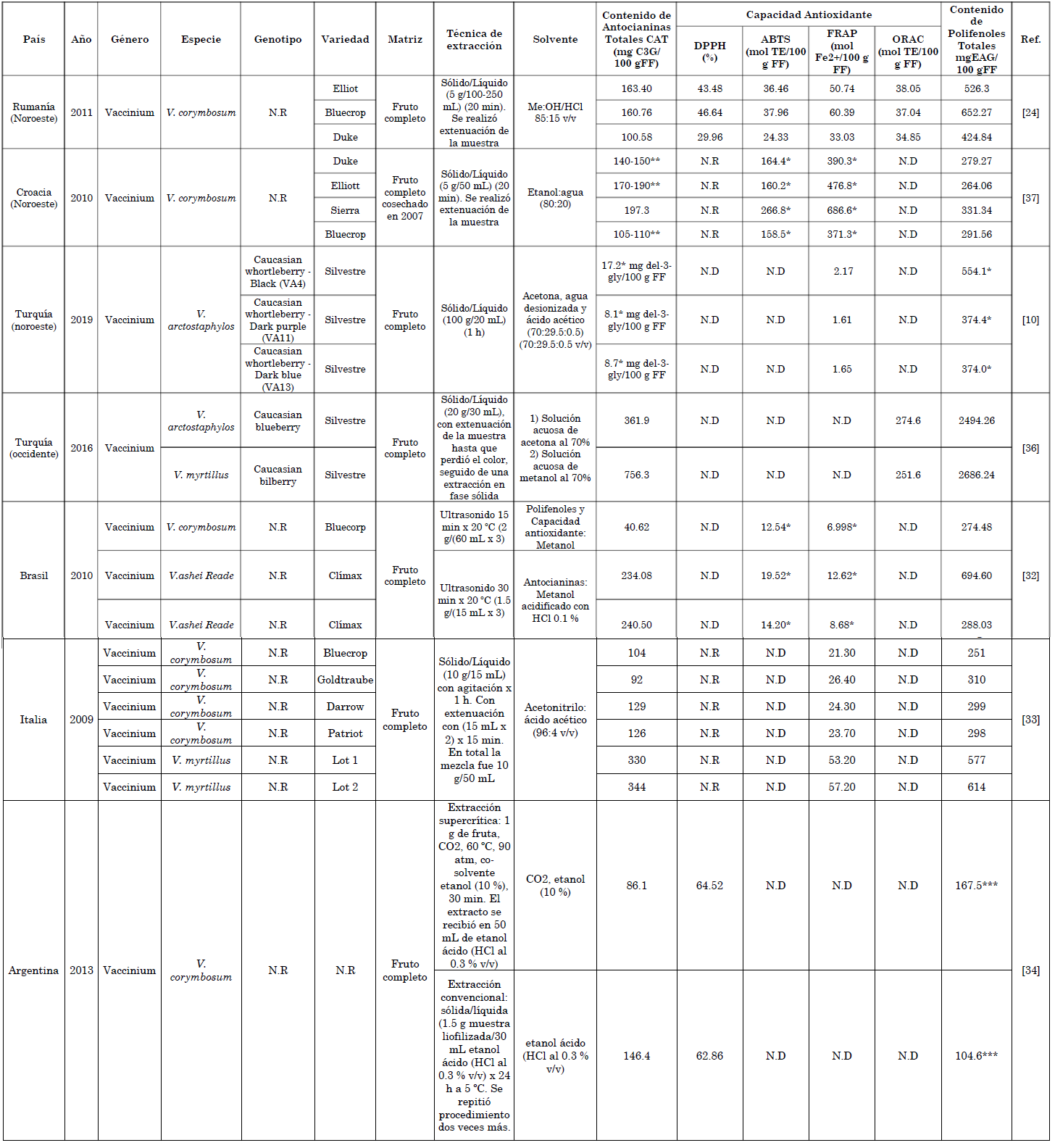
* Los valores se ajustaron a las unidades de mg/100 g
** Se reporta un rango aproximado, ya que los autores representan gráficamente los valores sin que haya una precisión en la graduación de la escala de valores de contenido de antocianinas totales
NR: No Reportado
N.D. No Determinadodel-3-gly: delphinidin-3-glucoside
*** Valor reportado en base seca
Fuente: elaboración propia.
Sumado a lo anterior, desde el punto de vista del solvente prótico empleado, se identificó que en los estudios analizados, el mayor valor reportado (756.3 mg C3G/100 g FF), lo reportan en Turquía [36], resultado de una extracción con acetona, seguida por metanol y aunque es clara la superioridad en el contenido, comparado con el alcanzado a partir del tratamiento EtOH/CH3COOH/H2O ((82.09 ± 2.59) mg C3G/100 g FF), es necesario enfatizar que el metanol no está permitido en la industria alimentaria, farmacéutica o cosmética, si el aditivo va a ser empleado para uso oral, según el Codex Alimentarius, lo que limita una futura optimización con este tipo de solvente, a pesar de su efectividad. Finalmente, el único tratamiento similar al evaluado EtOH/H2O (50:50) que fue el de menor valor en este estudio, al compararse con el reportado por [37], con una relación (80:20), presentó un mejor desempeño. Además, en este último se llevó a cabo una extenuación de la muestra y la relación de la muestra/solvente fue de (5 g/50 mL), mientras que la de este estudio estuvo 50 % menos concentrada (1.5/30 mL) y no se realizó extenuación, aspectos que podrían ser objeto de futuras optimizaciones para el aumento del CAT.
En complemento, este estudio de máximo rendimiento [36] se realizó en la especie V. myrtillus y se complementó con V. arctostaphylos, pero para este último, el CAT estuvo 52.1 % por debajo, lo que corrobora la importante dependencia en los tratamientos de extracción a la variedad y solvente.
De acuerdo a la literatura, el contenido de antocianinas totales dentro del grupo de bayas puede variar significativamente entre 10 a 600 mg C-3-G/100 g Fruto Fresco, que dependerá de la especie, su variedad, su tamaño, estado de maduración, y de las condiciones ambientales [38]. De hecho, en el estudio realizado y comparación con la Tabla 2 los resultados concuerdan con el intervalo según lo mencionado en literatura.
La relación CAT/CPT para el tratamiento EtOH/CH3COOH/H2O alcanzó un valor de 0.15, igual al reportado por [32] para V. corimbosum L., que corresponde a la misma especie evaluada en el presente trabajo, diferente al valor de la relación en promedio, reportada por los mismos autores (0.54) para 14 variedades de la especie V. ashei Reade, lo cual indica que en esa especie, hay un aporte más representativo del CAT para explicar el valor final del CPT. Sin embargo, el método de extracción también es un aspecto relevante, al comparar el valor obtenido por [32], se logra identificar que la extracción de llevó a cabo con una extenuación por triplicado de la muestra (Tabla 2). Por el contrario, en el presente estudio solo se realizó una extracción, de allí que se podría aumentar, aplicando esta práctica metodológica de extenuación de la muestra, evitando saturación del solvente. Por otra parte, la variación en la mezcla de solvente con y sin presencia del ácido acético, tuvo un efecto relevante en el CAT, como se explicó antes, lo cual conlleva a bajos valores de esta relación.
De acuerdo con el análisis de regresión, se logra mostrar como la relación entre el CAT y CPT de los tratamientos evaluados tienen una tendencia inversamente proporcional, como se muestra en la Figura 3, explicado por un coeficiente de determinación de 93.13 %. Este comportamiento es resultante, en consecuencia, de la mayor efectividad de extracción del contenido de polifenoles totales con el solvente prótico EtOH/H2O, no solo para la obtención de antocianinas, sino también los demás compuestos fenólicos en la muestra, que consiste en flavonoides y flavan-3-ol [37], así como derivados de ácidos hidroxibenzóicos e hidroxicinámicos [36] compuestos que no fueron del alcance del objeto de estudio, pero que podrían explicar de forma más global el contenido fenólico, pero al no estar acidulado va a tener un efecto, probablemente menor afinidad por las antocianinas monoméricas, opuesto a los tratamientos evaluados en presencia de CH3COOH, de allí que la variación en los CPT no expliquen de forma contundente el CAT.
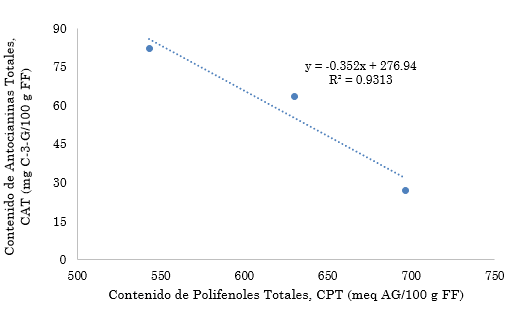
Fuente: Elaboración propia.
Figura 3 Relación lineal entre el Contenido de Polifenoles Totales (CPT) y Contenido de Antocianinas Totales (CAT)
Finalmente, el análisis de correlación realizado para ambas variables muestra un r = 0.9659 (valor Fcalculado (13.55) > Fcrítico (0.17)), indicando que esta relación es “alta” o “fuerte”, a pesar de tener una tendencia inversa.
3.2 Determinación de capacidad antioxidante por un método electroquímico
En la Figura 4 se presentan los voltamperogramas y curva de calibración obtenidos para 5 concentraciones diferentes de ácido gálico. Es posible observar principalmente dos picos de oxidación a 0.40 V y 0.90 V, los cuales son ausentes para la primera curva correspondiente al blanco (buffer de acetatos), mostrando que ambos picos pertenecen a la oxidación del ácido gálico. El primer pico corresponde a la oxidación del grupo OH que se encuentra en posición para al ácido carboxílico, mientras que el segundo pico pertenece a la oxidación de un grupo OH en posición meta [5]. Para la realización de la curva de calibración se tomó la corriente en el segundo pico, en dirección anódica.
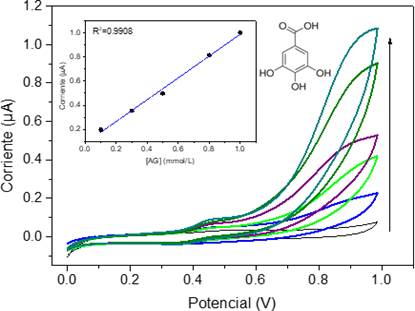
Fuente: elaboración propia.
Figura 4 Voltamperometrías cíclicas para blanco (buffer de acetatos pH 3) y ácido gálico a 0.1, 0.3, 0.5, 0.8 y 1.0 mM. Inserto: curva de calibración
Para evaluar el comportamiento electroquímico de los extractos de arándanos, se realizaron voltamperometrías cíclicas para las muestras obtenidas por los tres solventes diferentes: EtOH/H2O, CH3COOH/H2O y EtOH/CH3COOH/H2O. Las CV fueron barridas desde 0 a 1.0 V a una velocidad de 10 mV/s, las cuales son registradas en la Figura 5. Para los tres sistemas de solventes se presentan 2 picos alrededor de 0.40 V y 0.90 V, mostrando la oxidación de compuestos electroquímicamente activos dentro de los extractos.
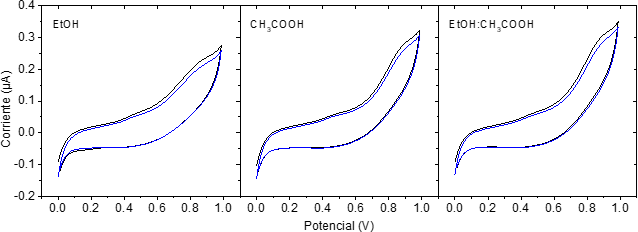
Figura 5 Voltamperometrías cíclicas de los extractos de arándanos obtenidos con tres sistemas de solventes diferentes (EtOH/H2O, CH3COOH/H2O y EtOH/CH3COOH/H2O)
El análisis de los potenciales de oxidación puede dar información de la fuerza del polifenol como agente reductor, entre menor sea el potencial de oxidación, más fácilmente se oxida la molécula y dona electrones [26].
Estudios voltamperométricos previos realizados en arándanos, Nikolić y colaboradores (2019), atribuyen el primer pico anódico a la oxidación de moléculas como quercetina y quercetina 3-O-glucósido presentadas en la Figura 6a, donde reaccionan los grupos hidroxilo sustituyentes 3’ y 4’ del anillo B [14]. Otros grupos fácilmente oxidables presentan un pico a potenciales anódicos bajos tales como el ácido caféico y fenoles de estructura simple presentes también en los arándanos [39]. El segundo pico de oxidación puede deberse a grupos OH del anillo A de la molécula de las quercetinas. Sin embargo, se debe tener en cuenta que los arándanos Vaccinium corymbosum poseen antocianinas con grupos fenólicos oxidables como delfinidina-3-O-glucósido, cinidina-3-O-glucósido, y malvidina-3-O-glucósido [39], por lo tanto este segundo pico responde al solapamiento de los procesos de oxidación de dichas moléculas Figura 6b.
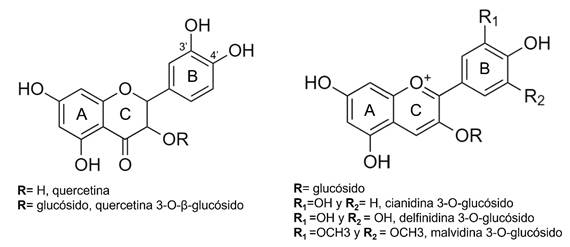
Fuente: elaboración propia.
Figura 6 a. Fórmula estructural de la quercetina y quercetina 3-O-β-glucósido y b. Formula estructural de la cianidina-3-glucósido, delfinidina-3-glucósido y malvidina-3-glucósido
Aunque el comportamiento electroquímico de los compuestos electroactivos en los sistemas de solventes evaluados es similar, es posible observarse algunas diferencias en el pico alrededor de 0.90 V, el cual la magnitud de la corriente alcanzada se da en el orden EtOH/H2O < CH3COOH/H2O < EtOH/CH3COOH/H2O. Es importante tener en cuenta que la magnitud de la corriente es proporcional a la concentración de antioxidantes presentes en la muestra [8].
En la Tabla 3 se reporta el equivalente de ácido gálico para los tres extractos, usando la curva de calibración presentada en la Figura 4 y las densidades de corrientes obtenidas en el segundo pico de oxidación, alrededor de 0.90 V. Los resultados se expresaron como los promedios ± la desviación estándar del análisis por triplicado.
Tabla 3 Cuantificación de capacidad antioxidante total por Voltamperometría cíclica en arándano Vaccinium corymbosum en etanol (EtOH/H2O), ácido acético (CH3COOH/H2O) y etanol ácido acético (EtOH/CH3COOH/H2O).
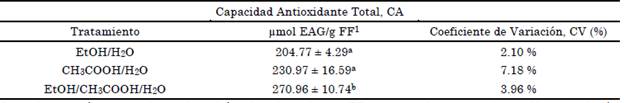
Los valores están expresados en base húmeda o fruto fresco (FF) y reportados como valor medio y desviación estándar (SD), n = 3. Las letras superíndice diferentes en la misma columna, indican diferencias significativas (p < 0.05 por la prueba de Tukey). 1 Resultado expresado como EAG (equivalente a ácido gálico).
Fuente: elaboración propia.
La capacidad antioxidante medida por CV usando un equivalente en ácido gálico, muestra que la mezcla EtOH/CH3COOH/H2O puede extraer mayor contenido de polifenoles y por lo tanto presenta mayor capacidad antioxidante. Es importante observar que esta misma mezcla arroja mayor contenido de antocianinas como se mostró en la Tabla 1, este comportamiento puede deberse a que, para hallar la capacidad antioxidante de los sistemas por CV, se usó la corriente del segundo pico el cual se relaciona con la oxidación de los grupos OH de las antocianinas.
Las antocianinas existen en diferentes configuraciones estructurales dentro de la naturaleza, ya sea protonadas, desprotonadas, hidratadas e isoméricas [40], cuya proporción de cada una de ellas depende significativamente del pH en el ambiente químico en el que se encuentran, donde a valores bajos de pH entre 1.0 y 3.0, el catión flavilio es la especie predominante, mientras que a pH entre 4.0 y 5.0 se transforma a una pseudobase de carbinol incolora que da lugar a especies nuevas como chalconas y, posteriormente a pH más altos entre 6.0 y 7.0, el catión flavilio se transforma en isómeros de base quinoidal a través de procesos transferencia de protones [41]. Por tanto, la influencia del pH del solvente proporcionaría un horizonte acerca del potencial de oxidación de las especies de antocianinas contenidas el extracto de Vaccinium corymbosum, como las pseudobases de carbinol de las antocianinas más abundantes en el arándano anteriormente mencionadas y las especies chalconas contenidas a pH 4.5 en la solución Buffer de acetatos utilizada en el estudio.
Otros estudios han realizado el análisis de CA para arándanos usando el equivalente en µmol trolox/g FF muestra a través de CV. Para este estudio la relación fue hallada usando la carga, área bajo la curva del pico de oxidación anódica del extracto del Vaccinium corymbosum. Para este estudio, la muestra que presenta mayor CPT, arroja el mayor CAT y por consiguiente mayor CA mientras que, en el presente trabajo, analizado por la misma técnica, la CA reportada en µmol EAG/g FF, es mayor cuando la muestra tiene mayor CAT, pero menor CPT. Dicha diferencia puede deberse a la técnica de extracción y a los tipos de solvente utilizados. Ambos estudios tienen en común que se correlaciona fuertemente la CA con el CAT [14].
A modo general, se observó que realizando la extracción por solventes usando etanol puede arrastrar el mayor contenido de polifenoles totales, la mezcla etanol/ácido acético realiza una mayor extracción de antocianinas. Esto puede deberse que a pH ácidos, las antocianinas son protonadas formando un catión [31], la formación del catión favorece su solubilidad en solventes acuosos. Por lo tanto, es recomendable acidular el medio etanólico para favorecer la extracción de antocianinas las cuales son las moléculas con mayores propiedades terapéuticas dentro del grupo de moléculas fenólicas.
Si bien las técnicas electroquímicas representan ciertas ventajas con respecto a los demás métodos analíticos para la evaluación de la capacidad antioxidante de los compuestos fenólicos presentes en los arándanos, éstas solo contribuyen a fortalecer la perfilación y/o caracterización de las propiedades bioactivas del fitoquímico dentro del compendio de métodos existentes para tal fin.
En la Figura 7 se evidencia como el valor promedio de la capacidad antioxidante obtenida con el tratamiento EtOH/CH3COOH/H2O difiere significativamente del tratamiento con etanol o con ácido acético, lo que soporta lo discutido anteriormente sobre la importancia de la sinergia entre un solvente prótico en solución acuosa, ligeramente acidulado.
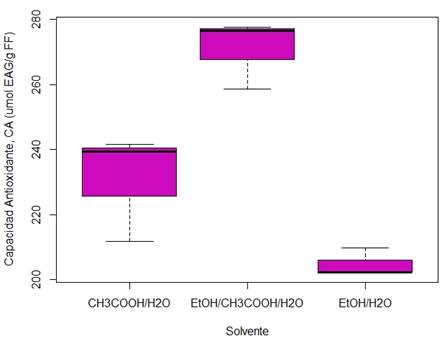
Fuente: elaboración propia.
Figura 7 Boxplot del CA obtenido del método de electroquímico a partir del arándano con EtOH/H2O, CH3COOH/H2O y EtOH/CH3COOH/H2O
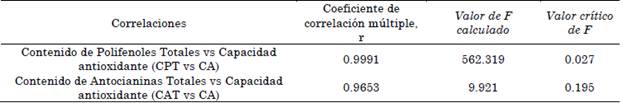
Para la evaluación estadística de las relaciones entre la capacidad antioxidante con el contenido de polifenoles totales y específicamente con el contenido de antocianinas monoméricas, se evaluaron las correlaciones (Tabla 4).
Tabla 4 Coeficiente de correlación múltiple r y valor del estadístico de prueba (F) de la evaluación del CPT vs CA y CAT vs CA
Fuente: elaboración propia.
Las correlaciones entre la capacidad antioxidante con el CPT y el CAT, muestran una asociación fuerte que permite identificar como los tratamientos de solventes propuestos se comportan de forma lineal, para ambos indicadores, permitiendo a futuro hacer posibles predicciones, de cómo el comportamiento del contenido de polifenoles con respecto a ambos indicadores, se ve afectada al introducir variables como cambio en las proporciones de los solventes y la presencia o ausencia de acidulantes débiles como el CH3COOH. En adición, el análisis de la regresión lineal o bondad de ajuste permitió evidenciar la dirección de las asociaciones evaluadas, como se muestra en la Figura 8.

Fuente: elaboración Propia.
Figura 8 Relación lineal entre la Capacidad Antioxidante (CA) por el método de voltamperometría cíclica (CV), con el Contenido de Polifenoles Totales (CPT) y el Contenido de Antocianinas Totales (CAT)
De la Figura 8 se puede identificar que la relación de la CA con el CPT es inversa y con CAT, directa, lo cual conlleva a inferir que la presencia de antocianinas está ejerciendo un efecto antioxidante relevante y aunque no expliquen en alta proporción el CPT, si logran tener una relación “fuerte”, lo cual permite evidenciar como el CAT se ve afectada de manera directa en la capacidad antioxidante si se acidifica el sistema de solventes de extracción.
Contrario es el comportamiento con los compuestos fenólicos, los cuales pueden ser una variedad importante, pero que indica que se puede obtener más CPT con ETOH/H2O, pero su capacidad antioxidante se verá menguada de forma significativa estadísticamente.
3.3 Evaluación del riesgo de los solventes
"La selección de solventes verdes son las rutas más eficaces para reducir el impacto medioambiental" [16]. De acuerdo con el contexto, en la Tabla 5 se evaluó cada uno de los solventes empleados en este estudio, además de los reportados para la extracción de polifenoles de arándanos de la Tabla 2 según la guía de la sociedad europea promotora de metodologías biológicas y químicas sostenibles CHEM21 basados en 3 criterios fundamentales de Seguridad, Salud y Medio Ambiente.
Tabla 5 Evaluación de solventes en base a criterios de seguridad, salud y medio ambiente
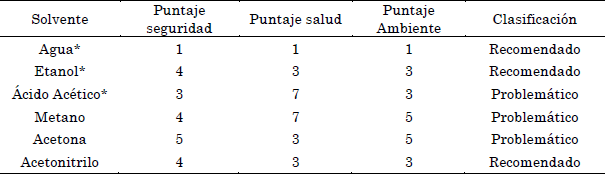
*Solventes utilizados en el estudio.
Evaluación del riesgo: recomendado 1-3; problemático 4-6; y > 7, peligroso.
De acuerdo con la Tabla 5, se evidencia que el empleo de solventes como agua y etanol no representan un riesgo significativo con base a los 3 criterios anteriormente mencionados. Sin embargo, a pesar de que el ácido acético representa un problema de acuerdo con su clasificación cabe resaltar que se empleó a una baja concentración lo que disminuye su riesgo.
Dentro de los demás solventes empleados por los autores, solo el acetonitrilo cumple los criterios propuestos por la CHEM21, lo que hace imperativa la búsqueda de nuevas soluciones verdes y optimización en la obtención de compuestos antioxidantes de los arándanos.
Uno de principales objetivos de la química verde se basa en reducir significativamente el uso y la producción de derivados químicos con una mirada hacia las fuentes renovables. De acuerdo con lo anterior, la gran variedad de disolventes, sobre todo los de carácter orgánico, son dañinos, tóxicos y nocivos en el contexto medioambiental. Por tanto, comprender las propiedades de los disolventes es un factor de relevancia en el desarrollo sostenible [19].
Dentro de los disolventes que se han sugerido en la literatura como “verdes” se ha reportado el agua, fluidos supercríticos, líquidos iónicos, polímeros líquidos y disolventes derivados de biomasa [20]. Sin embargo, el remplazo de un solvente “no verde” por uno “verde” podrían coincidir en aspectos como menor rendimiento o mayor desperdicio, lo que no lo hace sustentable desde una mirada medioambiental; pero, es válido que un disolvente adecuado proporcione una solución sostenible, exponen los autores.
Análogamente, un disolvente se puede considerar verde cuando es más adecuado que el actual para una aplicación concreta. De hecho, no existe ningún disolvente completamente ecológico y, por tanto, siempre dependerá del contexto de su aplicación y de varios requerimientos como restricciones medioambientales (emisiones de compuestos orgánicos volátiles, biodegradabilidad, capa de ozono, y efecto invernadero), eficacia (costo, selectividad, disponibilidad, y poder del solvente) y, finalmente, de seguridad y legislación (riesgo de exposición, toxicidad, inflamabilidad y permiso legal de uso) [21].
No obstante, dentro de la química de los compuestos bioactivos se ha introducido el concepto de extracción verde de productos naturales que se basa en el desarrollo y diseño de procesos de extracción que reduzcan notablemente el consumo energético y permitan proponer el empleo de disolventes alternativos que garanticen la obtención de extractos seguros y de calidad que parten de la optimización e innovación de los procesos de extracción, el uso de equipos, y el empleo de solventes alternativos en alusión a los 6 principios de la extracción verde de productos naturales [29]. Además, los autores recalcan la idea de que para cuantificar el efecto del “extracto verde” desde el punto de vista sostenible, es necesario realizar un análisis de ciclo de vida, no solo del producto ni del proceso de extracción, sino también tener en cuenta la cadena de valor desde la producción del fruto y su recolección, así como de su aplicación, el reciclaje de los subproductos y su biodegradabilidad, Figura 9.
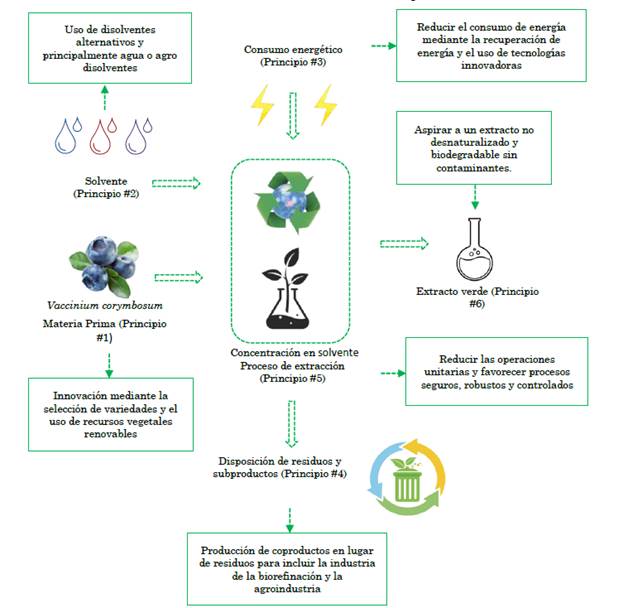
Fuente: Inspirado de [22].
Figura 9 Representación gráfica de acuerdo con los 6 principios de la extracción verde
Finalmente, la extracción ecológica de compuestos bioactivos podría ser un paso con un énfasis en la protección del medio ambiente, la seguridad y el desarrollo de la química verde y al mismo tiempo, mejorar la competencia a nivel industrial promoviendo el desarrollo de procesos ecológicos, económicos e innovadores [22]. Además, el empleo de solventes verdes como el etanol (considerado como agro-solvente), el agua (reconocido por el Codex Alimentarius) y el ácido acético (a concentraciones moderadas), promueven efectos positivos y de relevante impacto ambiental en la obtención de antioxidantes de Vaccinium corymbosum.
4. CONCLUSIONES
Con los tres sistemas de solventes utilizados en este trabajo, se logró la extracción de polifenoles a partir de arándanos Vaccinium corymbosum con resultados comparables con métodos antes reportados, lo cual es una alternativa sostenible al tratarse de solventes verdes amigables con el medioambiente, económicos y con una eficiencia esperada además de ser solventes aprobados por el Codex Alimentarius para su uso.
La evaluación estadística permitió identificar el tipo de correlaciones entre el CAT y CPT con la capacidad antioxidante CA, para identificar el aporte que cada uno de los sistemas de solventes evaluados contribuyeron en la obtención de un extracto a partir un fruto promisorio como materia prima, para tener como referencia en el desarrollo futuro de un ingrediente funcional, orientado al aporte de la capacidad antioxidante, ya sea con un interés por presentar un mayor contenido de polifenoles totales extrayendo con EtOH/H2O, o ser específico en el aporte de antocianinas poliméricas empleando (EtOH/CH3COOH/H2O).
La técnica de CV además de ser económica, sensible, rápida y de fácil empleo, contribuye a fortalecer la caracterización de compuestos bioactivos antioxidantes.