1. INTRODUCCIÓN
Las microalgas, son un grupo de microorganismos procariotas o eucariotas con un alto contenido lípidos, que poseen una pigmentación y una alta tasa de crecimiento, que habitan en todos los ecosistemas del planeta, son reconocidos por su capacidad de captar la luz y el dióxido de carbono para producir los componentes de su biomasa [1]. Las microalgas presentan diversas aplicaciones, como el tratamiento de efluentes contaminados, el aprovechamiento de compuestos y la generación de biomasa, de igual manera pueden biorremediar el aire [2]. Las especies más relevantes en cuanto a aplicaciones son Scenedesmus quadricauda, Chlorella miniata, Chlorella vulgaris y Chlorella sorokiniana, ya que estas eliminan de manera eficiente metales pesados presentes en aguas residuales, además de poder crecer en medios contaminados [3], otras de sus aplicaciones van hacia la Acuicultura, sirviendo de alimento para peces, promoviendo así su crecimiento. Otras aplicaciones se dan en la alimentación humana, en la obtención de colorantes o aditivos alimentarios, cosméticos, nutracéutico, y en áreas relacionadas con bioenergía, como los hidrocarburos (combustible), adsorbentes, enzimas y otros materiales de investigación [4], son además una fuente de una amplia variedad de metabolitos valiosos, que en la actualidad se busca a través de estos maximizar su producción este debido a las dificultades de hacer rentables sus procesos, siendo los cultivos en foto biorreactores, un ejemplo de ello, ya que la alta densidad de biomasa es un factor que puede limitar el acceso de la luz, por lo que se convierte en un elemento importante para la fotosíntesis. En cultivos autotróficos la producción de biomasa se reduce un 25 % al entrar en oscuridad ya que esta depende totalmente de la actividad fotosintética, en condiciones mixotróficas, el cultivo puede seguir creciendo durante la noche utilizando materia orgánica de el mismo medio, por lo que la luz deja de ser un factor limitante para el crecimiento. Los estudios realizados por [5]-[7], se centran en evaluar sustratos más adecuados para la producción de carbohidratos lípidos y proteínas.
Un tipo de moléculas muy importantes son las ficobiliproteínas, pigmentos captadores de luz que están presentes en diversas especies de algas, dependiendo de su máximo de absorbancia se clasifican en aloficocianina, ficocianinas, ficoeritrina [8]. El ficobilisoma es un complejo multiproteico que capta eficazmente la energía luminosa en el rango de longitudes de onda de 450-650 nm, el principal componente de los ficobilisomas son las ficobiliproteínas localizadas en las membranas de los tilacoides, representando hasta el 50 % del total de las proteínas celulares en las cianobacterias, de acuerdo con [9]. Las ficobiliproteínas son las responsables de capturar y transferir energía lumínica y los enlazadores permiten el correcto ensamblaje de las ficobiliproteínas y modulan la transferencia de energía. La ficocianina es una ficobiliproteína responsable del color azul-verde en microalgas y cianobacterias representa hasta el 20 % de la masa seca de las proteínas celulares totales que posee diferentes aplicaciones, en nutrición por su alto contenido de proteínas y antioxidantes, además como agente quelante, con aplicaciones cosméticas en mascarillas, cremas y geles su característico color azul le permite ser usado como pigmento natural en dichas industrias y ampliamente utilizada en industrias farmacéutica antitumorales, la ficocianina y otros compuestos extraídos de las algas ha sido ampliamente revisada en la literatura [10], cuyo mercado mundial se estima en unos 250 millones de dólares en esta década. Los diversos mercados de ficocianina se distinguen por su forma (por ejemplo, polvo o formas acuosas), por su grado (por ejemplo, grados analíticos, cosméticos o alimentarios) y por su aplicación (como biomédica, diagnóstico, bebidas, alimentos, nutracéuticos y productos farmacéuticos), que demuestran la importancia de los (Libras por yarda cúbica PCY por sus siglas en inglés) la cual no puede ser socavada [11], permitiendo de esta manera que el conocimiento de datos sobre la influencia del espectro lumínico sobre microalgas y cianobacterias siendo este un tema relevante en la investigación para la producción de biomoléculas como ficobiliproteínas, las cual toma un alto valor en diferentes industrias, lo que ha permitido mejoras en la producción de metabolitos de interés en diversos campos y aplicaciones ingenieriles a los procesos biotecnológicos como simulaciones y producción industrial [12]. Por ello esta revisión contribuye a la búsqueda y recopilación de datos e información referente al efecto de la luz en la producción de biomoléculas producidas a partir de microalgas como las ficobiliproteínas, específicamente la ficocianina, ya que estas poseen diferentes aplicaciones para las industrias con un alto valor en el mercado. Esta revisión busca la recopilación de información referente a el efecto de la luz en la producción de biomoléculas producidas a partir de microalgas como las ficobiliproteínas, específicamente la ficocianina, ya que estas poseen diferentes aplicaciones para las industrias con un alto valor en el mercado.
2. METODOLOGÍA
Se utilizó el Software VOSviewer para el análisis de metadatos de la base de datos Web of Science, usando la búsqueda con los términos “microalgae Pigment light effect” como palabras de búsqueda, elaborando un mapa a base de información bibliográfica teniendo en cuenta los archivos bibliográficos suministrados por la base de datos Web of Science, para ello se escogieron un total de 200 artículos de investigación disponibles sobre el tema, siendo se seleccionados y exportados como archivo de texto sin formato, en el cual se incluyeron las palabras claves que fueron analizadas por el software, por lo que no fue necesario hacer una revisión individual de cada artículo para lo cual se tuvo en cuenta publicaciones disponibles de los últimos 15 años (2005-2020) como limitación temporal. Así mismo se usaron tres tipos de análisis. el primero co-ocurrencia usando como unidad de análisis todas las “palabras claves” y el método de conteo empleado por el software fue el total de ellas; El número mínimo de ocurrencia por palabra fue 11, por lo que la relación en este caso fueron coincidencias en palabras claves. Para el segundo y tercer análisis el tipo de análisis fue por coautoría, usando como unidad de análisis la categoría “por países” y en método de conteo total. Con un número mínimo de documentos por país de 5. Analizando en uno la cantidad de documentos y el otro la cantidad de citas. Para el resto de la revisión empleada en la recopilación de la información y tablas anexadas se realizó un análisis utilizando diversas bases de datos incluyendo Web of Science, Scient direct, google académico, Nature, entre otras.
3. RESULTADOS Y DISCUSIONES
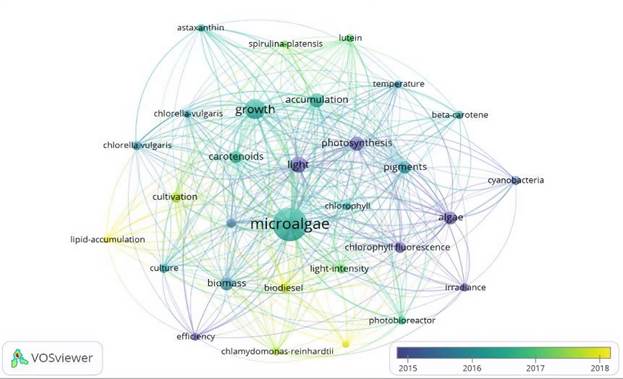
En la correlación entre palabras claves se obtuvieron un total de las 30 palabras con mayor coincidencia entre ellas de una muestra de 200 artículos. Las primeras 10 palabras de mayor relevancia fueron: microalga, crecimiento, luz, acumulación, biomasa, fotosíntesis, pigmentos, carotenoides, alga y biodiesel, observándose en las Figuras 1 y 2 como las palabras más densas. Los temas más actualizados corresponden a una correlación de palabras claves como: biodiesel, acumulación de lípidos, y Chlamydomonas reinhardtii. El análisis de la Figura 1 muestra la correlación de las cepas con los estudios del efecto de la luz en cultivo de microalgas, siendo Spirulina plantesis, Chrorella vulgaris y Chlamydomonas reinhardtii, las más estudiadas. De acuerdo con [13], las microalgas realizan fotosíntesis de manera similar a las plantas superiores por lo que estas juegan un papel importante en el ciclo del carbono siendo productores primarios en la cadena trófica marina y exportando carbono a lo profundo de los océanos donde penetra principalmente la luz en el rango azul y ultravioleta del espectro, factor determínate en su crecimiento ya que investigaciones como las de [14]-[16], han demostrado que la luz afecta sus procesos fotoquímicos por su parte [17], plantea que existen 50 000 especies de algas presentes, pero solo unas 30.000 de ellas han sido analizadas [18], menciona que hay 200 000 a 800 000 especies de microalgas, de las cuales se destacan: cianobacterias, Charophyta, Ochrophyta, Glaucophyta, Chrysophyta, Bacillariophyceae, Dinophyceae, Chlorophyta, Rhodophyta, Glaucocystophyta, Euglenophyta, Chlorarachniophyta, Heterokonta, Haptophyta, Cryptophyta y Alveolata. Estas pueden estar presentes en lagos, estuarios y embalses eutróficos, lo cual hace que estas puedan convertirse en un problema de salud pública por su excesiva proliferación la cual según [19], genera problemas de contaminación en el agua, causando problemas de eutrofización por el consumo del oxígeno disuelto (OD).
Chlamydomonas reinhardtii y Chrorella vulgaris se encuentran más relacionadas con la producción de lípidos, biodiesel y pigmentos a diferencia Spirulina plantesis (ver Figura 2). Su relación se encuentra más dada hacia la producción de pigmentos. Así mismo los carotenoides, axtasantina, betacarotenos y luteína han sido tenidas en cuenta en diversas investigaciones según cuenta la producción bibliográfica de Web of Science.
Es importante mencionar que la coloración en las aguas es causada por los pigmentos de las microalgas que a su vez producen a su vez toxinas y compuestos de sabor y olor, por lo que de acuerdo con [20]-[22], estas reducen la calidad del líquido. Sin embargo, las microalgas y las cianobacterias no simplemente representan problemas, sino que, al contrario, contribuyen a la civilización de numerosas formas [23]. Así mismo, [24] plantea que las microalgas son un componente clave de las redes tróficas acuáticas en su función de productores primarios y desempeñan una serie de funciones en los ciclos geoquímicos globales, por lo que presenta un potencial para biorrefinerías debido su capacidad de mayor fijación de dióxido de carbono.
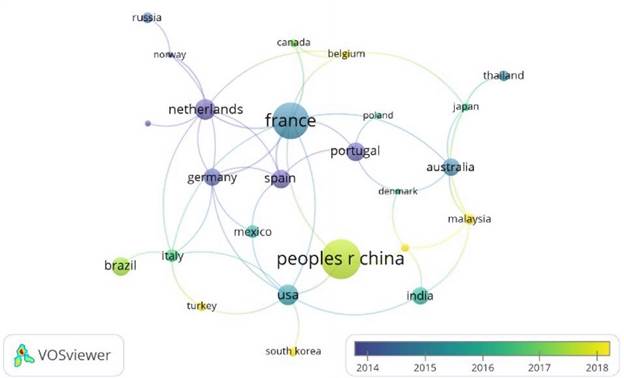
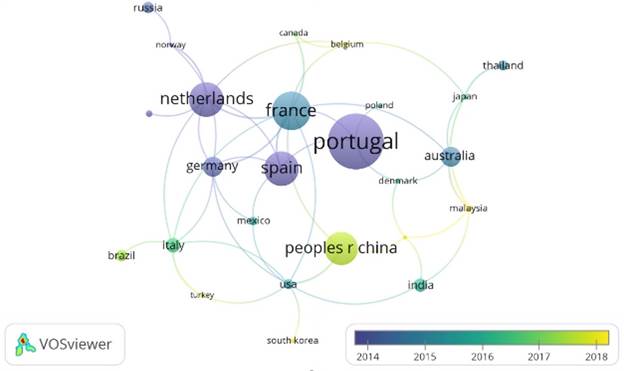
Una tasa de crecimiento de biomasa elevada y el hecho de almacenar carbono en forma carbohidratos y lípidos, lo hace rentable para la recuperación de una amplia gama de biocombustibles y productos de valor agregado [25]. El cultivo de microalgas consume menos espacio, por lo que [26], destaca utilidades para la agricultura, esto sin depender de factores estacionales, como el no uso de tierra y de agroquímicos o pesticida en sus procesos, sirviendo como alimento humano o animal. Las ficobiliproteínas tienen una variedad de usos que ofrecen interesantes perspectivas industriales [27], [28]. El tipo de pigmento y su concentración dependen de la especie de microalgas [29], algunas con la capacidad de crecer en medios como aguas salobres y residuales pudiendo remediarlas y en el proceso fijar CO2. Este tipo de pigmentos tienen un efecto terapéutico sobre humanos y animales debido a sus fuertes propiedades antioxidantes, protegiendo a los organismos de la oxidación. esto ha conferido a las ficobiliproteínas de las cianobacterias y microalgas, una variedad de aplicaciones comerciales, como es el caso de la ficocianina (PC) que se emplea principalmente para reemplazar los pigmentos sintéticos en helados, refrescos, productos lácteos y cosméticos [30], no obstante, existen otras aplicaciones que están orientadas hacia la salud, tratamiento de enfermedades como el Alzheimer y Parkinson [31], en el caso de ficobiliproteínas estos pigmentos son adecuados para análisis fluorescentes de alta resolución, entonces encontraron aplicación en histoquímica, flujo citometría, clasificación de células activadas por fluorescencia, inmunodiagnóstico fluorescente y macromoléculas de detección. Además, diferentes propiedades para la salud, como potente antioxidante, antiinflamatorio [32]-[34]. A continuación, en la Figura 3 se observa los 10 países que presentan mayor producción documental sobre el tema entre los cuales se destacan: China (25), Francia (23), Usa (13), Países Bajos (13), Brasil (12), España (12), Portugal (12), India (11), Australia (11) y Alemania (11).
De acuerdo con Web of Science, durante los últimos 15 años, ha venido en aumento las investigaciones sobre la temática, la Figura 4 muestra como en el año 2019, se dio incremento en la producción bibliográfica relacionada con el tema del efecto la luz en producción de pigmentos, ya que estas juegan un papel importante, en el crecimiento y desarrollo de las algas y afecta principalmente la fotosíntesis [35].
Las proteínas juegan un papel fundamental en la captación de luz para la fotosíntesis, como los complejos pigmento-proteína que captan y canalizan la energía proporcionada por la luz [36]. Para lograr la captura de energía los organismos fotosintéticos emplean antenas recolectoras de luz, en comparación a las cianobacterias esta lo realizan a través de una estructura formada por las bilinas que son cromóforos tetrapirrol lineales sintonizables, conocidas como el ficobiliproteinasa, las bilinas que conforman el ficobilisoma se conocen como ficobiliproteínas, donde la cantidad y concentración de ficobiliproteínas variara para maximizar la captura de las longitudes de ondas predominantes en el ambiente [37]-[39]. Las microalgas han desarrollado este sistema que les permite responder con mayor eficiencia a los estímulos lumínicos cambiando la composición de sus ficobiliproteínas en función el color o espectro de la luz en el ambiental [40]-[43]. Por ello la calidad de la luz juega un papel importante en el crecimiento y desarrollo de las algas y afecta principalmente la fotosíntesis [44]. La luz solar y la artificial, presentan cada una sus ventajas y desventajas [45]. Aunque la luz LED se posiciona como la alternativa tecnológicamente más viable no hay que descuidar el control de la intensidad lumínica ya que una muy alta puede resultar en la disminución del número de proteína cromóforas y reducir las concentraciones de ficobiliproteína, por ello uno de los principales desafíos en los cultivos de microalgas y cianobacterias para la producción de metabolitos secundarios es el equilibrar las altas producciones del compuesto de interés y la biomasa [46].
En cuanto esto, [47] destaca 4 tipos de comportamiento de aclimatación. El tipo 1 presenta cambios en su contenido de ficobiliproteínas por la luz externa, el tipo 2 aumenta de ficoeritrina por luces verde o roja pero no variable en ficocianina, el tipo 3 aumento de ficoeritrina al verde y acumulación de ficocianinas al rojo (aclimatación cromática complementaria) y un tipo 4 adicional principalmente en cianobacterias marinas que ajustan su composición en respuesta a la prevalencia de longitudes de ondas azules frente al verde. Diversos estudios han descrito que la luz azul produce tasas de producción de O2 más bajas que la luz roja en las cianobacterias y también en algas rojas que contienen PBS y otro mostró el color azul como uno con una respuesta de crecimiento más lenta en cianobacterias [48].
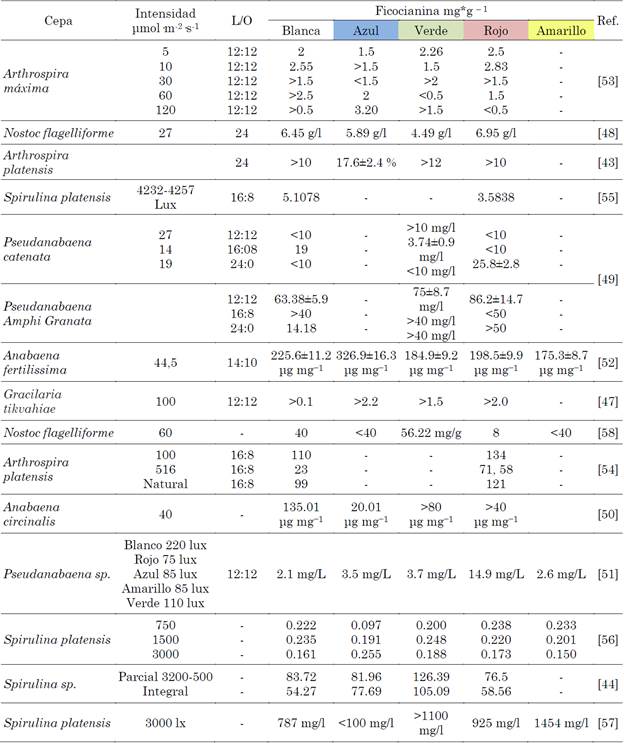
A continuación, la Tabla 1 presenta datos sobre los resultados del uso de diferentes longitudes de onda para la producción de ficocianina.
La cepa de tipo salvaje de Gracilaria tikvahiae fue estudiada por [49], la cual poseía concentraciones significativamente mayores de clorofila y ficoeritrina en comparación a una cepa mutante verde del mismo género y especie, mientras que los mutantes verdes tenían niveles más altos de ficocianina. La investigación realizada por [50], detalló que la ficocianina aumento para luz roja y violeta ya que N. flageliforme tiende a absorber esta longitud de onda para la fotosíntesis crecimiento celular y síntesis de polisacáridos. La ficocianina y a la clorofila a poseen las principales absorbancias en la región de la luz roja. La microalga ajusta la composición de ficobiliproteína en respuesta a la luz proporcionada y presente, este fenómeno corresponde a la capacidad de adaptación cromática complementaria de N. flagelliforme. Se destaca que, para la aloficocianina, se considera que su absorbancia máxima es a 645 nm (luz roja) pero en este estudio alcanzo su máximo en la luz violeta, lo mismo para la ficoeritrina que no logro un comportamiento esperado para luz verde, por lo que se hace necesario otros estudios para comprobar si en esta especie estos dos pigmentos cumplen una función auxiliar para otros colores, permitiéndole aumentar la eficiencia lumínica.
En el estudio de [51], para Pseudanabaena sp. presento afinidad con la luz roja para la producción de ficocianina, en ambientes naturales acuáticos el color rojo predomina en las zonas más superficiales del agua mientras en las más profundas predomina el verde y azul, teniendo en cuenta que los miembros de Pseudanabaena se encuentran comúnmente en aguas poco profundas, sin embargo, la adaptación cromática puede variar según el género y la especie.
Al comparar con otros autores como [52], el cual detalla que para Anabaena circinalis existe una relación directa entre la luz blanca y ficocianina. La luz blanca proporciono la tasa más alta de producción de C-ficocianina, más que los demás espectros de luz, no hubo diferencia significativa entre los tratamientos de luz azul y verde. El orden de los rendimientos fue luz blanca, roja, verde y azul. Otros datos obtenidos de [53], muestran al igual que otras investigaciones un alto rendimiento de producción de C-ficocianina con luz roja (14,9 mg/l) y menor en otras condiciones de luz para Pseudanabaena sp, por su parte [54], encontró que el contenido de ficocianina y ficoeritrina en Anabaena Fertilissima aumentó en un 45 % y un 102 %, respectivamente, ya que la acumulación de ficobiliproteínas en A. maxima se incrementó con LED azul y obtuvo su mayor rendimiento de ficocianina a luz azul en general. La mayor cantidad se encontró a una intensidad lumínica de 120 μmol de fotones m−2s-1 (3.20 mg·g−1), para otras intensidades de luz se encontró el valor máximo de ficocianina en color verde a 5 μmol m−2s−1 (2.26 mg·g−1) y rojo y blanco a 10 μmol m−2s-1 (2.83 mg·g−1) (2.55 mg·g−1). En las algas rojas, a menudo se encuentra que la luz azul estimula la síntesis de ficobiliproteínas más que la luz roja [56]. Otro caso de la favorabilidad de la luz azul fue encontrado por [55], para Arthrospira platensis el contenido mínimo de ficocianina se presentó en el rosa (8.2±1.2 %) y el máximo en la luz azul (17.6±2.4 %). Por otro lado, el contenido de clorofila fue menor en el rojo (1.04±0.04 %) y más alto en el azul (1.42±0.29 %). No óbstate otras investigación como la de [57], encontró favorabilidad en el aumento de la concentración de ficocianina usando filtros para luz roja para Arthrospira platensis SAG 21.99 obteniendo un mayor contenido para intensidades de luces bajas (134 mg g-1), seguido de luz natural (121 mg-1) y finalmente la intensidad de luz alta (71 mg-1) el autor afirma que en observaciones previas una reducción de la intensidad lumínica resultaba favorable para la concentración de ficocianina en Arthrospira platensis, debido a la adaptación cromática donde las cianobacterias ajustan su composición de pigmento en respuesta a las alteraciones de la luz, transferido a la clorofila a en el fotosistema II para mejorar la capacidad fotosintética de Arthrospira platensis. En Spirulina platensis el mayor contenido de ficocianina se dio en el espectro rojo en relación con el azul [58], para ello se utilizó un medio MT y el medio de Walne en el estudio y el resultado de ficocianina fue mayor en el medio MT, se cree que por la mayor biodisponibilidad de nitrógeno y fosfato. La deficiencia de fósforo hace que las células de las algas disminuyan el contenido de proteínas seguido de la degradación de varios componentes celulares asociados con la síntesis de proteínas, incluida la ficocianina. Así mismo para el crecimiento de S. platensis. [59], resaltaron que su máximo contenido de ficocianina de 0.152 (g/g de biomasa) se dio cuando se utilizó LED’s rojos. Por otra parte, la luz azul dio el contenido de Phy más bajo de 0.126 (g/g de biomasa). sin embargo, los datos fueron muy dispersos y la diferencia de contenido de ficocianina fue estadísticamente insignificante. A su vez se ha encontrado efectos positivos de otros espectros de luz en producción de ficocianina. Así mismo en todos los colores de LED’s usados presentaron un buen rendimiento de ficocianina en comparación con la luz blanca fluorescente. También [60], con Spirulina platensis se obtuvo como resultado un contenido más alto de la ficocianina en condiciones mixotroficas con lámpara fluorescente blanca (236 mg/g de biomasa seca). Para luz monocromática usando LED’s el mejor rendimiento lo presento el amarillo (380.2 mg/g de biomasa seca) quintuplicando al control (70.36 mg/g de biomasa seca). El orden de los rendimientos fue de mayor a menor amarillo, azul, verde, rojo y blanco. Los LED’s verde, rojo y blanco produjeron células que contenían casi la misma cantidad de ficocianina en modo mixotrófico. Todo esto para condiciones mixotroficas usando como fuente de carbono glucosa (0.1 %), ya que a condiciones autotróficas los resultaros fueron mucho menores. Todas estas investigaciones presentan condiciones de cultivo distintas que podrían afectar el efecto del tipo de espectro empleado, así como el tipo de cepa. Para otras investigaciones con especies distintas de microalgas [61], realizo experimentos con Nostoc flagelliforme con una intensidad lumínica baja de 60 μmol/(m2s) usando luz monocromática roja, azul, verde, amarilla, purpura y blanca obteniendo en la fase exponencial el mayor rendimiento con luz verde para clorofila (4.61 mg/g), seguido de luz blanca (4.04), amarilla (3.97), purpura (2.91), azul (2.88) y finalmente, roja (0.98 mg/g) destacando que en la fase especial la luz roja presentaba altos rendimientos de clorofila pero en la estacionaria fue la menor. A su vez la luz purpura tuvo el mejor rendimiento de carotenoides (1.84 mg/g) esto debido a que la luz purpura es perjudicial para Nostoc flagelliforme y los carotenoides cumplen una función de protección como pigmento accesorio, sumada su función fotosintética lo que explica su abundancia en este tipo de luz [62], evaluó tres cultivos marinos y la influencia de la luz en su producción de ficobiliproteínas, las cepas estudiadas fueron Lyngbya sp. A09DM, Phormidium sp. A27DM y Halomicronema sp. A32DM. donde la mejor adaptación cromática fue la de, Lyngbya sp. A09DM seguida por Halomicronema sp. A32DM, Phormidium sp. Halomicronema sp. A32DM no presento buena adaptabilidad a luz verde. El estudio significa que incluso la luz juega un papel junto con la disponibilidad de nutrientes para adaptarse a las condiciones de estrés [63]. Cabe mencionar que uno de los factores determinantes en la producción de ficobiliproteínas es suministrar una intensidad y espectro de luz adecuados en equipos con sistemas cerrados de cultivo de microalgas ya que la luz ejerce una fuerte influencia sobre los metabolitos y la biomasa, [64], [65], permitiendo maximizar el crecimiento y la concentración de productos.
4. CONCLUSIONES
Las investigaciones sobre el efecto del espectro de luz en el cultivo de microalgas para producción de metabolitos como pigmentos, es un tema de interés, actualmente debido a la alta importancia que están tomando las ficobiliproteínas y otros pigmentos naturales en el mercado, esto sumado al creciente interés por métodos sostenibles y nuevas formas de producción que permitan una bioeconomía. La ficocianina se posiciona como la ficobiliproteína de mayor interés actualmente debido a su diversidad de aplicaciones en distintos sectores. En cuanto a otros pigmentos de interés, la astaxantina y carotenoides también son pigmentos atractivos para temas de investigación que involucren la luz en su productividad. Por otra parte, Athrospira platensis se posiciona como la microalga de más utilidad comercialmente y foco de investigación por su misma relevancia industrial. En cuanto a los espectros de luz roja por lo general estas presentan un incremento en el contenido de biomasa mientras el espectro azul a pesar de no ser promotor de altas tasas de crecimiento. Finalmente es de resaltar que la mayor producción investigativa se concentra en Europa y china, mientras las redes de colaboración de investigación en cuanto a citas están principalmente en Europa, por lo que el efecto de la luz en la producción de ficobiliproteínas representa una alternativa de investigación pertinente con aplicaciones al mercado.