Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cancerología
versión impresa ISSN 0123-9015
rev.colomb.cancerol. vol.17 no.2 Bogotá abr./jun. 2013
ORIGINAL
Supervivencia en adenocarcinoma gástrico posterior a tratamiento adyuvante tratados en el Instituto Nacional de Cancerología de Colombia durante el 2009
Survival in gastric adenocarcinoma patients after adjuvant treatment in the Colombian National Institute of Cancerology during 2009.
Fabio Grossoa,*, Ricardo Brugésa y Licet Villamizarb
a Grupo de Oncología Clínica, Instituto Nacional de Cancerología, Bogotá D. C., Colombia
b Grupo de Investigación clínica, Instituto Nacional de Cancerología, Bogotá D. C., Colombia
* Autor para correspondencia.
Correo electrónico: fabiogrosso_@hotmail.com (F. Grosso).
Recibido el 9 de noviembre de 2012; aceptado el 7 de mayo de 2013
Resumen
Objetivo: Determinar la supervivencia libre de enfermedad y global a dos años en pacientes con cáncer gástrico que recibieron tratamiento adyuvante en el Instituto Nacional de Cancerología de Colombia (INC) durante el 2009.
Pacientes y métodos: De forma retrospectiva, se incluyeron pacientes con diagnóstico de adenocarcinoma gástrico o de la unión gastroesofágica que hubieran recibido quimioterapia adyuvante en el INC durante el 2009. Se describieron las características clínicas, epidemiológicas, tratamiento recibido, supervivencia global y libre de enfermedad a dos años.
Resultados: Se incluyeron en el análisis a 32 pacientes. La edad media fue de 55 años. Los hombres representaron el 56,2% de los casos. El subtipo histológico predominante fue el intestinal (53,1%). El grado de invasión tumoral T3-T4 se presentó en el 81,2%, y el compromiso ganglionar, en el 84,3%, con 34,3% de los casos, con siete o más ganglios comprometidos. El 96,8% recibieron tratamiento adyuvante de acuerdo con el protocolo Macdonald. El 75% de los pacientes completaron el tratamiento. En el 12% de los casos se suspendió el tratamiento por toxicidad. El seguimiento medio de los pacientes fue de 37,8 meses. La supervivencia global y libre de enfermedad a dos años en pacientes que recibieron quimioterapia adyuvante fue de 85,18% y 77,4%, respectivamente.
Conclusiones: El estudio mostró una mayor supervivencia global y libre de enfermedad para pacientes que recibieron tratamiento adyuvante en el INC frente a la encontrada en los estudios INT 0116 y MAGIC; la supervivencia es similar a estudios con población asiática.
Palabras clave: Neoplasias gástricas; Quimioterapia adyuvante; Terapia combinada; Supervivencia; Análisis de supervivencia; Mortalidad.
Abstract
Objective: To determine the disease free and overall survival at two years in patients with gastric cancer who received adjuvant treatment in the Colombian National Institute of Cancerology (INC) during 2009.
Patients and methods: A retrospective study was conducted on patients with a diagnosis of a gastric adenocarcinoma or of the gastroesophageal junction and who had received adjuvant chemotherapy in the INC during the year 2009. The variables recorded were: clinical and epidemiological characteristics, treatment received, and the overall and disease free survival at two years.
Results: A total of 32 patients (56.2% males), with a mean age of 55 years were included in the analysis. The most predominant histological sub-type was intestinal (53.1%). T3-T4 tumor invasion grade was present in 81.2%, and lymph involvement in 84.3%, with 34.3% of cases with seven or more lymph nodes involved. Almost all of them (96.8%) received adjuvant treatment according to the Macdonald protocol. Three-quarters (75%) of the patients completed the treatment. Treatment was stopped in 12% of cases due to toxicity. The mean follow-up of the patients was 37.8 months. The overall and disease free survival was at two years in the patients who received adjuvant chemotherapy was 85.18% and 77.4%, respectively.
Conclusions: The study showed a greater overall and disease free survival in patients who received adjuvant treatment in the INC compared to that found in patients in the INT 0116 and MAGIC studies. The survival is similar to that in studies with Asiatic populations.
Keywords: Gastric tumors; Adjuvant chemotherapy; Combined treatment; Survival; Survival analysis; Mortality.
Introducción
Mundialmente, el cáncer gástrico es la cuarta causa de cáncer y la tercera en mortalidad1. En el 2008 se reportaron 989.500 nuevos casos de cáncer gástrico y 738.000 muertes asociadas, correspondiente al 8% del total de casos de cáncer y al 10% de todas las muertes por cáncer en el mundo. El adenocarcinoma corresponde al 95% de las neoplasias gástricas malignas, y generalmente el término cáncer gástrico se refiere a adenocarcinoma del estómago. Otros tumores malignos incluyen adenoacantoma, tumores carcinoides, GIST y linfomas2,3.
En países occidentales, al menos el 70% de los adenocarcinomas gástricos son diagnosticados en estadios localmente avanzados4,5. En general, el pronóstico de pacientes con cáncer gástrico es pobre, con supervivencias a cinco años del 20%. En cáncer gástrico temprano tratado, la supervivencia a cinco años es del 90%6,7. En estadios más avanzados, posterior a cirugía potencialmente curativa, la supervivencia a cinco años es del 20 al 30%8.
La recurrencia luego de cirugía es usualmente la causa de muerte. Los factores de riesgo asociados con menor supervivencia en cáncer gástrico luego de resección quirúrgica con intención curativa son edad avanzada, estadio tumoral, número de ganglios linfáticos comprometidos9 y grado de infiltración del tumor en la pared gástrica6,10. La localización del tumor también es un factor pronóstico independiente en cáncer gástrico; los carcinomas proximales son los de peor pronóstico. Varios estudios han reportado la positividad de los bordes de resección como un factor asociado con disminución en la supervivencia global11,12.
Las recaídas posteriores al tratamiento quirúrgico con intención curativa son predominantemente a distancia12-14, aunque en otras publicaciones se reporta una mayor tasa de recaídas locorregionales15. Los sitios de recaída local incluyen los márgenes de resección, lecho quirúrgico y drenaje linfático regional11,13,16.
En la actualidad, se considera que el tratamiento del cáncer gástrico debe ser multimodal17. En los últimos años se han dado avances importantes en el tratamiento adyuvante. En la mayoría de meta-análisis publicados en la literatura mundial, este ha mostrado beneficio en supervivencia global y por tanto se considera como estándar de manejo en pacientes de alto riesgo18-24. Sin embargo, no se ha definido cuál es el esquema óptimo por utilizar17.
El tratamiento perioperatorio con quimioterapia en pacientes de alto riesgo varía en diferentes partes del mundo. En Europa es estándar la quimioterapia perioperatoria; en Estados Unidos, la quimiorradioterapia, y en Japón, la quimioterapia adyuvante con fluoropirimidinas orales. En grandes estudios aleatorizados en Japón que comparan quimioterapia adyuvante con S1 frente a cirugía se encuentra aumento en la supervivencia global a favor de los pacientes tratados con quimioterapia adyuvante4-5,25.
Aproximadamente el 70% de los casos nuevos y muertes ocurren en países en desarrollo1,26. En Colombia, el cáncer gástrico es una enfermedad de alta prevalencia y morbimortalidad; así, es la principal causa de muerte por enfermedad neoplásica en ambos sexos27,28. GLOBOCAN, en el 2008, estima una incidencia en adultos de 23,4 por cada 100.000 habitantes, que corresponde a la segunda causa de nuevos casos de cáncer (14%), y una mortalidad de 17,8 por 100.000 habitantes en población adulta, que corresponde a la primera causa de muerte26 (18%). De acuerdo con el Departamento Administrativo Nacional de Estadística (DANE), en el 2009 se presentaron en Colombia 16.113 muertes en hombres y 16.702 en mujeres por tumores malignos; de estas, 2.688 fueron por cáncer gástrico en hombres y 1.749 en mujeres, por tanto es la primera causa de muerte por cáncer en hombres y la segunda en mujeres después del cáncer de mama29.
En el Instituto Nacional de Cancerología de Colombia (INC), de acuerdo con el Anuario estadístico del 2010, el cáncer gástrico es la primera causa de mortalidad. En el 2010 se presentaron 426 casos nuevos de cáncer gástrico (255 casos en hombres y 171 en mujeres), siendo así el cáncer con más casos nuevos del tracto gastrointestinal.29
En la actualidad, en el INC, se dispone de información acerca de los casos nuevos y la mortalidad por cáncer gástrico, pero se desconoce el impacto en la supervivencia de tratamientos rutinariamente empleados en adyuvancia. El objetivo del estudio es determinar la supervivencia libre de enfermedad y global a dos años de pacientes con cáncer gástrico que recibieron tratamiento adyuvante en el INC en el 2009.
Materiales y métodos
Diseño
Estudio descriptivo, retrospectivo, tipo serie de casos.
Población
Pacientes con diagnóstico de adenocarcinoma gástrico que iniciaron quimioterapia adyuvante en el INC en el periodo comprendido entre el 1 de enero y el 31 de diciembre del 2009.
Criterios de inclusión
Pacientes con:
- Cáncer gástrico de alto riesgo, que incluye pacientes con estadio T3-4 o ganglio positivo, de acuerdo con la clasificación AJCC del 2010 (los pacientes fueron reclasificados de acuerdo con la última clasificación de la AJCC).
- Pacientes con adenocarcinoma de la unión gastroesofágica que se hayan llevado a gastrectomía más esofaguectomía distal, o gastrectomía sin tratamiento previo neoadyuvante de quimiorradioterapia.
- Edad mayor o igual a 18 años.
- ECOG menor de 2.
- Expectativa de vida mayor a tres meses.
- Adecuada función hematológica, hepática y renal, definida como recuento absoluto de neutrófilos mayor o igual a 1.500, recuento de plaquetas mayor o igual a 100.000, hemoglobina mayor o igual a 9 g/dl, bilirrubina total en el rango normal de laboratorio, fosfatasa alcalina, ALT y AST menor o igual a 2,5 veces el valor superior normal, creatinina dentro del rango normal de laboratorio.
Criterios de exclusión
- Antecedente previo de cáncer en los últimos dos años diferente a cáncer de piel.
- Manejo quirúrgico extrainstitucional.
- Pacientes con inadecuada estadificación de la enfermedad reportada en la historia clínica.
- Pacientes sin reportes completos en la historia clínica del tipo de quimioterapia y número de ciclos recibidos en adyuvancia.
- Pacientes con cáncer gástrico con histologías diferentes a adenocarcinoma.
Recolección de la información
Se obtuvo información de las bases de datos del INC de forma retrospectiva, al evaluar la supervivencia libre de enfermedad y global a dos años posterior al tratamiento adyuvante, que describe las características clínicas y epidemiológicas, y el tratamiento recibido. La supervivencia fue confirmada telefónicamente.
Plan de análisis estadístico
La información fue tabulada y verificada en una base de datos en formato Excel® y analizada empleando el programa Stata versión 11.0®. En el caso de las variables cualitativas, se emplearon medidas de frecuencia absoluta y relativa; en el caso de las variables cuantitativas, se emplearon medidas de tendencia central y dispersión acorde con la distribución. Para los desenlaces de supervivencia se utilizó el método de Kaplan-Meier. La supervivencia global fue definida como el intervalo de tiempo comprendido a partir de la fecha del diagnóstico con confirmación patológica, a la fecha de muerte por cualquier causa. La supervivencia libre de enfermedad fue definida como el intervalo de tiempo comprendido a partir de la fecha de la resección quirúrgica del tumor gástrico, a la fecha en la que se confirme recurrencia o muerte por cualquier causa (lo que ocurra primero).
Resultados
En el INC, 48 pacientes recibieron quimioterapia adyuvante durante el 2009. De esta población se excluyó un total de 16 pacientes, 15 por manejo quirúrgico extrainstitucional y un paciente por ECOG de 2. Se incluyeron, por tanto, en el análisis a 32 pacientes.
Características de los pacientes
La edad media fue de 55 años, con un rango entre 29 y 77 años. Hubo predominio de hombres, los cuales representaron el 56,2% de los casos. La mayoría de los pacientes tenían ECOG de 1 (81,7%), el resto tenían ECOG de 0. El subtipo histológico predominante fue el intestinal (53,1%), seguido del difuso (37,5%) y mucinoso (9,3%). La mayoría de los tumores eran pobremente diferenciados (50%), seguidos de tumores moderadamente diferenciados (25%). De acuerdo con la séptima edición de la AJCC, se identificó el estadio 11Ia (25%), seguido del IIIB (21,8%) y el IIB (18,7%). De acuerdo con el grado de invasión, de forma predominante los pacientes tenían un T3, con el 46,8% de los pacientes; seguido del T4, correspondiente a un 34,7% de los casos. En el 84,3% de los casos había compromiso ganglionar, con un 34,3% de los casos, con siete o más ganglios comprometidos. Las características de los pacientes del estudio se resumen en la tabla 1.

Tratamiento
El 96,8% de los pacientes recibieron tratamiento adyuvante de acuerdo con el protocolo Macdonald y el porcentaje restante recibió tratamiento perioperatorio (esquema MAGIC). De los pacientes llevados a cirugía en el INC, el 90,6% de los pacientes fueron R0, se reportaron complicaciones quirúrgicas inmediatas en el 9,3% de los casos.
El 75% de los pacientes que iniciaron quimioterapia adyuvante completaron el tratamiento. De los pacientes que suspendieron el tratamiento, el 12% lo hizo por toxicidad. Se reportaron efectos adversos de cualquier grado en el 53,1% de los casos. El 90,6% de los pacientes recibió radioterapia adyuvante y el 96,5% de los pacientes la completaron.
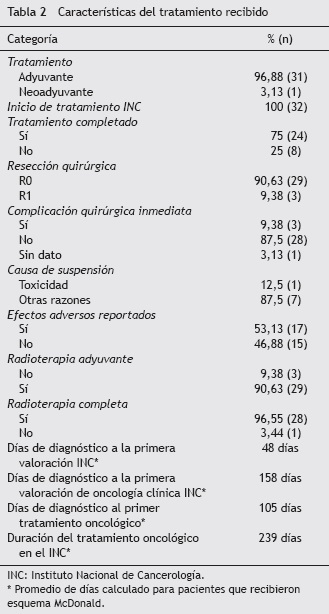
El promedio de días del diagnóstico a la primera valoración en el INC son 48 días; a la primera valoración por oncología clínica, 158 días, y al primer tratamiento oncológico, 105 días, que en la mayoría de casos fue el manejo quirúrgico. La duración promedio del tratamiento oncológico para pacientes que recibieron adyuvancia con esquema Macdonald, tomándose el tiempo comprendido entre la cirugía hasta el último día de quimioterapia, fue de 239 días. Las características del tratamiento adyuvante recibido se describen en la tabla 2.
Desenlaces
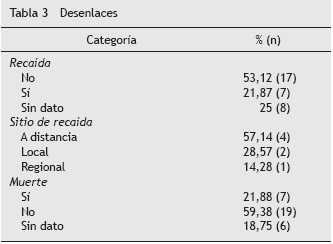
El tiempo mediano de seguimiento de los pacientes fue de 37,2 meses, correspondiente a aproximadamente 3,1 años, con un rango de 9,4 meses a 53 meses. Durante el seguimiento se documentó recaída en el 21,8% de los pacientes, de forma predominante se encontró recaída a distancia en el 57,1%, y el 21,8% de los pacientes murieron durante el seguimiento. El 60% de las recaídas se presentaron en el subtipo intestinal y el 40%, en el difuso. El 55,5% de las muertes se presentaron en el subtipo difuso y el 44,4%, en el intestinal.
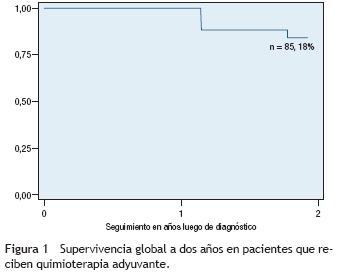
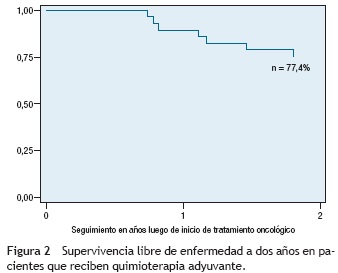
De los pacientes con cáncer gástrico difuso se presentaron recaídas en el 33,3% y muertes en el 41,6%. En el subgrupo de tipo intestinal se presentaron recaídas en el 35,2% y muertes en el 23,5% de los pacientes. Los desenlaces se describen en la tabla 3. La supervivencia global a dos años en pacientes que recibieron quimioterapia adyuvante fue del 85,18% (fig. 1). La supervivencia libre de enfermedad a dos años en pacientes que recibieron quimioterapia adyuvante fue del 77,4% (fig. 2).
Discusión
En el presente estudio, los protocolos de quimioterapia adyuvante utilizados son el INT 0116 (Macdonald) y el del UK Medical Research (MRC Adjuvant Gastric Infusional Chemotherapy - estudio MAGIC). En el estudio INT0116 (protocolo Macdonald), pacientes con cáncer gástrico resecado fueron aleatorizados a recibir quimiorradiación adyuvante con 5 fluorouracilo y leucovorin frente a observación. El estudio, luego de cinco años de seguimiento, encontró aumento en la supervivencia global y libre de enfermedad estadísticamente significativo14,30. A pesar de esto, ha sido criticado debido a que se realizó una linfadenectomía su-bóptima, en la cual solo al 10% de los pacientes se les practicó disección D2, y D1 en el 36%. Por esto, se consideró que la quimiorradioterapia tuvo un efecto compensador, considerando que los menos beneficiados de la intervención fueron los pacientes con D214. Este beneficio en supervivencia global se mantiene en la actualización del mismo estudio, con un seguimiento de los pacientes a dos años31.
El otro esquema utilizado en el INC es el del UK Medical Research (Adjuvant Gastric Infusional Chemotherapy - estudio MAGIC), en este se encontró aumento significativo en la supervivencia a cinco años, con tres ciclos de ECF (epirubicina, cisplatino e infusión continua de 5 fluorouracilo), tratamiento administrado antes y después de cirugía. La crítica a dicho estudio es que solo el 45% de los pacientes que iniciaron quimioterapia y fueron llevados a cirugía completaron el tratamiento como se propuso inicialmente25,32.
En el presente estudio, el esquema Macdonald fue utilizado en el 96,88% de los casos, esto pudiera explicarse debido a que la primera valoración de los pacientes con cáncer gástrico en el INC la hacen los servicios quirúrgicos y a la facilidad de la administración del esquema Macdonald sobre el MAGIC, el cual requiere administración infusional del 5 fluorouracilo.
Al comparar las características de los pacientes del presente estudio con las del Macdonald y MAGIC, encontramos que son similares respecto a edad, predominio de pacientes de sexo masculino y ECOG. Todos los pacientes de este estudio y del MAGIC tenían ECOG entre 0 y 1; en el estudio Macdonald, el 6% de la población tenía un ECOG de 2.
En el estudio Macdonald fueron excluidos los pacientes con resección R1, mientras que en el presente estudio representaron el 9,3% de los pacientes, lo cual pudo impactar los desenlaces de supervivencia11.
El grado de invasión tumoral T3-T4 se presentó en este estudio en el 81,2% de los pacientes, el 68% en el Macdonald y el 48,3% en el MAGIC. Sin embargo, debemos tener en cuenta que hay diferencias en la estadificación de la AJCC en los diferentes estudios. Se presentó compromiso ganglionar en el 84,3% (34,3% con siete o más ganglios), en el Macdonald en el 86% y en el MAGIC en el 69% de los pacientes.
Tanto para el grado de invasión tumoral como para el compromiso ganglionar, los hallazgos reportados en el estudio MAGIC son posteriores a tres ciclos de quimioterapia. Otro aspecto que puede subestimar el grado de compromiso ganglionar para los estudios Macdonald y MAGIC es la disección ganglionar realizada, en el Macdonald se hizo disección D2 en el 10% de los pacientes y D1 en el 36%. En el MAGIC, la disección D2 se realizó en el 42,5% de los pacientes y D1 en el 17,8%. En el INC se realiza de forma rutinaria disección D2.
Se reportó toxicidad en este estudio en el 53,1% de los pacientes (sin especificación de grado); en el Macdonald, en un 54% se presentó toxicidad grado III y IV, esto llevó a suspensión del tratamiento en el 12 y 17% de los casos, respectivamente. El tratamiento fue completado en el 75% de los casos en el presente estudio, 64% en el Macdonald y 41,6% en el MAGIC. Las recaídas a distancia predominaron en el presente estudio (57,4%) y en el MAGIC, mientras que en el Macdonald predominaron las regionales, en el 65% de los casos.
El análisis de la comparación indirecta de la supervivencia global y libre de enfermedad frente a los estudios MAGIC y Macdonald muestra mejores desenlaces; sin embargo, debe aclararse que el seguimiento de los pacientes del INC se realizó de forma retrospectiva con punto de corte a dos años, sin poder compararse con valores absolutos de los ensayos anteriormente mencionados en este mismo rango de tiempo.
La supervivencia global y libre de enfermedad a dos años del presente estudio, el 85,18 y 77,4% respectivamente, están más cercanas a las reportadas en las fases III ACTS-GC33,34 (Adjuvant Chemotherapy Trial of S1 for Gastric Cancer), CLASSIC35 (Capecitabine and oxaliplatin adjuvant study in stomach cancer) y ARTIST36 (Adjuvant Chemoradiation Therapy in Stomach Cancer). En estos, la supervivencia global y libre de enfermedad es superior a la reportada con los protocolos MAGIC y Macdonald37. Dichos estudios comparten características que podrían explicar estos desenlaces: fueron realizados en población asiática, en la cual se han observado mejores desenlaces frente a población occidental, para lo cual se han considerado varias hipótesis que incluyen diferencias en tratamiento, raciales y en la biología tumoral7,37,38.
La disección D2 fue realizada en todos los pacientes del presente estudio, como en el ACTS-GC, CLASSIC, ARTIST, lo cual explicaría la menor tasa de recurrencias locorregionales. Estos resultados podrían llevar a plantear como hipótesis que la población de este estudio, con una alta incidencia de cáncer gástrico similar a la reportada en Japón, puede tener una mayor supervivencia frente a la población europea y de Estados Unidos, cuando se les ofrecen tratamientos quirúrgicos con disecciones ganglionares del tipo D2 asociadas con quimioterapia adyuvante. Estas son conclusiones a las que se han llegado en algunas publicaciones; así, se propone que los desenlaces en cáncer gástrico pueden ser superiores en áreas de mayor incidencia7.
Otra hipótesis frente a estos desenlaces podría ser el beneficio de la radioterapia en pacientes con ganglio positivo, como se ha sugerido en el análisis de subgrupos del estudio ARTIST en pacientes llevados a gastrectomía con disección D2, lo cual ha llevado al diseño del estudio ARTIST-2, que incluye una población exclusivamente con ganglio positivo, para definir el papel de la radioterapia adyuvante36,38. Aunque muy controversial, el impacto de la disección D2 podría afectar los desenlaces, tal como se ha descrito en el estudio aleatorizado más grande que compara la disección D2 y D1, en el cual, con un seguimiento a 15 años, se encontró que la linfa-denectomía D2 se asoció con una menor recaída locorregional y muerte asociada con cáncer gástrico, aunque sin impacto estadísticamente significativo en supervivencia global39.
A pesar de contar con una población de muy alto riesgo, T3-4 en el 81,2%, compromiso nodal en el 84,3% (34,3% de pacientes con siete o más ganglios comprometidos), tumores pobremente diferenciados en el 50%, resección R1 en el 9,3% y adenocarcinoma de tipo difuso en el 37,5%, la supervivencia global y libre de enfermedad es superior a la reportada en los estudios Macdonald y MAGIC. El subtipo histológico difuso, en la última actualización del estudio Macdonald, se observó que era el de menor beneficio. Esto podría explicar el predominio de muertes en pacientes con este subtipo histológico, reportadas en los pacientes del INC. Adicionalmente, hay que tener en cuenta que los intervalos de tiempo de inicio y duración de tratamiento (calculados solo para los pacientes del protocolo Macdonald) son mucho más prolongados frente a los propuestos en el protocolo original (Macdonald), lo cual sugeriría también un menor beneficio de la intervención.
En el INC, durante el 2009 iniciaron quimioterapia adyuvante el 14% de los nuevos casos de cáncer gástrico durante el mismo año, y de estos, el 31% recibió manejo quirúrgico extrainstitucional. Con la información del estudio, debe considerarse el diseño de estrategias para acortar los intervalos de tiempo del tratamiento adyuvante. Adicionalmente, en pacientes con cáncer gástrico de tipo difuso podría considerarse el uso esquemas de quimioterapia adyuvante diferentes al Macdonald.
El estudio tiene limitaciones, como el número de pacientes incluidos, selección de la población, naturaleza retrospectiva y un seguimiento corto para valorar supervivencia global y libre de progresión. Además, tanto en recaídas como para las muertes reportadas, hay un porcentaje significativo en el cual no se obtuvo información, lo cual puede afectar los desenlaces y afectar las conclusiones derivadas. Debido a la variabilidad tanto de los métodos como de los intervalos de seguimiento de los pacientes propios de un estudio retrospectivo, puede haber sesgo en la supervivencia libre de enfermedad descrita.
En las muertes reportadas, el porcentaje de pacientes en los que no se obtuvo información corresponde a los pacientes con los cuales no se pudo establecer comunicación telefónica en la fecha determinada para recolección de la información, correspondiente a un total de seis pacientes. De forma retrospectiva, se logró comunicación con uno de los pacientes, para confirmar que se encontraba vivo, pero sin descartar progresión de la enfermedad. De hecho, si incluyéramos a los cinco pacientes restantes en el grupo de muertes, la supervivencia a dos años en esta población sería del 62,5% (no llegando aún a la media), que continúa siendo favorable al compararse con las gráficas de supervivencia del MAGIC y el Macdonald.
Se requiere la realización de estudios de tipo prospectivo con mayores seguimientos y una mayor población.
Financiación
Este trabajo fue financiado por el Instituto Nacional de Cancerología, Bogotá, Colombia.
Agradecimientos
Agradecimientos especiales al grupo de monitoria del INC, pues sin su ayuda no hubiera sido posible la realización de este estudio.
Bibliografia
1. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [ Links ]
2. Hyatt BJ, Paull PE, Wassef W. Gastric oncology: an update. Curr Opin Gastroenterol. 2009;25:570-8. [ Links ]
3. Hamilton SR, Aaltonen LA, Cancer IAfRo, Organization WH. Pathology and genetics of tumours of the digestive system. Lyon: IARC; 2000. [ Links ]
4. Ott K, Lordick F, Blank S, Buchler M. Gastric cancer: surgery in 2011. Langenbecks Arch Surg. 2011;396:743-58. [ Links ]
5. Jiang Y, Ajani JA. Multidisciplinary management of gastric cancer. Curr Opin Gastroenterol. 2010;26:640-6. [ Links ]
6. Dicken BJ, Bigam DL, Cass C, Mackey JR, Joy AA, Hamilton SM. Gastric adenocarcinoma: review and considerations for future directions. Ann Surg. 2005;241:27-39. [ Links ]
7. Verdecchia A, Mariotto A, Gatta G, Bustamante-Teixeira MT, Ajiki W. Comparison of stomach cancer incidence and survival in four continents. Eur J Cancer. 2003;39:1603-9. [ Links ]
8. Patel SH, Kooby DA. Gastric adenocarcinoma surgery and adjuvant therapy. Surg Clin North Am. 2011;91:1039-77. [ Links ]
9. Hundahl SA, Phillips JL, Menck HR. The National Cancer Data Base Report on poor survival of U.S. gastric carcinoma patients treated with gastrectomy: 5th Edition American Joint Committee on Cancer staging, proximal disease, and the "different disease" hypothesis. Cancer. 2000;88:921-32. [ Links ]
10. Novotny AR, Schuhmacher C, Busch R, Kattan MW, Brennan MF, Siewert JR. Predicting individual survival after gastric cancer resection: validation of a U.S.-derived nomogram at a single high-volume center in Europe. Ann Surg. 2006;243:74-81. [ Links ]
11. Nagata T, Ichikawa D, Komatsu S, et al. Prognostic impact of microscopic positive margin in gastric cancer patients. J Surg Oncol. 2011;104:592-7. [ Links ]
12. Youn HG, An JY, Choi MG, Noh JH, Sohn TS, Kim S. Recurrence after curative resection of early gastric cancer. Ann Surg Oncol. 2010;17:448-54. [ Links ]
13. Kim JH, Jang YJ, Park SS, Park SH, Mok YJ. Benefit of post-operative surveillance for recurrence after curative resection for gastric cancer. J Gastrointest Surg. 2010;14:969-76. [ Links ]
14. Chang AT, Ng WT, Law AL, Ku KM, Lee MC, Lee AW. Adjuvant chemoradiation for resected gastric cancer: a 10-year experience. Gastric Cancer. 2011;14:63-71. [ Links ]
15. Li F, Zhang R, Liang H, Liu H, Quan J. The pattern and risk factors of recurrence of proximal gastric cancer after curative resection. J Surg Oncol. 2013;107:130-5. [ Links ]
16. Wang SY, Yeh CN, Lee HL, et al. Clinical impact of positive surgical margin status on gastric cancer patients undergoing gastrectomy. Ann Surg Oncol. 2009;16:2738-43. [ Links ]
17. Kovoor PA, Hwang J. Treatment of resectable gastric cancer: current standards of care. Expert Rev Anticancer Ther. 2009;9:135-42. [ Links ]
18. Paoletti X, Oba K, Burzykowski T, et al. Benefit of adjuvant chemotherapy for resectable gastric cancer: a meta-analysis. JAMA. 2010;303:1729-37. [ Links ]
19. Mari E, Floriani I, Tinazzi A, et al. Efficacy of adjuvant chemotherapy after curative resection for gastric cancer: a meta-analysis of published randomised trials. A study of the GISCAD (Gruppo Italiano per lo Studio dei Carcinomi dell'Apparato Digerente). Ann Oncol. 2000;11:837-43. [ Links ]
20. Sun P, Xiang JB, Chen ZY. Meta-analysis of adjuvant chemotherapy after radical surgery for advanced gastric cancer. Br J Surg. 2009;96:26-33. [ Links ]
21. Zhao SL, Fang JY. The role of postoperative adjuvant chemotherapy following curative resection for gastric cancer: a meta-analysis. Cancer Invest. 2008;26:317-25. [ Links ]
22. Liu TS, Wang Y, Chen SY, Sun YH. An updated meta-analysis of adjuvant chemotherapy after curative resection for gastric cancer. Eur J Surg Oncol. 2008;34:1208-16. [ Links ]
23. Oba K. Efficacy of adjuvant chemotherapy using tegafur-based regimen for curatively resected gastric cancer: update of a meta-analysis. Int J Clin Oncol. 2009;14:85-9. [ Links ]
24. Morabito A, Carillio G, Longo R. Systemic treatment of gastric cancer. Crit Rev Oncol Hematol. 2009;70:216-34. [ Links ]
25. Okines AF, Cunningham D. Multimodality treatment for localized gastro-oesophageal cancer. Ann Oncol. 2010;21(Suppl 7):vii286-93. [ Links ]
26. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-917. [ Links ]
27. Correa P, Piazuelo MB. Gastric cancer: The colombian enigma. Rev Colomb Gastroenterol. 2010;25:334-7. [ Links ]
28. Otero Regino W. Cáncer gástrico en Colombia: un diagnóstico tardío que amerita el compromiso del Estado. Rev Colomb Gastroenterol. 2008;23:302-4. [ Links ]
29. República de Colombia, Instituto Nacional de Cancerología. Cáncer en cifras [internet]. 2012 [consultado 5 Mar 2013]. Disponible en: http://www.cancer.gov.co/contenido/contenido.aspx?catID=434&apm;conID=790&pagID=774. [ Links ]
30. Macdonald JS, Smalley SR, Benedetti J, et al. Chemoradio-therapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med. 2001;345:725-30. [ Links ]
31. Smalley SR, Benedetti JK, Haller DG, et al. Updated analysis of SWOG-directed intergroup study 0116: a phase III trial of adjuvant radiochemotherapy versus observation after curative gastric cancer resection. J Clin Oncol. 2012;30:2327-33. [ Links ]
32. Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastro-esophageal cancer. N Engl J Med. 2006;355:11-20. [ Links ]
33. Sakuramoto S, Sasako M, Yamaguchi T, et al. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N Engl J Med. 2007;357:1810-20. [ Links ]
34. Sasako M, Sakuramoto S, Katai H, et al. Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. J Clin Oncol. 2011;29:4387-93. [ Links ]
35. Bang YJ, Kim YW, Yang HK, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial. Lancet. 2012;379:315-21. [ Links ]
36. Lee J, Lim do H, Kim S, et al. Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial. J Clin Oncol. 2012;30:268-73. [ Links ]
37. Macdonald JS. Gastric cancer: Nagoya is not New York. J Clin Oncol. 2011;29:4348-50. [ Links ]
38. Brooks GA, Enzinger PC, Fuchs CS. Adjuvant therapy for gastric cancer: revisiting the past to clarify the future. J Clin Oncol. 2012;30:2297-9. [ Links ]
39. Songun I, Putter H, Kranenbarg EM, Sasako M, van de Velde CJ. Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial. Lancet Oncol. 2010;11:439-49. [ Links ]













