Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cancerología
Print version ISSN 0123-9015
rev.colomb.cancerol. vol.17 no.3 Bogotá July/Sep. 2013
Original
Características del melanoma cutáneo primario en el Instituto Nacional de Cancerología 2006-2010
Characteristics of primary cutaneous melanoma in the Colombian National Cancerology Institute 2006-2010
Flavia Pozzobona, Álvaro Acostab,*, Alexander Carreñoc y Eduardo Fierroa
a Universidad Nacional de Colombia, Bogotá, D. C., Colombia
b Clínica de Piel, Instituto Nacional de Cancerología, Bogotá, D. C., Colombia
c Grupo de Investigación Clínica, Instituto Nacional de Cancerología, Bogotá, D. C., Colombia
* Autor para correspondencia. Correo electrónico: fcpozzobonnt@unal.edu.co (F. Pozzobon).
Recibido el 12 de octubre de 2012; aceptado el 7 de mayo de 2013
Resumen
Objetivos: Describir las principales características del melanoma cutáneo en el Instituto Nacional de Cancerología, centro de referencia del cáncer, en Bogotá, Colombia.
Materiales y métodos: Estudio descriptivo, retrospectivo, de las características demográfi cas, clínicas e histológicas de los pacientes con diagnóstico de melanoma cutáneo primario, en el Instituto Nacional de Cancerología entre 2006 y 2010.
Resultados: Se incluyeron un total de 599 pacientes, de los cuales el 57,4% eran mujeres (n = 344) y el 42,6% hombres (n = 255). La edad media de diagnóstico fue de 60,8 años. La mayoría de los casos fueron procedentes de Bogotá, con el 56,3% (n = 329). Fue más frecuente el área urbana como sitio de residencia habitual (n = 500). La media de frecuencia anual fue de 115 casos nuevos por año. La localización más frecuente fue acral, con el 42,2% (n = 253), seguido de cabeza y cuello (n = 186). Concordando con la localización, el subtipo más frecuente fue el melanoma lentiginoso acral, con el 43,7% (n = 262), seguido por el lentigo maligno, con el 24% (n = 144). En cuanto a la profundidad, se observó una frecuencia igual de melanomas in situ y melanomas con Breslow > 4 mm, ambos con el 19% de los casos. Se encontró que la mayoría de los lentigos malignos, el 75% (n = 108), fueron in situ o con un Breslow ≤ 1 mm; por el contrario, los lentiginosos acrales y los nodulares tuvieron un Breslow > 4 mm con mayor frecuencia (con el 26,3%, n = 69, y el 45,4%, n = 10, respectivamente). El estadio más frecuente fue el III, con el 26,2% de los casos (n = 157).
Conclusiones: Se evidenció un mayor porcentaje de melanomas en mujeres y mayor frecuencia de melanomas acrales. Un número importante de pacientes se ubicaron en estado avanzado, por lo que se requieren mayores acciones para la detección temprana del melanoma.
Palabras clave: Melanoma cutáneo; Cáncer de piel; Epidemiología; Colombia.
Abstract
Objectives: To describe the main characteristics of cutaneous melanoma in the National Cancerology Institute, a cancer reference center in Bogota, Colombia.
Materials and methods: A descriptive, retrospective study was conducted on the demographic, clinical and histological characteristics of patients diagnosed with primary cutaneous melanoma in the National Cancerology Institute between 2006 and 2010.
Results: A total of 599 patients were included, of whom 57.4% were females (n= 344) and 42.6% males (n=255). The mean age at diagnosis was 60.8 years. The majority of cases, 56.3% (n=329), were from Bogota. It was also the most common urban area where the patients had their usual residence (n=500). The mean annual frequency was 115 new cases per year. The most frequent location was acral, with 42.2% (n=253), followed by head and neck (n=186). In accordance with the location, the most common sub-type was acral lentiginous melanoma, with con 43.7% (n=262), followed by lentigo maligna, with 24% (n=144). As regards the depth, a similar frequency was observed for melanomas in situ and melanomas with Breslow >4 mm, both with 19% of the cases. It was found that the large majority of the lentigo maligna, 75% (n=108) were in situ or with a Breslow ≤1 mm. On the other hand, acral lentiginous and nodular melanomas had a higher frequency of Breslow >4 mm (with 26.3% n=69 and 45.4% n=10, respectively). Stage III was the most common stage, with 26.2% (n=157) of the cases.
Conclusions: A higher percentage of melanomas were observed in women, as well as a higher frequency of acral melanomas. A signifi cant number of patients were in an advanced stage, thus greater action is required for the early detection of melanoma.
Keywords: Cutaneous melanoma; Skin cancer; Epidemiology; Colombia.
Introducción
El melanoma maligno (MM) es un tumor originado en células neuroectodérmicas, formado a partir de melanocitos. Es una neoplasia compleja, heterogénea, cuyas tasas de incidencia varían entre géneros, edad, grupos étnicos y regiones. Se han encontrado diferentes patrones de presentación del MM que son específicos por edad, con vías causales diferentes, manifestando la heterogeneidad en su presentación1. Así mismo se cuenta como el tercero en frecuencia de las neoplasias cutáneas y es la forma más letal de cáncer de piel, causando aproximadamente el 78% de todas las muertes2. Por su incidencia, que se ha incrementado rápidamente (aproximadamente 3,1 por año en los últimos 20 años), el melanoma se constituye en un importante problema de salud pública3.
Anualmente, se diagnostican en el mundo aproximadamente 200.000 nuevos casos de MM y 46.500 muertes por esta causa4,5. La tasa mundial de incidencia aproximada de MM fue de 2,5/100.000 en hombres y 2,6/100.000 en mujeres en el año 20026.
En las últimas 4 décadas se ha observado un incremento continuo de la incidencia del MM a nivel mundial, principalmente en regiones con poblaciones blancas, como los Estados Unidos, Australia y Europa7,8. Por lo tanto, se ha considerado como un cáncer epidémico en estas áreas1. Por ejemplo, en los Estados Unidos, la tasa de incidencia también se ha incrementado de 6,8/100.000 en 1973 a 20,1/100.000 en 2003-2007. Algunos datos sugieren que el 1,93% de los hombres y las mujeres que nacen hoy pueden ser diagnosticados con MM en algún momento de su vida9,10.
Sin embargo, las tasas de incidencia pueden variar según género, edad, grupo étnico o poblacional1. Se han reportado las mayores tasas de incidencia en Australia y Nueva Zelanda, con 40-60 casos/100.000 habitantes-año, contribuyendo al 6,4% de los casos y al 3,2% de las muertes a nivel mundial7,8,11.
Aunque se ha evidenciado una tendencia a la disminución relativa de la tasa de incidencia, cuando se compara la década de los años 1975-1985 con un incremento del 4,6% por año, y el período 1996-2007 con el 2,6% por año9,12, estudios de cohortes apuntan a que la tendencia de aumento de las tasas de incidencia se mantendrá en el futuro durante al menos las siguientes dos décadas8.
La supervivencia se ha relacionado con la profundidad de la invasión. Por lo tanto, el diagnóstico temprano es esencial13,14. Se ha reportado en las 3 últimas décadas mayor supervivencia en países de Europa central y Estados Unidos, con una tendencia al aumento del diagnóstico de melanomas delgados (< 1 mm), así como una disminución de los melanomas gruesos, lo que podría adjudicarse a la implementación de campañas de prevención primaria y secundaria15-18.
En América Latina los datos son escasos19. Una incidencia aproximada para el período 1998-2002 fue de 3,4 casos nuevos por año por 100.000 habitantes, con cifras semejantes entre los diferentes países20. De estos, solamente Costa Rica tiene datos que contemplan todo el territorio nacional, mientras que el resto de los países tienen datos que corresponden a una región específica20.
Se conocen algunos reportes previos de la incidencia estimada en Colombia, si bien no se cuenta con un sistema de registro único del cáncer que permita establecer datos generales a la población colombiana21-23.
El Registro Poblacional del Cáncer de Cali es el único en el país que ha permitido el cálculo de la incidencia para una región específica. Dicho registro ha evidenciado un ligero incremento en la tasa cruda de incidencia del MM, siendo de 1,6 en 1962-1966 y de 3,5 en 2003-2007 para hombres; en mujeres fue de 1 en 1962-1996 y de 3,2 en 2003-200722,24. Estos aumentos en la frecuencia del MM podrían reflejar en parte las mejoras en el diagnóstico de la enfermedad25.
Un estudio realizado en el Hospital de Caldas entre 1982-1995 reveló que la incidencia aproximada del MM en la consulta externa de esa institución fue de 1,6/100.000 pacientes nuevos por año23.
En el Centro Dermatológico Federico Lleras Acosta se reportó una tasa de 2,7 y 13 casos por 10.000 pacientes con diagnóstico confirmado nuevo por año, en 2003 y 2005, respectivamente21.
En cuanto a cifras de mortalidad en Colombia, el MM correspondió al 1,3% del total de las muertes en 2010, según el Registro Institucional de Cáncer del Instituto Nacional de Cancerología26 (INC).
El conocimiento de los datos epidemiológicos en Colombia permitirá una mejor comprensión de la enfermedad en el país. El INC es un centro de referencia del cáncer, por lo que los datos encontrados permiten tener una muestra importante, principalmente con respecto a la población de Bogotá.
El objetivo del estudio fue determinar las características epidemiológicas de los pacientes que consultaron al INC con diagnóstico confirmado de MM cutáneo primario, puesto que no se dispone de una caracterización del MM en las últimas décadas en esta institución.
Materiales y métodos
Se realizó un estudio descriptivo, basado en fuentes secundarias institucionales (historias clínicas), de las características demográficas clínicas e histológicas de los pacientes con diagnóstico confirmado de MM cutáneo primario por el INC durante el período comprendido entre el 1 de enero de 2006 y el 31 de diciembre de 2010.
Los datos fueron registrados en formatos de captura, para lo que se diseñó una hoja de recolección con las diferentes variables. La categorización del estadio del MM se realizó con base en la clasificación propuesta por el American Joint Committee on Cancer (AJCC), en su sexta versión publicada en 200327.
Se tabularon y se analizaron características demográficas, como la edad, el sexo, el área de residencia y la procedencia, y datos de localización topográfica e histopatológicos (índice de Breslow, Clark y ulceración). El análisis estadístico se realizó mediante Stata. Las variables fueron descritas en frecuencias o medias y desviaciones estándar.
Resultados
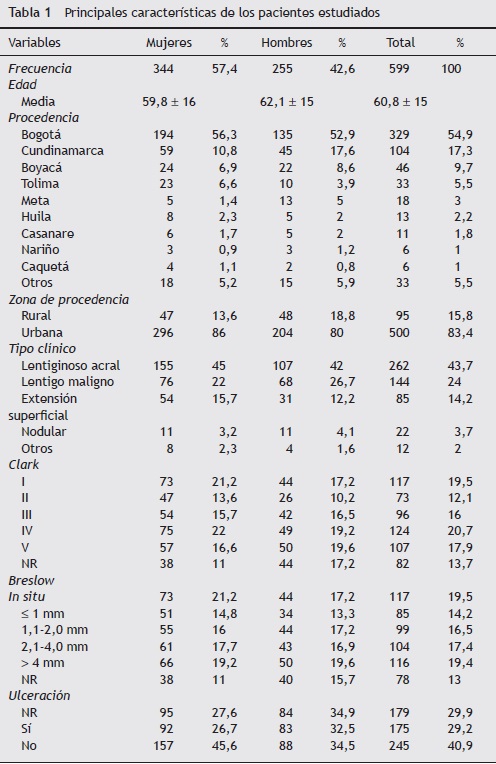
Los datos principales se resumen en la tabla 1. En total fueron incluidos 599 casos con diagnóstico confirmado por histopatología de MM cutáneo primario.
De todos los pacientes incluidos en el estudio, 255 eran hombres y 344 mujeres con una relación mujer/hombre de 1:35. El rango de edad fue de 2 a 96 años al momento del diagnóstico, con una edad media de 60,8 años; en hombres fue de 62,1, mientras que en las mujeres fue de 59,8 años. Sin embargo, el intervalo con mayor frecuencia fue de 65-69 años en hombres y de 60-64 años en mujeres (el 42% de los pacientes fueron mayores de 65 años) (fig. 1).
En cuanto al área de residencia habitual, 500 pacientes eran procedentes de la zona urbana, dentro de la que se incluyó el Distrito Capital (Bogotá), capitales de departamento y cabeceras municipales. El mayor sitio de procedencia correspondió a Bogotá con 329 casos, seguido por el departamento de Cundinamarca con 104 casos, y el departamento de Boyacá con 46 casos.
Por el contrario, 95 pacientes tuvieron su residencia en el área rural, procedentes de veredas, caracterizadas por ser zonas de viviendas campesinas, que por lo general carecen de servicios públicos y nomenclatura de calles. Solamente 4 pacientes no tuvieron registro de su área de residencia habitual.
Con referencia a la distribución anual de casos, se encontraron 118 casos en 2010, 124 en 2009, 108 en 2008, 110 en 2007 y 116 en 2006. Se obtuvo una media de 115 casos por año.
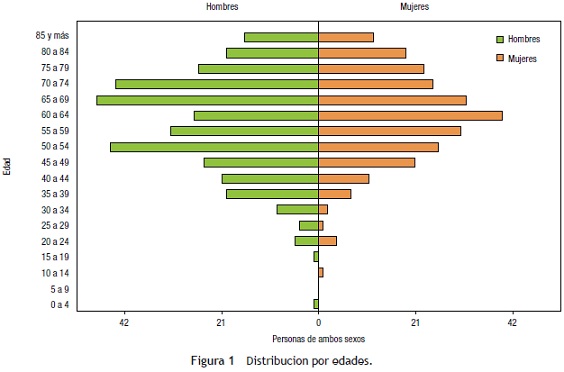
En cuanto a la localización, la más frecuente fue en sitios acrales (manos, pies y uñas), con el 42,2% (n = 253), seguido por cabeza y cuello, con el 31% (n = 186). Cuando se analizó según el género, la localización más frecuente en las mujeres fue en los pies (incluyendo plantas, dedos y uñas), con el 32%, seguido por cabeza y cuello, con el 29%; la tercera localización más frecuente fueron las piernas, con el 14%. En contraste, en los hombres la localización más frecuente fue cabeza y cuello, con el 32%, seguida por los pies, con el 31,7%, y el tronco, con el 15,2% (fig. 2).
De los localizados en áreas acrales, se encontraron en las mujeres 112 casos localizados en las plantas, mientras que solo 15 casos en palmas. En los hombres, 12 casos se localizaron en palmas y 81 en plantas. En total se registraron 34 pacientes con localización ungular, correspondiendo al 12,98% de los MM acrales. La mayoría de estos estuvieron localizados en las uñas de los pies, con un 55,9%.
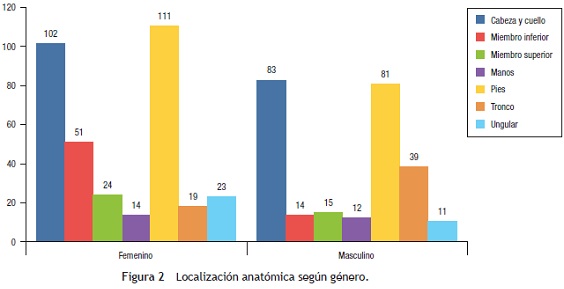
Concordando con la localización, el subtipo más frecuente fue el MM lentiginoso acral (LA) con el 43,7% (n = 262), seguido por el lentigo maligno (LM) con el 24% (n = 144) (fig. 3). De los casos en los cuales no se registró el subtipo, la localización más frecuente fue cabeza y cuello, así como miembros inferiores, ambos con 23 casos.
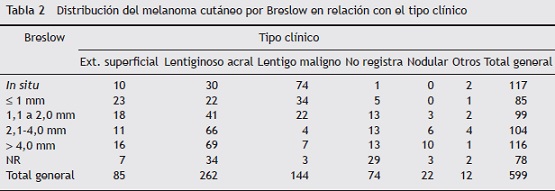
En cuanto a los hallazgos histológicos, se evidenció que el nivel de profundidad de Clark más frecuente fue de I y IV, con el 24 y el 19,5% respectivamente. Cuando se analizó la profundidad en milímetros de acuerdo al Breslow, se observó una frecuencia equivalente de melanomas in situ y melanomas con Breslow > 4 mm, ambos con el 19% de los casos, seguida por el rango 2,1-4 mm. Se encontró que la mayoría de los lentigos malignos, el 75% (n = 108), fueron in situ o con un Breslow ≤ 1 mm; por el contrario, el LA y el nodular (N) tuvieron un Breslow > 4 mm con mayor frecuencia (con el 26,3%, n = 69, y el 45,4%, n = 10, respectivamente). El LA, la extensión superficial (ES) y el N en su mayoría tuvieron un Breslow > 1 mm (tabla 2).
Por otro lado, se observó una mayor proporción de melanomas in situ en mujeres, con el 21,2 vs el 17,2% en hombres. De la misma forma, se encontró que el 33,7% eran melanomas in situ y ≤ 1 mm (n = 202). Un 16,5% (n = 99) tuvieron melanomas intermedios, entre 1,1 a 2 mm, y el mayor porcentaje se encontró para melanomas mayores de 4 mm, con el 36,7% (n = 220).
La ulceración estuvo presente en el 29% de los casos, mientras que fue negativa en el 40,9%. No se encontró registro en el 29,8% de los casos. Hubo una mayor frecuencia de melanomas ulcerados en hombres que en mujeres, con el 32,5 (n = 83) y el 26,7% (n = 92), respectivamente.
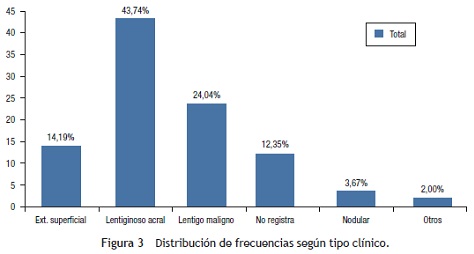
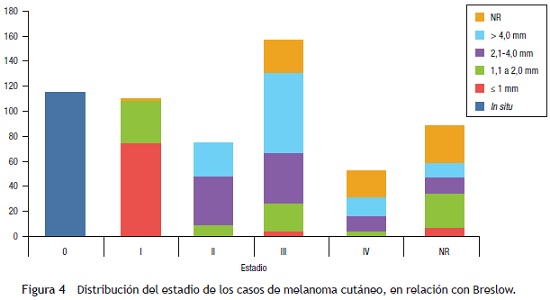
Con referencia al estadio, la mayoría de los pacientes se encontraron en estadio III, con el 26,2% (n = 157), seguidos por estadio 0 y I, con el 19 y el 18%, respectivamente. Cuando se comparó el estadio con la profundidad medida en milímetros (Breslow), se encontró que la mayoría de los melanomas en estadios tempranos fueron in situ y ≤ 2 mm (99%), en tanto que en los estadios tardíos predominaron los melanomas > 2 mm (66,2% en estadio III y 51% en estadio IV) (fig. 4).
Discusión
El MM se constituye en un problema de salud pública por su aumento creciente en la incidencia y su alta mortalidad, que ha sido ampliamente reportada en países industrializados1,3,8. Sin embargo, hay pocos datos de incidencia y prevalencia no solo en Colombia, sino también en Latinoamérica19.
Hasta donde tenemos conocimiento, el presente es el primer estudio en Colombia con el mayor número incluido de pacientes con MM, según lo reportado en la literatura.
En este estudio, se encontró una mayor frecuencia de mujeres y una media de edad de 60,8 años, que concuerda con lo reportado en otras series latinoamericanas20,28-30.
Según datos de Estados Unidos y Australia, así como de otros países anglosajones, el subtipo más común es de ES, que corresponde aproximadamente al 70% de los casos, con una edad media de presentación de 40 años9,13,31. En el INC, se encontró el LA como el subtipo más frecuente. Por otra parte, la literatura reporta que el LA tiene una mayor incidencia en japoneses, chinos y afroamericanos, a diferencia de la población caucásica32; corresponde a menos del 10% en pacientes blancos, más del 50% en asiáticos y del 60 al 70% en poblaciones de raza negra33.
En América Latina se han encontrado divergencias con respecto a los datos del patrón de crecimiento. Llama la atención que se han evidenciado datos diferentes entre Colombia y Brasil o Argentina. En Argentina, la distribución es similar a los países anglosajones, por lo que el subtipo más común que ha sido reportado es el de ES con el 54%, seguido por el N (27%), el LM (8%) y, por último, el LA, con el 6%20. En Brasil, se ha visto que el melanoma acral ha sido el tercero en frecuencia después del patrón de ES y N28. Hay algunos reportes del Perú, que evidencian una frecuencia del 50% de LA, con la mayoría de los melanomas localizados en miembros inferiores, resultados que se asemejan con los encontrados en nuestro estudio29,34.
De igual manera, se han encontrado datos previos en Colombia que han mostrado una frecuencia similar, también con aproximadamente el 50% de LA23,35. La discrepancia entre las frecuencias del subtipo de melanoma en América Latina podría deberse a los variados orígenes étnicos de cada población, así como la diferencia regional dentro de los mismos países.
Así mismo, Colombia se considera un país pluriétnico36, por lo que los cambios en el mestizaje, con respecto a la población argentina o brasileña, podrían explicar esta diferencia en los hallazgos.
El INC atiende en su mayoría a pacientes con estratos económicos bajos26 y se cree que estos pacientes tienen un fototipo más oscuro. Por el contrario, según observaciones de algunos dermatólogos oncólogos en instituciones privadas, la distribución del patrón de crecimiento del MM se asemejaría a lo reportado en países anglosajones. Esto podría ser secundario a la creencia de que los pacientes de mayor nivel socioeconómico tendrían un fototipo más claro.
Reportes de países anglosajones revelan que la localización es variable según el sexo, siendo más frecuente en el tronco los de hombres, con el 55%. De los que se localizan en el tronco, la espalda es la ubicación más frecuente, con el 39%. Por otro lado, en las mujeres es más frecuente en miembros inferiores, con el 42%. Cuando se localiza en cabeza y cuello, es igual en ambos sexos8,15. Igualmente, la distribución puede variar con la edad, puesto que se ha visto mayor incidencia de melanoma en cabeza y cuello en pacientes ancianos, correspondiendo al 80% de los melanomas en los mayores de 80 años37.
En nuestro estudio, se demuestra una diferencia en la localización con respecto a lo reportado previamente en países europeos y Estados Unidos, puesto que, según los datos obtenidos, la localización en los pies fue la más frecuente en mujeres, mientras que para hombres fue en cabeza y cuello, relacionándose de igual manera con el subtipo más frecuente, el LA.
En comparación con los datos de una población de Chile, el melanoma en las mujeres se localiza más frecuentemente en miembro superior e inferior; en hombres, se presenta más frecuentemente en cabeza y cuello, concordando con los datos de este estudio38.
Se conocen varios predictores de supervivencia de acuerdo a los diferentes estadios. El grosor tumoral medido en Breslow se ha reportado como el factor pronóstico independiente importante en el melanoma primario, en estadios I y II, así como la ulceración8,12,27.
El estadio es el determinante más importante para el pronóstico del melanoma. Los pacientes con melanomas delgados (< 1 mm) en estadio temprano en general tienen un pronóstico excelente. Sin embargo, el pronóstico es peor a medida que aumenta el estadio13,27. En nuestro estudio, el estadio más frecuente fue el III, con el 26%, seguido por los estadios tempranos 0 y I, sumando 37% ambos grupos. Este porcentaje en el diagnóstico de melanomas tempranos puede explicarse debido a la gran proporción de LM, el cual fue el segundo en frecuencia, cuya mayoría fue in situ. No obstante, el 45,4% (n = 119) de los LA se encontraron en estadios avanzados. Aunque en este estudio no pudo determinarse la supervivencia o mortalidad por el diseño del mismo, se podría deducir que los pacientes que fueron diagnosticados en estadio III (mayor frecuencia en este estudio) y IV pudieron tener un peor pronóstico y, por ende, mayor mortalidad39.
En algunos estudios europeos, se ha notado una mejoría en la supervivencia, lo cual se atribuye a la detección temprana de melanomas delgados15,40-42. En nuestro medio se desconoce si ha habido una mejora en el diagnóstico de melanomas en estadio temprano, aunque hay reportes de una disminución de las tasas de mortalidad en mujeres, y un aumento de las mismas en hombres para las últimas décadas22. Estas tendencias se han visto también en un estudio con población escocesa43.
Dentro de las posibles explicaciones para que un importante número de pacientes se haya encontrado en estadio tardío, se encuentran diferentes circunstancias que pueden hacer que se retrase el diagnóstico, como factores relacionados con el paciente, como la consulta tardía por parte de este44,45, las características propias del sistema de salud, la baja escolaridad y el régimen subsidiado de seguridad de salud25.
En relación con las limitaciones del estudio, una dificultad a la hora de realizar el análisis de los datos fue el sub-registro en las historias clínicas. Las variables con mayor número de ausencia de registros fueron la educación (n = 457, por lo que se decidió no incluirla en el análisis) y las variables histopatológicas, como Breslow, Clark y ulceración. Llama la atención que los pacientes en estadio IV tuvieron una ausencia importante del registro del Breslow, dado que posiblemente no se le dio importancia, asistieron a la consulta con reportes incompletos o habían sido manejados extra-institucionalmente.
El desconocimiento de tasas de incidencia y otros datos epidemiológicos se debe, en parte, a la falta de un registro unificado de casos a nivel nacional. Con este estudio se aporta al problema una aproximación al comportamiento del melanoma en Colombia. El INC es un hospital público que tiene una alta frecuencia de melanomas por año. Aunque la mayoría de los casos son procedentes de Bogotá, el instituto tiene afluencia de pacientes procedentes de la meseta cundi-boyacence, siendo un importante centro de referencia de patología oncológica cutánea. A pesar de que el estudio no incluye a toda la población colombiana, sí permite tener un registro institucional significativo.
El conocimiento de la epidemiología del melanoma en Colombia permitirá adoptar medidas de salud pública para un diagnóstico más temprano. Si bien el subtipo LA fue el más frecuente, se desconocen los factores de riesgo que pueden ser determinantes en su desarrollo; por lo tanto, se requieren más estudios que permitan relacionarlos. Con este estudio se abre la posibilidad para conducir más investigaciones que puedan generar nuevas hipótesis y estrategias en el control del cáncer.
De igual manera, puede ser usado como modelo para que otras instituciones públicas y privadas tengan sus propios datos estadísticos, y de esta manera tener una aproximación de las características del MM en Colombia.
Dado que el INC atiende en su mayoría estratos económicos bajos, se debe hacer una llamada de atención en campañas de prevención en estos pacientes con edades alrededor de los 60 años.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Tucker MA. Melanoma epidemiology. Hematol Oncol Clin North Am. 2009;23:383-95, VII. [ Links ]
2. Bradford PT, Goldstein AM, McMaster ML, Tucker MA. Acral lentiginous melanoma: incidence and survival patterns in the United States, 1986-2005. Arch Dermatol. 2009;145:427-34. [ Links ]
3. Rigel DS. Epidemiology of melanoma. Semin Cutan Med Surg. 2010;29:204-9. [ Links ]
4. Chang AE, Karnell LH, Menck HR. The National Cancer Data Base report on cutaneous and noncutaneous melanoma: a summary of 84,836 cases from the past decade. The American College of Surgeons Commission on Cancer and the American Cancer Society. Cancer. 1998;83:1664-78. [ Links ]
5. Eisemann N, Jansen L, Holleczek B, Waldmann A, Luttmann S, Emrich K, et al. Up-to-date results on survival of patients with melanoma in Germany. Br J Dermatol. 2012;167:606-12. [ Links ]
6. Desmond RA, Soong S. Epidemiology of malignant melanoma. Surg Clin North Am. 2003;83:1-29. [ Links ]
7. Marks R. Epidemiology of melanoma. Clin Exp Dermatol. 2000; 25:459-63. [ Links ]
8. Garbe C, Leiter U. Melanoma epidemiology and trends. Clin Dermatol. 2009;27:3-9. [ Links ]
9. Acosta ÁE, Fierro E, Velásquez VE, Rueda X. Melanoma: patogénesis, clínica e histopatología. Revista Asociación Colombiana Dermatología. 2009;17:87-108. [ Links ]
10. Ferlay J, Shin HR, Bray F, Forman D, Mathers C PD. GLOBOCAN 2008 v2.0. Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 10 [Internet]. Lyon, Francia: International Agency for Research on Cancer; 2010 [consultado 1 Sep 2012]. Disponible en: http://globocan.iarc.fr. [ Links ]
11. Marrett LD, Nguyen HL, Armstrong BK. Trends in the incidence of cutaneous malignant melanoma in New South Wales, 1983-1996. Int J Cancer. 2001;92:457-62. [ Links ]
12. Purdue MP, Freeman LEB, Anderson WF, Tucker MA. Recent trends in incidence of cutaneous melanoma among US Caucasian young adults. J Invest Dermatol. 2008;128:2905-8. [ Links ]
13. Aitken JF, Barbour A, Burmeister B, Taylor S, Walpole E, Network AC, et al. Clinical practice guidelines for the management of melanoma in Australia and New Zealand. New Zealand: Cancer Council Australia; Australian Cancer Network; Ministry of Health; 2008. p. 1-246. [ Links ]
14. Balch CM, Soong SJ, Gershenwald JE, Thompson JF, Reintgen DS, Cascinelli N, et al. Prognostic factors analysis of 17,600 melanoma patients: validation of the American Joint Committee on Cancer melanoma staging system. J Clin Oncol. 2001;19:3622-34. [ Links ]
15. Buettner PG, Leiter U, Eigentler TK, Garbe C. Development of prognostic factors and survival in cutaneous melanoma over 25 years: An analysis of the Central Malignant Melanoma Registry of the German Dermatological Society. Cancer. 2005;103:616-24. [ Links ]
16. Buendía Eisman A, Ortega del Olmo RM, Serrano Ortega S. ¿Han cambiado nuestros melanomas? Actas Dermosifi liogr. 88:13-8. [ Links ]
17. Baade PD, English DR, Youl PH, McPherson M, Elwood JM, Aitken JF. The relationship between melanoma thickness and time to diagnosis in a large population-based study. Arch Dermatol. 2006;142:1422-7. [ Links ]
18. Bono A, Tolomio E, Bartoli C, Carbone A, Tomatis S, Zurrida S, et al. Metamorphosis of melanoma. Trends in size and thickness of cutaneous melanoma over one decade at the Istituto Nazionale Tumori, Milan. Tumori. 94:11-3. [ Links ]
19. Schmerling RA, Loria D, Cinat G, Ramos WE, Cardona AF, Sánchez JL, et al. Cutaneous melanoma in Latin America: the need for more data. Revista panamericana de salud pública = Pan American Journal of Public Health. 2011;30:431-8. [ Links ]
20. Loria DI, González A, Latorre C. Epidemiología del melanoma cutáneo en Argentina : análisis del Registro Argentino de Melanoma Cutáneo. Cutaneous melanoma epidemiology in Argentina: analysis from the Argentine Cutaneous Melanoma Registry. [ Links ]
21. Nova-Villanueva J, Sánchez-Vanegas G, Porras de Quintana L. Cáncer de piel: perfil epidemiológico de un centro de referencia en Colombia 2003-2005. Revista de Salud Pública. 2007;9:595-601. [ Links ]
22. Registro Poblacional de Cáncer de Cali [Internet] [consultado 17 Dic 2011]. Disponible en: http://rpcc.univalle.edu.co/es/index.php. [ Links ]
23. Villegas M, Jaramillo F. Comportamiento clínico, epidemiológico e histológico del melanoma maligno en el Departamento de Caldas (Colombia). Rev Asoc Colomb Dermatol. 1999;7:192-6. [ Links ]
24. Curado M, Edwards B, Shin H, Storm H, Ferlay J, Heanue M, et al. Cancer incidence in five continents, Vol. IX. IARC Scientific Publications No. 160. [IARC]; 2007. [ Links ]
25. Colmenares L, Velazquez M, Vargas G. Melanoma lentiginoso acral : una variante de melanoma maligno de especial interés en Colombia. Iatrea. 2008;21:386-97. [ Links ]
26. Anuario estadístico 2010 [Internet]. Instituto Nacional de Cancerología. Ministerio de la protección social [consultado 1 Sep 2012]. p. 63-4. Disponible en: http://www.cancer.gov.co/contenido/contenido.aspx?catID=437&conID=747. [ Links ]
27. Sober AJ. Cutaneous melanoma: practical usefulness of the American Joint Committee on Cancer staging system. Dermatol Ther. 2005;18:407-11. [ Links ]
28. Ferrari NM, Muller H, Ribeiro M, Maia M, Sanches JA. Cutaneous melanoma: descriptive epidemiological study. Sao Paulo Med J. 2008;126:41-7. [ Links ]
29. Gutierrez C, Alarcón E, Valle R, Calderón G. Epidemiología del melanoma maligno en el Instituto Nacional de Enfermedades Neoplásicas, Perú, 2000-2004. Folia dermatol Perú. 2007;18:23-7. [ Links ]
30. Anger M, Friedhofer H, Fukutaki MF, Ferreira MC, Landman G. Primary cutaneous melanoma: an 18-year study. Clinics (São Paulo, Brazil). 2010;65:257-63. [ Links ]
31. Zalaudek I, Catricalà C, Moscarella E, Argenziano G. What dermoscopy tells us about nevogenesis. J Dermatol. 2011;38:16-24. [ Links ]
32. Soudry E, Gutman H, Feinmesser M, Gutman R, Schachter J. "Gloves-and-socks" melanoma: does histology make a difference? Dermatol Surg. 2008;34:1372-8. [ Links ]
33. Phan A, Touzet S, Dalle S, Ronger-Savlé S, Balme B, Thomas L. Acral lentiginous melanoma: histopathological prognostic features of 121 cases. Br J Dermatol. 2007;157:311-8. [ Links ]
34. Zegarra R. Situación del melanoma maligno cutáneo en el hospital militar central de Lima, 1985-2007. Dermatol Perú. 2008;18:267-83. [ Links ]
35. Lopez H, Gutierrez R, Posso H. Melanoma cutáneo maligno. Revista del Instituto Nacional de Cancerología. 1993;2:8-17. [ Links ]
36. Departamento Administrativo Nacional de Estadística (DANE) [Internet]. Bogotá, Colombia [consultado 24 Sep 2012]. p. 7. Disponible en: http://www.dane.gov.co/files/censo2005/etnia/sys/visibilidad_estadistica_etnicos.pdf. [ Links ]
37. Whiteman DC, Stickley M, Watt P, Hughes MC, Davis MB, Green AC. Anatomic site, sun exposure, and risk of cutaneous melanoma. J Clin Oncol. 2006;24:3172-7. [ Links ]
38. Iribarren BO, Sepúlveda TM, Hidalgo GJ, Madariaga GJ. Estudio epidemiológico de melanoma maligno en la IV Región de Chile. Cuadernos de Cirugía. 2005;19:33-8. [ Links ]
39. Roh MR, Kim J, Chung KY. Treatment and outcomes of melanoma in acral location in Korean patients. Yonsei Med J. 2010;51:562-8. [ Links ]
40. Grange F. [Epidemiology of cutaneous melanoma: descriptive data in France and Europe]. Ann Dermatol Venereol. 2005; 132(12 Pt 1):975-82. [ Links ]
41. Lindholm C, Andersson R, Dufmats M, Hansson J, Ingvar C, Möller T, et al. Invasive cutaneous malignant melanoma in Sweden, 1990-1999. A prospective, population-based study of survival and prognostic factors. Cancer. 2004;101:2067-78. [ Links ]
42. MacKie RM, Hauschild A, Eggermont AMM. Epidemiology of invasive cutaneous melanoma. Ann Oncol. 2009;20 Suppl 6:vi1-7. [ Links ]
43. MacKie RM, Bray C, Vestey J, Doherty V, Evans A, Thomson D, et al. Melanoma incidence and mortality in Scotland 1979-2003. Br J Cancer. 2007;96:1772-7. [ Links ]
44. Mesa J, Jaramillo F, Benjumea M. Factores relacionados con la consulta tardía a dermatología por cáncer de piel. Prueba piloto. Departamento de Caldas. Promocion Salud. 2008;13:178-94. [ Links ]
45. Betti R, Vergani R, Tolomio E, Santambrogio R, Crosti C. Factors of delay in the diagnosis of melanoma. Eur J Dermatol. 2003;13: 183-8. [ Links ]