Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cancerología
Print version ISSN 0123-9015
rev.colomb.cancerol. vol.18 no.1 Bogotá Jan./Mar. 2014
REVISIÓN
Terapia génica para el tratamiento del cáncer
Gene therapy for cancer treatment
Josefa A. Rodriguez*, Lina M. Martinez, Nataly Cruz y Alba L. Cómbita
Grupo de Investigation en Biologia del Cáncer, Instituto Nacional de Cancerología ESE., Bogotá, D.C., Colombia
* Autor de correspondencia.
Correo electrónico: jrodriguezg@cancer.gov.co (J.A. Rodriguez).
Recibido el 17 de septiembre de 2013; aceptado el 10 de febrero de 2014
Resumen
El cáncer es una enfermedad compleja de etiología desconocida. Factores genéticos y epigenéticos se asocian al incremento en el riesgo de desarrollar esta enfermedad.
A pesar del avance en los tratamientos tradicionales contra el cáncer, el pronóstico de los pacientes no ha mejorado significativamente. Estudios en la patogénesis molecular del cáncer han evidenciado la existencia de dianas moleculares con potencial terapéutico que permiten trasladar los conocimientos de la investigación básica a la clínica implementando nuevas terapias para el beneficio del paciente.
El conocimiento del genoma viral, su función, replicación y los mecanismos de infección a la célula tumoral han permitido el desarrollo de la terapia génica viral que puede ser la herramienta ideal para el tratamiento del cáncer.
Este artículo revisa diferentes metodologias desarrolladas para el diseno de una terapia génica contra el cáncer, abordada desde diferentes contextos biológicos, y su aplicación clínica para el tratamiento del cáncer.
Palabras Clave: Compensación de mutaciones; Quimioterapia molecular o terapia génica suicida; Terapia antiangiogénesis; Oncólisis viral; Inmunopotenciación genética.
Abstract
Cancer is a complicated disease of unknown etiology. Genetic and epigenetic factors are associated with an increased risk for developing this disease.
Despite the progress in the traditional cancer therapies, the prognosis of patients has not improved significantly. Studies on the molecular pathogenesis of cancer have demonstrated the existence of molecular targets with therapeutic potential. Furthermore, knowledge of the viral genome function and replication, as well as of the mechanisms of tumor cell infection, have made it possible to develop an ideal tool for gene therapy against cancer and thus, enable the transfer of knowledge from basic to clinical research for the benefit of patients.
This article reviews different methodologies developed to design a cancer gene therapy and its clinical application for treating cancer, addressed from various biological contexts.
Keywords: Mutation compensation; Molecular chemotherapy; Antiangiogenic gene therapy; Viral oncolysis; Genetic immunopotentiation.
Introducción
El cáncer es un problema de salud pública cuya incidencia y mortalidad se han incrementado durante las últimas décadas. Según estudios realizados por la Agencia Internacional para la Investigación en Cáncer, en el año 2015, aproximadamente 7.564.802 personas morirán por esta enfermedad1. A pesar de los avances quirúrgicos y del desarrollo de nuediseñarvos fármacos, el pronóstico de los pacientes con cáncer no ha mejorado significativamente, por lo cual se requiere el desarrollo de nuevas intervenciones terapéuticas como la terapia génica, una aproximación viable y segura para el tratamiento de pacientes con cáncer. Esta terapia se basa en la introducción de genes funcionales en células somáticas para corregir defectos genéticos o ejercer un efecto terapéutico2,3. Se utilizó por primera vez con intención teradiseñarpéutica en 1990 para el tratamiento de la inmunodeficiencia severa combinada ADA-SCID4,5, y posteriormente, para la inmunodeficiencia severa combinada SCID-X16,7. Pese a que los resultados no fueron muy alentadores en su momento8, se demostró que la terapia génica humana es factible y puede ser útil para el tratamiento de enfermedades genéticas, por lo cual se han desarrollado estrategias para aplicarla en el tratamiento de enfermedades complejas como el cáncer9,10.
Durante la última década, los vectores virales se convirtiediseñarron en la herramienta ideal para mejorar el tratamiento del cáncer. Dada la complejidad de esta enfermedad, es indispensable conocer la secuencia de eventos genéticos y epigediseñarnéticos implicados en la transformación maligna para aplicar este conocimiento al desarrollo racional de vectores que puedan utilizarse para el tratamiento del cáncer. El sistema viral más eficiente para la transferencia génica contra el cáncer in vivo es el basado en adenovirus. Estos virus poseen características biológicas deseables en un vector viral: transdiseñarfieren y expresan el gen terapéutico en células quiescentes o en división, son de fácil manipulación y propagación in vitro, no se integran en el genoma celular y tienen ciclo de vida lítico. Adicionalmente, inducen una fuerte respuesta inmune in vivo que potencializa la inmunidad antitumoral y permite la rápida eliminación del vector, lo que garantiza un efecto antitumoral de corta duración que protege las células sanas de la exposición prolongada a productos tóxicos. Los ensayos clínicos dirigidos contra diferentes dianas moleculares utilizando adenovirus han arrojado resultados alentadores11.
El objetivo de este artículo es revisar los conceptos básicos en terapia génica y su aplicación para el tratamiento primario del cáncer o como coadyuvante en los tratamientos tradicionadiseñarles. Además, se describen diferentes estrategias terapéuticas que están siendo evaluadas para su uso y aplicación clínica.
La búsqueda de bibliografía se realizó con las palabras clave: compensación de mutaciones, quimioterapia molecular o terapia génica suicida, terapia antiangiogénesis, oncólisis viral, e inmunopotenciación genética, en las bases de datos PubMed, MedLine, LILACS, (Literatura Latinoamericana y del Caribe en Ciencias de la Salud), the Cochrane Library y CANCERLIT.
Sistemas para la introducción de material genético en las células
La transferencia de genes terapéuticos en células eucariotas puede realizarse por métodos físicos o químicos (transferencia no viral), y biológicos (transferencia viral)2. La transferencia génica no viral se denomina transfección (infección de una célula con un ácido nucleico libre) y depende de los sistemas de transporte celulares para internalizar el ácido nucleico y expresar el gen terapéutico. Los métodos más empleados para la transfección son: electroporación, bomdiseñarbardeo de partículas y liposomas catiónicos. En contraste, la transferencia génica viral depende de un virus para transferir el material genético en el interior celular, se denomina transducción (el virus conduce el gen terapéutico a través de la membrana al interior celular) o infección, y el gen terapéutico se denomina transgén.
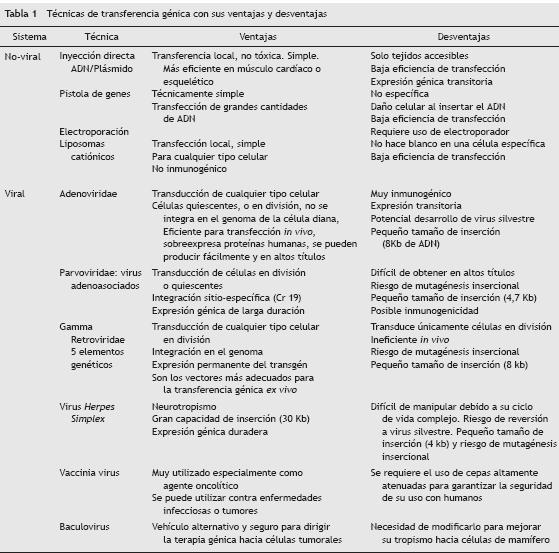
Aunque los sistemas no virales para la transferencia de genes al interior celular tienen muchas ventajas12,13, en endiseñarsayos clínicos se emplean más los sistemas virales por su tamaño, su cápside proteica que protege al gen terapéutico de la degradación enzimática, y sus mecanismos de internadiseñarlización eficientes. Además, el genoma viral se puede manipular para eliminar los genes de patogénesis y diseñar virus con alta capacidad de infección y con espacio suficiente para el transgén terapéutico (tabla 1)14. Los virus más utilizados en terapia génica incluyen miembros de las familias Retroviridae (gammaretrovirus y lentivirus)15,16, Adenoviridiseñardae17,18, y Herpesviridae (HSV)19, y Parvoviridae (virus adediseñarnoasociados)20.
La transferencia génica viral puede realizarse in vivo o ex vivo. In vivo implica la transferencia génica dentro del organismo. Este método es de fácil aplicación clínica, pero la diana no es completamente específica y la eficiencia de transducción es muy baja. Ex vivo implica la remoción de las células del huésped, su modificación genética in vitro, y su reimplantación dentro del tejido original. Este es el método de elección para los protocolos que utilizan células dendrídiseñarticas21, o células CD34+22,23 porque garantiza la especificidad de la diana y permite cuantificar la eficiencia de la transdiseñarducción10,24,25.
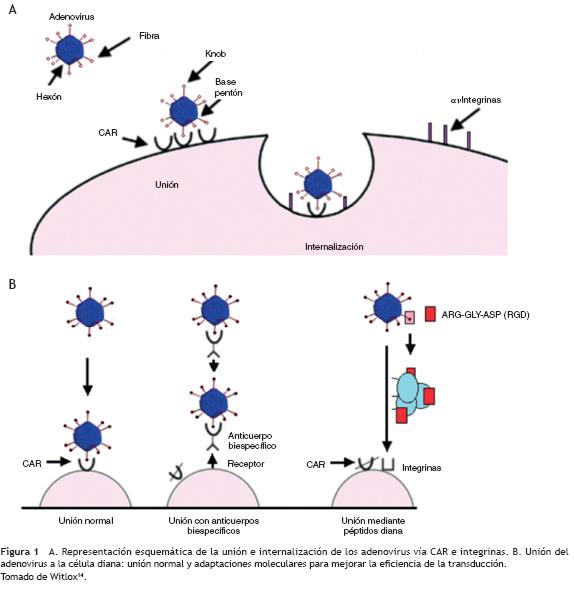
Los adenovirus son muy eficientes para la transferencia génica in vivo. Se han identificado 51 serotipos que infectan humaños, pero los más utilizados en terapia génica son el Ad5 y el Ad2, cuya internalización en la célula diana ocurre por la unión de alta afinidad entre la fibra Knob y el receptor coxsackie/adenovirus, seguida por la interacción entre la base pentón y las integrinas (fig. 1A).
Terapia génica contra el cáncer
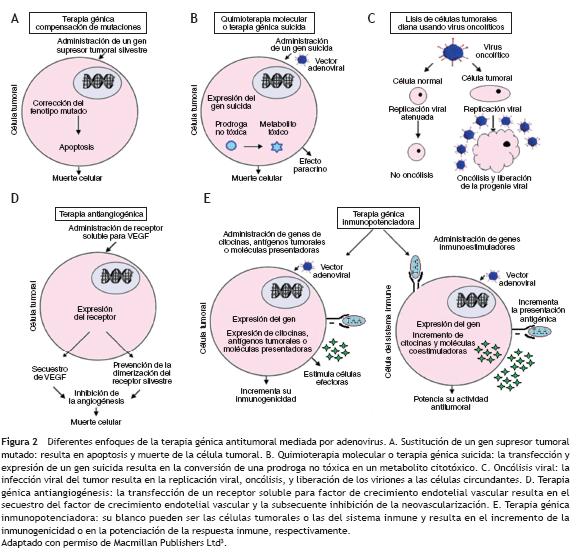
La transformación maligna es un proceso secuencial mediante el cual una célula adquiere nuevas características que le permiten proliferar sin control e invadir localmente y a distancia. Estas características pueden ser dianas para el diseño de terapias que eliminen las células tumorales, mejoren la respuesta inmune o bloqueen la proliferación tumoral. La eliminación de células tumorales puede llevarse a cabo mediante la terapia por compensación de mutaciones (codiseñarrrección de genes supresores de tumor o inhibición de ondiseñarcogenes activados); la terapia génica suicida (infección del tumor con un virus de replicación selectiva que codifique una enzima capaz de activar un profármaco en el tumor) y la terapia oncolítica (infección de las células tumorales con un virus lítico). La respuesta inmune del huésped se puediseñarde mejorar mediante una terapia inmunopotenciadora (que incremente la inmunogenicidad del tumor o potencie la acdiseñartividad antitumoral de las células del sistema inmune), y la proliferación de células tumorales se puede inhibir mediante una terapia antiangiogénesis26 (fig. 2).
Terapia génica por compensación de mutaciones
Dado que la mayoría de mutaciones que conducen al desadiseñarrrollo tumoral afectan a protooncogenes, genes supresores de tumor y genes reparadores del ADN27, y teniendo en cuenta que estas mutaciones son comunes a muchos tumores, el restablecimiento de su función normal puede ser diana de una terapia génica contra el cáncer26. Por ejemplo, el gen p53, se encuentra mutado en más del 50% de tumores, y su expresión normal puede restablecerse mediante un adeno diseñar-virus que codifique la copia silvestre del mismo (Ad-p53)28-34. En cáncer de próstata y de cuello uterino, Ad-p53 inhibe el crecimiento tumoral in vitro e in vivo29,30,34, y en osteosarcodiseñarma, incrementa la sensibilidad al cisplatino y la doxorrubicina31.
Un ensayo preclínico en cáncer de pulmón demuestra que Ad-p53 induce la regresión tumoral con una toxicidad aceptable cuando se usa solo o en combinación con radioterapia y/o quimioterapia32,35, y en carcinoma hepático, Ad-p53 combinado con TRAIL exógeno incrementa la muerte celular por apoptosis33, lo que demuestra que Ad-p53 ejerce un efecto antitumoral sinérgico al administrarse combinado con los tratamientos tradicionales de quimio/radioterapia o con nuevos medicamentos antitumorales, maximizando la eliminación del tumor, y minimizando los efectos colaterales.
Debido al excelente perfil de seguridad y a los efectos antitumorales significativos obtenidos con estos vectores36, se han conducido más de 100 ensayos clinicos (fase/I-III) utilizando Ad-p53. La primera patente de terapia génica utilizando Ad-p53 (Gendicine®), contra el cáncer de cabeza y cuello, se aprobó en octubre de 2003. Posteriormente, se aprobó Oncorine®, contra el carcinoma nasofaríngeo37,38. Ambos vectores demostraron un efecto sinérgico antitumoral en combinación con radio/quimioterapia, cirugia o hipertermia39. Posteriormente, se patentó Advexin®, similar a Gendicine®, cuya patente abarca cualquier adenovirus que porte p53 bajo el control de cualquier promotor40.
Otro gen supresor tumoral frecuentemente mutado en cáncer, y por lo tanto candidato para la terapia génica, es el del retinoblastoma (Rb), que desempeña un importante papel en el control de la proliferación celular. Estudios preclínicos en carcinoma escamocelular oral con adenovirus que portan la copia silvestre del gen Rb (Ad-RB110) demostraron la inhibición del crecimiento tumoral in vitro e in vivo41. Sin embargo, estudios realizados con un mutante de este gen, truncado en la región N-terminal (RB94), reportan mayor actividad antitumoral y supresión del crecimiento tumoral en varios tumores, incluido el cáncer de vejiga. Esta terapia activó mecanismos antitumorales como la erosión de los telómeros, la crisis cromosómica42, y la apoptosis independiente de activación de caspasas y de fragmentación del ADN43. Dado que esta terapia no afecta a las células normales, se han ensayado sistemas virales y no virales para administrar de manera sistémica el mutante Rb94. Millikan et al. están evaluando la expresión de un plásmido que porta el gen RB94 (SGT-94), encapsulado en liposomas en tumores sólidos Rb negativos, para demostrar que transfecta específicamente células tumorales, ocasiona muerte celular e incrementa la respuesta antitumoral de la quimio-radiación44.
Otros mecanismos indispensables para mantener la homeostasis celular en los tejidos saños son la apoptosis (muerte celular programada) y la autofagia (muerte celular programada de tipo II). Alteraciones en la expresión de las proteínas que controlan estos procesos favorecen el desarrollo tumoral y se asocian con el desarrollo de resistencia a las terapias tradicionales. Se puede inducir la muerte celular por apoptosis y sensibilizar a las células tumorales frente a los tratamientos tradicionales utilizando como diana proteínas de la familia Bcl-2 (Bcl-x[S], Bcl-x[AK], Bik/Nbk y Bax) o ligandos de muerte relacionados con el factor de necrosis tumoral (CD95L/FasL, factor de necrosis tumoral a y TRAIL)45; Igualmente, se puede inducir la autofagia mediante el restablecimiento de la expresión de XAF1 (XIAP-associated factor-1) con Adeno-XAF1 en células de cáncer gástrico46. Cuando se combina esta terapia con TRAIL (Adeno-XIAF1/TRAIL), se observa un efecto sinérgico que resulta en la muerte por apoptosis47.
Terapia génica suicida
La terapia génica suicida incrementa la susceptibilidad del tumor a la quimioterapia mediante la expresión de un gen suicida que codifica una enzima capaz de catalizar la conversión de un profármaco no toxico en un metabolito tóxico potente y de corta duración con capacidad para difundir desde la célula tumoral en la que se produce y eliminar las células tumorales que la rodean (efecto bystander) tras la administración del profármaco, sin entrar en la circulación sistémica ni causar efectos secundarios48.
Los sistemas suicidas (enzima/profármaco) más utilizados son: el gen de la timidinacinasa del virus Herpes simplex (HSV-tk) (gen suicida), y como profármaco, el ganciclovir (GCV), cuyo producto metabólico tóxico es el deoxitimidina trifosfato, un análogo de la purina que inhibe la ADN polimerasa e induce apoptosis como resultado del arresto del ciclo celular49, y el gen de la citosina desaminasa (CD) de Escherichia coli (gen suicida), y 5-fluorocitocina (5-FC) (profármaco), cuyo metabolito tóxico es el 5-fluorouracilo48. Se han desarrollado nuevos sistemas suicidas como el basado en el gen del citocromo P450 (gen suicida) y ciclofosfamida o isofosfamida como profármacos cuya actividad antitumoral se potencializa con la transferencia del gen del citocromo P45050.
Numerosos ensayos preclínicos para el tratamiento de glioma51,52, cáncer de vejiga53, colon46, gástrico54 y pulmón55, utilizando el sistema HSV-tk-GCV han arrojado resultados prometedores para aplicarlos a la clínica. En glioma de alto grado operable, se incrementó significativamente la supervivencia, y debido a que la citotoxicidad de este tratamiento en células normales es muy baja, se ha sugerido su posible utilización como tratamiento primario o adyuvante51,56.
Puesto que el cáncer es el resultado de múltiples alteraciones genéticas, el desarrollo de terapias génicas que puedan utilizarse simultáneamente con otras es de gran importancia. Estudios con xenoinjertos de glioma humaño en ratas permitieron demostrar que la terapia génica suicida en combinación con la terapia por compensación de mutaciones tiene mayor efecto antitumoral. El tratamiento simultaneo de HSV-tk/GCV y AdCMVp53 arrojó resultados similares a los obtenidos con la terapia suicida sola, utilizando únicamente la mitad de la dosis de GCV52.
Lisis de células tumorales usando adenovirus de replicación selectiva (oncólisis viral)
Los adenovirus son seguros, fáciles de manipular genéticamente y poseen ciclo de vida lítico, por lo cual, se han desarrollado variantes virales incapaces de replicarse en células normales pero capaces de infectar y lisar efectivamente células tumorales57. Una vez infectada la célula tumoral, el virus lítico se replica en su interior hasta que la lisa para liberar nuevas partículas virales que infectan las células tumorales vecinas, perpetuando los ciclos de infección, replicación y lisis mientras existan células tumorales que soporten la infección. Estos adenovirus actúan como un agente biológico antitumoral más que como vehículo para administrar genes terapéuticos, sin embargo, su efecto puede mejorarse al insertar genes de citocinas o enzimas58,59.
Con el fin de dirigir su actividad oncolítica, se desarrollaron los adenovirus de replicación selectiva, mediante la depleción de funciones virales no necesarias en células tumorales y la substitución de promotores virales por promotores selectivos del tumor como la alfa-fetoproteína, el antígeno prostático específico, la kallikreína, la mucina 1 y la osteocalcina, entre otros60,61.
El primer virus de replicación selectiva utilizado en ensayos clínicos aleatorios fue el ONYX-015, que permite la replicación y lisis de células tumorales deficientes en p53. Este vector demostró un nivel de eficacia satisfactorio en modelos preclínicos contra xenoinjertos de carcinoma de ovario humaño deficiente de p53. Sin embargo, a pesar de su seguridad, su aplicación en un estudio clínico en mujeres con cáncer de ovario recurrente y refractario al tratamiento no mostró evidencia clara de respuesta clínica o radiológica en ningún paciente62.
En un estudio en fase II, tras haberse demostrado una modesta actividad antitumoral con el tratamiento oncolítico en pacientes con cáncer de cabeza y cuello63, se observó que cuando las pacientes recibieron el tratamiento oncolítico combinado con quimioterapia (cisplatino y 5-fluorouracilo), tuvieron una respuesta completa sin progresión a los 6 meses de seguimiento, mientras que todos los tratados únicamente con quimioterapia, progresaron64. Adicionalmente, un ensayo aleatorio de fase III, en el que se utilizó el adenovirus H101 en 160 pacientes con cáncer de cabeza y cuello o esófago, demostró que el tratamiento combinado con quimioterapia (cisplatino o adriamicina combinados con 5-fluorouracilo) duplica la respuesta y es bien tolerado65,66.
La oncólisis viral puede combinarse con otras terapias génicas. El adenovirus oncolítico que porta E1A bajo el control del promotor de hTERT, y el gen suicida CD bajo el control del promotor del CMV (Ad.hTERT-E1A/CMV-CD) se replican selectivamente en células tumorales humanas e incrementan el efecto letal sobre células tumorales67.
También se pueden disehar virus que complementen su actividad oncolítica con la enzimática. El virus oncolítico (Ad5/3-Delta24-FCU1) es una quimera (Ad5/3) en la cual se reemplaza la fibra Knob del serotipo 5 por la del serotipo 3 para mejorar la eficiencia de transfección de los virus con cápside silvestre68. Adicionalmente, tiene una depleción de 24-bp (Ad5/3-D24) en la región constante del gen E1A que restringe su expresión a las células tumorales deficientes en Rb69,70, y porta el gen FCU1 (Ad5/3-Delta24-FCU1) que codifica una enzima con doble actividad catalítica: metaboliza la 5-Fluorocitosina, en 5-fluorouracilo y monofosfato de 5-fluorouridina. Un estudio preclínico en carcinoma escamoso de cabeza y cuello múrido demostró el efecto antitumoral sinérgico cuando se administró el Ad5/3-Delta24FCU1 con 5-Fluorocitosina en comparación con los tratados sin el profármaco64.
Terapia génica inmunopotenciadora
Dado que las células tumorales son poco inmunogénicas, y debido a que durante su desarrollo el cáncer no causa inflamación ni daño tisular (señales de peligro), no se activa una respuesta inmune efectiva que controle su crecimiento. La terapia génica inmunopotenciadora o vacunación genética en cáncer se ha desarrollado con base en la inducción de una inmunización activa que module los componentes celulares del sistema inmune e incremente su capacidad para reconocer y rechazar los antígenos tumorales. Esta estrategia solo es posible en tumores que expresen antígenos tumorales específicos71.
Numerosos ensayos clínicos se han centrado en la introducción de genes de citocinas estimuladoras como interleucina (IL)-2, IL-12 o interferón (fig. 2). Modelos de hepatocarcinoma en ratas tratadas con AdCMV-IL-12 demostraron una inhibición dosis-dependiente del crecimiento tumoral72, y en modelos múridos, se demostró que la cantidad de citocinas expresadas de novo en el tumor es importante, puesto que la regresión es mayor cuando el tratamiento de realiza con adenovirus que codifican la IL-2 bajo el control de un promotor fuerte (citomegalovirus) que cuando se realiza con adenovirus que la codifican bajo el control de un promotor débil como el del Rous Sarcoma Virus73.
Las múltiples alteraciones que pueden estar presentes en un tumor dificultan la escogencia de un blanco molecular único para el tratamiento del cáncer. La posibilidad de transferir varios genes para estimular diferentes componentes de la inmunidad y ejercer un efecto aditivo se demostró en un modelo de mieloma múltiple in vitro, donde la transferencia de Ad-p53/GM-CSF/B7-1 indujo apoptosis, proliferación de linfocitos y citotoxicidad específica contra células tumorales28. Adicionalmente, células del sistema inmune pueden modificarse para optimizar los protocolos de inmunopotenciación. Las más utilizadas son: presentadoras de antígeno y linfocitos infiltrantes de tumor (NK o LT cito-tóxicos específicos para antígenos tumorales)74.
Terapia antiangiogénesis
La angiogénesis es la formación de nuevos vasos sanguíneos a partir de los preexistentes como consecuencia del desbalance en la concentración de factores anti y proangiogénesis por parte de células endoteliales, monocitos, células de músculo liso y plaquetas. La angiogénesis, común a los tumores sólidos, es fundamental para la vascularización y el desarrollo del microambiente favorable que garantiza la supervivencia y progresión tumoral, y el desarrollo de metástasis75. Su inducción requiere factores de crecimiento (factor de crecimiento endotelial vascular, factor de crecimiento de fibroblastos, factor de crecimiento epidérmico, factor estimulante de colonias de granulocitos y monocitos, factor de crecimiento derivado de plaquetas), citocinas, (IL-1, IL-6, IL-8, factor de necrosis tumoral a) proteínas de la matriz extracelular (colágeno, endostatina, e integrinas) y enzimas proteolíticas (catepsina, activador del plasminógeno tipo uroquinasa, y gelatinasas A y B), cuya expresión desequilibrada favorece la formación de vasos sanguíneos que irrigan el tumor. Un tumor incapaz de inducir la angiogénesis permanece en estado latente76, por lo cual, una terapia antian-giogénesis conducirá a la muerte de las células tumorales al impedir su irrigación sanguínea77.
Numerosos ensayos clínicos han demostrado que la endostatina es el inhibidor endógeno de la angiogénesis con mayor espectro antitumoral y menor toxicidad, por lo cual se aprobó su uso para el tratamiento del cáncer. Sin embargo, no ha tenido mucha aplicación clínica por la dificultad para producirla a gran escala y por su inestabilidad in vitro. Se han desarrollado metodologías que permiten producir y purificar la endostatina humana recombinante mediante la infección de células Ad293 con el vector adenoviral AdrhEndo. Esta proteína es más efectiva y estable que la obtenida a partir de levaduras, y su administración no genera resistencia en modelos animales ni en humaños78. Diferentes vectores que portan el gen de la endostatina han demostrado actividad antitumoral: el vector E10A incrementó significativamente el efecto inhibidor del crecimiento tumoral del cisplatino en xenoinjertos de carcinoma escamocelular de cabeza y cuello79, y exhibió un excelente perfil de seguridad dado que cuando se evaluó su toxicidad, producción viral y respuesta antitumoral, se encontró que la inyección intratumoral de 1 x 1012 partículas virales por semana en pacientes con tumores sólidos ejerce un efecto antitumoral moderado y es bien tolerado80.
También se han ensayado adenovirus recombinantes deficientes de replicación, que codifican las formas secretadas de endostatina: el rAd, que codifica la endostatina múrida, inhibe la formación de vasos sanguíneos, la migración y proliferación de células endoteliales, e induce apoptosis en células del endotelio vascular in vitro e in vivo81; y el Ad-rhE que codifica la endostatina humana, genera una alta expresión de endostatina in vivo. Tanto el adenovirus como la proteína son metabolizados en el hígado82, y se está llevando a cabo un ensayo clínico de fase 1 para evaluar la seguridad y eficacia del adenovirus (Ad-rhE) en pacientes con tumores sólidos avanzados83.
La inducción de un microambiente antioncogénico que anule el prooncogénico se puede lograr mediante la terapia génica. El vector Ad-HBx-mIL-12 combina la actividad antiangiogénesis e inhibidora de apoptosis de la proteína X del virus de la hepatitis B con la actividad de la IL-12, y en carcinoma hepatocelular, conduce a la acumulación masiva de células inmunes, la apoptosis de células tumorales y la reducción de los vasos sanguíneos angiogénicos84.
Terapia génica neoadyuvante para el tratamiento tradicional del cáncer
La terapia génica en combinación con los tratamientos tradicionales (neoadyuvancia) mejora la respuesta clínica de los pacientes. Nokisalmi et al. analizaron la dosis de radiación, la modificación de la cápside viral y 5 diferentes promotores para el transgén con el fin de evaluar los mecanismos que median la sobrerregulación del transgén inducida por la radioterapia, y la respuesta al tratamiento combinado con adenovirus deficientes de replicación y radioterapia, en líneas celulares de cáncer de mama, próstata y pulmón. Un amplio rango de dosis de radiación incrementa la expresión del transgén independientemente de la línea celular, el transgén, el promotor o la modificación de la cápside viral. La radiación induce una respuesta celular global y mayor producción de ARN y proteínas, incluidos los productos transgénicos del adenovirus85.
La terapia génica suicida es un claro ejemplo de tratamiento neoadyuvante para mejorar la eficacia del tratamiento quimioterapéutico. Predina et al. reportaron una terapia génica con el sistema AdV-tk/GCV para el tratamiento neoadyuvante en carcinoma de esófago. La combinación entre cirugía, quimioterapia y AdV-tk/GCV mejora la super-vivencia y disminuye la recurrencia de la enfermedad por el efecto citotóxico y el incremento del tráfico de células T-CD8 intratumorales86. En la tabla 2 se muestran algunos ejemplos de ensayos clínicos que han sido desarrollados mediante las diferentes modalidades de terapia génica exclusiva o en combinación con las terapias convencionales.
Avances de los ensayos clínicos en terapia génica
Actualmente, se están llevando a cabo múltiples ensayos clínicos utilizando una gran variedad de enfoques terapéuticos para el tratamiento del cáncer. Unicamente en los institutos nacionales de salud en Estados Unidos, se encuentran reportes de 1.886 ensayos clínicos con terapias génicas para el tratamiento del cáncer, de los cuales 81 están utilizando adenovirus.
Se han desarrollado múltiples agentes virales y no virales para la terapia génica del cáncer con resultados prometedores. En la actualidad, los adenovirus son los más populares y estudiados ya que, además de sus características deseables, han demostrado poseer un excelente récord de seguridad en pacientes con cáncer. Los adenovirus seguirán desarrollándose, y se descubrirá la manera de hacerlos más competitivos al minimizar el efecto de los factores limitantes para su desarrollo y utilización en el tratamiento del cáncer.
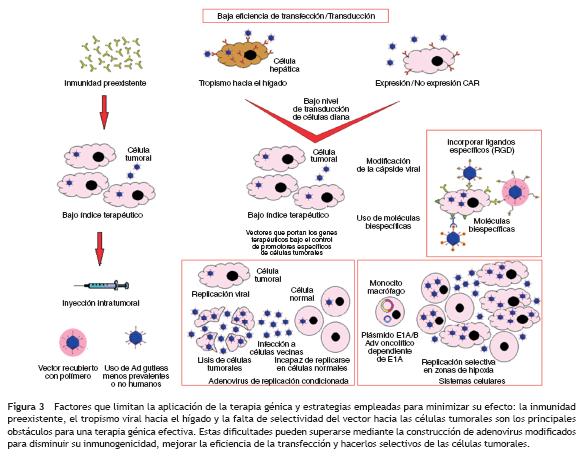
Factores como la imposibilidad para identificar un único gen que funcione en una terapia antitumoral, la falta de selectividad hacia el tumor, la corta duración de la expresión del gen terapéutico87, la dificultad para transfectar toda la masa tumoral y la fuerte respuesta inmune antiviral generada en el hospedero son las principales limitaciones para la aplicación de la terapia génica88,89.
Dado que inicialmente se determinó que la respuesta inmune antiviral y la falta de selectividad hacia el tumor eran las principales limitaciones para la administración del vector terapéutico90, se diseharon vectores capaces de garantizar la llegada del virus al tumor, la activación de la respuesta inmune antitumoral y la infección selectiva de las células tumorales. Los adenovirus dependientes de virus auxiliar (gutless) poseen amplias depleciones del genoma, por lo que expresan pocas proteínas virales y no inducen una respuesta inmune vigorosa in vivo. Adicionalmente, mantienen su tropismo y la eficiencia para la transducción y expresión del gen terapéutico91.
La vía de administración juega un papel importante en la respuesta al tratamiento con adenovirus recombinantes. La inyección intratumoral del interferon -mediante un adenovirus- induce mayor inmunidad antitumoral y genera menor toxicidad que la inyección intravenosa del mismo vector92. Un ensayo clínico de fase 1 evaluó la eficacia terapéutica, biodistribución y neurotoxicidad de los adenovirus de gran capacidad (HC-Ad) en ratas con glioblastoma y demostró que su administración intratumoral induce inmunidad sistémica antiadenovirus sin afectar a su eficacia terapéutica93. Para salvar la dificultad de la selectividad hacia el tumor, se diseñaron vectores con los genes terapéuticos bajo el control de promotores específicos de células tumorales como hTERT67, PMSA94 o survivina54, o con motivos que permiten visualizar el virus (mRFP1) y que lo dirigen a la célula diana (polilisina), donde ejerce el efecto terapéutico (HSV-1/TK)87.
Avances como el desarrollo de sistemas celulares monocito-macrófagos para administrar adenovirus oncolíticos en zonas de hipoxia en tumores de próstata permitieron utilizar 3 niveles de especificidad: el homming de los macrófagos en zonas de hipoxia, la inducción de proliferación viral en el macrófago por hipoxia y la replicación selectiva del virus en células tumorales de próstata. Este sistema permitió la transducción de células tumorales en zonas de hipoxia y en las metástasis, que son difíciles de transfectar95.
Muchos factores resultan en una baja eficiencia de transfección: el tropismo viral hacia el hígado, los anticuerpos preexistentes, la gran variedad de células que expresan el receptor coxsackie/adenovirus y la no expresión del receptor coxsackie/adenovirus en algunas células. Estas dificultades pueden salvarse mediante diversas estrategias de terapia génica (figs. 1B y 3)94.
Por último, si se considera que tumores como el cáncer colorrectal hereditario no poliposo, normalmente posee mutaciones en los genes de la maquinaria de reparación de apareamientos erróneos, y que este "fenotipo mutador" puede anular el efecto de la transferencia génica, se podría pensar en una terapia génica que además del gen terapéutico incluya la copia silvestre del gen de la reparación de apareamientos erróneos que esté alterado (MLH1, MSH2, MSH6 y PMS2) para revertir el fenotipo mutador.
Conclusiones
La terapia génica es un grupo de modalidades terapéuticas únicas proyectadas para introducir ácidos nucleicos en las células y reemplazar material genético defectuoso o perdido para tratar o curar una enfermedad. Estas terapias, que inicialmente arrojaron resultados inesperados que justificaron su fuerte regulación para garantizar su seguridad, han demostrado una clara evidencia de su eficacia terapéutica con una toxicidad extraordinariamente menor que la generada por los tratamientos tradicionales.
Se espera que durante la próxima década se aprueben y regulen diferentes terapias génicas para el tratamiento del cáncer, aunque los resultados preclínicos en modelos animales no son muy alentadores. La mayoría del trabajo preclínico se realiza por xenoinjerto en animales inmunosuprimidos cuyos resultados no se pueden extrapolar a los que se obtendrían en un animal inmunocompetente. Incluso si se contara con modelos inmunocompetentes, los datos obtenidos pueden no ser extrapolables a los seres humaños.
Queda mucho por aprender sobre la biología de la terapia génica viral en pacientes con cáncer. Aunque existe evidencia del potencial terapéutico y de la seguridad en el uso de estos agentes terapéuticos, la mayor conclusión de los ensayos clínicos que se han llevado a cabo es que la penetración del tumor y la eficiencia de transducción son muy bajas para permitir un efecto antitumoral significativo. Actualmente, se están llevando a cabo numerosos estudios que permitirán desarrollar vectores más eficientes que generen una inmunidad antitumoral sistémica reforzada por la respuesta antiviral que genere el vector terapéutico.
Conflicto de intereses
Los autores declaran que no existe ningún conflicto de intereses.
Bibliografía
1. Ferlay J. SHBFFDMCaPD. Cancer Incidence and Mortality Worldwide: IARC Cancer Base. 2;10. Lyon, France: International Agency for Research on Cancer: 2008. [ Links ]
2. Giacca M, Zacchigna S. Virus-mediated gene delivery for human gene therapy. J Control Release. 2012;161:377-88. [ Links ]
3. Raki M, Rein DT, Kanerva A, Hemminki A. Gene transfer approaches for gynecological diseases. Mol Ther. 2006;14: 154-63. [ Links ]
4. Blaese RM, Culver KW, Miller AD, Carter CS, Fleisher T, Clerici M, et al. T lymphocyte-directed gene therapy for ADA- SCID: initial trial results after 4 years. Science. 1995;270:475-80. [ Links ]
5. Muul LM, Tuschong LM, Soenen SL, Jagadeesh GJ, Ramsey WJ, Long Z, et al. Persistence and expression of the adenosine deaminase gene for 12 years and immune reaction to gene transfer components: long-term results of the first clinical gene therapy trial. Blood. 2003;101:2563-9. [ Links ]
6. Cavazzana-Calvo M, Hacein-Bey S, de Saint BG, Gross F, Yvon E, Nusbaum P, et al. Gene therapy of human severe combined immunodeficiency (SCID) -X1 disease. Science. 2000;288:669-72. [ Links ]
7. Cavazzana-Calvo M, Fischer A. Gene therapy for severe combined immunodeficiency: are we there yet? J Clin Invest. 2007;117:1456-65. [ Links ]
8. Hacein-Bey-Abina S, Von KC, Schmidt M, McCormack MP, Wulffraat N, Leboulch P, et al. LMO2-associated clonal T cell proliferation in two patients after gene therapy for SCID-X1. Science. 2003;302:415-9. [ Links ]
9. Fujii N, Isaka Y, Takabatake Y, Mizui M, Suzuki C, Takahara S, et al. Targeting of interstitial cells using a simple gene-transfer strategy. Nephrol Dial Transplant. 2006;21:2745-53. [ Links ]
10. Isaka Y. Gene therapy targeting kidney diseases: routes and vehicles. Clin Exp Nephrol. 2006;10:229-35. [ Links ]
11. Sharma A, Tandon M, Bangari DS, Mittal SK. Adenoviral vector-based strategies for cancer therapy. Curr Drug Ther. 2009;4:117-38. [ Links ]
12. Felgner PL, Gadek TR, Holm M, Roman R, Chan HW, Wenz M, et al. Lipofection: a highly efficient, lipid-mediated DNA-transfection procedure. Proc Natl Acad Sci USA. 1987;84:7413-7. [ Links ]
13. Jeschke MG, Barrow RE, Hawkins HK, Yang K, Hayes RL, Lichtenbelt BJ, et al. IGF-I gene transfer in thermally injured rats. Gene Ther. 1999;6:1015-20. [ Links ]
14. Witlox MA, Lamfers ML, Wuisman PI, Curiel DT, Siegal GP. Evolving gene therapy approaches for osteosarcoma using viral vectors: review. Bone. 2007;40:797-812. [ Links ]
15. Bleiziffer O, Eriksson E, Yao F, Horch RE, Kneser U. Gene transfer strategies in tissue engineering. J Cell Mol Med. 2007;11:206-23. [ Links ]
16. Kay MA, Glorioso JC, Naldini L. Viral vectors for gene therapy: the art of turning infectious agents into vehicles of therapeutics. Nat Med. 2001;7:33-40. [ Links ]
17. McConnell MJ, Imperiale MJ. Biology of adenovirus and its use as a vector for gene therapy. Hum Gene Ther. 2004;15:1022-33. [ Links ]
18. Nadeau I, Kamen A. Production of adenovirus vector for gene therapy. Biotechnol Adv. 2003;20:475-89. [ Links ]
19. Li J, Zeng W, Huang Y, Zhang Q, Hu P, Rabkin SD, et al. Treatment of breast cancer stem cells with oncolytic herpes simplex virus. Cancer Gene Ther. 2012;19:707-14. [ Links ]
20. Ni TH, McDonald WF, Zolotukhin I, Melendy T, Waga S, Stillman B, et al. Cellular proteins required for adeno-associated virus DNA replication in the absence of adenovirus coinfection. J Virol. 1998;72:2777-87. [ Links ]
21. Melero I, Vile RG, Colombo MP. Feeding dendritic cells with tumor antigens: self-service buffet or a la carte? Gene Ther. 2000;7:1167-70. [ Links ]
22. Moniri MR, Sun XY, Rayat J, Dai D, He Z, Verchere CB, et al. TRAIL-engineered pancreas-derived mesenchymal stem cells: characterization and cytotoxic effects on pancreatic cancer cells. Cancer Gene Ther. 2012;19:652-8. [ Links ]
23. Ochsenreither S, Majeti R, Schmitt T, Stirewalt D, Keilholz U, Loeb KR, et al. Cyclin-A1 represents a new immunogenic targetable antigen expressed in acute myeloid leukemia stem cells with characteristics of a cancer-testis antigen. Blood. 2012;119:5492-501. [ Links ]
24. Anderson WF. Human gene therapy. Science. 1992;256:808-13. [ Links ]
25. Cheng L, Ziegelhoffer PR, Yang NS. In vivo promoter activity and transgene expression in mammalian somatic tissues evaluated by using particle bombardment. Proc Natl Acad Sci USA. 1993;90:4455-9. [ Links ]
26. Sangro B, Herraiz M, Prieto J. Gene therapy of neoplastic liver diseases. Int J Biochem Cell Biol. 2003;35:135-48. [ Links ]
27. Casado E, Nettelbeck DM, Gomez-Navarro J, Hemminki A, Gonzalez Baron M, Siegal GP, et al. Transcriptional targeting for ovarian cancer gene therapy. Gynecol Oncol. 2001;82: 229-37. [ Links ]
28. Ren SP, Wu CT, Huang WR, Lu ZZ, Kia XX, Wang L, et al. Adenoviral-mediated transfer of human wild-type p53, GM-CSF and B7-1 genes results in growth suppression and autologous anti-tumor cytotoxicity of multiple myeloma cells in vitro. Cancer Immunol Immunother. 2006;55:375-85. [ Links ]
29. Ahn WS, Bae SM, Lee KH, Lee JM, Namkoong SE, Chun HJ, et al. Recombinant adenovirus-p53 gene transfer and cell-specific growth suppression of human cervical cancer cells in vitro and in vivo. Gynecol Oncol. 2004;92:611-21. [ Links ]
30. Ahn WS, Bae SM, Lee JM, Namkoong SE, Yoo JY, Seo YS, et al. Anti-cancer effect of adenovirus p53 on human cervical cancer cell growth in vitro and in vivo. Int J Gynecol Cancer. 2004;14:322-32. [ Links ]
31. Ganjavi H, Gee M, Narendran A, Parkinson N, Krishnamoorthy M, Freedman MH, et al. Adenovirus-mediated p53 gene therapy in osteosarcoma cell lines: sensitization to cisplatin and doxorubicin. Cancer Gene Ther. 2006;13:415-9. [ Links ]
32. Swisher SG, Roth JA. p53 Gene therapy for lung cancer. Curr Oncol Rep. 2002;4:334-40. [ Links ]
33. Inoue H, Shiraki K, Murata K, Sugimoto K, Kawakita T, Yamaguchi Y, et al. Adenoviral-mediated transfer of p53 gene enhances TRAIL-induced apoptosis in human hepatocellular carcinoma cells. Int J Mol Med. 2004;14:271-5. [ Links ]
34. Yang C, Cirielli C, Capogrossi MC, Passaniti A. Adenovirus-mediated wild-type p53 expression induces apoptosis and suppresses tumorigenesis of prostatic tumor cells. Cancer Res. 1995;55:4210-3. [ Links ]
35. El-Deiry WS. The role of p53 in chemosensitivity and radio-sensitivity. Oncogene. 2003;22:7486-95. [ Links ]
36. Roth JA. Adenovirus p53 gene therapy. Expert Opin Biol Ther. 2006;6:55-61. [ Links ]
37. Ma G, Shimada H, Hiroshima K, Tada Y, Suzuki N, Tagawa M. Gene medicine for cancer treatment: commercially available medicine and accumulated clinical data in China. Drug Des Devel Ther. 2009;2:115-22. [ Links ]
38. Shi J, Zheng D. An update on gene therapy in China. Curr Opin Mol Ther. 2009;11:547-53. [ Links ]
39. Peng Z. Current status of gendicine in China: recombinant human Ad-p53 agent for treatment of cancers. Hum Gene Ther. 2005;16:1016-27. [ Links ]
40. INGN 201: Ad-p53, Ad5CMV-p53, adenoviral p53, p53 gene therapy--introgen, RPR/INGN 201. Drugs R.D. 2007;8:176-87. [ Links ]
41. Zhang X, Liu S, Liang C, Yang H. Adenovirus-mediated Rb gene transfect for head and neck cancer. Hua Xi Yi Ke Da Xue Xue Bao. 2001;32:194-5, 207. [ Links ]
42. Zhang X, Multani AS, Zhou JH, Shay JW, McConkey D, Dong L, et al. Adenoviral-mediated retinoblastoma 94 produces rapid telomere erosion, chromosomal crisis, and caspase-dependent apoptosis in bladder cancer and immortalized human urothelial cells but not in normal urothelial cells. Cancer Res. 2003;63:760-5. [ Links ]
43. Zhou J, Zhang XQ, Ashoori F, McConkey DJ, Knowles MA, Dong L, et al. Early RB94-produced cytotoxicity in cancer cells is independent of caspase activation or 50 kb DNA fragmentation. Cancer Gene Ther. 2009;16:13-9. [ Links ]
44. Millikan RE, Perez CA. A Phase I Study of Systemic Gene Therapy With SGT-94 in Patients With Solid Tumors. [Internet]. 27 Jul 2012. [ Links ]
45. Eberle J, Fecker LF, Hossini AM, Kurbañov BM, Fechner H. Apoptosis pathways and oncolytic adenoviral vectors: promising targets and tools to overcome therapy resistance of malignant melañoma. Exp Dermatol. 2008;17:1-11. [ Links ]
46. Kagaya T, Nakamoto Y, Sakai Y, Tsuchiyama T, Yagita H, Mukaida N, et al. Monocyte chemoattractant protein-1 gene delivery enhances antitumor effects of herpes simplex virus thymidine kinase/ganciclovir system in a model of colon cancer. Cancer Gene Ther. 2006;13:357-66. [ Links ]
47. Tu SP, Liston P, Cui JT, Lin MC, Jiang XH, Yang Y, et al. Restoration of XAF1 expression induces apoptosis and inhibits tumor growth in gastric cancer. Int J Cancer. 2009;125: 688-97. [ Links ]
48. Dachs GU, Tupper J, Tozer GM. From bench to bedside for gene-directed enzyme prodrug therapy of cancer. Anticancer Drugs. 2005;16:349-59. [ Links ]
49. Wang J, Lu XX, Chen DZ, Li SF, Zhang LS. Herpes simplex virus thymidine kinase and ganciclovir suicide gene therapy for human pancreatic cancer. World J Gastroenterol. 2004;10:400-3. [ Links ]
50. Chen L, Waxman DJ. Cytochrome P450 gene-directed enzyme prodrug therapy (GDEPT) for cancer. Curr Pharm Des. 2002;8: 1405-16. [ Links ]
51. Maatta AM, Samaranayake H, Pikkarainen J, Wirth T, Yla-Herttuala S. Adenovirus mediated herpes simplex virus-thymidine kinase/ ganciclovir gene therapy for resectable malignant glioma. Curr Gene Ther. 2009;9:356-67. [ Links ]
52. Huang Q, Pu P, Xia Z, You Y. Exogenous wt-p53 enhances the antitumor effect of HSV-TK/GCV on C6 glioma cells. J Neurooncol. 2007;82:239-48. [ Links ]
53. Huang H, Tan WL, Zhu WH, Liang ZK. Lethal effect of adenovirus-mediated HSV-TK gene in combination with hydroxycamptothecin on human bladder cancer in vitro. Nan Fang Yi Ke Da Xue Xue Bao. 2007;27:461-4. [ Links ]
54. Luo XR, Li JS, Niu Y, Miao L. Adenovirus-mediated double suicide gene selectively kills gastric cancer cells. Asian Pac J Cancer Prev. 2012;13:781-4. [ Links ]
55. Maatta AM, Tenhunen A, Pasanen T, Merilãinen O, Pellinen R, Mãkinen K, et al. Non-small cell lung cancer as a target disease for herpes simplex type 1 thymidine kinase-ganciclovir gene therapy. Int J Oncol. 2004;24:943-9. [ Links ]
56. Immonen A, Vapalahti M, Tyynelã K, Hurskainen H, Sandmair A, Vanninen R, et al. AdvHSV-tk gene therapy with intravenous ganciclovir improves survival in human malignant glioma: a randomised, controlled study. Mol Ther. 2004;10:967-72. [ Links ]
57. Sviatchenko VA, Tarasova MV, Netesov SV, Chumakov PM. Oncolytic adenoviruses in anti-cancer therapy: current status and perspectives. Mol Biol (Mosk). 2012;46:556-69. [ Links ]
58. Wildner O. Comparison of replication-selective, oncolytic viruses for the treatment of human cancers. Curr Opin Mol Ther. 2003;5:351-61. [ Links ]
59. Wildner O, Hoffmann D, Jogler C, Uberla K. Comparison of HSV-1 thymidine kinase-dependent and -independent inhibition of replication-competent adenoviral vectors by a panel of drugs. Cancer Gene Ther. 2003;10:791-802. [ Links ]
60. Alemany R, Balague C, Curiel DT. Replicative adenoviruses for cancer therapy. Nat Biotechnol. 2000;18:723-7. [ Links ]
61. Curiel DT. Strategies to adapt adenoviral vectors for targeted delivery. Ann N Y Acad Sci. 1999;886:158-71. [ Links ]
62. Vasey PA, Shulman LN, Campos S, Davis J, Gore M, Johnston S, et al. Phase I trial of intraperitoneal injection of the E1B-55-kd-gene-deleted adenovirus ONYX-015 (dl1520) given on days 1 through 5 every 3 weeks in patients with recurrent/ refractory epithelial ovarian cancer. J Clin Oncol. 2002;20: 1562-9. [ Links ]
63. Nemunaitis J, Khuri F, Ganly I, Arseneau J, Posner M, Vokes E, et al. Phase II trial of intratumoral administration of ONYX-015, a replication-selective adenovirus, in patients with refractory head and neck cancer. J Clin Oncol. 2001;19:289-98. [ Links ]
64. Dias JD, Liikanen I, Guse K, Foloppe J, Sloniecka M, Diaconu I, et al. Targeted chemotherapy for head and neck cancer with a chimeric oncolytic adenovirus coding for bifunctional suicide protein FCU1. Clin Cancer Res. 2010;16:2540-9. [ Links ]
65. Yu W, Fang H. Clinical trials with oncolytic adenovirus in China. Curr Cancer Drug Targets. 2007;7:141-8. [ Links ]
66. Xia ZJ, Chang JH, Zhang L, Jiang WQ, Guan ZZ, Liu JW, et al. Phase III randomized clinical trial of intratumoral injection of E1B gene-deleted adenovirus (H101) combined with cisplatin-based chemotherapy in treating squamous cell cancer of head and neck or esophagus. Ai Zheng. 2004;23:1666-70. [ Links ]
67. Zhang J, Wei F, Wang H, Li H, Qiu W, Ren P, et al. A novel oncolytic adenovirus expressing Escherichia coli cytosine deaminase exhibits potent antitumor effect on human solid tumors. Cancer Biother Radiopharm. 2010;25:487-95. [ Links ]
68. Dias JD, Guse K, Nokisalmi P, Eriksson M, Chen DT, Diaconu I, et al. Multimodal approach using oncolytic adenovirus, cetuximab, chemotherapy and radiotherapy in HNSCC low passage tumour cell cultures. Eur J Cancer. 2010;46:625-35. [ Links ]
69. Fueyo J, Gomez-Manzaño C, Alemany R, Lee PS, McDonnell TJ, Mitlianga P, et al. A mutant oncolytic adenovirus targeting the Rb pathway produces anti-glioma effect in vivo. Oncogene. 2000;19:2-12. [ Links ]
70. Heise C, Hermiston T, Johnson L, Brooks G, Sampson-Johannes A, Williams A, et al. An adenovirus E1A mutant that demonstrates potent and selective systemic anti-tumoral efficacy. Nat Med. 2000;6:1134-9. [ Links ]
71. Tuting T, Storkus WJ, Lotze MT. Gene-based strategies for the immunotherapy of cancer. J Mol Med (Berl). 1997;75:478-91. [ Links ]
72. Barajas M, Mazzolini G, Genové G, Bilbao R, Narvaiza I, Schmitz V, et al. Gene therapy of orthotopic hepatocellular carcinoma in rats using adenovirus coding for interleukin 12. Hepatology. 2001;33:52-61. [ Links ]
73. Slos P, De MM, Leroy P, Rousseau C, Acres B. Immunotherapy of established tumors in mice by intratumoral injection of an adenovirus vector harboring the human IL-2 cDNA: induction of CD8(+) T-cell immunity and NK activity. Cancer Gene Ther. 2001;8:321-32. [ Links ]
74. Nakamura M, Iwahashi M, Nakamori M, Ueda K, Matsuura I, Noguchi K, et al. Dendritic cells genetically engineered to simultaneously express endogenous tumor antigen and granulocyte macrophage colony-stimulating factor elicit potent therapeutic antitumor immunity. Clin Cancer Res. 2002;8:2742-9. [ Links ]
75. Volpert OV, Dameron KM, Bouck N. Sequential development of an angiogenic phenotype by human fibroblasts progressing to tumorigenicity. Oncogene. 1997;14:1495-502. [ Links ]
76. Ribatti D, Vacca A, Presta M. The discovery of angiogenic factors: a historical review. Gen Pharmacol. 2000;35:227-31. [ Links ]
77. Denekamp J, Dasu A, Waites A. Vasculature and micro-environmental gradients: the missing links in novel approaches to cancer therapy? Adv Enzyme Regul. 1998;38:281-99. [ Links ]
78. Liang Z, Wu J, Huang J, Tan W, Ke M, Liu R, et al. Bioactivity and stability analysis of endostatin purified from fermentation supernatant of 293 cells transfected with Ad/rhEndo. Protein Expr Purif. 2007;56:205-11. [ Links ]
79. Adhim Z, Lin X, Huang W, Morishita N, Nakamura T, Yasui H, et al. E10A, an adenovirus-carrying endostatin gene, dramatically increased the tumor drug concentration of metronomic chemotherapy with low-dose cisplatin in a xenograft mouse model for head and neck squamous-cell carcinoma. Cancer Gene Ther. 2012;19:144-52. [ Links ]
80. Lin X, Huang H, Li S, Li H, Li Y, Cao Y, et al. A phase I clinical trial of an adenovirus-mediated endostatin gene (E10A) in patients with solid tumors. Cancer Biol Ther. 2007;6:648-53. [ Links ]
81. Jin X, Bookstein R, Wills K, Avanzini J, Tsai V, LaFace D, et al. Evaluation of endostatin antiangiogenesis gene therapy in vitro and in vivo. Cancer Gene Ther. 2001;8:982-9. [ Links ]
82. He GA, Xue G, Xiao L, Wu JX, Xu BL, Huang JL, et al. Dynamic distribution and expression in vivo of human endostatin gene delivered by adenoviral vector. Life Sci. 2005;77:1331-40. [ Links ]
83. Wenqi Jiang. Phase I Trial of Intratumoral Injection of an Adenovirus Encoding Human Endostatin for Advanced Solid Tumors. [Internet] 20 Ago 2013. Clinical Trials Feeds.org J.A. Rodríguez et al. [ Links ]
84. He H, Fan P, Yin T, Chen Q, Shi H, Liu S, et al. Local delivery of recombinant adenovirus expressing hepatitis B virus X protein and interleukin-12 results in antitumor effects via inhibition of hepatoma cell growth and intervention of tumor microenvironment. Int J Mol Med. 2012;30:599-605. [ Links ]
85. Nokisalmi P, Rajecki M, Pesonen S, Escutenaire S, Soliymani R, Tenhunen M, et al. Radiation-induced upregulation of gene expression from adenoviral vectors mediated by DNA damage repair and regulation. Int J Radiat Oncol Biol Phys. 2012;83:376-84. [ Links ]
86. Predina JD, Judy B, Aliperti LA, Fridlender ZG, Blouin A, Kapoor V, et al. Neoadjuvant in situ gene-mediated cytotoxic immunotherapy improves postoperative outcomes in novel syngeneic esophageal carcinoma models. Cancer Gene Ther. 2011;18:871-83. [ Links ]
87. Tang Y, Wu H, Ugai H, Matthews QL, Curiel DT. Derivation of a triple mosaic adenovirus for cancer gene therapy. PLoS.One. 2009;4:e8526. [ Links ]
88. Appledorn DM, Patial S, McBride A, Godbehere S, Van Rooijen N, Parameswaran N, et al. Adenovirus vector-induced innate inflammatory mediators, MAPK signaling, as well as adaptive immune responses are dependent upon both TLR2 and TLR9 in vivo. J Immunol. 2008;181:2134-44. [ Links ]
89. Appledorn DM, Kiang A, McBride A, Jiang H, Seregin S, Scott JM, et al. Wild-type adenoviruses from groups A-F evoke unique innate immune responses, of which HAd3 and SAd23 are partially complement dependent. Gene Ther. 2008;15:885-901. [ Links ]
90. Kaufmann JK, Nettelbeck DM. Virus chimeras for gene therapy, vaccination, and oncolysis: adenoviruses and beyond. Trends Mol Med. 2012;18:365-76. [ Links ]
91. Alba R, Bosch A, Chillon M. Gutless adenovirus: last-generation adenovirus for gene therapy. Gene Ther. 2005;12 Suppl 1:S18-S27. [ Links ]
92. Narumi K, Kondoh A, Udagawa T, Hara H, Goto N, Ikarashi Y, et al. Administration route-dependent induction of antitumor immunity by interferon-alpha gene transfer. Cancer Sci. 2010;101:1686-94. [ Links ]
93. Muhammad AK, Puntel M, Candolfi M, Salem A, Yagiz K, Farrokhi C, et al. Study of the efficacy, biodistribution, and safety profile of therapeutic gutless adenovirus vectors as a prelude to a phase I clinical trial for glioblastoma. Clin Pharmacol Ther. 2010;88:204-13. [ Links ]
94. Williams BJ, Bhatia S, Adams LK, Boling S, Carroll JL, Li XL, et al. Dendritic cell based PSMA immunotherapy for prostate cancer using a CD40-targeted adenovirus vector. PLoS One. 2012;7:e46981. [ Links ]
95. Muthana M, Giannoudis A, Scott SD, Fang HY, Coffelt SB, Morrow FJ, et al. Use of macrophages to target therapeutic adenovirus to human prostate tumors. Cancer Res. 2011;71:1805-15. [ Links ]