Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cancerología
Print version ISSN 0123-9015
rev.colomb.cancerol. vol.18 no.3 Bogotá July/Sept. 2014
https://doi.org/10.1016/j.rcc.2014.06.003
REVISION
http://dx.doi.org/10.1016/j.rcc.2014.06.003
Cirugía Robótica Transoral (TORS), en el manejo de lesiones neoplásicas de cabeza y cuello
Transoral Robotic Surgery (TORS), in the management of head and neck tumors
Enrique Cadenaa,b,c,*, Ricardo Guerrab,d y Carlos Pérez-Mitchelle,f
a Grupo Cirugía de Cabeza y Cuello, Instituto Nacional de Cancerología, Bogotá D. C., Colombia
b Unidad de Otorrinolaringología, cirugía de cabeza y cuello, cirugía robótica, Cirurobótica, Clínica de Marly, Bogotá D. C., Colombia
c Unidad Otorrinolaringología, Universidad Nacional de Colombia, Bogotá D. C., Colombia
d Unidad de Otorrinolaringología, Sesión de Laringología, Hospital Universitario Infantil de San José, Fundación Universitaria de Ciencias de la Salud, Bogotá D. C., Colombia
e Instituto Oncológico de Cabeza y Cuello Hospital HIMA San Pablo, Caguas, Puerto Rico
f Departamento de Otorrinolaringología, Cirugía de Cabeza y Cuello, Universidad de Puerto Rico Recinto de Ciencias Médicas, San Juan, Puerto Rico
* Autor para correspondencia.
Correos electrónicos: enriquecadena2005@yahoo.com, ecadena@cancer.gov.co (E. Cadena).
Recibido el 29 de enero de 2014; aceptado el 10 de junio de 2014
Resumen
El cáncer de cabeza y cuello es una enfermedad muy complicada cuya incidencia ha venido incrementando en la última década y está relacionada con la infección del virus del papiloma humano. La base del tratamiento es la cirugía, que debe hacerse con intervenciones extensas y mutilantes a través del cuello, son acompañadas de quimioterapia y radioterapia, dejando secuelas funcionales difíciles de manejar. Desde 2009 se aprobó el uso del robot Da Vinci® para resecar tumores de la orofaringe y supraglotis, con la cirugía robótica transoral. Las bondades de esta técnica, que inciden en la pronta recuperación del paciente, y que están derivadas de la excelente visión tridimensional y la versatilidad de movimientos del instrumental articulado (EndoWrist®), han hecho que las recomendaciones de su uso estén redefiniéndose continuamente. Este artículo resume las ventajas, las desventajas, las indicaciones de manejo actual, el cuidado posoperatorio, la rehabilitación y la terapia adyuvante de este novedoso tratamiento.
Palabras clave: Carcinoma de células escamosas; Neoplasias de cabeza y cuello; Robótica; Operaciones remotas.
Abstract
Head and neck cancer is a complicated disease, with an increasing incidence in the last decade, and is associated with the human papilloma virus infection. The basic treatment is surgery, which should be done with interventions through the neck, which are extensive and crippling, supplemented by chemotherapy and radiotherapy, leaving hard-to-manage functional sequels. The use of the Da Vinci® robot was approved in 2009 for the resection of tumors of the oropharynx and supraglotis, using transoral robotic surgery. The benefits of this technique, leading to an early recovery of the patient, arise from the excellent three-dimensional views and exceptional movements of the automated instrument (EndoWrist®). This has led to the recommendations for its use being continuously redefined. This article summarizes the indications, advantages, disadvantages, postoperative care, management, rehabilitation, and adjuvant therapy of this new treatment.
Keywords: Squamous cell carcinoma; Head and neck tumors; Robotics; Remote operations.
Introducción
Es sorprendente el incremento en la incidencia de tumores de cabeza y cuello. Son la quinta neoplasia más frecuente, y en general, son el 7% de los casos nuevos de cáncer. En el mundo se reportan cerca de medio millón de casos de cáncer en cavidad oral, orofaringe, hipofaringe y laringe, y en el Instituto Nacional de Cancerología de Colombia (INC) durante 2010 se presentaron 170 casos nuevos con tumores en esta localización, de los cuales 142 (83,5%) fueron carcinomas escamocelulares1. Según cálculos estimados, para 2020 se duplicarán las cifras mundiales, produciéndose cerca de quinientas mil muertes cada año.
Hábitos como el consumo de tabaco inhalado y mascado, más alcohol y posiblemente drogas, se reconocen como factores causales de esta alarmante enfermedad. A pesar de los esfuerzos universales no se ha logrado implementar medidas preventivas que incidan directamente sobre las cifras antes mencionadas.
En la actualidad el manejo de este tipo de cáncer, se centra en el tratamiento curativo con múltiples armas terapéuticas, entre las que están: los nuevos medicamentos oncológicos, la radioterapia (3 D, IMRT: radioterapia de intensidad modulada, por sus siglas en idioma inglés: Intensity-Modulated Radition Therapy Technique), y la cirugía abierta que tradicionalmente ha sido mutilante, invasiva y deformante. Sin embargo, en la última década se ha abierto una ventana alternativa con el surgimiento de la cirugía robótica, que en cabeza y cuello está centrada en el uso de un puerto de acceso natural como es la cavidad oral. Weinstein y O'Malley, la describen como la cirugía robótica transoral (TORS, por sus siglas en idioma inglés, TransOral Robotic Surgery)2.
El presente artículo describe esta novedosa técnica y la presenta como una alternativa para los pacientes que sufren de alteraciones funcionales, neoplásicas benignas y malignas del tracto aerodigestivo superior (cavidad oral, orofaringe, hipofaringe y laringe), enumerando las ventajas, las desventajas, las indicaciones quirúrgicas, el manejo posoperatorio, la rehabilitación y la terapia adyuvante.
Ventajas y desventajas
La cirugía mínimamente invasiva busca la realización de procedimientos sencillos o complejos a través de pequeños orificios o pequeñas incisiones, es así como se han desarrollado técnicas video asistidas para lograr este objetivo. Para el área de cabeza y cuello, durante los últimos años han surgido múltiples descripciones de abordajes a través de la cavidad oral con la finalidad de extirpar lesiones benignas o malignas con ayuda de microscopios, endoscopios e instrumental quirúrgico que es manipulado directamente por las manos del cirujano. Incluso el láser ha demostrado ser una herramienta sumamente útil en estos procedimientos.
En cuanto a la resección de tumores malignos del tracto aerodigestivo superior (TADS) es necesario dejar un margen libre de tejido sano alrededor del tumor, lo que técnicamente es muy difícil con el instrumental de endoscopia tradicional, debido a que son implementos rígidos, además de tener limitaciones derivadas de la visión en dos dimensiones. Como una alternativa muy útil surgió la TORS, y O'Malley destaca en su publicación del 2006, por la visión tridimensional y el uso de instrumental con movimientos versátiles que permiten ser aplicados en la cirugía de cavidad oral, orofaringe, hipofaringe, supraglotis y glotis3. Al igual para este autor y su grupo, la TORS ofrece claras ventajas sobre las técnicas endoscópicas y abordajes quirúrgicos transorales tradicionales, siendo segura, menos mórbida y potencialmente más efectiva para lesiones benignas o malignas de cabeza y cuello4.
Park y colaboradores, en su publicación considerando 141 casos operados con TORS, destacan las siguientes ventajas y limitaciones de esta técnica en diferentes resecciones tumorales de cabeza y cuello5:
- Cavidad oral y orofaringe: resección completa de los tumores sin daño de vasos mayores, se resalta la resección transoral lateral de orofaringe para casos de cáncer de amígdala. El riesgo de trauma de la carótida interna es menor usando el brazo robótico articulado (BRA) en un ángulo obtuso, ya que la posibilidad de lesión de la arteria aumenta, cuando este es localizado en ángulo agudo. La visión 3-D de la base de la lengua ayuda a obtener un margen suficiente de la parte profunda y posterior. En los casos de lengua oral y de piso de la boca esta visión tridimensional es muy importante para disminuir sección de los nervios. En la reducción del tejido linfoideo redundante en base de la lengua, de pacientes con apnea del sueño fue muy útil (fig. 1).
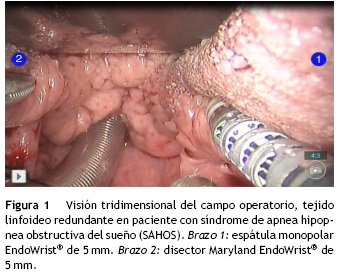
- Laringe: el cáncer temprano de la glotis es tratado de forma regular con cordectomía endoscópica. Al igual que en la cavidad oral, existe limitación en las cirugía de estas lesiones por no tener visión en profundidad, pero ahora la perspectiva 3-D de la TORS permite un análisis geométrico del área y con ayuda de los brazos articulados se pueden realizar movimientos a dos manos en un pequeño campo operatorio, permitiendo resecciones en bloque sin daño de tejidos sanos contiguos.
- Hipofaringe: debido a su anatomía compleja y posición más profunda usaron el retractor FK-WO (Feyh-Kastenbauer Weistein-OMalley) en conjunto con el separador convencional de endoscopia. Esto limitó en forma importante el campo de visión haciendo los procedimientos muy difíciles. Sin embargo, la visión 3-D en conjunto con los brazos articulados les permitió manejar los tejidos en varios planos axiales, coronales y sagitales. Además, realizaron desbridamiento del pericondrio interno del cartílago tiroides, lo que no es factible con el láser. Después de la cirugía los pacientes lograron una rápida rehabilitación para la deglución y para la fonación. - Espacio parafaríngeo: la visión tridimensional permitió visualizar la pulsación de la arteria carótida, el rafe pterigomandibular y el músculo pterigoideo medial, que usualmente a simple visión son difíciles de diferenciar. Además, se evitó el trauma de pares craneales.
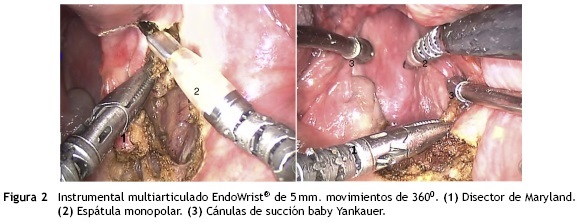
Asimismo, se suprime por completo el temblor derivado del uso de instrumentos largos y finos a través de un mínimo campo operatorio. Esto sumado a la visión 3-D (cercana al tumor) y al instrumental 5 mm EndoWrist® (multi articulado), lo que facilita las disecciones, haciendo la técnica segura, fácil y eficiente sin la morbilidad asociada a la cirugía abierta4,6 (fig. 2). Sin embargo, una posible desventaja podría ser el obtener márgenes negativos en las piezas quirúrgicas, tanto es así que para Quon, O'Malley y cols. en un inicio, el tratamiento adyuvante con radioterapia siempre fue necesario en carcinomas avanzados de orofaringe4. En comparación con la tradicional microcirugía láser transoral (TLM por sus siglas en idioma inglés: Transoral Laser Microsurgery) para T1 y T2 de orofaringe, la TORS permite resecciones en bloque con márgenes quirúrgicos confiables tanto en la biopsia por congelación como en la patología definitiva, para lo cual se recomienda que el cirujano oriente en fresco la pieza quirúrgica en conjunto con el patólogo6,7.
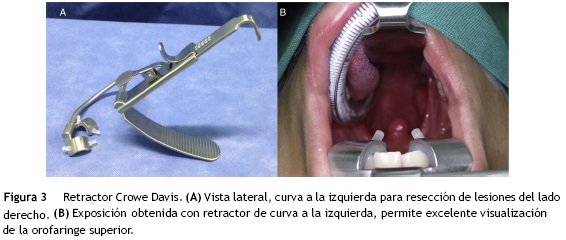
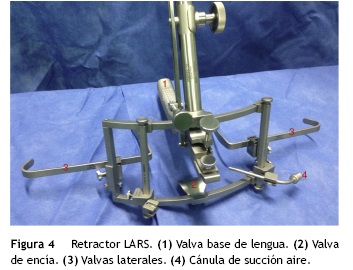
Una desventaja adicional son los costos derivados por el uso del robot y del instrumental, especialmente porque se recomienda emplear diferentes retractores de cavidad oral dependiendo del sitio que va a ser intervenido. Para amígdalas linguales el retractor de Dingman o el retractor de Crowe Davis se adaptan al Storz endoscope holder que va sostenido en el riel de la mesa de operaciones (fig. 3). Para la base de lengua, laringe y la hipofaringe el separador de FK-WO o LARS (por sus siglas en idioma inglés: Larynx Avanced Retractor System) de Remakle y Lawson5 (fig. 4). Al final de la intervención, se usan agentes hemostáticos como Surgiflo®, FloSeal® o Tisseel® de forma rutinaria para disminuir el sangrado postoperatorio.
A pesar de lo anteriormente mencionado, la TORS está demostrando ventajas, entre ellas está la rápida tolerancia de la vía oral en pacientes intervenidos con esta técnica en un promedio de 6,2 días y la pronta recuperación de la deglución y fonación. El éxito de la rápida recuperación en deglución se debe a la preservación parcial de los músculos constrictores y del plexo nervioso parafaríngeo, lo que disminuye la disfagia y la broncoaspiración4.
Tradicionalmente, la recomendación postoperatoria para el manejo de la vía área en los tumores malignos es el uso rutinario de la traqueostomía, con decanulación temprana en promedio a los 5,5 días, y en los tumores benignos únicamente intubación orotraqueal, aunque esta recomendación ha cambiado5. En nuestros pacientes hemos evitado la traqueostomía de forma rutinaria.
Indicaciones y contraindicaciones
Los abordajes a través del cuello con o sin mandibulotomía son tradicionalmente usados para la extirpación de tumores del tracto aerodigestivo superior (TADS), dichos abordajes producen alteraciones en la fonación, deglución y respiración, incrementando en forma importante el tiempo de hospitalización y de rehabilitación. Sin embargo, con la TORS se logra la extirpación de estos tumores sin necesidad de realizar estas maniobras complejas que conllevan secuelas cosméticas y funcionales.
Es muy importante, para practicar este tipo de cirugía obtener una buena exposición, porque el instrumental EndoWrist® de 5 mm sujeto a los brazos robóticos articulados (BRAS) deberá moverse en un pequeño espacio. Es por ello que previo a la cirugía el paciente debe ser valorado para descartar limitaciones en la apertura bucal, o alteraciones como la retrognatia y dentadura aberrante.
Para finales de 2009, la Federal Drug Administration (FDA) aprobó el uso de la TORS, con el sistema Da Vinci® para tumores malignos T1 y T2 de la cavidad oral, faringe y laringe, así como para lesiones benignas de las mismas localizaciones8. Sin embargo, en los últimos años se han ampliado las indicaciones de tumores T1, T2, a tumores T3 y T4 con N (--- ) o N(+) en casos muy seleccionados, incluso se ha reportado su utilidad en resecciones de la nasofaringe, base de cráneo y espacio parafaríngeo5,7-12.
Las principales contraindicaciones generales para el uso de la TORS son8:
- Apertura bucal reducida
- Visualización parcial del tumor
- Compromiso mandibular
- Compromiso tumoral de la base de la lengua, mayor al 50%
- Compromiso tumoral de la pared faríngea posterior, mayor al 50%
- Compromiso de la fascia prevertebral
- Compromiso de la arteria carótida
Así como lo resalta el grupo de Weinstein4, y una vez discutidas las ventajas y limitaciones de la TORS, las indicaciones de este procedimiento para la resección de las diferentes lesiones localizadas en el TADS cambian:
- - Orofaringe: inicialmente la TORS puede ser empleada para biopsias de la base de la lengua y en la evaluación del primario de origen desconocido13. Mehta y cols describen la utilidad de la TORS en 10 pacientes con primario de origen desconocido, a quiénes se les realizó PET/CT, endoscopia convencional, amigdalectomía palatina bilateral, resección de la base de lengua con TORS, encontrándose en 90% de ellos el tumor primario en esta última localización14.
Las contraindicaciones específicas para el uso de la TORS en tumores de orofaringe son4:
- Estado IVC excepto las metástasis a distancia curables
- Ganglios linfáticos irresecables
- T4a con compromiso de músculos extrínsecos de la lengua con trismus asociado
- Tumores T4b
- Compromiso de los músculos constrictores
Las contraindicaciones no relacionadas con el tumor son4:
- Lesiones benignas que causen trismos que impidan el abordaje con el instrumental EndoWrist® de 5 mm.
- Arteria carótida retrofaríngea que está localizada inmediatamente por detrás de la fosa amigdalina, que contraindica la amigdalectomía radical.
- Contraindicaciones médicas anestésicas, así como las relacionadas con disminución de la cicatrización por segunda intención, entre las cuales está la anticoagulación crónica.
La reconstrucción debe ser considerada en casos con defectos posoperatorios grandes para disminuir la broncoaspiración. Una buena alternativa es el colgajo radial microvascularizado15,16, especialmente si se ha realizado en forma concomitante la TORS y la disección de cuello, con el fin de evitar la fistula17. Si la resección compromete más del 50% del paladar blando es indispensable restaurar la competencia velofaringea. Se recomiendan colgajos faríngeos o un colgajo libre radial microvascularizado18.
En síntesis, la TORS en orofaringe está indicada inicialmente para tumores benignos, carcinomas T1, T2 y para T3, T4a seleccionados. Adicionalmente, para reducción del tejido amigdalino redundante de la base de la lengua en paciente con SAHOS (síndrome apnea hipopnea obstructiva del sueño).
- Laringe: en el tratamiento del cáncer temprano o intermedio de la supraglotis siempre se enuncian como metas: erradicar la enfermedad, minimizar la morbilidad y preservar la función tanto ventilatoria como la deglutoria. La cirugía abierta puede cumplir con estas metas, sin embargo, se asocia a la usual morbilidad de un procedimiento abierto, por lo que algunos grupos recomiendan la radioterapia con o sin quimioterapia que también está asociada a alta morbilidad, como lo es la disfunción en deglución y en el habla, que puede conllevar a larga dependencia a gastrostomía. En relación a esto, Weinstein y su grupo reportaron en 2007, el manejo quirúrgico para tumores supraglóticos con TORS, resaltando la excelente exposición y la resección completa sin complicaciones, refiriendo que este procedimiento es una gran alternativa en comparación con las técnicas quirúrgicas abiertas y laringectomías supraglóticas transorales convencionales19. Como ventaja de la TORS está la visión en 3-D magnificada, permitiendo una resección multiplanar en 360°. Con el fin de obtener una adecuada exposición del campo operatorio se recomienda el uso del retractor FK-WO o el retractor de LARS20.
Entre las indicaciones actuales para laringectomía supraglótica asistida con robot están las resecciones de tumores benignos, tumores malignos T1, T2 y T3 seleccionados (mínima invasión del seno piriforme, invasión espacio pre-epiglótico que permita preservar el 50% de la base de la lengua, siempre con márgenes oncológicos adecuados)4,20.
Las contraindicaciones para laringectomía supraglótica asistida con la TORS incluyen: invasión de los cartílagos cricoides y/o tiroides, invasión bilateral de los cartílagos aritenoides, compromiso de la comisura posterior y anterior, fijación del aritenoides y del pliegue vocal, invasión de la base de lengua cercana a 1 cm de las papilas linguales, pobre reserva pulmonar (VEF1/CFV < 50%)4,20. En resumen, las indicaciones de TORS en laringe son: tumores benignos, cánceres supraglóticos T1, T2 y T3 seleccionados.
- Hipofaringe: el carcinoma de hipofaringe está entre los de más pobre pronóstico, pues las tasas de sobrevida no han mejorado a pesar de los avances en las técnicas de quimio-radioterapia. Recientemente, se ha publicado un artículo que relata la mejoría en la calidad de vida por la preservación del órgano, con la técnica de microcirugía transoral láser (TLM)21. Derivada de esta técnica se ha implementado el uso del robot para la resección de tumores de esta localización, tomando como criterios de inclusión; pacientes con 18 años o más, con indicación quirúrgica y movilidad de al menos un cartílago aritenoides21.
Las contraindicaciones para aplicar esta técnica, en general son las mismas de la cirugía abierta. Así como, el antecedente de tratamiento previo con radioterapia y la presencia de enfermedad avanzada que produzca fijación del pliegue vocal, invasión del cartílago tiroides, compromiso del área poscricoidea o el ápex del seno piriforme. Se recomienda realizar disección de cuello entre 8 a 10 días previos a la TORS, para esta última usar el endoscopio de 30 grados21. Comparativamente con la TLM la visión 3-D con el endoscopio de 0 y 30 grados permite un margen seguro, en especial en la parte más distal de la disección, esto sumado a la versatilidad en la articulación de los instrumentos EndoWrist®, lo que da como resultado una resección geométrica del órgano.
- Primario desconocido: los tumores primarios de origen no conocido en cabeza y cuello siempre han sido un reto mayor para el especialista, ya que usualmente están ocultos en la base de la lengua, en las amígdalas linguales o palatinas. Por lo general su tamaño es menor a 5 mm haciéndolos invisibles a la visualización con imágenes de PET-CT que para el momento actual son el patrón de oro para su detección22. Estos son del 2% al 4% de los escamocelulares de cabeza y cuello, y tradicionalmente su tratamiento es disección de cuello acompañada de quimioterapia y radioterapia de la mucosa del anillo de Waldeyer, lo que deja secuelas de disfagia severa hasta en el 50% de los pacientes acompañada de importante xerostomía14,23.
La identificación del tumor primario oculto puede aumentar la sobrevivencia de 58% al 100% en aquellos pacientes que lo padecen24. Por el contrario, cuando esto no se logra las tasa de sobrevida depende del tamaño del conglomerado ganglionar de cuello, es as como para los N1 es de 69%, para los N2 es de 58% y para los N3 es de 30%25.
En la última década se ha encontrado una alta incidencia de virus de papiloma humano (VPH) presente en los escamocelulares de cabeza y cuello, por lo que la identificación y tipificación del mismo es parte importante del diagnóstico. Este virus está positivo entre el 47% y el 63% de los escamocelulares de orofaringe, y usualmente se anidan en las amígdalas linguales o palatinas, que por su epitelio escamoso reticulado y frágil facilita el depósito del virus y su consecuente infección. Adicionalmente, los tumores VPH positivos muestran predilección por metástasis a ganglios en forma temprana, lo que explicaría la presentación inicial del carcinoma en ganglios del cuello sin una lesión de faringe evidente.
Los escamocelulares VPH positivos tienen propensión por la mucosa de la orofaringe. Por el contrario, los VPH negativos se localizan en la hipofaringe y laringe. En consecuencia, la presencia o ausencia de VPH puede orientar al cirujano en la búsqueda del primario26. Sumado a esto, la determinación de VPH en aspiración con aguja fina (ACAF) de adenopatías de cuello, puede ser una herramienta útil en la decisión terapéutica27.
De acuerdo a lo anterior, una vez se determine la presencia del VPH en los pacientes con primarios ocultos y si la lesión primaria no es detectada en la amígdala palatina, un nuevo enfoque terapéutico, es la resección mediante TORS de la base de la lengua ipsilateral al conglomerado ganglionar posterior a la disección de cuello, con lo cual se puede dejar el manejo con radioterapia adyuvante, sólo para aquellos que tienen ganglios con invasión extracapsular14.
Finalmente, la evaluación de la orofaringe con biopsias asistidas con robot en los pacientes con tumores de primario desconocido, pueden ser mucho más costo-efectivas que las biopsias aleatorias a ciegas del TADS13.
- Apnea obstructiva del sueño: los pacientes que sufren del síndrome de apnea hipopnea obstructiva del sueño (SAHOS), son evaluados con polisomnograma y usualmente son manejados en forma conservadora con equipos que producen presión positiva en la vía área (CPAP: por sus siglas en idioma inglés, Continuous Positive Airway Pressure). El uso de estos dispositivos usualmente deterioran la calidad de vida de los pacientes, no dan una solución definitiva al problema, que por lo general está relacionado con obstrucción de la faringe derivada del colapso de las paredes faríngeas o de la hipertrofia del tejido amigdalino en la base de la lengua.
Para el grupo de Weinstein y OMalley, el uso de la TORS en los pacientes que sufren de este síndrome ha sido de gran utilidad. Proponen amigdalectomía lingual asociada a cirugía de uvulopalatofaringoplastia con una tasa de respuesta quirúrgica del 65% y éxito del 45%, con reducción del índice de apnea-hipopnea de 55,6 a 24,1 (p< 0,001), con aumento de la media de saturación arterial preoperatoria de 75,8% a una media postoperatoria de 81,7% (p=0.013). Con esto concluyen, que esta técnica resulta en una disminución significativa del índice de apnea-hipopnea, con importante aumento de la saturación de oxígeno y de la escala de sueño de Epworth28.
En el reporte de Friedman y cols., al comparar la reducción volumétrica obtenida por la TORS en relación con la radiofrecuencia, la tasa de curación fue de 66,7% para la primera y de 20,8% para la segunda29. Complementando este estudio, está el de Vicini y cols, donde se concluye que la hipertrofia de la base de la lengua en pacientes con SAHOS, puede ser manejada en forma efectiva y segura con TORS30. Este mismo autor refiere que la utilidad de la radiofrecuencia en estos casos, está limitada sólo a obstrucciones leves y para las severas recomienda la TORS. Anota también, que el uso de la TLM para el manejo del SAHOS ha sido abandonado en muchas partes del mundo debido a la dificultad técnica que conlleva realizarla, igualmente por el severo dolor posoperatorio30. Dentro de las ventajas del uso del TORS está la posibilidad de resección multiplanar en cualquier ángulo en una zona de anatomía muy compleja, acompañada de visión en 3-D magnificada, con excelente tolerancia y mínimo dolor para el paciente.
Manejo del cuello
Los órganos del TADS tienen una red linfática intrincada con un drenaje que no siempre es predecible, por lo que aquellos pacientes que sufren de cáncer en esta zona requieren del manejo complementario del cuello como parte fundamental del tratamiento.
Con el advenimiento de técnicas combinadas de quimioterapia y radioterapia para preservación de órgano en estadios localmente avanzados en la pasada década, se ha relegado el manejo quirúrgico a lesiones tumorales que puedan ser resecadas con la técnica de TLM, en su gran mayoría T1 y T2. Por lo general el uso de la radioterapia para el cuello es rutinario con la consecuente morbilidad, restringiendo también las indicaciones de la cirugía abierta a los casos de rescate.
En reciente publicación se describen los patrones de drenaje del TADS31:
- Orofaringe: paladar blando hacia niveles IIA y III bilateralmente, fosas amigdalinas en orden de frecuencia hacia niveles IIA, III, IIB, IV y IIB, base de lengua y paredes faríngeas laterales también en orden de frecuencia hacia niveles IIA, IIB y IV bilateralmente.
- Laringe: la supraglotis es la de mayor drenaje linfático el cual es regularmente hacia los niveles IIA, III y IV de forma cruzada y bilateral.
- Hipofaringe: la mayoría de las lesiones son del seno piriforme que tiene un rico drenaje hacia niveles IIA, III y IV unilateralmente.
Teniendo en cuenta este patrón de drenaje, se hará el manejo del cuello que puede ser de forma electiva o terapéutica dependiendo si existen ganglios positivos o negativos7. Sin embargo, una alternativa es el uso del ganglio centinela, previo mapeo linfático con linfogammagrafía como lo describe Shoaib y colaboradores32. Vermeeren y su grupo, refieren que el uso de SPECT/CT (por sus siglas en idioma inglés: Hybrid Single-Photon Emission Computed Tomography with integrated Computed Tomography), mejora la localización de los ganglios centinelas de la cabeza y el cuello. Especialmente porque disminuye el efecto sombra de la lesión primaria sobre los relevos ganglionares más cercanos, lo que la hace una herramienta muy útil en la evaluación preoperatoria del cuello, y define el manejo del mismo en los pacientes N(0)33.
Existe controversia sobre el momento adecuado para realizar el mapeo linfático en las lesiones del TADS, en especial cuando son tumores localizados en la orofaringe, laringe e hipofaringe. Vigili y cols, proponen un protocolo de linfogammagrafía y ganglio centinela en el mismo día de la resección quirúrgica en los pacientes con cánceres de la cavidad oral34, lo que no es factible en la faringe y laringe por la dificultad para inyectar el radiocoloide a nivel perilesional, con el paciente despierto, una buena alternativa es en la valoración inicial de la lesión primaria bajo anestesia general. La adquisición de imágenes se recomienda realizarla con equipo híbrido de SPECT/CT, que da imágenes anatómicas precisas que contribuyen a definir el tipo de abordaje para el cuello bien sea, disección selectiva, superselectiva o ganglio centinela.
En contraposición, Weinstein siempre practica disección selectiva de cuello de los niveles i a IV en aquellos pacientes con cáncer escamocelular de orofaringe, clínicamente N0 o N135, basado en que el mayor riesgo de metástasis es a los niveles IIA y III. Sin embargo, según esta teoría es razonable realizar sólo disección de superselectiva de estos niveles en aquellos N0, o incluso practicar la técnica de ganglio centinela. Al igual que para el grupo de Aubry, encontramos segura la disección simultánea de cuello durante la TORS9.
En general la recomendación para el manejo del cuello es la disección selectiva o DRMC, 8 a 10 días previos a la cirugía TORS, y en cáncer de amígdala lingual o palatina la ligadura ipsilateral selectiva de las arterias lingual y facial ayuda a disminuir el riesgo de sangrado intraoperatorio y postoperatorio7.
Reconstrucción inmediata
El tema de reconstrucción después de las resecciones practicadas con TORS, ha sido poco discutido. Weinstein y su grupo no la recomendaron inicialmente, y prefirieron la cicatrización por segunda intención en la mayoría de los casos, o a lo sumo, faringoplastia del velo palatino remanente7. Pero en pacientes con radioterapia previa y cirugía de rescate con TORS la cicatrización de segunda intención es mala, por lo que la reconstrucción inmediata es indispensable. Como alternativas están los colgajos locales, los regionales o los injertos libres microvascularizados. Estos ocluyen el defecto comunicante del lecho quirúrgico con el cuello, protegiendo así la arteria carótida, además que mantienen la competencia velopalatina con lo que se mejora la deglución y fonación15,17,36.
Cuidado posoperatorio
Existe muy poco descrito en relación al cuidado posoperatorio específico para TORS. Es muy importante que el cuidado posoperatorio comience desde el mismo momento de la cirugía, por lo que debe existir una comunicación continua entre el equipo quirúrgico y el de anestesia. Durante el manejo posoperatorio inmediato se fijan dos objetivos primordiales, el primero mantener permeabilidad de la vía área y el segundo reinicio temprano de la alimentación.
Al terminar el procedimiento se intercambia el tubo de anestesia argollado por un tubo orotraqueal flexible y no reforzado lo que facilita el cuidado durante su permanencia, que usualmente es de 24 a 48 horas para proteger la vía aérea de la obstrucción por edema o por sangrado. Este último tiene una baja incidencia que es sólo de 5,4%37. Recomendación adicional es el uso de esteroides intravenosos durante el tiempo de intubación.
En aquellos pacientes con cirugías por tumores malignos, se prefiere monitoreo en unidad de cuidado intensivo, bien sea para oxigenación o para soporte ventilatorio cuando sea requerido, a la vez administración de nutrición a través de una sonda flexible para alimentación, hasta el retiro del tubo orotraqueal, posteriormente se continua con dieta blanda por 10 días5. El tiempo de hospitalización en promedio es de 3 días, con lo cual se disminuye la estancia hospitalaria de 7 a 10 días, comparada con la cirugía convencional.
En los casos que requieren de soporte ventilatorio prolongado el uso de traqueostomía temporal es una opción a considerar, y en aquellos con dificultad prolongada para la deglución la gastrostomía se debe realizar tempranamente15,36,38.
Terapia adyuvante
Durante décadas el manejo de los tumores localizados en el TADS han tenido como su piedra angular la radioterapia preoperatoria, postoperatoria, neoadyuvante o adyuvante a quimioterapia, o como único tratamiento. Sin embargo, en el último quinquenio con el advenimiento de la cirugía robótica transoral está planteado un cambio en este paradigma porque se han demostrado resecciones tumorales completas con dicha técnica disminuyendo las indicaciones de radioterapia adyuvante postoperatoria dirigida al lecho tumoral.
En lo referente a radioterapia postoperatoria para el cuello después de disección de cuello, Weinstein y su grupo en publicación de 2010 plantean la inexistencia de aceptación en los criterios para aplicarla35. Por consenso de expertos para ese entonces, se propone no administrarla en casos de disecciones selectivas de cuello, que demostraron pN(0) o pN(+) sin evidencia de extensión extracapsular. En su artículo, Weinstein reportó que el 86% de los pacientes pN1 y que el 30% de los pacientes pN2, no tenían invasión extra-capsular, después de practicarles disección de cuello y TORS para manejo de escamocelulares de orofaringe. Plantea que se puede disminuir el volumen, la dosis o incluso no administrar quimio ni radioterapia en estos casos, con la finalidad de disminuir la dependencia a gastrostomía, derivada de estos tratamientos35.
En general no está claro el tratamiento adyuvante después de disección de cuello y TORS para tumores escamocelulares de orofaringe, por lo que Weinstein y OMalley recomiendan la quimioterapia y la radioterapia simultánea en concordancia con Bernier39, de la European Organisation for Research and Treatment of Cancer40 y de la Radiation Therapy Oncology Group (RTOG)41, en aquellos casos en que se demuestre primero márgenes positivos y luego ganglios del cuello con invasión extracapsular7. En este caso es una buena opción la radioterapia de intensidad modulada (IMRT por sus siglas en idioma inglés, Intensity-Modulated Radiation Therapy), puesto que esta disminuye el riesgo de xerostomía tardía y dependencia a gastrostomía posterior al tratamiento.
Rehabilitación
La rehabilitación está encaminada a lograr pronto reintegro del paciente a sus actividades cotidianas. Por ello, es indispensable conformar un equipo multidisciplinario integrado por terapista respiratoria, terapista física y del lenguaje con alta experiencia en el manejo de trastornos deglutorios y fonatorios. Además se debe contar con profesionales expertos en la rehabilitación nutricional y ocupacional.
Recomendaciones
Una vez realizada esta revisión podemos recomendar el uso de la TORS para acceder a zonas complejas de la cabeza y el cuello, como son la faringe y la laringe, con el fin de manejar alteraciones funcionales y neoplásicas de estas áreas. Siempre y cuando el grupo tratante tenga conocimiento profundo de la anatomía del área y cuente con el entrenamiento adecuado y conozca las indicaciones de su uso, así como el manejo posoperatorio.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. InstitutoNacional de Cancerología (INC). Anuario estadístico 2010. Bogotá: INC; 2012. [ Links ]
2. Weinstein GS, O'Malley Jr BW, Hockstein NG. Transoral robotic surgery: supraglotic laryngectomy in a canine model. Laryngoscope. 2005;115:1315-9. [ Links ]
3. O'Malley Jr BW, Weinstein GS, Snyder E, Hockstein NG. Transoral Robotic surgery (TORS) for base of tongue neoplasms. Laryngoscope. 2006;116:1465-76. [ Links ]
4. Quon H, O'Malley Jr BW, Weinstein GS. Transoral robotic surgery (TORS) for the head and neck: current and future indications. International journal head necksurg. 2010;1(3):133-40. [ Links ]
5. Park YM, Kim WS, Byeon HK, De Virgilio A, Lee SY, Kim S-H. Clinical Outcomes of transoral robotic surgery for head and neck tumors. Ann Surg Rhinol Laryngol. 2013;122(2):73-84. [ Links ]
6. Laccourreye O, Hans S, Menard M, Garcia D, Brasnu D, Holsinger FC. Transoral lateral oropharyngectomy for squamous cell carcinoma of the tonsillar region: II. An analysis of the incidence, related variables, and consenquences of local recurrence. Arch otol head neck surg. 2005;131(7):592-9. [ Links ]
7. Weinstein GS, O'Malley Jr BW, Snyder W, Sherman E, Quon H. Transoral Robotic Surgery: Radical tonsillectomy. Arch otol head neck surg. 2007;133(12):1220-6. [ Links ]
8. Rinaldi V, Pagani D, Toretta S, Pignataro L. Transoral robotic surgery in the management of the head and neck tumors. Ecancer. 2013. DOI: 10.3332/ecancer. 2013.359. [ Links ]
9. Aubry K, Yachine M, Lerat J, Vivent M, Perez AF, Scomparin A. Transoral robotic surgery for the treatment of head and neck cancer of various localizations. Surgical innovation. 2012;19(1):60-6. [ Links ]
10. Genden EM, Desai S, Sung C-K. Robotic surgery for the management of head and neck cancer: Apreliminary experience. Head neck. 2009. DOI: 10.1002/hed. 20972: 283-289. [ Links ]
11. Moore EJ, Olsen SM, Laborde RR, García JJ, Walsh FJ, Price DL, et al. Long-term functional and oncologic results of transoral robotic surgery for oropharyngeal squamous cell carcinoma. Mayo Clinic proceedings. 2012;8(3):219-25. [ Links ]
12. Weinstein GS, Quon H, Newman J, Chalian JA, Malloy K, Lin A, Desai A, et al. Transoral robotic surgery alone for oropharyngeal cancer. Arch Otolaryngol Head Neck Surg. 2012;138(7): 628 -34. [ Links ]
13. Abuzeid WM, Bradford CR, Divi V. Transoral robotic biopsy of the tongue base: a novel paradigm in the evaluation of unknown primary tumors of the head and neck. Head Neck. 2013;35(4):126-30. [ Links ]
14. Mehta V, Johnson P, Tassler A, et al. A new paradigm for the diagnosis and management of unknown primary tumors of the head and neck: a role for transoral robotic surgery. Laryngoscope. 2013. 2012;123(1):146-51. [ Links ]
15. de Almeida JR, Park RC, Genden EM. Reconstruction of transoral robotic surgery defects: principles and techniques. J Reconstr Microsurg. 2012;28(7):465-72. [ Links ]
16. O'Connell DA, Rieger J, Harris JR, Dziegielewski P, Zalmanowitz J, Sylasanko A, et al. Swallowing function in patients with base of tongue cancers treated with primary surgery and reconstructed with a modified radial forearm flap. Arch Otolaryngol Head Neck Surg. 2008;134(8):857-64. [ Links ]
17. Genden EM, Park R, Smith C, Kotz T. The role of reconstruction for transoral robotic pharyngectomy and concomitant neck dissection. Arch Otolaryngol Head Neck Surg. 2011;137(2):151-6. [ Links ]
18. Seikaly H, Rieger J, Zalmanowitz J, Tang JL, Alkahtani K, Ansari K, et al. Functional soft palate reconstruction: a comprehensive surgical approach. Head Neck. 2008;30(12):1615-23. [ Links ]
19. Weinstein GS, OMalley Jr WB, Snyder W, Hockstein NG. Transoral robotic surgery: supraglottic partial laryngectomy. Ann Otol Rhinol Laryngol. 2007;116(1):19-23. [ Links ]
20. Dziegielewski PT, Ozer E. Transoral robotic surgery: supra-glotic laryngectomy. Operative techniques otolaryngology. 2013;24(2):86-91. [ Links ]
21. Park YM, Kim WS, Byeon HK, De Virgilio A, Jung JS, Kim S-H. Feasibility of transoral robotic hypopharyngectomy for early-stage hypopharyngeal carcinoma. Oral oncology. 2010;46:597-602. [ Links ]
22. Cadena E, Angarita E, Estévez JA, Buitrago G. PET-TC en pacientes con tumores de cabeza y cuello. Rev Colomb Cancerol. 2011;15 Supl.1:45-55. [ Links ]
23. Madani I, Vakaet L, Bonte K, Boterberg T, De Neve W. Intensity-modulated radiotherap for cervical lymph node metastases from unknown primary cancer. Int J Radiat Oncol Biol Phys. 2008;71:1158-66. [ Links ]
24. Haas I, Hoffmann TK, Engers R, Ganzer U. Diagnostic strategies in cervical carcinoma of an unknown primary (CUP). Eur Arch Otorhinolaryngol. 2002;259:325-33. [ Links ]
25. Grau C, Johansen LV, Jakobsen J, Geertsen P, Andersen E, Jensen BB. Cervical lymph node metastases from unknown primary tumours. Results from a national survey by the Danish Society for Head and Neck Oncology. Radiother Oncol. 2000;55:121-9. [ Links ]
26. Fischer CA, Kampmann M, Zlobec I, et al. p16 expression in orop-haryngeal cancer: its impact on staging and prognosis compared with theconventional clinical staging parameters. Ann Oncol. 2010;21:1961-6. [ Links ]
27. Begum S, Gillison ML, Nicol TL, Westra WH. Detection of human papillomavirus-16 in fine-needle aspirates to determine tumor origin in patients with metastatic squamous cell carcinoma of the head and neck. Clin Cancer Res. 2007;13:1186-91. [ Links ]
28. Lee JM, Weinstein GS, O'Malley Jr BW, Thaler ER. Transoral robot-assisted lingual tonsillectomy and uvulopalatopharyngo-plasty for obstructive sleep apnea. Ann Otol Rhinol Laryngol. 2012;121:635-9. [ Links ]
29. Friedman M, Hamilton C, Samuelson CG, Kelley K, Taylor D, Pearson-Chauhan K, Maley A, Taylor R, Venkatesan TK. Transoral robotic glossectomy for the treatment of obstructive sleep apnea-hypopnea syndrome. Otolaryngol Head Neck Surg. 2012;146:854-62. [ Links ]
30. Vicini C, Dallan I, Canzi P, Frassineti S, Nacci A, Seccia V, et al. Transoral robotic surgery of the tongue base in obstructive sleep Apnea-Hypopnea syndrome: anatomic considerations and clinical experience. Head Neck. 2012;34:15-22. [ Links ]
31. Cadena E, Sanabria A. Disección ganglionar de cuello conceptos actuales. Rev Colomb Cancerol. 2011;15(3):31-40. [ Links ]
32. Shoaib T, Soutar DS, Macdonald DG, Gray HW, Ross GL. The nodal neck level of sentinel lymph nodes in mucosal head and neck cancer. Br J Plastic Surg. 2005;58:790-4. [ Links ]
33. Vermeeren L, Klop WM, van den Brekel MW, Balm AJ, Nle-weg OE, Valdés-Olmos RA. Sentinel node detection in head and neck malignancies: innovations in radioguided surgery. J Oncol. 2009:681746, doi:10.1155/2009/681746. [ Links ]
34. Vigili MG, Tartaglione SR, Mafera B, Pagan M. Lymphoscinti-graph and radioguided sentinel node biopsy in oral cavity squamous cell carcinoma: same day protocol. Eur Arch Otor-hinolaryngol. 2007;264:163-7. [ Links ]
35. Weinstein GS, Quon H, OMalleyJr BW, Kim GG, Cohen MA. Selective neck dissection and deintensified postoperative radiation and chemotherapy for oropharyngeal cancer: a subset analysis of the University of Pennsylvania transoral robotic surgery trial. Laryngoscope. 2010;120(9):1749-55. [ Links ]
36. Hans S, Jouffry T, Veivers D, Hoffman C, Girod A, Badoual C, Rodriguez J, Brasnu D. Transoral robotic-assiste free flap reconstruction after radiation therapy in hypopharyngeal carcinoma: report of two cases. Eur Arch Otorhinolaryngol. 2013;270:2359-64. [ Links ]
37. Pollei TR, Hinni ML, Moore EJ, Hayden RE, Olsen KD, Casler JD, et al. Analysis of postoperative bleeding and risk factors in transoral surgery of the oropharynx. JAMA Otolaryngol Head Neck surg. 2013;139(11):1212-8. [ Links ]
38. Hans S, Delas B, Gorphe P, Menard M, Brasnu D. Transoral robotic surgery in head and neck cancer. Eur Ann Otorhinolaryngol Head Neck Dis. 2012;129:32-7. [ Links ]
39. Bernier J, Cooper JS, Pajak TF, et al. Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (#9501). Head Neck. 2005;27(10):843-50. [ Links ]
40. Bernier J, Domenge C, Ozsahin M, et al. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med. 2004;350(19):1945-52. [ Links ]
41. Coope JS, Pajak TF, Forastiere AA, et al. Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med. 2004;350(19):1937-44. [ Links ]













