Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cancerología
Print version ISSN 0123-9015
rev.colomb.cancerol. vol.19 no.1 Bogotá Jan./Mar. 2015
https://doi.org/10.10167j.rccan.2014.10.001
http://dx.doi.org/10.10167j.rccan.2014.10.001
Original
Experiencia clínica en el tratamiento adyuvante de los pacientes con melanoma de tronco y extremidades estado III en un hospital del Tercer Mundo
Clinical experience with adjuvant treatment of patients with Stage III melanoma of the trunk and extremities in a developing country
Mauricio Garcíaa,*, Sandra Díaza, Angélica Gutiérreza,b, Jesús Sánchezb y Ricardo Sánchezc
a Clínica de Seno y Tumores de Tejidos Blandos, Instituto Nacional de Cancerología, Bogotá D.C., Colombia
b Residente Mastología, Fundación Universitaria Ciencias de la Salud, Bogotá D.C., Colombia
c Grupo de Investigación Clínica, Instituto Nacional de Cancerología, Bogotá D.C., Colombia
* Autor para correspondencia. Correo electrónico: maurogmora@hotmail.com (M. García).
Recibido el 9 de diciembre de 2013; aceptado el 13 de octubre de 2014 Disponible en Internet el 15 de diciembre de 2014
Resumen
Objetivos: describir la experiencia del uso de interferón adyuvante en altas dosis en pacientes con melanoma de tronco y extremidades estadio III y establecer las causas por las que los pacientes con indicación del tratamiento adyuvante no lo recibieron, así como la toxicidad y los principales desenlaces.
Materiales y métodos: se trata de una cohorte retrospectiva de pacientes con diagnóstico de melanoma de tronco y extremidades, que fueron llevados a tratamiento quirúrgico de la lesión primaria y vaciamiento ganglionar durante 10 años en el INC (1999-2009) y que tenían indicación de tratamiento adyuvante con interferon.
Resultados: se identificaron 88 pacientes con melanoma de tronco y extremidades estado clínico ni, de los cuales 50 (56,8%) recibieron tratamiento adyuvante con Interferón. Entre las principales razones por las cuales los 38 pacientes restantes no lo recibieron se encontraban la edad y comorbilidades asociadas (21), consulta diferida a oncología (5), decisión del oncólogo clínico (5). Solo el 36% (18) pacientes recibió el interferón por más de 10 meses y el 62% (N = 31) de los pacientes suspendió el tratamiento por progresión de la enfermedad (N = 16, 51,6%) y 25 pacientes (28,4%) presentaron toxicidad grado III. Se encontró una menor tasa de incidencia de recaídas en el grupo que recibió el medicamento.
Conclusión: en esta cohorte se encontró que los pacientes con melanoma estado III que recibieron tratamiento adyuvante con interferón tenían una menor tasa de recaída y una mejor supervivencia libre de enfermedad, lo cual se relaciona con lo reportado en la literatura.
Palabras clave: Tratamiento adyuvante; Melanoma; Interferón.
Abstract
Objectives: To describe the experience with the use of adjuvant high-dose interferon in patients with stage III melanoma of the trunk and extremities, establishing the causes why patients with an indication of adjuvant treatment did not receive it, as well as major toxicity and outcomes.
Materials and Methods: This is a retrospective study of a cohort of patients diagnosed with melanoma of the trunk and extremities, who were subjected to surgical treatment of the primary lesion and lymph node dissection in the INC over a ten-year period (1999-2009), and who had an indication for Interferon adjuvant treatment.
Results: A total 88 patients were diagnosed with Stage III melanoma of the trunk and extremities, of whom 50 (56.8%) were identified to have received adjuvant treatment with interferon. Among the main reasons why the remaining 38 patients did not receive it were, age and associated comorbidities (21), delayed oncology consultation (5), and decision of medical oncologist (5). Only 36% (18) patients received interferon for more than 10 months, and 62% of patients (N = 31) discontinued treatment. The main reason for suspending treatment was disease progression (N = 16, 51.6%), and 25 patients had grade III toxicity. A lower incidence of relapse was found in the group receiving the drug.
Conclusion: In this cohort it was found that patients with stage III melanoma receiving adjuvant interferon therapy had a lower relapse rate and better disease-free survival, which is in agreement with that reported in the literature.
Keywords: Adjuvant therapy; Melanoma; Interferon.
Introducción
El melanoma es el cáncer de piel más frecuente después del carcinoma basocelular y el carcinoma escamocelular, con una mortalidad cercana al 80%. La incidencia mundial es de 2,8 por cada 100.0001,2. En Colombia, la incidencia global es de 2,2 por cada 100.0001,2, y según el Anuario Estadístico del INC para 2010 representó el 9,2% de los tumores de piel, con una frecuencia de 44 casos en hombres y 73 casos en mujeres3.
En Colombia se carece de información sobre la presentación clínica de esta enfermedad, de tal manera que no se conocen datos sobre: estadificación clínica, factores pronósticos, tratamientos recibidos, supervivencia, etc. Pese a esto, en el INC la mayoría de los pacientes que ingresan a la consulta se encuentran en estados clínicos avanzados.
Los estados clínicos I y II corresponden a la enfermedad localizada, con una supervivencia a 5 años entre el 53 al 97%. El estado clínico III, corresponde al compromiso regional ganglionar, con una supervivencia a 5 años que varía entre el 40 al 78%4.
El interferón alfa-2b es una glucoproteína del grupo de las citoquinas con acción antirretroviral pues interfiere con su replicación a través de la regulación de la presentación antigénica sobre la superficie celular. Además, estimula las células "natural killer" y los linfocitos B, confiriendo mayor actividad immune, lo que se constituye en la base de la hipótesis de su efecto sobre las micrometástasis encargadas de la diseminación a distancia4-6. Este medicamento es el tratamiento adyuvante estándar en melanoma estados IIB-III, aprobado por la FDA en 1995, a raíz de los resultados del estudio ECOG 1684 que comparó altas dosis de interferón versus observación en 287 pacientes, con mediana de seguimiento de 4,8 años, encontrando beneficio en la supervivencia libre de enfermedad (SLE), y en la supervivencia global (SG), aunque, en la actualización se perdió el beneficio en este último desenlace7-9.
El EORTC 18991 comparó interferón pegilado por 5 años versus observación en pacientes con estado III, encontrando beneficio absoluto del 6,7% para el grupo de tratamiento en supervivencia libre de enfermedad, pero no en supervivencia global. Igualmente se observó mayor beneficio en los pacientes cuyos tumores se encontraban ulcerados y en los que el centinela mostró micrometástasis10. Se reportó toxicidad grado III y IV en 45% de los pacientes que recibieron interferón por periodo prolongado versus 12% en grupo de observación, siendo la fatiga la más frecuente con un 16%9,11.
El EORTC 18952, reportó toxicidad grado III y IV, siendo más frecuente síntomas de influenza en el 21% de los pacientes que recibieron tratamiento de interferón por 13 meses vs. 20% el grupo de tratamiento por 25 meses vs. el 3% en el grupo de observación12. En el estudio DeCOG se registró toxicidad grado III y IV en el 9% de los pacientes13, y en el estudio de Stadler se reportó toxicidad grado III y IV en el 2,9%14.
Según los datos del meta-análisis del 2010, que incluyó 14 estudios clínicos controlados en donde se valoró el beneficio del interferón en altas dosis en la supervivencia libre de enfermedad, se encontró un efecto favorable con significancia estadística a favor del tratamiento (HR de 0,82, IC 95% = 0,77 a 0,87; p< 0,001). En cuanto a la supervivencia global, hubo también beneficio con significancia significativa (HR de 0,89, IC 95% = 0,83 a 0,96; p = 0,002)15.
El metanálisis del 2012, por su parte, en donde incluyeron los pacientes de los estudios del EORTC 18991 y del EORTC 18952, se encontró beneficio de la terapia con el medicamento en la supervivencia libre de enfermedad (HR 0,85, IC 95% = 0,76-0,95; p = 0,004), pero no en la supervivencia global (HR0,94, IC 95% = 0,80- 1,11; p = 0,36)10.
Teniendo en cuenta la falta de información sobre este tipo de tumor en el país y particularmente en el INC, se realizó esta cohorte retrospectiva con el objetivo de describir la experiencia con el uso de la terapia con interferón adyuvante en altas dosis en los pacientes con melanoma de tronco y extremidades estadio III. Asimismo, establecer: las causas por las que los pacientes con indicación del tratamiento adyuvante no lo recibieron; las causas por las que el medicamento se suspendió; la toxicidad asociada al tratamiento, y los desenlaces de seguimiento en cuanto a recidiva tumoral y supervivencia. Se incluyeron pacientes atendidos durante una década (1 de enero de 1999 hasta el 31 de diciembre de 2009).
Materiales y métodos
Se describe una cohorte retrospectiva de pacientes con diagnóstico de melanoma de tronco y extremidades y que fueron llevados a tratamiento quirúrgico de la lesión primaria y de las cadenas ganglionares. Se realizó una búsqueda en el servicio de vigilancia epidemiológica de los números de registro del CIE 10 de los códigos de melanoma de tronco y extremidades (C43.5, C43.6, C43.7), desde 1999 a 2009. Luego se cruzó dicha información con los registros de los libros de programación quirúrgica del servicio de mama y tejidos blandos, los archivos de reportes de patología, al igual que el sistema de historias clínicas del hospital (SAP), para así identificando 88 historias clínicas para revisar. El criterio de inclusión fue considerar historias clínicas de pacientes con diagnóstico de melanoma de tronco y extremidades que fueron llevados a resección quirúrgica del tumor primario y vaciamiento ganglionar por el servicio de mama y tejidos blandos en la década de 1999 a 2009 y cuyo procedimiento quirúrgico fue realizado en la INC caracterizando los pacientes que recibieron y no recibieron interferón.
Se elaboró un formato de recolección de la información que incluía las variables demográficas, clínicas y de seguimiento relevantes para el estudio. La información fue almacenada en una base de datos diseñada exclusivamente para fines del estudio.
Para el análisis estadístico se utilizaron herramientas descriptivas (medias y desviación estándar para variables continuas y porcentajes para variables categóricas). Se estimaron tasas de incidencia de mortalidad y de supervivencia libre de enfermedad para los pacientes que recibieron interferón y los que no. Los datos fueron analizados con el programa Stata 11®. El presente estudio fue aprobado por el Comité de Ética del INC.
Resultados
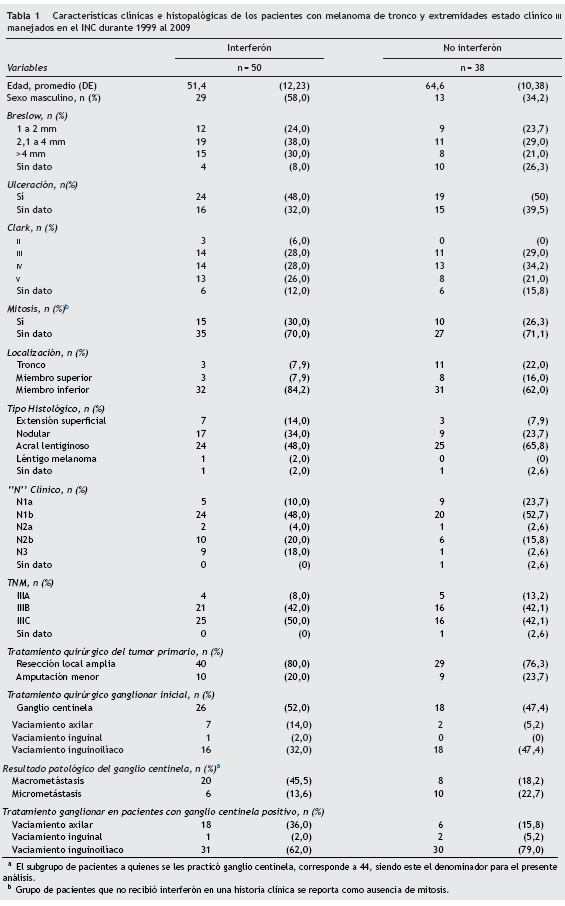
Se identificaron 88 pacientes con diagnóstico de melanoma de tronco y extremidades estado III, manejados en el INC con resección del tumor primario y disección ganglionar durante la década comprendida entre 1999 y 2009. De los cuales 50 habían recibido tratamiento adyuvante con interferón y los 38 restantes no.
La edad promedio de la cohorte fue 57,1 años (DE 13,2 años), con un rango entre los 28 y los 80 años. El rango de edad para el grupo de pacientes que recibió interferón fue entre 22 y 69 años y para el grupo que no recibió el tratamiento con el medicamento estuvo entre 38 y 80 años (tabla 1).
En la mayoría de los pacientes de esta serie el tumor se encontraba localizado en el miembro inferior (N = 63, 71,6%) seguido por tronco (N = 14, 15,9%). En dicha muestra el tipo histológico más frecuente fue el acral lentiginoso en un 55,7% (N=49) (tabla 1). De los 88 pacientes incluidos en esta cohorte, el 52% presentó complicación postquirúrgica.
Dentro del grupo de pacientes que recibieron interferón, la complicación local más frecuente fue la infección del sitio operatorio (10 pacientes), 8 pacientes presentaron seroma y 5 mostraron necrosis de los colgajos. En el grupo que no recibió el medicamento se presentaron: 10 casos de infección del sitio operatorio, 5 casos de necrosis de colgajos y 2 casos de seroma.
Las razones por las cuales los 38 pacientes no recibieron interferón fueron en orden de frecuencia: edad17; consulta diferida a oncología (5 pacientes); ganglio centinela positivo con vaciamiento ganglionar negativo (4 pacientes, en los cuales no se indicó por decisión del oncólogo); no aceptación de tratamiento (4 pacientes); comorbilidades asociadas (4 casos); decisión de únicamente radioterapia por concepto de oncología (1 paciente); situación social (2 pacientes), y problemas administrativos con la EPS (1 paciente).
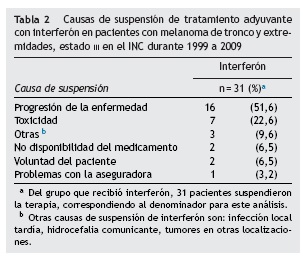
La mediana de tiempo para los 50 pacientes en los cuales se ordenó, entre el procedimiento quirúrgico ganglionar definitivo y el inicio de interferón, fue de 59 días. En relación con el tiempo recibido de tratamiento, 15 pacientes lo recibieron durante 3 meses (30%), 12 pacientes lo recibieron entre 4 y 6 meses (24%), 5 pacientes entre 7 y 9 meses (10%) y 18 pacientes entre 10 y 12 meses (36%). El 62% de los pacientes suspendió el tratamiento (N = 31). La principal causa para suspender el tratamiento fue progresión de la enfermedad (N = 16, 51,6%) (tabla 2).
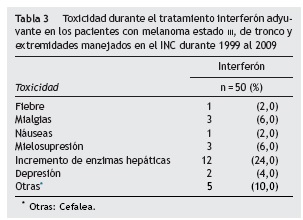
Un total de 25 pacientes presentaron toxicidad grado III. Estos pacientes aportaron 27 eventos de toxicidad y un paciente presentó simultáneamente mielo supresión e incremento de enzimas hepáticas y la elevación de enzimas hepáticas más frecuente fue la toxicidad grado III (tabla 3).
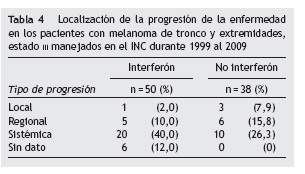
Del total de pacientes del estudio, 45 presentaron progresión. De 30 pacientes con progresión sistémica, 2 presentaron simultáneamente progresión local y 4 progresión regional. En el grupo de pacientes que recibió interferón, 2 presentaron simultáneamente progresión en más de un sitio, mientras que en el grupo que no recibió tratamiento hubo 3 casos (tabla 4).
En cuanto a los sitios de progresión sistémica para el total de pacientes, la localización más frecuente fue pulmón (14 pacientes) e hígado (7 pacientes) (tabla 4).
La mediana de seguimiento fue la siguiente: para toda la serie fue de 24 meses, para el grupo con tratamiento con interferón fue de 24,7 meses y para el grupo sin el tratamiento adyuvante fue de 18,3 meses.
En relación con la condición final del paciente en el grupo que recibió tratamiento con interferón se pudieron seguir 35 pacientes y concluyendo lo siguiente: 11 pacientes vivos sin enfermedad (31%), 4 pacientes vivos con enfermedad (11%), 18 pacientes muertos por causa de la enfermedad (51,4%) y 2 pacientes que fallecieron por otra causa (5,8%).
En el grupo de pacientes que no recibió la terapia farmacológica con interferón, se pudieron seguir solo 20 pacientes, de los cuales 9 (45%) están vivos sin enfermedad, 1 paciente (5%) vivo con enfermedad y 10 pacientes (50%) que fallecieron por causa de la enfermedad.
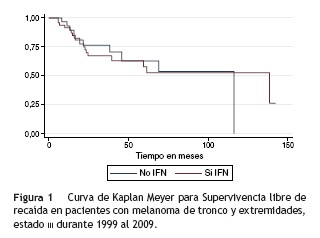
La tasa de incidencia de recaída en el total de la serie fue de 3,18 recaídas por 100 pacientes/mes. En el grupo de interferón la tasa fue de 2,85 recaídas por 100 pacientes/mes y en el que no recibió interferón la tasa fue de 3,7. La mediana de supervivencia libre de enfermedad fue la siguiente; para el total de la población del estudio fue de 13,7 meses; para el grupo de interferón de 18,17 meses, y para el grupo que no recibió el tratamiento fue de 11,4 meses (fig. 1).
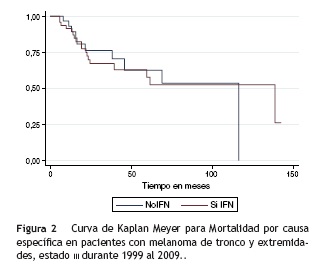
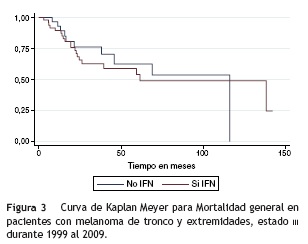
La mediana de supervivencia global por causa específica para el total de la población fue de 116,2 meses: para el grupo de tratamiento con interferón fue de 138,5 meses y para los que no recibieron interferón fue de 116,2 meses (fig. 2). La mediana de supervivencia global por causa general para la población total del estudio fue de 116,2 meses: para el grupo de interferón fue de 61,5 meses y para el grupo que no lo recibió fue de 116,2 meses (fig. 3).
La tasa de incidencia de mortalidad por causa específica para toda la población del estudio fue de 0,83 muertes por 100 pacientes/mes. En el grupo de interferón la tasa fue de 0,88 muertes por 100 pacientes/mes y para el grupo de no interferón la tasa fue de 1,76 muertes por 100 pacientes/mes.
La tasa de incidencia de mortalidad por causa general para toda la población del estudio fue de 0,89 muertes por 100 pacientes/mes; para el grupo de tratamiento con interferón fue de 0,98 muertes por 100 pacientes/mes y para el grupo de no tratamiento con interferón fue de 0,76 muertes por 100 pacientes/mes.
Discusión
La mayoría de los pacientes que ingresan al INC con diagnóstico de melanoma de tronco y extremidades estado , tienen una alta carga tumoral con lesiones primarias de gran tamaño, ulceradas (48,9%), y son pacientes con melanoma acral lentiginoso (55,7%), a diferencia de la población caucásica en donde predomina el melanoma de extensión superficial (70%)16"18.
En la actual clasificación propuesta para melanoma, según la AJCC del 2010, la presencia de mitosis juega un papel en cuanto a las características histológicas y como factor pronóstico. Sin embargo, en este estudio se encontró ausencia de información en 62 casos porque este factor pronóstico no estaba incluido en la clasificación anterior.
En la mitad de los pacientes del estudio se realizó ganglio centinela y en el 13,6% de los pacientes en el grupo de interferón se documentó micrometástasis y el 22,7% en el grupo que no recibió el medicamento adyuvante. En el ECOG 1684 el 61% de los pacientes presentaron recurrencia ganglionar y el 14% presentaron enfermedad clínica ganglionar primaria7. En el ECOG 1684, el 44% de los pacientes tenían micrometástasis en el grupo de interferón. En el EORTC 18991, el 43% del grupo de tratamiento y el 43% del grupo de observación tenían reporte de micrometástasis10,11. Hay que resaltar que el 50% de la población de este estudio ingresa con enfermedad ganglionar clínica. Eggermont reportó enfermedad clínica al ingreso en el 57% de los pacientes11.
Los pacientes que usualmente ingresan al INC son de bajo nivel socioeconómico, por lo que la adherencia a tratamientos adyuvantes es menor en relación a otros centros y siendo una de las razones para no recibir el año completo de tratamiento adyuvante. En esta serie únicamente el 36% de los pacientes completó el tratamiento con interferón entre los 10 y 12 meses, a diferencia del resultado del ECOG 1684 en donde el 80% de los pacientes culminó la terapia según el periodo planeado7.
En el 62% de los pacientes de esta cohorte se suspendió el tratamiento, teniendo como principal causa la progresión de la enfermedad en un 51,6% de los casos. Pectásides en su estudio reportó suspensión del tratamiento en un 30% de los pacientes y como principal motivo para ello la progresión de la enfermedad (68%) y en el estudio de Eggermont, el 31% de los pacientes suspendieron la terapia farmacológica por toxicidad11,19.
En el grupo de pacientes que recibió interferón, el 50% presentó toxicidad grado asociada al tratamiento, siendo la más frecuente elevación de las enzimas hepáticas (24%), mientras que Mao en su estudio reportó como toxicidad grado más frecuente la leucopenia (14%)20. Por su parte, Eggermont reportó toxicidad grado en el 45%11 siendo la más frecuente la fatiga en el 25%, mientras que la elevación de las enzimas hepáticas solo se presentó en el 13%. En el estudio de ECOG se presentó toxicidad grado en el 9%20. Se destaca que en esta serie, la de este estudio del INC, ningún paciente del grupo de tratamiento recibió ajuste de dosis durante el periodo de administración de interferón, pero sí suspensión del medicamento mientras se restauraba su condición clínica para reiniciarlo.
La literatura ha documentado que el mayor beneficio de interferón se observa en los pacientes con micrometástasis, según los resultados del EORTC 1899110,11. En nuestro estudio no se observó dicho hallazgo y algunos pacientes con presencia de micrometástasis no recibieron el medicamento, sin embargo, dado el momento histórico del estudio, la evidencia no era contundente como la actual para la administración de interferón adyuvante en este subgrupo.
Los ensayos clínicos en melanoma que han evaluado el tratamiento adyuvante con interferón muestran un beneficio en la supervivencia libre de enfermedad, con un HR de 0,76 (IC 95% = 0,67 a 0,87); p = 0,00019. En el estudio de Eggermont también se reportó beneficio en este desenlace, con un HRde 0,82, (IC 95% = 0,77 a 0,87); p< 0,001. Algunos estudios no han mostrado beneficio con significancia estadística en la supervivencia global, exceptuando el metaanálisis de Mocellin que para los pacientes que recibieron interferón documentó beneficio en supervivencia global15. En este estudio, se presentó una mayor mayor tasa de incidencia de recaída para el grupo que no recibió el tratamiento con interferón.
El estudio efectuado reveló el comportamiento epidemiológico de los pacientes con diagnóstico de melanoma de tronco y extremidades estado clínico , que recibieron el manejo quirúrgico en el INC y la adyuvancia con interferón. Las fortalezas del mismo están encaminadas al conocimiento de las características de: la histología, la clínica de los pacientes, los eventos asociados al uso del medicamento y las causas de suspensión del mismo. Pese a esto, sus limitaciones están asociadas a las propias de los estudios descriptivos que son dadas por: el pequeño tamaño de la muestra; la ausencia de múltiples datos en las historias clínicas, al igual que pérdidas en el seguimiento de los pacientes. Además, aunque se incorporaron los pacientes que habían recibido la terapia farmacológica en la adyuvancia y los que no la recibieron, no hubo intención analítica si no descriptiva por lo que este estudio se constituye en base para futuras investigaciones, y pese a que el diseñno del presente no se puede equiparar el beneficio del tratamiento con interferón, se tiene una aproximación dada la menor tasa de incidencia de recaídas en el grupo que recibió el tratamiento con el medicamento.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes. Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Dr. Javier Ángel Aristizábal
Dr. Oscar García
Dr. Carlos Lehmann
Dr. Carlos Duarte
Dr. Luis Guzmán
Dra. Magda Alba
Dr. César Piñneros.
Bibliografía
1. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. GLO-BOCAN 2008 v2.0, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 10 [Internet]. Lyon, Francia: International Agency for Research on Cancer; 2010. Disponible en: http://globocan.iarc.fr.
2. Acosta AE, Fierro E, Velásquez VE, Rueda X. Melanoma: patogénesis, clínica e histopatología. Rev Asoc Col Dermatol.2009;17(2):87-108. [ Links ]
3. República de Colombia, Ministerio de Salud y Protección Social, Instituto Nacional de, Cancerología., Anuario Estadístico 2010. Bogotá: Legis; 2010. [ Links ]
4. Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL, Troty Andy. AJCC Cancer Staging Manual. 7 ed. Chicago: Springer; 2010. [ Links ]
5. Tarhini AA, Kirkwood J. Clinical and Immunologic Basis of Interferon Therapy in Melanoma. Ann N Y Acad Sci. 2009;1182:47-57. [ Links ]
6. Lens M. Cutaneous melanoma: interferon alpha adjuvant therapy for patients at high risk for recurrent disease. Dermatol Ther. 2006;19(1):9-18. [ Links ]
7. Kirkwood JM, Strawderman MH, Ernstoff MS, Smith TJ, Borden EC, Blum RH. Interferon alfa-2b adjuvant therapy of high-riskresected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol. 1996;14(1):7-17. [ Links ]
8. Kirkwood JM, Manola J, Ibrahim J, Sondak V, Ernstoff MS, Rao U. A pooled analysis of Eastern Cooperative Oncology Groupand intergroup trials of adjuvant high-dose interferon for melanoma. Clin Cancer Res. 2004;10(5):1670-7. [ Links ]
9. Petrella T, Verma S, Sipthoff K, Quirt I, McCready D. Adjuvantinterferon therapy for patients at high risk for recurrent melanoma: an updated systematic review and practice guideline. Clin Oncol. 2012;24(6):413-23. [ Links ]
10. Eggermont AM, Suciu S, Testori A, Kruit WH, Mardsen J, Punt CJ, et al. Ulceration and stage are predictive of interferon efficacy in melanoma: Results of the phase III adjuvant trials EORTC 18952 and EORTC 18991. Eur J Cancer. 2012;48(2):218-25. [ Links ]
11. Eggermont AM, Suciu S, Santinami M, Testori A, Kruit WH, Marsden J, et al. Adjuvant therapy with pegylated interferonalfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomized phase III trial. Lancet. 2008;372(9633):117-26. [ Links ]
12. Eggermont AM, Suciu S, Mackie R, MacKie R, Ruka W, Testori A, et al. Post-surgery adjuvant therapy with intermediate dosesof interferon alfa 2 b versus observation in patients with stageIIb/III melanoma (EORTC 18952): randomized controlled trial. Lancet. 2005;366(9492):1189-96. [ Links ]
13. Garbe C, Radny P, Linse R, Dummer R, Gutzmaer R, Ulrich J, et al. Adjuvant low-dose interferon {alpha}2a with or withoutdacarbazine compared with surgery alone: a prospective-randomized phase III DeCOG trial in melanoma patients withregional lymph node metastasis. 2008;19(6):1195-201.
14. Stadler R, Luger T, Bieber T, Köhler U, Linse R, Technau K, et al. Longterm survival benefit after adjuvant treatment ofcutaneous melanoma with dacarbazine and low dose naturalinterferon alpha: a controlled, randomized multicenter trial. Acta Oncol. 2006;45(4):389-99. [ Links ]
15. Mocellin S, Pasquali S, Rossi C, Nitti D. Interferon alphaadjuvant therapy in patients with high-risk melanoma: asystematic review and meta-analysis. J Natl Cancer Inst.2010;102(7):493-501. [ Links ]
16. Pollitt RA, Clarke CA, Swetter SM, Peng DH, Zadnick J, Cockburn M. The expanding melanoma burden in Carlifornia hispanics: importance of socioeconomic distribution, histologic subtype, and anatomic location. Cancer. 2011;117(1):152-61. [ Links ]
17. Linos E, Swetter SM, Cockburn MG, Colditz GA, Clarke CA. Incresing burden of melanoma in the United States. J Invest Dermatol. 2009;129(7):1666-74. [ Links ]
18. Shin S, Palis BE, Phillips JL, Stewart AK, Perry RR. Cutaneousmelanoma in Asian-Americans. J Surg Oncol. 2009;99(2):114-8. [ Links ]
19. Pectasides D, Dafni U, Bafaloukos D, Skarlos D, Polyzos A, Tsoutsos D, et al. Randomized phase III study of 1 month versus 1 year of adjuvant high-dose interferon alfa-2b in patientswith resected high-risk melanoma. J Clin Oncol. 2009;27(6):939-44. [ Links ]
20. Mao L, Si L, Chi Z, Cui C, Sheng X, Li S, et al. A randomised phase II trial of 1 month versus 1 year of adjuvant high-dose interferon α-2b in high-risk acral melanoma patients. Eur J Cancer.2011;47(10):1498-503. [ Links ]