Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cancerología
versión impresa ISSN 0123-9015
rev.colomb.cancerol. vol.19 no.2 Bogotá abr./jun. 2015
https://doi.org/10.10167j.rccan.2015.02.002
http://dx.doi.org/10.10167j.rccan.2015.02.002
Revisión
Desenlaces clínicos en hematoncología: diez años de investigaciones en Pubmed
Clinical outcomes in Hemato-Oncology: Ten year Pubmed literature review
Diego Rosselli*, Carlos Eduardo Díaz y Laura Gutiérrez
Departamento de Epidemiología Clínica y Bioestadística, Facultad de Medicina, Pontificia Universidad Javeriana, Bogotá D.C., Colombia
* Autor para correspondencia. Correo electrónico: diego.rosselli@gmail.com (D. Rosselli).
Recibido el 14 de julio de 2014; aceptado el 3 de febrero de 2015 Disponible en Internet el 11 de abril de 2015
Resumen
Objetivo: Determinar cuáles son los desenlaces clínicos empleados en los estudios fase III de tratamiento de neoplasias hematoncológicas y qué proporción de ellos emplean supervivencia global como desenlace primario.
Método: Mediante una búsqueda en Pubmed, analizar todos los experimentos clínicos aleatorios publicados en los últimos 10 años, de tratamientos de novo, en población adulta.
Resultados: La búsqueda inicial arrojó 310 referencias, entre las que se seleccionaron 90 estudios clínicos. La enfermedad más estudiada fue mieloma múltiple, con 29 estudios, seguida de linfoma no Hodgkin, con 26. Las otras fueron: leucemia mieloide aguda (12), leucemia linfocítica crónica (10), leucemia mieloide crónica (8), síndromes mielodisplásicos (3) y linfoma de Hodgkin (2). En 20 estudios (22%) se empleó la supervivencia global como desenlace primario (en solo 3 de ellos alcanzó significación estadística), en 37 más (41%) se agrupó con otros desenlaces para conformar un desenlace compuesto. En 55 estudios (61%) la supervivencia global fue un desenlace secundario.
Conclusiones: Aunque la supervivencia global es el estándar de oro en terapia oncológica, los desenlaces agrupados u otros, como tiempo libre de enfermedad o indicadores paraclínicos de actividad de la enfermedad, son más empleados, quizá por ser buenos predictores y requerir muestras y seguimientos menores. Su capacidad para predecir supervivencia global (en algunos casos calidad de vida) debe ser validada. Solo en las formas más agresivas de cáncer se justifica usar de rutina la supervivencia global como el desenlace primario.
Palabras clave: Mieloma múltiple; Leucemias; Linfomas; Estudios clínicos aleatorizados; Oncología; Desenlaces intermedios; Supervivencia global.
Abstract
Objective: To describe the clinical outcomes used in phase III studies in Hematology-Oncology malignancies, and to determine what proportion use overall survival as the primary outcome. Methods: Using a systematic literature search in PubMed, an analysis was made of phaseIII randomized clinical trials with de novo treatments of hematology-oncological neoplasias in adult populations published in the last 10 years.
Results: The initial search yielded 310 references, 90 of which were finally selected. The overall survival rate was used in 20 studies (22%) as the primary outcome (in 3 of them it reached statistical significance). Grouped intermediate outcomes were used in 37 others (41%). As a secondary outcome the overall survival rate was used in 55 studies (61%). Among the intermediate outcomes used were, response rates, disease-free or relapse-free survival rates, and progression-free survival rate. Multiple myeloma was the most studied disease, with 29 studies (32%), followed by non-Hodgkin lymphoma (28%).
Conclusions: Although overall survival rate is the gold standard in cancer therapy, it is not the most often used outcome. Intermediate outcomes, such as disease-free survival or biomarkers are often good predictors, and require smaller samples and less follow-up time. Nevertheless, their predictive capacity for overall survival rate (or, in some cases, quality of life) should also be assessed. The use of the overall survival rate as the routine primary outcome is only justified in the most aggressive forms of cancer.
Keywords: Multiple myeloma; Leukemia; Lymphoma; Randomized controlled trial; Medical oncology; Intermediate endpoints; Survival Rate.
Introducción
El estudio de los desenlaces de las intervenciones en salud se ha convertido en un tema de gran interés1. De hecho, toda una nueva disciplina denominada «investigación de resultados» (outcomes research) ha surgido alrededor de la necesidad de describir, interpretar y predecir el impacto de las intervenciones en salud, en unidades que sean clínicamente significativas, que sean comparables de una intervención a otra, y que sean relevantes para los tomadores de decisiones (desde pacientes hasta pagadores de servicios)2. Se pueden distinguir desenlaces biomédicos, clínicamente evaluables, y no-biomédicos, como son los desenlaces económicos y los relacionados con las percepciones de los pacientes3.
Adicionalmente existen desenlaces finales –también llamados fuertes– , como la reducción en mortalidad o supervivencia libre de enfermedad, y los desenlaces intermedios y clínicos. Los marcadores biológicos y la reducción macroscópica de tumores son, respectivamente, algunos ejemplos. Los desenlaces clínicos se definen como aquellos indicadores utilizados en investigación clínica enfocados en el paciente (funcionalidad, sentimientos y modo de supervivencia)4.
El desarrollo de la investigación en desenlaces en oncología se ha dispuesto en un modelo con 3 enfoques: macronivel, el cual analiza a nivel poblacional aspectos relacionados con la calidad de vida asociada a estados de salud y carga económica; mesonivel, que incluye desde estudios que miden eficacia y efectividad de las intervenciones en cáncer hasta evaluaciones económicas, y micronivel, donde se enfatiza en la interacción médico-paciente durante la toma de decisiones y el uso de herramientas para definir perfiles de riesgo5.
Muchos de los estudios a largo plazo en oncología buscan modificar la mortalidad general (o su inverso, la supervivencia global) de los pacientes tratados3. Hay, sin embargo, numerosas razones prácticas para que los estudios clínicos busquen otros desenlaces «intermedios», que pueden ser signos clínicos o paraclínicos (por ejemplo, mediante imágenes diagnósticas, resultados de patología o pruebas inmunológicas)6. Entre las razones para usar desenlaces intermedios está el hecho de que el tamaño de la muestra y el tiempo de seguimiento necesarios para demostrar cambios estadísticamente significativos sobre la mortalidad general son mucho mayores que si se plantean desenlaces intermedios7. Además, en muchos de los estudios clínicos, por razones éticas, los pacientes asignados al «grupo control» también terminan recibiendo la intervención de interés una vez se demuestra su superioridad terapéutica. Ello lleva a que las diferencias de supervivencia global desaparezcan o se reduzcan, y a que se incentive la búsqueda de predictores de mortalidad antes de que el desenlace sea inevitable8. A pesar de estas ventajas, los desenlaces intermedios reflejan un beneficio indirecto de las terapias utilizadas en los estudios clínicos, mientras que los desenlaces fuertes o clínicamente importantes son una medida directa9. Para la validación de un desenlace intermedio en la práctica clínica, debe existir evidencia de que este predice el efecto de la intervención terapéutica sobre desenlaces fuertes o clínicamente importantes, y que este efecto debe ser mediado directamente por el desenlace intermedio10.
La supervivencia global, definida como el tiempo desde el momento de la aleatorización hasta la muerte por cualquier causa, sigue siendo el desenlace fuerte estándar de oro en investigación clínica en oncología11. Una de las desventajas de este desenlace, además de las ya mencionadas anteriormente, es la imposibilidad de evaluar discriminadamente el efecto de terapias de segunda línea. Con el desarrollo de nuevas tecnologías los desenlaces intermedios aprobados por la FDA en oncología para sustituir la supervivencia global se posicionan como indicadores de efectividad en los protocolos de aprobación de las agencias encargadas del control de medicamentos.
El propósito de este trabajo fue revisar cuáles son los desenlaces primarios y secundarios empleados en los estudios clínicos en hematoncología, y en cuántos de ellos se empleó la supervivencia global como el desenlace principal.
Materiales y métodos
Se realizó una revisión bibliográfica a través del motor de búsqueda Pubmed de la US National Library of Medicine (MEDLINE) con los siguientes términos MESH, utilizando entre ellos el conector booleano «OR»: «Neoplasms, Plasma Cell» [Mesh], «Leukemia» [Mesh] y «Lymphoma» [Mesh]. La búsqueda se limitó con los siguientes filtros: experimentos clínicos fase III, que buscaran determinar la efectividad de uno o más medicamentos oncológicos, publicados en los últimos 10 años y en población mayor de 18 años.
Dos investigadores independientes realizaron la selección por título y resumen de los artículos teniendo en cuenta los siguientes criterios de inclusión:
Experimentos clínicos aleatorizados.
Neoplasias hematopoyéticas: linfoma, leucemia, mieloma múltiple o síndrome mielodisplásico.
Población mayor de 18 años.
Patologías de novo, sin tratamiento previo.
Experimentos que evaluaran terapias, ya sea de inducción o de mantenimiento.
Adicionalmente se excluyeron los estudios de análisis secundarios de estudios clínicos, en los cuales se analizaban patologías secundarias o los que se concentraban exclusivamente en efectos adversos. En casos de divergencia se realizó una evaluación conjunta por parte de todos los investigadores.
Para la recolección de datos se tuvieron en cuenta las variables: edad, sexo, tipo de cáncer, intervenciones evaluadas, tiempo de seguimiento, desenlaces primarios, desenlaces secundarios, año de publicación y revista. Para la descripción de los resultados se utilizaron tablas de frecuencias, proporciones y porcentajes. La información se recogió en una hoja de Excel predisenada con este fin. Se hizo sobre esta base de datos un análisis estadístico descriptivo de los hallazgos.
Este trabajo es considerado una investigación sin riesgo por su naturaleza de investigación secundaria, en el que no se hace alguna manipulación intencionada de las variables biológicas, fisiológicas, sicológicas o sociales de individuos.
Resultados
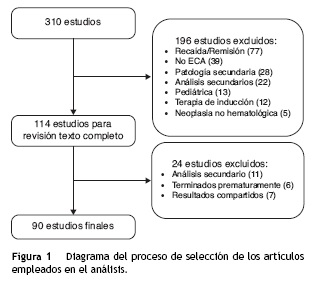
La figura 1 muestra el proceso de selección de los artículos que conformaron la muestra final de análisis. La enfermedad más estudiada en estos 90 estudios fue mieloma múltiple, con 29 estudios clínicos, seguida de linfoma no Hodgkin, con 26. Las otras fueron: leucemia mieloide aguda (12), leucemia linfocítica crónica (10), leucemia mieloide crónica (8), síndromes mielodisplásicos (3) y linfoma de Hodgkin (2). Los estudios de mieloma múltiple incluyeron un total de 12.047 pacientes: los de linfoma no Hodgkin, 11.135; leucemia mieloide aguda, 4.795; leucemia linfocítica crónica, 3.170; leucemia mieloide crónica, 4.050; síndromes mielo-displásicos, 721, y linfoma de Hodgkin, 3.036. En total, los 90 estudios analizaron 39.134 pacientes.
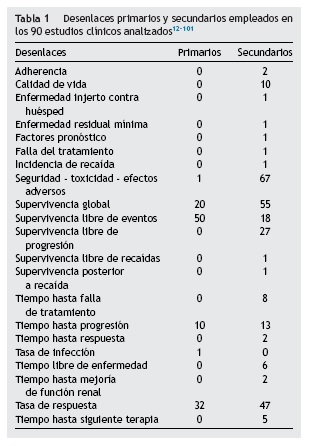
En total, se emplearon 6 desenlaces primarios. El más común de ellos, empleado en 50 estudios (56%), fue un desenlace compuesto, que agrupaba supervivencia libre de eventos, enfermedad libre de progresión, enfermedad libre de recaída y, en algunos casos, «falla al tratamiento». El segundo desenlace más utilizado en orden de frecuencia fueron las tasas de respuesta (compuesta en unos casos por tasas de respuesta citogenética, en otras respuesta molecular, dividida usualmente en completa o parcial) en 31 estudios (34%). La supervivencia global como desenlace primario se empleó en 20 estudios (22%). Los otros desenlaces primarios fueron tasa de infección en uno (1%) y seguridad del medicamento en uno (1%).
Al analizar los 20 estudios que usaron supervivencia global como desenlace principal, la mediana de las medianas de seguimiento fue de 47,5 meses, con un rango de 19,1 y 90 meses. Tan solo en 3 estudios (en mieloma múltiple, lin-foma no Hodgkin y leucemia mieloide aguda) las diferencias encontradas fueron estadísticamente significativas.
La tabla 1 muestra los desenlaces primarios y secundarios empleados en los estudios. En los desenlaces secundarios hubo aún más variabilidad. En total se emplearon 21 desenlaces diferentes; el más común fue la seguridad, que se evaluó como desenlace en 67 estudios (7%), seguida de la supervivencia global, que se consideró como tal en 55 estudios (61%).
Discusión
La importancia de la mejoría en la supervivencia global, como un objetivo central de las terapias farmacológicas en hematoncología, se corrobora al observar que casi todos los estudios clínicos (5 de cada 6) la incluyen como uno de los desenlaces a medir; sin embargo, este tipo de desenlace se incluyó como desenlace secundario en la mayoría de los estudios revisados (61%). La razón podría ser la dificultad para encontrar diferencias estadísticamente significativas (solo 3 de los 20 estudios que consideraron supervivencia global como desenlace principal en esta revisión lograron encontrarla).
El uso de desenlaces intermedios o subrogados en investigación clínica se puede justificar por varias razones. De hecho, en 1992 la FDA modificó las normas de aceptación de estudios clínicos en enfermedades que amenazan la vida, como cáncer o VIH/sida102. Antes de esa normatividad, se esperaba que los estudios clínicos en cáncer modificaran la supervivencia global. Los primeros desenlaces intermedios en ser aceptados fueron supervivencia libre de enfermedad, en cáncer tratado quirúrgicamente, y tasa de respuesta completa en leucemias102.
Aunque hay una estrecha correlación entre supervivencia libre de enfermedad y supervivencia global103,104, la supervivencia global sigue siendo el estándar de oro en estudios clínicos: su importancia es inobjetable, y su medición no depende para nada en interpretación por parte del investigador. Este desenlace tiene varios inconvenientes, como requerir un tamaño de muestra mayor así como más tiempo de seguimiento de los pacientes. Esa demora, que puede ser de años, lleva a que haya un número importante de sujetos que no se beneficien de la terapia, y a que los desarrollado-res vean transcurrir el tiempo de la patente, lo que reduce sus márgenes de ganancia.
Saad et al.105, por ejemplo, analizaron 76 estudios clínicos en cáncer de seno avanzado y encontraron que en solo 15 de ellos (20%) se lograba demostrar un aumento estadísticamente significativo en supervivencia global. Una razón, según ellos, es que por razones éticas las pacientes del grupo control suelen también recibir el medicamento que muestra mayor efectividad, contaminando los resultados. Ellos resaltan también que en formas menos agresivas de cáncer las diferencias significativas serían aún más difíciles de demostrar.
Este estudio tiene como limitación haber revisado solo una base de datos y de tan solo hacerse la búsqueda mediante palabras clave (términos MeSH), y haber mezclado enfermedades oncológicas tan diversas como mieloma múltiple, leucemias y linfomas. La extrapolación de los resultados a los estudios en otras formas de cáncer también puede ser limitada.
En conclusión, el empleo de desenlaces intermedios es una práctica común. Estos desenlaces son a veces específicos para cada tipo de enfermedad neoplásica, lo que hace difícil establecer comparaciones entre ellas. Es esencial, sin embargo, que un desenlace «intermedio» tenga una correlación clara, ya sea con la supervivencia global o con la calidad de vida del paciente1,6,105. A medida que mejora la supervivencia de los pacientes con cáncer, los desenlaces intermedios se van haciendo más útiles, y el uso de supervivencia global como desenlace primario se ha ido reservando a las formas más agresivas de la enfermedad, o a aquellos tratamientos que tienen ya seguimiento de muchos años.
Financiación
Este trabajo recibió el apoyo económico de Biotoscana.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Lee SJ, Earle CC, Weeks JC. Outcomes research in oncology: History, conceptual framework, and trends in the literature. J Natl Cancer Inst. 2000;92:195-204. [ Links ]
2. Jefford M, Stockler MR, Tattersall MHN. Outcomes research: What is it and why does it matter? Intern Med J. 2003;33:110-8. [ Links ]
3. Clancy CM, Eisenberg JM. Outcomes research: Measuring the end results of health care. Science. 1998;282:245-6. [ Links ]
4. Temple R. Are surrogate markers adequate to assess cardiovascular disease drugs? JAMA. 1999;282:790-5. [ Links ]
5. Karakiewicz PI, Briganti A, Chun FK-H, Valiquette L. Outcomes research: A methodologic review. Eur Urol. 2006;50:218-24. [ Links ]
6. Lebwohl D, Kay A, Berg W, Baladi JF, Zheng J. Progressionfree survival: Gaining on overall survival as a gold standard and accelerating drug development. Cancer J. 2009;15: 386-94. [ Links ]
7. Shi Q, Sargent DJ. Meta-analysis for the evaluation of surrogate endpoints in cancer clinical trials. Int J Clin Oncol. 2009;14:102-11. [ Links ]
8. Kelloff GJ, Sigman CC, Johnson KM, Boone CW, Greenwald P, Crowell JA, et al. Perspectives on surrogate end points in the development of drugs that reduce the risk of cancer. Cancer Epidemiol Biomarkers Prev. 2000;9:127-37. [ Links ]
9. Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: Preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69:89-95. [ Links ]
10. Vanderweele TJ. Surrogate measures and consistent surrogates. Biometrics. 2013;69:561-9. [ Links ]
11. Driscoll JJ, Rixe O. Overall survival: Still the gold standard: Why overall survival remains the definitive end point in cancer clinical trials. Cancer J. 2009;15:401-5. [ Links ]
12. Knauf WU, Lissitchkov T, Aldaoud A, Liberati AM, Loscertales J, Herbrecht R, et al. Bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukaemia: updated results of a randomized phase III trial. Br J Haematol. 2012;159:67-77. [ Links ]
13. Lepretre S, Aurran T, Mahé B, Cazin B, Tournilhac O, Maisonneuve H, et al. Excess mortality after treatment with fludarabine and cyclophosphamide in combination with alemtuzumab in previously untreated patients with chronic lymphocytic leukemia in a randomized phase 3 trial. Blood. 2012;119:5104-10. [ Links ]
14. Reynolds C, di Bella N, Lyons RM, Hyman W, Richards DA, Robbins GJ, et al. A phase III trial of fludarabine, cyclophosphamide, and rituximab vs pentostatin, cyclophosphamide, and rituximab in B-cell chronic lymphocytic leukemia. Invest New Drugs. 2012;30:1232-40. [ Links ]
15. Hallek M, Fischer K, Fingerle-Rowson G, Fink AM, Busch R, Mayer J, et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: A randomised, open-label, phase 3 trial. Lancet. 2010;376:1164-74. [ Links ]
16. Robak T, Jamroziak K, Gora-Tybor J, Stella-Holowiecka B, Konopka L, Ceglarek B, et al. Comparison of cladribine plus cyclophosphamide with fludarabine plus cyclophosphamide as first-line therapy for chronic lymphocytic leukemia: A phase III randomized study by the Polish Adult Leukemia Group (PALGCLL3 Study). J Clin Oncol. 2010;28:1863-9. [ Links ]
17. Knauf WU, Lissichkov T, Aldaoud A, Liberati A, Loscertales J, Herbrecht R, et al. Phase III randomized study of bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol. 2009;27:4378-84. [ Links ]
18. Eichhorst BF, Busch R, Stilgenbauer S, Stauch M, Bergmann MA, Ritgen M, et al. First-line therapy with fludarabine compared with chlorambucil does not result in a major benefit for elderly patients with advanced chronic lymphocytic leukemia. Blood. 2009;114:3382-91. [ Links ]
19. Hillmen P, Skotnicki AB, Robak T, Jaksic B, Dmoszynska A, Wu J, et al. Alemtuzumab compared with chlorambucil as firstline therapy for chronic lymphocytic leukemia. J Clin Oncol. 2007;25:5616-23. [ Links ]
20. Flinn IW, Neuberg DS, Grever MR, Dewald GW, Bennett JM, Paietta EM, et al. Phase III trial of fludarabine plus cyclophosphamide compared with fludarabine for patients with previously untreated chronic lymphocytic leukemia: US Intergroup Trial E2997. J Clin Oncol. 2007;25:793-8. [ Links ]
21. Lo-Coco F, Avvisati G, Vignetti M, Thiede C, Orlando SM, Lacobelli S, et al. Retinoic acid and arsenic trioxide for acute promyelocytic leukemia. N Engl J Med. 2013;369:111-21. [ Links ]
22. Petersdorf SH, Kopecky KJ, Slovak M, Willman C, Nevill T, Brandwein J, et al. A phase 3 study of gemtuzumab ozogamicin during induction and postconsolidation therapy in younger patients with acute myeloid leukemia. Blood. 2013;121:4854-60. [ Links ]
23. Kantarjian HM, Thomas XG, Dmoszynska A, Wierzbowska A, Mazur G, Mayer J, et al. Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia. J Clin Oncol. 2012;30:2670-7. [ Links ]
24. Holowiecki J, Grosicki S, Giebel S, Robak T, Kyrcz-Krzemien S, Kuliczkowski K, et al. Cladribine, but not fludarabine, added to daunorubicin and cytarabine during induction prolongs survival of patients with acute myeloid leukemia: A multicenter, randomized phase III study. J Clin Oncol. 2012;30:2441-8. [ Links ]
25. Hengeveld M, Suciu S, Karrasch M, Specchia G, Marie JP, Muus P, et al. Intensive consolidation therapy compared with standard consolidation and maintenance therapy for adults with acute myeloid leukaemia aged between 46 and 60 years: Final results of the randomized phase III study (AML 8 B) of the European Organization for Research and Treatment of Cancer (EORTC) and the Gruppo Italiano Malattie Ematologiche Maligne dell'Adulto (GIMEMA) Leukemia Cooperative Groups. Ann Hematol. 2012;91:825-35. [ Links ]
26. Brune M, Castaigne S, Catalano J, Gehlsen K, Ho AD, Hofmann WK, et al. Improved leukemia-free survival after postconsolidation immunotherapy with histamine dihydrochloride and interleukin-2 in acute myeloid leukemia: Results of a randomized phase 3 trial. Blood. 2006;108:88-96. [ Links ]
27. Harousseau J-L, Martinelli G, Jedrzejczak WW, Brandwein JM, Bordessoule D, Masszi T, et al. A randomized phase 3 study of tipifarnib compared with best supportive care, including hydroxyurea, in the treatment of newly diagnosed acute myeloid leukemia in patients 70 years or older. Blood. 2009;114:1166-73. [ Links ]
28. Latagliata R, Breccia M, Fazi P, Lacobelli S, Martinelli G, di Raimondo F, et al. Liposomal daunorubicin versus standard daunorubicin: Long term follow-up of the GIMEMA GSI 103 AMLE randomized trial in patients older than 60 years with acute myelogenous leukaemia. Br J Haematol. 2008;143:681-9. [ Links ]
29. Russo D, Malagola M, de Vivo A, Fiacchini M, Martinelli G, Piccaluga PP, et al. Multicentre phase III trial on fludarabine, cytarabine (Ara-C), and idarubicin versus idarubicin, Ara-C and etoposide for induction treatment of younger, newly diagnosed acute myeloid leukaemia patients. Br J Haematol. 2005;131:172-9. [ Links ]
30. Schlenk RF, Fröhling S, Hartmann F, Fischer JT, Glasmacher A, del Valle F, et al. Phase III study of all-trans retinoic acid in previously untreated patients 61 years or older with acute myeloid leukemia. Leukemia. 2004;18:1798-803. [ Links ]
31. Amadori S, Suciu S, Jehn U, Stasi R, Thomas X, Marie JP, et al. Use of glycosylated recombinant human G-CSF (lenograstim) during and/or after induction chemotherapy in patients 61 years of age and older with acute myeloid leukemia: Final results of AML-13, a randomized phase-3 study. Blood. 2005;106:27-34. [ Links ]
32. Cortes JE, Kim DW, Kantarjian HM, Brümmendorf TH, Dyagil I, Griskevicius L, et al. Bosutinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia: Results from the BELA trial. J Clin Oncol. 2012;30:3486-92. [ Links ]
33. Petzer AL, Fong D, Lion T, Dyagil I, Masliak Z, Bogdanovic A, et al. High-dose imatinib induction followed by standard-dose maintenance in pre-treated chronic phase chronic myeloid leukemia patients-final analysis of a randomized, multicenter, phase III trial. Haematologica. 2012;97:1562-9. [ Links ]
34. Kantarjian HM, Shah NP, Cortes JE, Baccarani M, Agarwal MB, Undurraga MS, et al. Dasatinib or imatinib in newly diagnosed chronic-phase chronic myeloid leukemia: 2-year follow-up from a randomized phase 3 trial (DASISION). Blood. 2012;119:1123-9. [ Links ]
35. Kantarjian HM, Hochhaus A, Saglio G, de Souza C, Flinn IW, Stenke L, et al. Nilotinib versus imatinib for the treatment of patients with newly diagnosed chronic phase, Philadelphia chromosome-positive, chronic myeloid leukaemia: 24-month minimum follow-up of the phase 3 randomised ENESTnd trial. Lancet Oncol. 2011;12:841-51. [ Links ]
36. Kantarjian H, Shah NP, Hochhaus A, Cortes J, Shah S, Ayala M, et al. Dasatinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2010;362:2260-70. [ Links ]
37. Saglio G, Kim DW, Issaragrisil S, le Coutre P, Etienne G, Lobo C, et al. Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med. 2010;362:2251-9. [ Links ]
38. Cortes JE, Baccarani M, Guilhot F, Druker BJ, Branford S, Kim DW, et al. Phase III, randomized, open-label study of daily imatinib mesylate 400 mg versus 800 mg in patients with newly diagnosed, previously untreated chronic myeloid leukemia in chronic phase using molecular end points: Tyrosine kinase inhibitor optimization and selectivity study. J Clin Oncol. 2010;28:424-30. [ Links ]
39. Deenik W, van der Holt B, Verhoef GE, Schattenberg AV, Verdonck LF, Daenen SM, et al. High-vs low-dose cytarabine combined with interferon alfa in patients with first chronic phase chronic myeloid leukemia. A prospective randomized phase III study. Ann Hematol. 2007;86:117-25. [ Links ]
40. Gordon LI, Hong F, Fisher RI, Bartlett NL, Connors JM, Gascoyne RD, et al. Randomized phase III trial of ABVD versus Stanford V with or without radiation therapy in locally extensive and advanced-stage Hodgkin lymphoma: An intergroup study coordinated by the Eastern Cooperative Oncology Group (E2496). J Clin Oncol. 2013;31:684-91. [ Links ]
41. Engert A, Haverkamp H, Kobe C, Markova J, Renner C, Ho A, et al. Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin's lymphoma (HD15 trial): A randomised, open-label, phase 3 non-inferiority trial. Lancet. 2012;379:1791-9. [ Links ]
42. Récher C, Coiffier B, Haioun C, Molina TJ, Fermé C, Casasnovas O, et al. Intensified chemotherapy with ACVBP plus rituximab versus standard CHOP plus rituximab for the treatment of diffuse large B-cell lymphoma (LNH03-2B): An open-label randomised phase 3 trial. Lancet. 2011;378:1858-67. [ Links ]
43. Salles G, Seymour JF, Offner F, López-Guillermo A, Belada D, Xerri L, et al. Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): A phase 3, randomised controlled trial. Lancet. 2011;377:42-51. [ Links ]
44. Marcus R, Imrie K, Solal-Celigny P, Catalano JV, Dmoszynska A, Raposo JC, et al. Phase III study of R-CVP compared with cyclophosphamide, vincristine, and prednisone alone in patients with previously untreated advanced follicular lymphoma. J Clin Oncol. 2008;26:4579-86. [ Links ]
45. Herold M, Haas A, Srock S, Neser S, Al-Ali KH, Neubauer A, et al. Rituximab added to first-line mitoxantrone, chlorambucil, and prednisolone chemotherapy followed by interferon maintenance prolongs survival in patients with advanced follicular lymphoma: An East German Study Group Hematology and Oncology Study. J Clin Oncol. 2007;25:1986-92. [ Links ]
46. Hiddemann W, Kneba M, Dreyling M, Schmitz N, Lengfelder E, Schmits R, et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: Results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood. 2005;106:3725-32. [ Links ]
47. Cunningham D, Hawkes EA, Jack A, Qian W, Smith P, Mouncey P, et al. Rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisolone in patients with newly diagnosed diffuse large B-cell non-Hodgkin lymphoma: A phase 3 comparison of dose intensification with 14-day versus 21-day cycles. Lancet. 2013;381:1817-26. [ Links ]
48. Delarue R, Tilly H, Mounier N, Petrella T, Salles G, Thieblemont C, et al. Dose-dense rituximab-CHOP compared with standard rituximab-CHOP in elderly patients with diffuse large B-cell lymphoma (the LNH03-6B study): A randomised phase 3 trial. Lancet Oncol. 2013;14:525-33. [ Links ]
49. Rummel MJ, Niederle N, Maschmeyer G, Banat GA, von Grünhagen U, Losem C, et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: An open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet. 2013;381:1203-10. [ Links ]
50. Zucca E, Conconi A, Laszlo D, López-Guillermo A, Bouabdallah R, Coiffier B, et al. Addition of rituximab to chlorambucil produces superior event-free survival in the treatment of patients with extranodal marginal-zone B-cell lymphoma: 5- year analysis of the IELSG-19 Randomized Study. J Clin Oncol. 2013;31:565-72. [ Links ]
51. Ketterer N, Coiffier B, Thieblemont C, Fermé C, Brière J, Casasnovas O, et al. Phase III study of ACVBP versus ACVBP plus rituximab for patients with localized low-risk diffuse large B-cell lymphoma (LNH03-1B). Ann Oncol. 2013;24:1032-7. [ Links ]
52. Press OW, Unger JM, Rimsza LM, Friedberg JW, LeBlanc M, Czuczman MS, et al. Phase III randomized intergroup trial of CHOP plus rituximab compared with CHOP chemotherapy plus (131)iodine-tositumomab for previously untreated follicular non-Hodgkin lymphoma: SWOG S0016. J Clin Oncol. 2013;31:314-20. [ Links ]
53. Schmitz N, Nickelsen M, Ziepert M, Haenel M, Borchmann P, Schmidt C, et al. Conventional chemotherapy (CHOEP-14) with rituximab or high-dose chemotherapy (MegaCHOEP) with rituximab for young, high-risk patients with aggressive B-cell lymphoma: An open-label, randomised, phase 3 trial (DSHNHL 2002-1). Lancet Oncol. 2012;13:1250-9. [ Links ]
54. Economopoulos T, Psyrri A, Dimopoulos MA, Kalogera-Fountzila A, Pavlidis N, Tsatalas C, et al. CEOP-21 versus CEOP-14 chemotherapy with or without rituximab for the first-line treatment of patients with aggressive lymphomas: Results of the HE22A99 trial of the Hellenic Cooperative Oncology Group. Cancer J. 2007;13:327-34. [ Links ]
55. Watanabe T, Tobinai K, Shibata T, Tsukasaki K, Morishima Y, Maseki N, et al. Phase II/III study of R-CHOP-21 versus R-CHOP- 14 for untreated indolent B-cell non-Hodgkin's lymphoma: JCOG 0203 trial. J Clin Oncol. 2011;29:3990-8. [ Links ]
56. Lowry L, Smith P, Qian W, Falk S, Benstead K, Illidge T, et al. Reduced dose radiotherapy for local control in non-Hodgkin lymphoma: A randomised phase III trial. Radiother Oncol. 2011;100:86-92. [ Links ]
57. Tsukasaki K, Utsunomiya A, Fukuda H, Shibata T, Fukushima T, Takatsuka Y, et al. VCAP-AMP-VECP compared with biweekly CHOP for adult T-cell leukemia-lymphoma: Japan Clinical Oncology Group Study JCOG9801. J Clin Oncol. 2007;25:5458-64. [ Links ]
58. Ohmachi K, Tobinai K, Kobayashi Y, Itoh K, Nakata M, Shibata T, et al. Phase III trial of CHOP-21 versus CHOP-14 for aggressive non-Hodgkin's lymphoma: Final results of the Japan Clinical Oncology Group Study, JCOG 9809. Ann Oncol. 2011;22:1382-91. [ Links ]
59. Fridrik MA, Hausmaninger H, Lang A, Drach J, Krieger O, Geissler D, et al. Dose-dense therapy improves survival in aggressive non-Hodgkin's lymphoma. Ann Hematol. 2010;89:273-82. [ Links ]
60. Avilés A, Castañeda C, Neri N, Cleto S, Talavera A, González M, et al. Results of a phase III clinical trial: CHOP versus CMED in peripheral T-cell lymphoma unspecified. Med Oncol. 2008;25:360-4. [ Links ]
61. Merli F, Bertini M, Luminari S, Mozzana R, Botto B, Liberati AM, et al. Long term results of a randomized study performed by Intergruppo Italiano Linfomi comparing Mini-CEOP vs P-VEBEC in elderly patients with diffuse large B-cell lymphoma. Leuk Lymphoma. 2007;48:367-73. [ Links ]
62. Verdonck LF, Notenboom A, de Jong DD, MacKenzie MA, Verhoef GE, Kramer MH, et al. Intensified 12-week CHOP (I-CHOP) plus G-CSF compared with standard 24-week CHOP (CHOP-21) for patients with intermediate-risk aggressive non-Hodgkin lymphoma: A phase 3 trial of the Dutch-Belgian Hemato-Oncology Cooperative Group (HOVON). Blood. 2007;109:2759-66. [ Links ]
63. Betticher DC, Martinelli G, Radford JA, Kaufmann M, Dyer MJ, Kaiser U, et al. Sequential high dose chemotherapy as initial treatment for aggressive sub-types of non-Hodgkin lymphoma: Results of the international randomized phase III trial (MISTRAL). Ann Oncol. 2006;17:1546-52. [ Links ]
64. Habermann TM, Weller EA, Morrison VA, Gascoyne RD, Cassileth PA, Cohn JB, et al. Rituximab-CHOP versus CHOP alone or with maintenance rituximab in older patients with diffuse large B-cell lymphoma. J Clin Oncol. 2006;24:3121-7. [ Links ]
65. Hagenbeek A, Eghbali H, Monfardini S, Vitolo U, Hoskin PJ, de Wolf-Peeters C, et al. Phase III intergroup study of fludarabine phosphate compared with cyclophosphamide, vincristine, and prednisone chemotherapy in newly diagnosed patients with stage III and IV low-grade malignant Non-Hodgkin's lymphoma. J Clin Oncol. 2006;24:1590-6. [ Links ]
66. Burton C, Linch D, Hoskin P, Milligan D, Dyer MJ, Hancock B, et al. A phase III trial comparing CHOP to PMitCEBO with or without G-CSF in patients aged 60 plus with aggressive non- Hodgkin's lymphoma. Br J Cancer. 2006;94:806-13. [ Links ]
67. Federico M, Luminari S, Gobbi PG, Sacchi S, di Renzo N, Lombardo M, et al. The length of treatment of aggressive non-Hodgkin's lymphomas established according to the international prognostic index score: Long-term results of the GISL LA03 study. Eur J Haematol. 2006;76:217-29. [ Links ]
68. Chamorey E, Gressin R, Peyrade F, Rossi JF, Lepeu G, Foussard C, et al. Prospective randomized study comparing MEMID with a chop-like regimen in elderly patients with aggressive non- Hodgkin's lymphoma. Oncology. 2005;69:19-26. [ Links ]
69. Foussard C, Colombat P, Maisonneuve H, Berthou C, Gressin R, Rousselet MC, et al. Long-term follow-up of a randomized trial of fludarabine-mitoxantrone, compared with cyclophosphamide, doxorubicin, vindesine, prednisone (CHVP), as first-line treatment of elderly patients with advanced, lowgrade non-Hodgkin's lymphoma before the era of. Ann Oncol. 2005;16:466-72. [ Links ]
70. Mateos MV, Hernández MT, Giraldo P, de la Rubia J, de Arriba F, López Corral L, et al. Lenalidomide plus dexamethasone for high-risk smoldering multiple myeloma. N Engl J Med. 2013;369:438-47. [ Links ]
71. Mellqvist UH, Gimsing P, Hjertner O, Lenhoff S, Laane E, Remes K, et al. Bortezomib consolidation after autologous stem cell transplantation in multiple myeloma: A Nordic Myeloma Study Group randomized phase 3 trial. Blood. 2013;121:4647-54. [ Links ]
72. Stewart AK, Trudel S, Bahlis NJ, White D, Sabry W, Belch A, et al. A randomized phase 3 trial of thalidomide and prednisone as maintenance therapy after ASCT in patients with MM with a quality-of-life assessment: The National Cancer Institute of Canada Clinicals Trials Group Myeloma 10 Trial. Blood. 2013;121:1517-23. [ Links ]
73. Witzig TE, Laumann KM, Lacy MQ, Hayman SR, Dispenzieri A, Kumar S, et al. A phase III randomized trial of thalidomide plus zoledronic acid versus zoledronic acid alone in patients with asymptomatic multiple myeloma. Leukemia. 2013;27:220-5. [ Links ]
74. Sonneveld P, Schmidt-Wolf IGH, van der Holt B, El Jarari L, Bertsch U, Salwender H, et al. Bortezomib induction and maintenance treatment in patients with newly diagnosed multiple myeloma: Results of the randomized phase III HOVON- 65/GMMG-HD4 trial. J Clin Oncol. 2012;30:2946-55. [ Links ]
75. Rosiñol L, Oriol A, Teruel AI, Hernández D, López-Jiménez J, de la Rubia J, et al. Superiority of bortezomib, thalidomide, and dexamethasone (VTD) as induction pretransplantation therapy in multiple myeloma: A randomized phase 3 PETHEMA/GEM study. Blood. 2012;120:1589-96. [ Links ]
76. Garderet L, Lacobelli S, Moreau P, Dib M, Lafon I, Niederwieser D, et al. Superiority of the triple combination of bortezomib-thalidomide-dexamethasone over the dual combination of thalidomide-dexamethasone in patients with multiple myeloma progressing or relapsing after autologous transplantation: The MMVAR/IFM 2005-04 Randomized Phase III Trial from the Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol. 2012;30:2475-82. [ Links ]
77. Attal M, Lauwers-Cances V, Marit G, Caillot D, Moreau P, Facon T, et al. Lenalidomide maintenance after stem-cell transplantation for multiple myeloma. N Engl J Med. 2012;366: 1782-91. [ Links ]
78. McCarthy PL, Owzar K, Hofmeister CC, Hurd DD, Hassoun H, Richardson PG, et al. Lenalidomide after stem-cell transplantation for multiple myeloma. N Engl J Med. 2012;366: 1770-81. [ Links ]
79. Palumbo A, Hajek R, Delforge M, Kropff M, Petrucci MT, Catalano J, et al. Continuous lenalidomide treatment for newly diagnosed multiple myeloma. N Engl J Med. 2012;366:1759-69. [ Links ]
80. Cavo M, Pantani L, Petrucci MT, Patriarca F, Zamagni E, Donnarumma D, et al. Bortezomib-thalidomide-dexamethasone is superior to thalidomide-dexamethasone as consolidation therapy after autologous hematopoietic stem cell transplantation in patients with newly diagnosed multiple myeloma. Blood. 2012;120:9-19. [ Links ]
81. Morabito F, Gentile M, Mazzone C, Rossi D, di Raimondo F, Bringhen S, et al. Safety and efficacy of bortezomib- melphalan-prednisone-thalidomide followed by bortezomib- thalidomide maintenance (VMPT-VT) versus bortezomib- melphalan-prednisone (VMP) in untreated multiple myeloma patients with renal impairment. Blood. 2011;118: 5759-66. [ Links ]
82. Spicka I, Mateos MV, Redman K, Dimopoulos MA, Richardson PG. An overview of the VISTA trial: Newly diagnosed, untreated patients with multiple myeloma ineligible for stem cell transplantation. Immunotherapy. 2011;3:1033-40. [ Links ]
83. Morgan GJ, Davies FE, Gregory WM, Russell NH, Bell SE, Szubert AJ, et al. Cyclophosphamide, thalidomide, and dexamethasone (CTD) as initial therapy for patients with multiple myeloma unsuitable for autologous transplantation. Blood. 2011;118:1231-8. [ Links ]
84. Palumbo A, Bringhen S, Rossi D, Cavalli M, Larocca A, Ria R, et al. Bortezomib-melphalan-prednisone-thalidomide followed by maintenance with bortezomib-thalidomide compared with bortezomib-melphalan-prednisone for initial treatment of multiple myeloma: a randomized controlled trial. J Clin Oncol. 2010;28:5101-9. [ Links ]
85. Wijermans P, Schaafsma M, Termorshuizen F, Ammerlaan R, Wittebol S, Sinnige H, et al. Phase III study of the value of thalidomide added to melphalan plus prednisone in elderly patients with newly diagnosed multiple myeloma: The HOVON 49 Study. J Clin Oncol. 2010;28:3160-6. [ Links ]
86. Waage A, Gimsing P, Fayers P, Abildgaard N, Ahlberg L, Björkstrand B, et al. Melphalan and prednisone plus thalidomide or placebo in elderly patients with multiple myeloma. Blood. 2010;116:1405-12. [ Links ]
87. Nair B, van Rhee F, Shaughnessy JD, Anaissie E, Szymonifka J, Hoering A, et al. Superior results of Total Therapy 3 (2003-33) in gene expression profiling-defined low-risk multiple myeloma confirmed in subsequent trial 2006-66 with VRD maintenance. Blood. 2010;115:4168-73. [ Links ]
88. Palumbo A, Bringhen S, Bruno B, Falcone AP, Liberati AM, Grasso M, et al. Melphalan 200 mg/m2 versus melphalan 100 mg/m2 in newly diagnosed myeloma patients: A prospective, multicenter phase 3 study. Blood. 2010;115:1873-9. [ Links ]
89. Dimopoulos MA, Richardson PG, Schlag R, Khuageva NK, Shpilberg O, Kastritis E, et al. VMP (Bortezomib, Melphalan, and Prednisone) is active and well tolerated in newly diagnosed patients with multiple myeloma with moderately impaired renal function, and results in reversal of renal impairment: Cohort analysis of the phase III VISTA study. J Clin Oncol. 2009;27:6086-93. [ Links ]
90. Hulin C, Facon T, Rodon P, Pegourie B, Benboubker L, Doyen C, et al. Efficacy of melphalan and prednisone plus thalidomide in patients older than 75 years with newly diagnosed multiple myeloma: IFM 01/01 trial. J Clin Oncol. 2009;27:3664-70. [ Links ]
91. Kyle RA, Jacobus S, Friedenberg WR, Slabber CF, Rajkumar SV, Greipp PR. The treatment of multiple myeloma using vincristine, carmustine, melphalan, cyclophosphamide, and prednisone (VBMCP) alternating with high-dose cyclophosphamide and alpha(2)beta interferon versus VBMCP: results of a phase III Eastern Cooperative Oncology Study E5A93. Cancer. 2009;115:2155-64. [ Links ]
92. San Miguel JF, Schlag R, Khuageva NK, Dimopoulos MA, Shpilberg O, Kropff M, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. N Engl J Med. 2008;359:906-17. [ Links ]
93. Rajkumar SV, Rosiñol L, Hussein M, Catalano J, Jedrzejczak W, Lucy L, et al. Multicenter, randomized, double-blind, placebocontrolled study of thalidomide plus dexamethasone compared with dexamethasone as initial therapy for newly diagnosed multiple myeloma. J Clin Oncol. 2008;26:2171-7. [ Links ]
94. Barlogie B, Tricot G, Anaissie E, Shaughnessy J, Rasmussen E, van Rhee F, et al. Thalidomide and hematopoieticcell transplantation for multiple myeloma. N Engl J Med. 2006;354:1021-30. [ Links ]
95. Barlogie B, Kyle RA, Anderson KC, Greipp PR, Lazarus HM, Hurd DD, et al. Standard chemotherapy compared with high-dose chemoradiotherapy for multiple myeloma: final results of phase III US Intergroup Trial S9321. J Clin Oncol. 2006;24:929-36. [ Links ]
96. Rifkin RM, Gregory SA, Mohrbacher A, Hussein MA. Pegylated liposomal doxorubicin, vincristine, and dexamethasone provide significant reduction in toxicity compared with doxorubicin, vincristine, and dexamethasone in patients with newly diagnosed multiple myeloma: A phase III multicenter randomized trial. Cancer. 2006;106:848-58. [ Links ]
97. Pönisch W, Mitrou PS, Merkle K, Herold M, Assmann M, Wilhelm G, et al. Treatment of bendamustine and prednisone in patients with newly diagnosed multiple myeloma results in superior complete response rate, prolonged time to treatment failure and improved quality of life compared to treatment with melphalan and prednisone--a randomized phase III study of the East German Study Group of Hematology and Oncology (OSHO). J Cancer Res Clin Oncol. 2006;132: 205-12. [ Links ]
98. Rajkumar SV, Blood E, Vesole D, Fonseca R, Greipp PR. Phase III clinical trial of thalidomide plus dexamethasone compared with dexamethasone alone in newly diagnosed multiple myeloma: A clinical trial coordinated by the Eastern Cooperative Oncology Group. J Clin Oncol. 2006;24:431-6. [ Links ]
99. Kantarjian H, Issa JP, Rosenfeld CS, Bennett JM, Albitar M, DiPersio J, et al. Decitabine improves patient outcomes in myelodysplastic syndromes: Results of a phase III randomized study. Cancer. 2006;106:1794-803. [ Links ]
100. Zwierzina H, Suciu S, Loeffler-Ragg J, Neuwirtova R, Fenaux P, Beksac M, et al. Low-dose cytosine arabinoside (LD-AraC) vs LD-AraC plus granulocyte/macrophage colony stimulating factor vs LD-AraC plus Interleukin-3 for myelodysplastic syndrome patients with a high risk of developing acute leukemia: Final results of a randomized phase. Leukemia. 2005;19:1929-33. [ Links ]
101. Anasetti C, Logan BR, Lee SJ, Waller EK, Weisdorf DJ, Wingard JR, et al. Peripheral-blood stem cells versus bone marrow from unrelated donors. N Engl J Med. 2012;367:1487-96. [ Links ]
102. Pazdur R. Endpoints for assessing drug activity in clinical trials. Oncologist. 2008;13 Suppl 2:19-21. [ Links ]
103. Sargent DJ, Wieand HS, Haller DG, Gray R, Benedetti JK, Buyse M, et al. Disease-free survival versus overall survival as a primary end point for adjuvant colon cancer studies: individual patient data from 20,898 patients on 18 randomized trials. J Clin Oncol. 2005;23:8664-70. [ Links ]
104. Piedbois P, Buyse M. Endpoints and surrogate endpoints in colorectal cancer: A review of recent developments. Curr Opin Oncol. 2008;20:466-71. [ Links ]
105. Saad ED, Katz A, Buyse M. Overall survival and post-progression survival in advanced breast cancer: A review of recent randomized clinical trials. J Clin Oncol. 2010;28:1958-62. [ Links ]