Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cancerología
versión impresa ISSN 0123-9015
rev.colomb.cancerol. vol.19 no.2 Bogotá abr./jun. 2015
https://doi.org/10.10167j.rccan.2015.03.002
http://dx.doi.org/10.10167j.rccan.2015.03.002
Reporte de caso
Adamantinoma de tibia: manejo quirúrgico con aloinjerto intercalar. A propósito de un caso
Adamantinoma of tibia: Surgical management with intercalary allograft. Report of a case
Felipe Criolloa,*, Luis Carlos Gómeza, Camilo Sotoa, Óscar Messab y Camilo Estradac
a Clínica de Ortopedia Oncológica, Instituto Nacional de Cancerología, Bogotá D. C., Colombia
b Anatomía Patológica, Instituto Nacional de Cancerología, Bogotá D. C., Colombia
c Ortopedia y Traumatología, Universidad El Bosque, Bogotá D. C., Colombia
* Autor para correspondencia. Correo electrónico: felipecriollo@gmail.com (F. Criollo).
Recibido el 25 de agosto de 2014; aceptado el 26 de marzo de 2015 Disponible en Internet el 12 de junio de 2015
Resumen
El adamantinoma es un tumor maligno bifásico que comprende el 0,4% de todos los tumores óseos primarios y el 23% comienza con fracturas patológicas asociadas a traumatismos ocurridos meses o años antes. Presentamos el caso de una paciente de veinte años de edad quien comienza con fractura patológica de la tibia derecha por un trauma de baja energía, con estudios radiológicos e histopatológicos que confirmaron la presencia de un adamantinoma. Fue manejado quirúrgicamente mediante resección amplia del segmento tumoral y reconstrucción con aloinjerto intercalar de tibia fijado con un clavo endomedular de estabilidad multidireccional sustentado con una placa antirrotatoria proximal. Los resultados radiológicos y clínicos fueron satisfactorios.
Palabras clave: Fractura; Patológica; Adamantinoma; Aloinjerto; Intercalar.
Abstract
The adamantinoma is a biphasic malignant tumor comprising 0.4% of all primary bone tumors and 23% debuts with pathological fractures associated with trauma that occurred months or years earlier. We report the case is presented of a twenty-year-old woman that debuted with a pathological fracture of the right tibia with a low-energy trauma. The radiological and histopathological studies confirmed the presence of an adamantinoma. This was treated surgically by wide resection of the tumor and reconstructed with an intercalary allograft bone segment that was fixed with a tibial intramedullary multidirectional antirotatory stability nail sustained further by a proximal plate. The radiological and clinical results were satisfactory.
Keywords: Fracture; Pathological; Adamantinoma; Allograft; Intercalary.
Introducción
El adamantinoma es un tumor maligno de bajo grado bifásico caracterizado por una variedad de patrones morfológicos, con grupos de células epiteliales rodeadas por células fusocelulares frecuentemente localizado en la tibia y que comprende el 0,4% de todos los tumores óseos primarios1. En 1913, Fischer nombró a la lesión como adamantinoma debido a su semejanza con el adamantinoma de la mandíbula (ameloblastoma)2. En 1976, Campanacci nombró a esta lesión como osteofibrodisplasia de la tibia y peroné en referencia a su localización anatómica, origen, desarrollo y parecido histológico a la displasia fibrosa3. Existe controversia sobre la naturaleza de la lesión, en cuanto a si se deriva a partir de una displasia osteofibrosa, o si la displasia osteofibrosa se debe a una lesión residual resultante de la regresión espontánea de un adamantinoma2,4-6. Las similitudes entre localización, edad de presentación, apariencia radiográfica e histopatológica, ha llevado a pensar que estas lesiones están estrechamente relacionadas.
El tratamiento actual del adamantinoma se direcciona hacia el salvamento de la extremidad determinada por la resección en bloque de la lesión tumoral con márgenes oncológicos efectivos más reconstrucción7. La reconstrucción biológica empleando aloinjertos segmentarios es la opción más atractiva en el caso de los adamantinomas, ya que esta neoplasia se considera de bajo grado que no requiere quimioterapia5, y la mayoría se presenta en grupos de edad relativamente joven y con demanda de actividad.
Caso clínico
Paciente de sexo femenino de 20 años de edad, quien acude con dolor y limitación funcional en su pierna derecha debido a una caída desde su propia altura mientras caminaba. Refería un cuadro previo de dolor en el sitio de la lesión de aproximadamente un año de evolución, de intensidad leve a moderada, relacionado con actividad física que mejoraba significativamente con el reposo y analgésicos.
Como antecedentes importantes tuvo su primer embarazo, que transcurrió sin complicaciones y finalizó con parto vaginal espontáneo, 8 meses antes de la caída que ha motivado la consulta. Fue valorada inicialmente en un hospital local en donde le diagnosticaron una fractura patológica diafisiaria de la tibia derecha y la inmovilizaron con férula suropédica posterior. Un mes después, fue remitida para valoración especializada. Encontramos a la paciente en buenas condiciones generales, con tumefacción en el tercio medio de la pierna, sin signos inflamatorios, sin circulación colateral ni cambios tróficos ni pigmentarios en la piel.
Demuestra antecurvatum y limitación para la dorsiflexión del tobillo ipsilateral. Estado neurovascular distal normal.
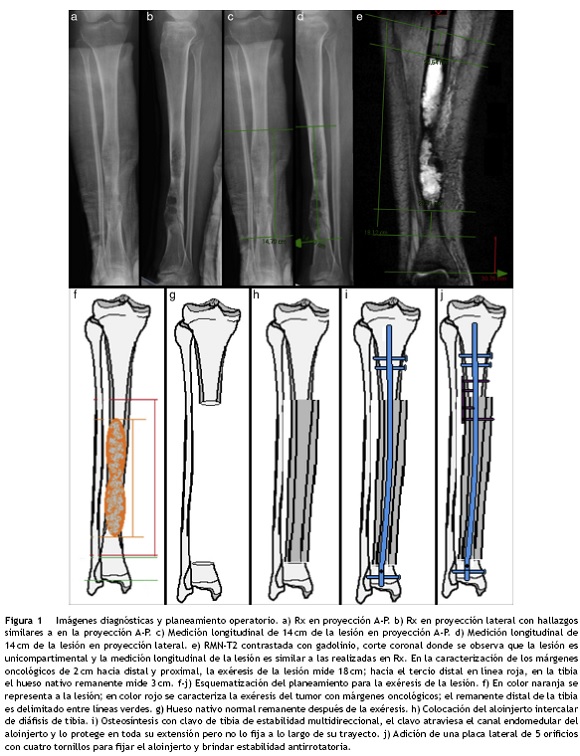
Imágenes diagnósticas: la Rx A-P mostró fractura patológica no desplazada en la unión del tercio medio y distal de la diáfisis en un trasfondo de lesión ósea en dos focos diafisiarios, de bordes apolillados, mal definidos con característica de vidrio esmerilado y que abomban las corticales, sin aparente evidencia de extensión a partes blandas. En la proyección lateral se observó que las lesiones son excéntricas, de orientación hacia la cortical anterior con áreas lobuladas en imagen de pompas de jabón; se corroboró el trazo fracturario predominante de la cortical anterior a través de la lesión inferior (fig. 1a-d). En la resonancia magnética contrastada de toda la pierna se descartó una masa de partes blandas e infiltración tumoral hacia la medular proximal y distal del hueso (fig. 1e).
Dados los hallazgos radiológicos de las lesiones, se plantearon los diagnósticos de osteofibrodisplasia vs. adamantinoma; por lo cual se decidió realizar estudios de extensión, TAC de tórax que no demostraron alteraciones. Se realizó una biopsia abierta para caracterización histopatológica de la lesión.
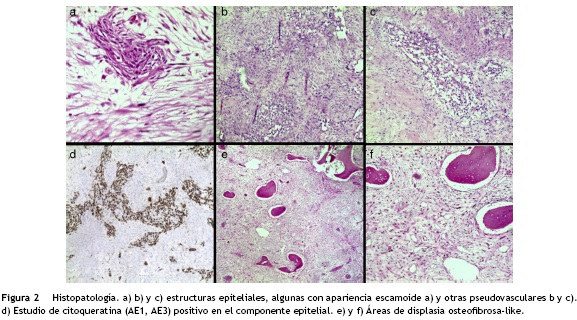
El diagnóstico histopatológico de la biopsia es de adamantinoma clásico de tibia positivo para CK (AE1AE3) y negativo para CK7, CK20, P.63, calretinina y CD138 (fig. 2).
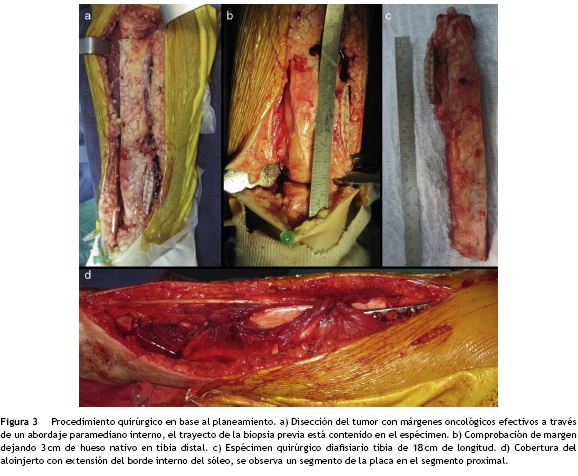
Fue llevada a cirugía de salvamento de la extremidad, con intención curativa en la que se realizó la resección con márgenes amplios más reconstrucción con aloinjerto diafisiario intercalar fijado con osteosíntesis mediante un clavo endomedular de estabilidad multiplanar con una placa antirrotatoria detalladas en el planeamiento operatorio (figs. 1-3).
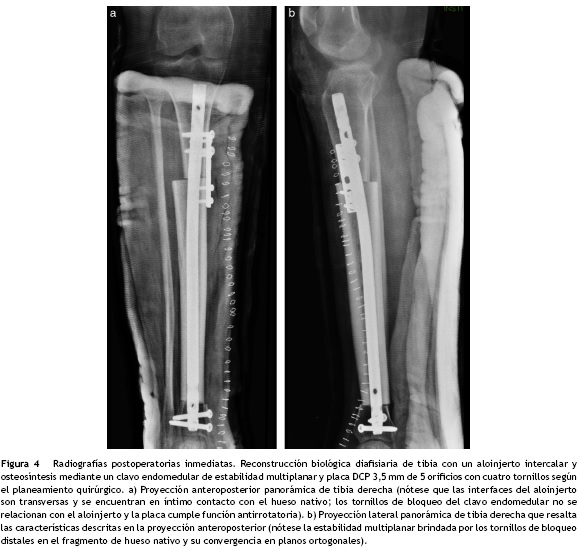
Los resultados radiológicos fueron satisfactorios en términos de alineación de la extremidad y posición del material de osteosíntesis (fig. 4). Finalmente, el análisis de la pieza quirúrgica informó bordes de sección negativos para tumor. El control posquirúrgico a los 5 meses fue satisfactorio y la paciente apoya completamente la extremidad durante la marcha.
Discusión
El adamantinoma es un tumor maligno bifásico de bajo grado caracterizado por grupos de células epiteliales rodeadas de estroma fusocelular, con cierta frecuencia hay hallazgos acompañados de displasia osteofibrosa clásica, la evidencia inmunohistoquímica y ultraestructural apunta a un origen epitelial4,5.
La teoría más aceptada sobre su origen menciona el desplazamiento del epitelio basal de la piel durante el desarrollo embrionario y es apoyado por su presentación predominante hacia la cortical anterior de la tibia, donde la osificación endocondral ocurre muy cerca de la piel. Basándose en estudios ultraestructurales y de inmunohisto-química, las células tumorales muestran ser positivas para pancitoqueratina, y, por microscopía electrónica se observa que las células tienen características epiteliales tales como lámina basal, desmosomas, uniones gap, queratinas específicas epiteliales y extracelulares, y composición similar al tejido epitelial5. Es por ello que, en una biopsia muy pequeña, los diagnósticos histopatológicos se pueden confundir con carcinomas metastásicos8.
La edad de presentación muestra un rango muy amplio, con casos observados desde los 3 hasta los 86 años con una media entre 25 a 35 años en más del 75% de los casos1. Los grupos de edad más temprana incluyen predominantemente a pacientes con osteofibrodisplasia-like adamantinoma8, aunque se han reportado niños con adamantinoma clásico y adultos con osteofibrodisplasia-like adamantinoma. Existe una leve predilección por el sexo masculino. Raramente ocurre en edades intermedias o avanzadas donde puede existir progresión hacia adamantinoma desdiferenciado1.
La clínica es similar a la displasia osteofibrosa con: dolor, hinchazón y deformidad al momento del diagnóstico. El 23% comienza con fracturas patológicas y existe el antecedente de traumas ocurridos meses o años previamente en el 30-60% de los casos. Puede ocurrir hipercalcemia como resultado de la liberación de sustancias relacionadas con la paratohormona5,9.
Radiográficamente la enfermedad es marcada por defectos osteolíticos bien definidos y elongados de tamaño variable separados por áreas de hueso esclerótico, lo cual ocasionalmente da la apariencia de «pompas de jabón», sin reacción perióstica marcada (fig. 1a-1d). A su vez, el adamantinoma puede afectar a todo el hueso con lesiones satélites. Las áreas de destrucción cortical en la tibia presentan imagen de dientes, que ayuda a distinguir el tumor10.
El hueso que más se ve involucrado es la tibia en su metá-fisis o diáfisis hacia la cortical anterior en aproximadamente el 85-90% de los casos. En el 10% restante, existe una combinación de una o más lesiones en el peroné ipsilateral de manera sincrónica2,8. Otros casos han reportado esta patología en el cúbito, y además en localizaciones más raras como en el húmero, fémur, costillas, vértebras y huesos cortos de los pies2.
Aunque existen patrones y variantes histológicas, no existe una correlación clara entre la histología y el curso clínico. Se ven resultados clínicos desfavorables relacionados con tratamientos intralesionales, sexo masculino, dolor al momento de la presentación, corta duración de los síntomas, edad de presentación menor de 20 años y escasa diferenciación escamosa del tumor. Las tasas de recurrencia local se observan del 18-32% y la tasa de mortalidad asciende del 13 al 18%5.
Las células neoplásicas del adamantinoma clásico varían desde pequeñas a grandes, con cromatina finamente dispersa. Pocos casos muestran atipia nuclear. Las figuras mitóticas son poco frecuentes (0-2 por 10 campos de alto poder). Tienen varios patrones de crecimiento descritos como: tubular, basaloide, escamosas, células fusiformes y la variante de «displasia osteofibrosa-like». En el adamanti-noma clásico, la forma más común consiste de nidos sólidos de células basaloides similar a los adamantinomas tubulares que consisten en cordones estrechos de células epiteliales con separación en el centro dando apariencia vascular o glandular; en la variante basaloide, las células epiteliales exhiben nidos sólidos de células basaloides con una empalizada periférica; la variante escamosa (con queratinización o sin esta) puede parecerse al carcinoma escamocelular bien diferenciado, y la variante de células fusiformes, muestra husos celulares con hendiduras revestidas por células epiteliales. En conjunto el adamantinoma diferenciado puede tener un patrón de displasia osteofibrosa, en este, las zonas similares a la displasia osteofibrosa clásica presenta áreas fusocelulares, trabéculas irregulares metaplásicas y nidos epiteliales clásicos del adamantinoma, focos de calcificación, células gigantes. Existen casos con desdiferenciación sarcomatosa11 y una variante rabdoide12.
A pesar de las variedades histológicas del adamantinoma, todas estas presentan positividad para queratinas 14 y 19 en las células epiteliales con coexpresión de queratinas de células basales CK5, CK14, CK19 y vimentina; lo que sugiere una histiogénesis común para todos los subtipos de adamantinoma. Estos patrones se conservan en las recurren-cias locales y en las metástasis y difieren significativamente de otras lesiones de hueso y tejidos blandos con características epiteliales conocidas como sarcomas sinoviales, cordomas y sarcomas epitelioides. Todos estos carecen de inmunorreactividad de queratinas 8 y 18, y expresan CD99, BCL2, marcadores mioepiteliales o CD34.
Pese a su morfología bifásica, la naturaleza neoplásica de la lesión depende del componente epitelial. Esto se demostró mediante pruebas de comparación con marcadores de proliferación (Ki-67), anticuerpos para factor de crecimiento epidérmico, receptor del factor de crecimiento epidérmico y factor de crecimiento de fibroblastos tipo 2. Demostrando estar presentes los factores antigénicos exclusiva o predominantemente en el componente epitelial, sugiriendo que el componente epitelial es neoplásico, proliferativo y que es capaz de estimular un crecimiento fibroso reactivo. Adicionalmente, se demostró aneuploidia e inmunorreac-tividad significativa para p53. Al estudiar las metástasis pulmonares de los adamantinomas existe reactividad para citoqueratinas en las células epiteliales y no en el estroma fibroso. Existe además la correlación del protooncogén p53 y producción de la proteína de matriz en la osteofibrodisplasia y en el adamantinoma, expresión de C-fos y C-jun en osteofibrodisplasia y en los componentes epiteliales de adamantinomas clásicos y diferenciados5.
La descripción de una lesión intermedia conocida como osteofibrodisplasia-like adamantinoma provee evidencia adicional de la existencia de un espectro de enfermedad con un extremo benigno que es la displasia osteofibrosa y un extremo maligno que es el adamantinoma diferenciado y, en grado intermedio, la osteofibrodisplasia-like adamantinoma. La relación que existe entre la osteofibrodisplasia y el adamantinoma se basa en que ambas entidades presentan copias extras de los cromosomas 7, 8, 12, 19 y 21, con excepción del cromosoma 19 para la osteofibrodisplasia2,8.
Es importante identificar esta particularidad para evitar no tratar una lesión o dar tratamientos insuficientes o inadecuados como manejos intralesionales y marginales, en los que puede presentar recurrencias una lesión maligna entre el 18 a 32%5 aproximadamente en 5,3 años7, y cuyo potencial de dar metástasis a distancia es de aproximadamente 10 a 30% durante los primeros dos a diez años posteriores al diagnóstico6. Las metástasis se diseminan mediante rutas hematológicas o linfáticas, con predilección hacia los pulmones, ganglios linfáticos, otras estructuras óseas, y en menor frecuencia a estructuras abdominales9 y con un curso fatal de la enfermedad4.
Aunque la vascularidad no es una característica notable de este tipo de tumor, a veces puede ser muy vascularizado, y es por ello que algunos autores los consideran como angioblastomas5. Una variante menos común de adamanti-noma se ha descrito en relación al sarcoma de Ewing. La variante se caracteriza por cordones uniformes de células pequeñas y redondas, anastomosados en un estroma mixoide. Estas células exhiben características ultraestruc-turales epiteliales y neuroendocrinas.
Los estudios de inmunohistoquímica muestran que las células tumorales contienen tanto antígenos epiteliales como neuroectodérmicas incluyendo CD99 y traslocación 11;22 en los núcleos de las células inmunorreactivas a cito-queratina; sin embargo, existen otros casos que carecen de las traslocaciones EWS-FLI-1e EWS-ERG. Se requieren estudios adicionales para clarificar las diferencias de pronóstico y quimiosensibilidad entre el sarcoma de Ewing convencional y el adamantinoma relacionado con el sarcoma de Ewing5.
El tratamiento actual del adamantinoma se direcciona hacia el salvamento de la extremidad determinada por la resección en bloque de la lesión tumoral con márgenes oncológicos efectivos más reconstrucción, sin necesidad de quimioterapia7. Este esquema ofrece menores tasas de recurrencia local y la tasa de supervivencia a 10 años asciende al 87,2%13.
La amputación por sí sola no ha demostrado mejorar la supervivencia en comparación con la cirugía de preservación del miembro, pero puede ser recomendable: si se produce la recurrencia local; si la resección en bloque no puede realizarse; si se presentan lesiones de partes blandas muy extensas, y si la reconstrucción ha fallado5,7. Desafortunadamente, ni la radioterapia ni la quimioterapia han demostrado ser eficaces en el tratamiento de este tumor14.
Dentro de las opciones de reconstrucción están: osteo-génesis por distracción; aloinjertos soportados con placas de osteosíntesis o clavos endomedulares7; autoinjertos de peroné vascularizados, y endoprótesis metálica segmentaria14.
La reconstrucción biológica empleando aloinjertos segmentarios es la opción más atractiva en el caso de los adamantinomas, ya que esta neoplasia se considera de bajo grado y aunque no recibirá quimioterapia5, la mayoría se presenta en grupos de edad relativamente joven y con demanda de actividad.
Las endoprótesis e implantes metálicos segmentarios en estos grupos de edad pueden fallar o aflojarse durante el tiempo de vida del paciente. Además, este tipo de tumores suelen tomar segmentos extensos de la diáfisis del hueso (10-25 cm)7 dejando estructuras óseas residuales que no permiten una fijación suficiente para que el reemplazo metálico funcione adecuadamente (fig. 1f y g) (fig. 2b), lo que incrementa la probabilidad de complicaciones.
La reconstrucción de los defectos óseos empleando aloinjertos ha demostrado ser exitosa, alcanzando excelentes resultados funcionales15-17. Es un procedimiento reconstructivo relativamente simple que ofrece ventajas en términos de menor tiempo quirúrgico y que al compararlo con técnicas que emplean autoinjertos y de peroné vascularizado excluye la morbilidad del sitio de cosecha en el paciente. Además proporciona un reemplazo estructural estable de la tibia sin tener que esperar a que el injerto se hipertrofie7.
La técnica quirúrgica para la fijación del aloinjerto puede emplear placas de compresión dinámica lo suficientemente largas para estabilizar los extremos del hueso nativo al aloin-jerto y proteger al mismo para evitar que se fracture16. Al menos tres orificios de la placa deben fijarse en el hueso nativo para considerarse como suficiente18, pero, en caso de que esto no ocurra, se emplea otra placa paralela para brindar mayor estabilidad al constructo, minimizando la cantidad de tornillos a través del aloinjerto19.
Otro método de estabilización para aloinjertos intercalares emplea un clavo endomedular de estabilidad multiplanar, asociado a una placa de compresión dinámica como soporte antirrotatorio. El clavo funciona como férula interna pues brinda estabilidad relativa al constructo y protege al aloinjerto. Asimismo, los orificios de bloqueo proximales y distales en el clavo permiten el paso multiplanar de tornillos de cerrojo convencionales o ASLS (por sus siglas en inglés de Angular Stability Locking Screws) brindando estabilidad angular en el caso de que exista poco hueso nativo en el pilón tibial o en la región metaepifisaria proximal y reduce las probabilidades de movilidad del clavo en los extremos20. Sin embargo, debido a la propia naturaleza del clavo endomedular, por sí solo no brinda estabilidad antirrotacional al aloinjerto. Por tal razón se adiciona una placa LCP de 3,5 mm con 4 o 5 orificios, empleando 4 tornillos de la siguiente manera: el primero es convencional, colocado en el fragmento proximal, en modalidad estática y bicortical, flanqueando el clavo endomedular; el segundo es convencional colocado en el fragmento distal en modalidad de compresión dinámica y bicortical; los dos restantes son tornillos de bloqueo hacia la placa, y unicorticales (fig. 1h-j) (fig. 3). De esta forma se obtiene un constructo lo suficientemente rígido aprovechando adicionalmente la estabilidad angular que brindan las placas LCP21.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Hogendoorn P, Kanamori M. Adamantinoma. En: Fletcher C, Bridge JA, Hogendoorn P, Mertens F, editores. WHO: Classification of tumors of soft tissue and bone. 4.th ed. Lyon: IARC; 2013. p. 343-5. [ Links ]
2. Borbas P, Leithner A, Sadoghi P, Berndt A, Liegl B, Haas OA. Clonality assessment in a case of multifocal adamantinoma and a review of the literature. Case Rep Med. 2012;2012:605-685. [ Links ]
3. Park YK, Unni KK, McLeod RA, Pritchard DJ. Osteofibrous dysplasia: clinicopathologic study of 80 cases. Hum Pathol. 1993;24(12):1339-47. [ Links ]
4. Most MJ, Sim FH, Inwards CY. Osteofibrous dysplasia and adamantinoma. J Am Acad Orthop Surg. 2010;18:358-66. [ Links ]
5. Jain D, Jain VK, Vasishta RK, Ranjan P, Kumar Y. Adamantinoma: a clinicopathological review and update. Diagn Pathol. 2008;3:8. [ Links ]
6. Hatori M, Watanabe M, Hosaca M, Sasano H, Narita M, Kokubun S. A Classic adamantinoma arising from osteofibrous dysplasialike adamantinoma in the lower leg: a case report and review of the literature. Tohoku J Exp Med. 2006;209:53-9. [ Links ]
7. Gebhardt MC, Lord FC, Rosenberg AE, Mankin HJ. The treatment of adamantinoma of the tibia by wide resection and allograft bone transplantation. J Bone Joint Surg Am. 1987;69(8):1177-88. [ Links ]
8. Kanamori M, Antonescu CR, Scott M, Bridge RS, Neff JR, Spanier SS, et al. Extra copies of chromosomes 7, 8, 12, 19, and 21 are recurrent in adamantinoma. J Mol Diag. 2001;3:16-21. [ Links ]
9. Lyons JA, Budd GT, Crownover RL. Hypercalcemia caused by metastatic adamantinoma: response to radiotherapy. Sarcoma. 1999;3(1):33-5. [ Links ]
10. Greenspan A. Other bone tumors, malignant bone tumors II: miscelaneous tumors. En: Greenspan A, editor. Orthopaedic imaging: A practical approach. 5th ed. Philadelphia: Wolters Kluwer, Lippincot Williams & Wilkins: 2011. p. 754-5. [ Links ]
11. Hazelbag HM, Laforga JB, Roels HJ, Hogendoorn PC. Dedifferentiated adamantinoma with revertant mesenchymal phenotype. Am J Surg Pathol. 2003;27:1530-7. [ Links ]
12. Povysil C, Kohout A, Urban K, Horák M. Differentiated adamantinoma of the fibula: a rhabdoid variant. Skeletal Radiol. 2004;33(8):488-92. [ Links ]
13. Qureshi AA, Shott S, Mallin BA, Gitelis S. Current trends in the management of adamantinoma of long bones. An international study. J Bone Joint Surg Am. 2000;82:1122-31. [ Links ]
14. Khan MH, Darji R, Rao U, McGough R. Leg pain and swelling in a 22-year-old man. Clin Orthop Relat Res. 2006;448:259-66. [ Links ]
15. Dion N, Sim FH. The use of allografts in musculoskeletal oncology. J Bone Joint Surg Am. 2002;84-A(4):644-54. [ Links ]
16. Ortiz-Cruz E, Gebhardt MC, Jennings LC, Springfield DS, Mankin HJ. The results of transplantation of intercalary allografts after resection of tumors. A long-term follow-up study. J Bone Joint Surg Am. 1997;79(1):97-106. [ Links ]
17. Mankin HJ, Gebhardt MC, Jennings LC, Springfield DS, Tomford WW. Long-term results of allograft replacement in the management of bone tumors. Clin Orthop Relat Res. 1996;(324):86-97. [ Links ]
18. Sanchez-Soteo J. Proximal humeral allograft prosthetic composites. En: Sim FH, Choong P, Weber KL, editores. Orthopaedic oncology and complex reconstruction. Philadelphia: Wolters Kluwer-Lippincot Williams & Wilkins; 2011. p. 30. [ Links ]
19. Vander Griend RA. The effect of internal fixation on the healing of large allografts. J Bone Joint Surg Am. 1994;Vol. 76A. [ Links ]
20. Rüedi TP. Tibia, Shaft. En: Rüedi TP, Buckley RE, Moran CG, editores. AO Principles of fracture management, specific fractures (Vol. 2). 2. nd ed. Stuttgart New York: Thieme; 2007. p. 837-9. [ Links ]
21. Siegel J. Locked and Minimally Invasive Plating. En: Ricci WM, Tornetta P III, editores. Trauma 2, instructional course lectures. Rosemont: American Academy of Orthopaedic Surgeons; 2012. p. 107-20. [ Links ]