Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Cancerología
versión impresa ISSN 0123-9015
rev.colomb.cancerol. vol.20 no.1 Bogotá ene./jun. 2016
https://doi.org/10.1016/j.rccan.2016.01.001
http://dx.doi.org/10.1016/j.rccan.2016.01.001
ORIGINAL
Comparación entre las técnicas de citocentrifugado y base líquida SurePathTM para procesamiento de muestras no ginecológicas: verificación de la validación
Comparison between cytocentrifugation techniques and liquid-based SurePathTM for the processing of non-gynaecological specimens: validation check
Luis Eduardo Barrera-Herreraa, Yubelly Abello a, Nathalie Ruiza y Paula Andrea Rodríguez-Urregoa,b,*
a Departamento de Patología y Laboratorio, Hospital Universitario Fundación Santa Fe de Bogotá, Bogotá D. C., Colombia
b Facultad de Medicina, Universidad de los Andes, Bogotá D. C., Colombia
* Autor para correspondencia. Correo electrónico: paula.rodriguez@fsfb.org.co (P.A. Rodríguez-Urrego).
Recibido el 17 de febrero de 2015; aceptado el 4 de enero de 2016 Disponible en Internet el 12 de marzo de 2016
Resumen
Objetivo: Evaluar el uso de base líquida de manera rutinaria para muestras no ginecológicas en nuestro laboratorio mediante una verificación de la validación y comparación de características morfológicas y la concordancia diagnóstica entre dos técnicas: citología convencional por citocentrífugado (CS) y citología de base líquida SurePathTM (CBL).
Metodología: Consecutivamente se procesaron un total de 109 muestras no ginecológicas por las dos técnicas, usando una sola muestra dividida, la mitad de la muestra para cada técnica. Todas las láminas fueron revisadas por el mismo citopatólogo evaluando: celularidad, preservación, presencia de elementos que oscurecen (inflamación, hemorragia, moco, otros) y presencia de grupos de diagnóstico para cada categoría de diagnóstico final. Retrospectivamente se realizó una evaluación de conformidad con la biopsia de seguimiento cuando estaba disponible.
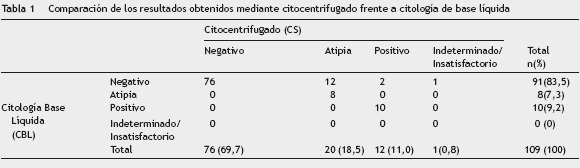
Resultados: Se observó una concordancia buena por categoría diagnóstica en el 84% de las muestras, con un índice Kappa bueno (0,65). La proporción en categorías: negativo, atípicos y positivas fue del 69%, 18% y 11% para citología de base líquida y el 83%, 7% y 9% para citología convencional por citocentrífugado.
Conclusión: La citología de base líquida es una técnica equiparable a la citología convencional por citocentrífugado (concordancia diagnóstica buena, índice kappa 0,6) y es superior en calidad ya que presenta una preservación inmediata de la muestra, un fondo limpio y menos elementos que oscurecen permitiendo un mejor examen morfológico.
Palabras clave: Técnicas de citología; Estudios de validación; Muestras no ginecológicas.
Abstract
Objective: The objective of this study was to evaluate the routine use of liquid based cytology for non-gynecologic specimens in our laboratory, comparing morphological characteristics and diagnostic agreement between the two techniques: conventional cytology cytospin, and SurePath liquid-based cytology.
Study design: A total of 109 consecutive non-gynecologic specimens were processed, split into two, and then prepared using the two techniques. All slides were reviewed by the same cytopathologist, who evaluated: cellularity, preservation, obscuring elements (inflammation, bleeding, mucus, etc.), and presence of diagnostic groups for each final diagnostic category. When available, an evaluation of the biopsy was performed retrospectively.
Results: Good agreement was observed by diagnostic category in 84% of specimens, with a good Kappa index (0.65). The proportion for each category: negative, atypical, and positive was 69%, 18%, and 11%, respectively, for cases processed by liquid-based cytology and 83%, 7%, and 9%, respectively, for conventional cytology cytospin.
Conclusion: Liquid based cytology is equivalent to conventional cytology cytospin when cases are grouped by category (good agreement, kappa index 0.651), and is superior in quality because the specimen is well preserved, has a clean background and fewer obscuring elements allowing a better morphological examination.
Keywords: Cytology techniques; Validation studies; Non-gynaecological specimens.
Introducción
El uso rutinario de la citología de base líquida SurePath (CBL) fue aprobado desde 1996 por la Administración Federal de Medicamentos y Alimentos de Estados Unidos (FDA) para procesar muestras ginecológicas, posteriormente su uso se difundió para el uso de muestras no ginecológicas.
La CBL es una técnica de enriquecimiento celular que permite obtener las células dispuestas en monocapa o capa delgada a partir de una muestra que se puede fijar inmediatamente y por lo tanto está bien preservada disminuyendo los artefactos por desecación así como las muestras insatisfactorias, ya que además de concentrar las células, reduce la sangre, la inflamación y el moco1. Otras ventajas adicionales son la disminución del tiempo de tamizaje por dos motivos, uno por tener mejor calidad y el segundo por concentrar las células en un pequeÑo círculo de 13 mm (CBL SP), con niveles superiores de sensibilidad diagnóstica y la posibilidad de usar el material residual para estudios y/o técnicas auxiliares como por ejemplo estudios de ADN para detección del virus del papiloma humano, FISH o estudios de inmunohistoquímica2,3.
En la literatura el uso rutinario de CBL para procesar muestras no ginecológicas es controversial, especialmente en aspiraciones con aguja fina ACAF. Al procesar las muestras pueden presentar diversos artefactos que cambian la arquitectura usual de un extendido como la fragmentación. Igualmente se disminuye el material de fondo dificultando el diagnóstico en lesiones donde esta característica es fundamental para el diagnóstico como, por ejemplo, en muestras de tiroides y neoplasias con matriz como las de glándulas salivares. También se ha descrito como una técnica que a pesar de tener buena calidad no justifica el sobrecosto, sobre todo en muestras como las de orina4,8. El presente estudio tiene como objetivo evaluar el uso de base líquida de manera rutinaria para muestras no ginecológicas en nuestro laboratorio mediante una verificación de la validación y comparación de características morfológicas y la concordancia diagnóstica entre dos técnicas: citología convencional por citocentrífugado (CS) y citología de base líquida Sure-Path (CBL).
Métodos
Se realizó una revisión retrospectiva de un total de 109 muestras no ginecológicas obtenidas consecutivamente, usando una sola muestra dividida, la mitad de la muestra para cada técnica evaluada primero por CBL y luego por CS. Teniendo en cuenta que en patología quirúrgica y en citología no existen estándares internacionales para revisión de la validación, el presente trabajo está orientado según los parámetros usados en patología clínica de los estándares americanos del Clinical Laboratory Improvement Amendments (CLIA), para verificaciones de la validación de tipo cualitativo tomando como límite inferior 20 muestras9.
Las muestras correspondían a 48 mujeres y 62 hombres entre los 11 y 80 años de edad (edad media: 56 años) y fueron obtenidas por exfoliación espontánea y/o aspiración con aguja fina y se incluyeron todas las muestras que pudieran ser preservadas en un medio líquido. Las muestras correspondieron a: 77 muestras de orina (O), 9 líquidos peritoneales (LP), 6 lavados broncoalveolares (LBA), 6 líquidos pleurales (LPL), 5 líquidos cefalorraquídeo (LCR), 2 aspirados de la glándula tiroides (GT), 2 masas ováricas (OV), 1 aspirado de mama (S) y 1 quiste sistema nervioso central (SNC). Cada muestra se dividió en dos y se procesó mediante CBL y citología convencional por citocentrífugado (CS).
Las muestras para procesar por CS fueron examinadas primero macroscópicamente retirando moco y coágulos. Posteriormente se tomó con una pipeta de plástico de 4 a 6 gotas de la muestra en fresco y se colocó la muestra en dos citoclips, los cuales fueron llevados a la centrífuga de CS a 600 rpm x 6 mn. Luego, se retiraron en posición vertical, una de las láminas se fijó en alcohol y se tiño con H&E y la otra lámina se fijó al aire y se tiño con Giemsa.
Las muestras procesadas mediante CBL fueron primero agitadas para obtener una muestra homogeneizada, el moco y los coágulos macroscópicamente visibles fueron eliminados. Se evaluó el volumen recibido, si este era menor a 20 cc se completaba hasta 40 cc con fijador (Cytorich), por el contrario si era un volumen mayor a 20 cc, la muestra se llevaba a centrifugación en fresco durante 10 min a 1866 rpm, y posteriormente el sobrenadante se decantó. Sobre el material concentrado se adicionó fijador (CytoRich blue o red según la presencia macroscópica de sangre, excepto en muestras de orina) se llevó el volumen a 40 cc con previo vortex y se dejó fijar el material por lo menos 30 min. La suspensión en fijador fue llevada a volumen de 40 cc y llevada a un segundo ciclo de centrifugación, 10 minutos a 1866 rpm. El sobrenadante se decantó y fue llevado al vortex por 5 segundos y la muestra fue evaluada para la presencia de botón celular visible. Si no se observó formación de botón, se agregó 10 cc de buffer pH, vortex y se realizó transferencia del material a tubo de 12 cc. Si el botón celular era visible se tomaban 1 a 5 gotas de la muestra y se transferían a un tubo de 12 cc, al cual se le agregó 10 cc de buffer y vortex. Este volumen de 10 cc fue llevado a una tercera centrifugación durante 10 min a 1866 rpm.
Se decantó el sobrenadante, se homogenizó en el vortex y se colocó en el procesador de BD-Prepstain cargado con tubos premarcados de 12 cc. Se ejecutó el programa de procesador PrepStain BD de muestras no ginecológicas obteniendo dos láminas por caso a excepción de los lavados broncoalveolares, donde además se realizaron tinciones especiales para hemosiderina, Gram, Ziehl Nielsen, PAS y Gomori (por ambas técnicas). De cada rack Prep se decantó el sobrenadante y uno a uno cada delimitador de campo fue retirado, lavándose con etanol y Xilol sin exceder de 5 min en este último. Las láminas fueron coloreadas con Papanicolau y H&E.
Las láminas fueron revisadas por el mismo patólogo, experto en el campo de citología, quien evaluó la celularidad, preservación, presencia de elementos que oscurecen y de grupos de diagnóstico en una escala de 0 a 3 cruces (+). Los casos se clasificaron por categorías diagnósticas en negativo, atípico, positivo o no diagnóstico para ambas técnicas. Se compararon y correlacionaron de forma retrospectiva con la histología cuando estaba disponible.
El nivel de concordancia de las dos técnicas según las dos categorías fue calculado con el índice Kappa (GraphPad Software, Inc.) considerando un índice de Kappa: < 0,2 Concordancia baja; > 0,2 pero < = 0,4 Aceptable; > 0,4-< = 0,6 Moderado; > 0,6-< = 0,8 Bueno; > 0,8-< = 1 Excelente10.
Resultados
Los resultados al comparar cada categoría de diagnóstico mostraron 94 acuerdos correspondientes al 82,64% de las observaciones (tabla 1). La concordancia diagnóstica entre las dos técnicas cuando se agruparon los diagnósticos por categorías fue buena (índice Kappa = 0,651 (95% CI: 0,690,79)).
Los 14 casos discordantes correspondieron a 11 O, 1 LBA, 1 S y 1 LPE. Todos los casos estaban en la categoría negativa por CS vs. 12 atípicos y 2 positivos en LBC-SP (tabla 2).
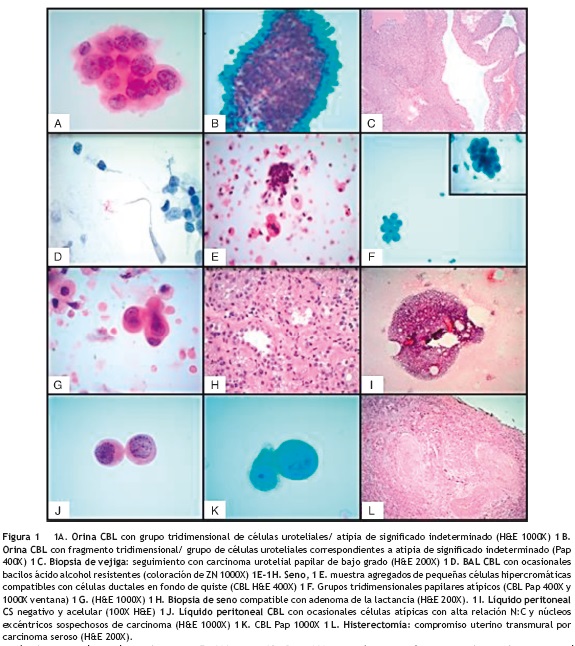
En relación con las muestras de orina (O) discordantes que presentaron grupos de células uroteliales (fig. 1A y 1B) y de las cuales se desconocía el método de recolección de muestra, solo un paciente que presentó en su CBL de orina un grupo de células uroteliales atípicas (fig. 1B) tenía correlación histológica positiva para carcinoma urotelial papilar de bajo grado (fig. 1C). Con respecto a las otras orinas discordantes, dos de los diez pacientes tenían antecedente de carcinoma urotelial. A todos los pacientes se les agregó una nota que decía: ‘‘La presencia de grupos de células uroteliales en una muestra de orina por micción espontánea se considera un hallazgo anormal y puede ser vista en casos de instrumentación, cálculos o neoplasia urotelial de bajo grado, correlación clínica es necesaria".
El LBA discordante fue un caso negativo, pero que en la coloración de ZN por CBL mostró ocasionales bacilos ácido-alcohol resistentes que no estaban presentes en el ZN por CS (fig. 1D).
La aspiración del quiste de seno mostró en el CS únicamente macrófagos sin representación del componente epitelial; sin embargo, en la CBL se observaron además del fondo de quiste, agregados tridimensionales de células epiteliales hipercromáticas compatibles con células ductales (fig. 1E) y algunos grupos tridimensionales papilares atípicos con núcleos excéntricos, citoplasmas vacuolados y nucléolo prominente (figs. 1F y 1G). Por los hallazgos atípicos se recomendó biopsia que mostró un adenoma de la lactancia (fig. 1H).
El último caso discordante correspondió a un líquido peritoneal que en CS fue negativo y acelular (fig. 1I) pero en CBL mostró ocasionales células marcadamente atípicas con alta relación N:C y núcleo excéntrico sospechosas para carcinoma (figs. 1J y 1K). La paciente fue llevada a histerectomía total, la cual fue positiva para carcinoma seroso uterino con compromiso transmural (fig. 1L).
Solamente 16 casos del total de casos categorizados como atípicos, sospechosos o positivos tenían seguimiento histológico. Cuando se compararon las características de la muestra, la CBL fue superior a la CS ya que mostró mayor celularidad, mejor preservación sin artefactos por desecación y además el 97% de los casos de CBL no tenían elementos que oscurecen (inflamación, sangre o moco) (tabla 3).
Discusión
La CBL para muestras ginecológicas se ha utilizado desde 1991 y desde entonces su uso se ha extendido en patología11. Su aplicación a muestras no ginecológicas ha presentado resultados contradictorios a favor y en contra de la CBL sobre la CS8,12. Sin embargo, un amplio número de publicaciones coinciden con los resultados del presente estudio, en donde la CBL permitió obtener una muestra de mejor calidad con un extendido celular más uniforme, menor artefacto por desecación, mayor celularidad o concentración celular, disminución de elementos que oscurecen (moco, sangre, etc.) y permitió preservar la morfología celular ya que la muestra es fijada inmediatamente. Lo anterior, facilitando el estudio morfológico por parte del patólogo al obtener muestras con alta calidad de tinciones y de esta forma logrando disminuir las muestras insatisfactorias o no diagnósticas1,2,6,7,12-16.
Entre otras ventajas de la CBL también se incluye: obtención estandarizada de la muestra, fácil transporte al laboratorio, automatización completa o parcial del procesamiento de la muestra, reducción del número de láminas por espécimen (1 a 9), reducción en el tiempo de interpretación, posibilidad de preparar láminas adicionales para coloraciones especiales, inmunohistoquímica y pruebas moleculares, y finalmente las muestras pueden ser almacenadas por periodos más amplios en caso de requerir estudios adicionales disminuyendo la repetición del número de procedimientos12,13.
Aunque la mayor parte de los criterios citomorfológicos utilizados para cualquier técnica en citología son los mismos, se ha observado que el procesamiento de las bases líquidas en algún tipo de muestras, especialmente en aspiraciones con agujas finas de algunos órganos o tumores como lo son tiroides, tumores de la parótida como el adenoma pleomorfo y tumores de hueso y tejidos blandos entre otros, se altera el material del fondo el cual es algunas veces indispensable para hacer un diagnóstico adecuado. Esto dificulta la interpretación, y por lo tanto, requiere personal con experiencia y estudios de validación de las dos técnicas para poder reconocer los cambios en la calidad y cantidad de este material3. Otra desventaja es que la fijación inmediata de la muestra hace que el material residual no pueda ser usado para técnicas que requieren tejido en fresco, como por ejemplo, la citometría de flujo, cariotipo, y/o cultivos entre otros13.
Los estudios que han comparado la CS con la CBL en muestras no ginecológicas en su gran mayoría presentan evidencia a favor de la CBL en términos de celularidad y citomorfometría, asociado además a una tasa menor de muestras insatisfactorias17. En el caso de la CBL se ha descrito como una técnica mucho más útil y costo efectiva que los CS18. El aporte del presente trabajo radica en presentar nuestra experiencia en la verificación de validación de la CBL en muestras no ginecológicas así como incentivar su aplicación en laboratorios colombianos. Sin embargo, destacamos la necesidad de tener personal entrenado en CBL para evitar el sobrediagnóstico. El presente estudio fue únicamente evaluado por un citopatólogo que analizó las dos técnicas, lo cual genera un sesgo de observación ya que se puede incrementar artificialmente el acuerdo entre las mismas. Finalmente el presente estudio está limitado por la escasa evaluación de conformidad con la histología, ya que la gran mayoría de los casos eran negativos y no requerían un procedimiento adicional y además no estaba disponible en la totalidad de casos atípicos, sospechosos y/o positivos.
En conclusión la CBL tiene un rendimiento similar que la CS cuando se comparan categorías diagnósticas con una concordancia buena (Kappa = 0,65) y ofrece una muestra de calidad superior con: aumento de la celularidad, fijación adecuada y disminución de factores que oscurecen. Nuestro estudio está limitado debido a los pocos casos con estudio histopatológico, ya que en la mayoría de los casos cuando el diagnóstico es negativo no se requiere un procedimiento de excisional adicional. Debido a esto, no es posible estimar la sensibilidad o especificidad de cada técnica con precisión; sin embargo, en los casos en los cuales se pudo evaluar la conformidad con la prueba gold standard es posible concluir que la CBL fue más precisa para concluir casos verdaderos negativos, por lo cual es necesario realizar estudios con mayor número de muestras. Consideramos que es indispensable realizar estudios de verificación de validación y entrenamiento para aprender a interpretar los artefactos de procesamiento y disminución de material de fondo principalmente en muestras de aspiración con aguja fina.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Fuente de financiación
Hospital Universitario Fundación Santa Fe de Bogotá - Departamento de Patología y Laboratorio.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Stabile SAB, Evangelista DHR, Talamonte VH, Lippi UG, Lopes RGC. Comparative study of the results from conventional cervico-vaginal oncotic cytology and liquid-based cytology. Einstein São Paulo Braz. 2012;10:466-72. [ Links ]
2. Birdsong G, Davey D, Darraugh T, Elgert P, Henry M. The Bethesda System for Reporting Cervical Cytology. 2 nd ed. New York: Springer; 2004. [ Links ]
3. Cox JT. ASCCP practice guidelines: management issues related to quality of the smear. 997;1:100-106 p. [ Links ]
4. Guo M, Hu L, Martin L, Liu S, Baliga M, Hughson MD. Accuracy of liquid-based Pap tests: comparison of concurrent liquid-based tests and cervical biopsies on 782 women with previously abnormal Pap smears. Acta Cytol. 2005;49:132-8. [ Links ]
5. Michael CW, McConnel J, Pecott J, Afify AM, Al-Khafaji B. Comparison of ThinPrep and TriPath PREP liquid-based preparations in nongynecologic specimens: a pilot study. Diagn Cytopathol. 2001;25:177-84. [ Links ]
6. Sass MA. Use of a liquid-based, thin-layer Pap test in a community hospital. Impact on cytology performance and productivity. Acta Cytol. 2004;48:17-22. [ Links ]
7. Nance KV. Evolution of Pap testing at a community hospital: a ten year experience. Diagn Cytopathol. 2007;35:148-53. [ Links ]
8. Geers C, Bourgain C. Liquid-based FNAC of the thyroid: a 4-year survey with SurePath. Cancer Cytopathol. 2011;119: 58-67. [ Links ]
9. Clinical and Laboratory Standards Institute. User Verification of Performance for Precision and Trueness; Approved Guideline-Second Edition. CLSI document EP15-A2. Wayne, Pennsylvania USA, Vol.17, 2005. [ Links ]
10. Viera A, Garrett J. Understanding interobserver agreement: the kappa statistic. Fam Med. 2005;37:360-3. [ Links ]
11. Laucirica R, Bentz JS, Souers RJ, Wasserman PG, Crothers BA, Clayton AC, et al. Do liquid-based preparations of urinary cytology perform differently than classically prepared cases? Observations from the College of American Pathologists Interlaboratory Comparison Program in Nongynecologic Cytology. Arch Pathol Lab Med. 2010;134:19-22. [ Links ]
12. Lu DY, Nassar A, Siddiqui MT. High-grade urothelial carcinoma: comparison of SurePath liquid-based processing with cytospin processing. Diagn Cytopathol. 2009;37:16-20. [ Links ]
13. Hoda RS. Non-gynecologic cytology on liquid-based preparations: A morphologic review of facts and artifacts. Diagn Cytopathol. 2007;35:621-34. [ Links ]
14. Studeman KD, Ioffe OB, Puszkiewicz J, Sauvegeot J, Henry MR. Effect of cellularity on the sensitivity of detecting squamous lesions in liquid-based cervical cytology. Acta Cytol. 2003;47:605-10. [ Links ]
15. Grace A, McBrearty P, Troost S, Thornhill M, Kay E, Leader M. Comparative study: conventional cervical and ThinPrep Pap tests in a routine clinical setting. Cytopathol Off J Br Soc Clin Cytol. 2002;13:200-5. [ Links ]
16. Fontaine D, Narine N, Naugler C. Unsatisfactory rates vary between cervical cytology samples prepared using ThinPrep and SurePath platforms: a review and meta-analysis. BMJ Open. 2012;2:e000847. [ Links ]
17. Rana DN, O'Donnell M, Malkin A, Griffin M. A comparative study: conventional preparation and ThinPrep 2000 in respiratory cytology. Cytopathol Off J Br Soc Clin Cytol. 2001;12:390-8. [ Links ]
18. Liu C, Wen Z, Li Y, Peng L. Application of ThinPrep bronchial brushing cytology in the early diagnosis of lung cancer: a retrospective study. PloS One. 2014;9:e90163. [ Links ]