Introducción
El cáncer de mama es la primera causa de cáncer en el mundo con 1.671.149 casos nuevos y 521.907 muertes cada año 1. En Colombia según GLOBOCAN se presentaron 8.686 casos en 2012 y fallecieron 2.649 pacientes en el mismo periodo 1. El pilar del tratamiento del cáncer de mama es la cirugía con radioterapia adyuvante y quimioterapia neoadyuvante o adyuvante 2-6.
Los estudios del Danish Breast Cancer Cooperative Group (DBCG) 82 b y c evaluaron la efectividad de la radioterapia adyuvante en pacientes con tumores de más de 5 cm o con ganglios positivos, la tasa de recurrencia después de 18 añnos fue de 73% sin radioterapia comparado con 59% en las pacientes que recibieron radioterapia (p < 0,001), la recurrencia local fue del 49% sin radioterapia y 14% con radioterapia (p < 0,001)7,8. El uso de radioterapia también redujo la frecuencia de desarrollo de metástasis a distancia de 64% a 53% (p < 0,001) 7,8. Estos estudios se realizaron empleando técnicas de radioterapia en dos dimensiones (2 D) 7,8.
Desde el 2010, con el desarrollo tecnológico, en el Instituto Nacional de Cancerología (INC) se han incorporado técnicas de tratamiento tridimensionales (3D-CRT) con las que se puede reducir la toxicidad asociada a la radioterapia 9,10. En el INC existe un vacío respecto a los desenlaces oncológicos y la toxicidad derivada de los tratamientos con nuevas técnicas de radioterapia empleadas. El propósito del estudio es determinar la supervivencia global, la supervivencia libre de recurrencia y la toxicidad con la radioterapia conformada en la institución.
Diseño del estudio y selección de pacientes
Se hizo un estudio retrospectivo, descriptivo, de tipo cohorte histórica. Se seleccionaron mujeres mayores de 18 años con diagnóstico histopatológico de cáncer de mama postmastectomía en estadios I a III, tratadas con radioterapia externa técnica conformada en el INC, entre el periodo: 1 de enero de 2010 y 31 de diciembre de 2011. Se excluyeron las pacientes con tumores in situ. Una vez identificados los pacientes que cumplían los criterios de elegibilidad, se extrajo la información de la historia clínica digital por uno de los co-investigadores. Los datos se recolectaron en REDCAP y la veracidad de la información fue verificada por la Unidad de Análisis del INC.
Cirugía y estudio histopatológico
El tratamiento quirúrgico primario fue realizado en el INC. Se realizó mastectomía y la disección de ganglios axilares en los niveles I y II. El examen histopatológico se realizó de acuerdo con el protocolo institucional e incluyó el tipo histológico del tumor según la Organización Mundial de la Salud (OMS), la clasificación histopatológica, el perfil hormonal y Ki-67 11.
Radioterapia
La simulación se realizó en supino, con plano inclinado, con brazos arriba y soporte de brazos, los cortes de la tomografía se realizaron cada 3 mm, la delimitación de volúmenes se realizó de acuerdo con las guías de RTOG de 2009 12. Se administró radioterapia a la pared torácica, incluida la cicatriz quirúrgica y a la fosa supraclavicular a la totalidad de las pacientes. La dosis prescrita fue de 50 Gy a la reja costal y a la fosa supraclavicular, administrado en 25 fracciones en un periodo de 5 semanas. Se utilizaron las recomendaciones de restricciones de dosis dadas por el QUANTEC y NSABP 13 anexo 1. Todas las pacientes fueron tratadas en acelerador lineal con energía de 6 MeV.
Análisis estadístico
Se realizó un análisis descriptivo. Las variables categóricas nominales y ordinales se resumieron mediante distribuciones de frecuencias absolutas y relativas. Con respecto a las variables continuas se utilizaron medidas de tendencia central y medidas de dispersión. La supervivencia global se calculó por el método de Kaplan-Meier. El evento se definió como muerte, el tiempo 0 fue la fecha de finalización del tratamiento con radioterapia y la fecha al evento fue la fecha de último seguimiento. La supervivencia libre de recaída, se calculó entre el tiempo 0 definido como la fecha de finalización de la radioterapia, el evento fue la documentación clínica o por otro método de recaída de la enfermedad, y la fecha al evento fue la fecha donde se realizó el diagnóstico de recaída. Para ambas funciones de supervivencia se censuraron los pacientes en la última fecha de seguimiento en el instituto o en la fecha en que se realizó la llamada telefónica, si no han presentado el evento (muerte o recaída). El análisis estadístico de la información se realizó en el software STATA 11.0 licenciado para el Instituto Nacional de Cancerología.
Consideraciones éticas
Por tratarse de una revisión de datos retrospectivos es una investigación sin riesgo según el artículo 11 de la resolución 8430 de 1993 del Ministerio de Salud de Colombia. El estudio fue aprobado por el comité de ética en investigación institucional conforme a los estándares internacionales para investigación en humanos.
Resultados
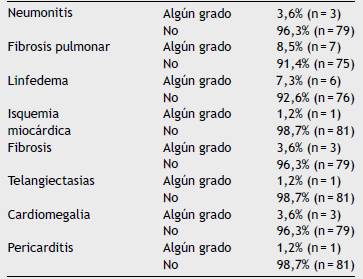
En el análisis se incluyó como población a 82 pacientes tratadas en el periodo descrito y las características de la población se resumen en la tabla 1. La mediana de edad fue 56 años, el 96% de las pacientes presentaban un estadio > IIB. El 98,7% de las pacientes recibió mastectomía radical. El 65,8% presentó ganglios linfáticos positivos, con una mediana de 18 (rango 3 --- 42) ganglios resecados y mediana de 5 ganglios comprometidos. Todas las pacientes se trataron con dosis de 50 Gy con técnica conformacional y recibieron algún tipo de quimioterapia (neoadyuvante, adyuvante o ambas). El 58,5% recibió hormonoterapia y el 21,9% terapia blanco y en el 40,2% de las pacientes se realizó reconstrucción de la mama. Las características del tratamiento se resumen en la tabla 2. A 6 años de seguimiento, el 87,8% (n = 72) siguen vivos con 3 pérdidas en el seguimiento: el 30% recayó, de estos, 76% a nivel sistémico, 12% regional, 12% a nivel regional y sistémico y ninguna local (figs. 1 y 2). El 20,5% de los pacientes presentaron complicaciones relacionadas con el tratamiento (tabla 3).
Tabla 1 Características clínicas de pacientes tratadas con radioterapia postmastectomía entre enero de 2010 y diciembre de 2011, Instituto Nacional de Cancerología.
| Edad (anños) | Mediana 56 (rango 32 - 83) | |
| Estadio | II | 17,0% (n = 14) |
| III | 81,7% (n = 67) | |
| IV | 1,2% (n = 1) | |
| Histología | Ductal infiltrante | 84,1% (n = 69) |
| Lobulillar infiltrante | 7,3% (n = 6) | |
| Otro | 8,4% (n = 7) | |
| Biología | Luminal A | 42,6% (n = 35) |
| Basal like | 25,6%(n = 21) | |
| Luminal B | 21,9%(n = 18) | |
| Her 2 | 7,3% (n = 6) | |
| Desconocido | 2,6% (n = 2) | |
| Grado histológico | Grado 1 | 9,7% (n = 8) |
| Grado 2 | 59,7% (n = 49) | |
| Grado 3 | 28,0% (n = 23) | |
| Sin información | 2,4% (n = 2) | |
| Invasión | No | 46,3% (n = 38) |
| linfovascular | Sí | 53,6% (n = 44) |
Tabla 2 Características del tratamiento recibido de pacientes tratadas con radioterapia postmastectomía entre enero de 2010 y diciembre de 2011, Instituto Nacional de Cancerología.
| Radioterapia | 3D-CRT | 100% (n = 82) |
| 50 Gy (fracciones | 100% (n = 82) | |
| de 2 Gy) | ||
| Días | 33 | |
| Cirugía | Mastectomía | 1,2% (n = 1) |
| simple | ||
| Mastectomía | 98,7% (n = 81) | |
| radical | ||
| Manejo de axila | Ganglio centinela | 1,2% (n = 1) |
| Vaciamiento axilar | 97,5% (n = 80) | |
| Sin información | 1,2% (n = 1) | |
| Ganglios resecados | Mediana | 18 (rango 3 - 42) |
| Compromiso | Positivos | 65,8% (n = 54) |
| ganglionar | ||
| Ganglios | Mediana | 5 (rango 0 - 31) |
| comprometidos | ||
| Quimioterapia | Neoadyuvante | 25,6% (n = 21) |
| Adyuvante | 19,5% (n = 16) | |
| Ambas | 54,8% (n = 45) | |
| Homonoterpia | No | 41,4% (n = 34) |
| Sí | 58,5% (n = 48) | |
| Terapia blanco | No | 76,8% (n = 63) |
| Sí | 21,9% (n = 18) | |
| Sin información | 1,2% (n = 1) |
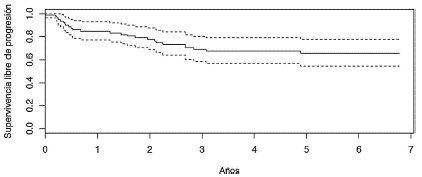
Figura 1 Supervivencia libre de progresión de pacientes tratadas con radioterapia postmastectomía entre enero de 2010 y diciembre de 2011, Instituto Nacional de Cancerología.
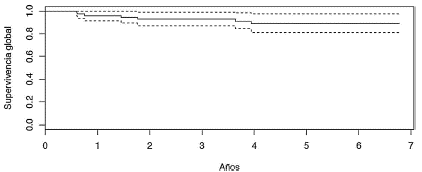
Figura 2 Supervivencia global de pacientes tratadas con radioterapia postmastectomía entre enero de 2010 y diciembre de 2011, Instituto Nacional de Cancerología.
Discusión
El estudio Danish Breast Cancer Cooperative Group 82b (DBCCG 82b) aleatorizó a 1.789 mujeres premenopáusicas con cáncer de mama, postmastectomía, con compromiso de ganglios axilares, tamanño tumoral mayor de 5 cm, o invasión de la piel o fascia pectoral a manejo adyuvante con radioterapia a la pared torácica y los ganglios linfáticos regionales frente a la quimioterapia CMF (ciclofosfamida, metrotexate, 5-fluororacilo) exclusiva 7. Este estudio demostró que la radioterapia postmastectomía no solo logró una reducción sustancial de la falla locorregional del 32% al 9% sino también una mejoría significativa en la supervivencia global del 45% al ??54%. En el análisis multivariado, el estudio encontró que el tamaño del tumor primario, el número de ganglios linfáticos afectados, el grado, la edad y el uso de la radioterapia fueron todos predictores independientes significativos de cualquier tipo de recaída o muerte 7.
En la serie actual en la que los criterios de radioterapia adyuvante fueron dados por los resultados del DBCCG 82b y 82c se evidencia que a 6 años de seguimiento el 87,8% (n = 72) de las pacientes han sobrevivido; sin embargo, nuestra cohorte tiene un tiempo de seguimiento inferior al del DBCCG 82b, lo que puede explicar la baja mortalidad observada a 6 años. Otro factor importante que puede explicar la diferencia en la mortalidad es el uso de CMF como terapia adyuvante en el DBCCG 82b, este esquema en la actualidad ha sido reemplazado por terapias sistémicas más efectivas que han demostrado incrementar la supervivencia de estas pacientes 14.
En referencia al control locorregional, es una fortaleza del estudio el adecuado vaciamiento axilar con mediana de 18 ganglios resecados, no obstante, el 66% de las pacientes presentaba compromiso ganglionar axilar con mediana de 7 ganglios positivos por paciente, frente a 49,8% en el DBCCG 82b, siendo estos factores pronósticos para recaída locorregional 7,15,16. A pesar del alto riesgo de recaída locorregional, la proporción de pacientes con este desenlace es del 12% y se encuentra dentro del rango reportado en los ensayos clínicos, ver tabla 4 7,8. Todas las recaídas locorregionales ocurrieron a nivel ganglionar, este hallazgo puede ser relacionado con el bajo uso de radioterapia nodal en zonas distintas a la fosa supraclavicular que ha demostrado mejorar el control locorregional 17, sin embargo, es necesario ampliar el tamaño de la muestra observada y el tiempo de seguimiento para confirmar este hallazgo 18.
Tabla 4 Comparación con resultados de ensayos clínicos.
| Estudio | Seguimiento | Pacientes | Brazo de tratamiento | Recurrencia locorregional | Supervivencia global |
| 82 b (7) | 10 años | 1.708 | Radioterapia | 9% | 54% |
| No radioterapia | 32% | 45% | |||
| 82 c (8) | 10 años | 1.375 | Radioterapia | 8% | 45% |
| No radioterapia | 35% | 36% | |||
| 82 b/c (16) | 18 años | 3.083 | Radioterapia | 14% | 37% |
| No radioterapia | 49% | 27% | |||
| Serie actual | 6 años | 82 | Radioterapia | 12% | 87,8% |
El 20,5% de las pacientes experimentaron algún tipo de complicaciones relacionadas con el tratamiento, la naturaleza retrospectiva hace que se deba tener cautela al hacer conclusiones sobre la toxicidad por las limitaciones en el registro de su presentación y la variabilidad de escalas para su graduación; sin embargo, la alta adherencia al tratamiento con radioterapia con 33 días de duración promedio y la baja frecuencia de pérdidas en el seguimiento (3,66% n = 3) pueden explicar una toxicidad aguda aceptable.
Dentro de las debilidades del estudio se encuentra la recolección retrospectiva de la información que aumenta el riesgo de sesgos de selección y de información. Existe la posibilidad de sesgo de confusión dado que el resultado de la supervivencia global y de la recurrencia no fue ajustado por el efecto de variables pronósticas como el uso de nuevos esquemas de quimioterapia, estadio, entre otros años años 14. No fue posible realizar ajuste multivariado a causa del limitado tamaño de muestra y la baja frecuencia de eventos por variable, que puede generar falsos negativos de las pruebas estadísticas.
Finalmente, este estudio concluye que los resultados del manejo multimodal de cáncer de mama localmente avanzado en las pacientes examinadas son similares a lo reportado por los ensayos clínicos. Es necesario en futuros estudios evaluar los factores asociados a recaída regional en la institución.