Introducción
La radioterapia de intensidad modulada (IMRT) se define como una técnica de modulación de la intensidad del haz de radiación mediante un algoritmo de cálculo que permita la planeación inversa1. En la práctica clínica nacional e internacional existen diversas recomendaciones sobre el uso o no uso de esta técnica en pacientes con cáncer, sin que exista evidencia explícita de tipo protocolo clínico que brinde información detallada para su adecuada administración. Por tal motivo el INC en 2014 desarrolló el Protocolo de indicaciones para IMRT1 y donde planteó los escenarios específicos para el adecuado uso de esta técnica. Debido a la incertidumbre sobre la aparición de nueva evidencia o cambios en las conductas clínicas en oncología, en 2017 se decidió realizar el proceso de actualización de la búsqueda del protocolo, cuyo objetivo principal fue establecer, con base en la mejor evidencia disponible, las indicaciones para la utilización de la técnica IMRT en el tratamiento de las patologías oncológicas tratadas más frecuentemente en el servicio de oncología radioterápica del INC.
Métodos
Se realizó un proceso de actualización de evidencia que siguió los pasos del Manual para la elaboración de Protocolos Clínicos en el Instituto Nacional de Cancerología2. De acuerdo a lo señalado por este Manual, se conformó un grupo desarrollador de actualización de protocolos (GDP) integrado por especialistas y médicos en formación en radioterapia oncológica, epidemiólogos clínicos y un especialista en estudios cualitativos. Se revisaron alcances y objetivos, y posteriormente se revisaron y definieron las preguntas claves de interés. La versión completa del protocolo se encuentra disponible en: https://www.cancer.gov.co/files/libros/archivos/IMRT%20071118.pdf.
Búsqueda de la información
Se realizó una búsqueda sistemática de la literatura en las bases de datos de MEDLINE y EMBASE, vía embase.com. Como fuentes de información adicionales se buscaron referencias de artículos incluidos y se consultaron a expertos en el tema. En cuanto a la búsqueda de guías de práctica clínica, guías basadas en consenso, protocolos clínicos informados en la evidencia y protocolos basados en consenso, se revisaron los siguientes organismos compiladores y elaboradores de guías: National Institute for Health and Care Excellence (NICE), Scottish Intercollegiate Guidelines Network (SIGN), National Comprehensive Cancer Network (NCCN), American Society for Radiation Oncology (ASTRO), Cancer Care Ontario (CCO), Centro Nacional de Excelencia Tecnológica en Salud (CENETEC), Ministerio de Salud y Protección Social (Minsalud), y The Royal College of Radiologist (RCR). También se realizaron búsquedas en los metabuscadores Google y Google Scholar. Las búsquedas fueron realizadas con filtros de fecha del 1 de enero de 2014 hasta el 8 de febrero de 2017 y donde fue posible se diseñaron estrategias usando operadores booleanos, operadores de proximidad, truncadores, términos de lenguaje controlado y términos de lenguaje libre.
Selección, calificación y síntesis de la evidencia
Se incluyeron guías de práctica clínica, guías basadas en consenso, protocolos clínicos o basados en consenso que reportaran algún tipo de orientación a favor o en contra del uso de la técnica IMRT. Para revisiones sistemáticas, ensayos clínicos y estudios no aleatorizados se consideró evidencia que realizaran la comparación directa entre la técnica IMRT y la radioterapia externa 3D conformacional (3D-CRT), que reportaran desenlaces relacionados con la supervivencia global, supervivencia libre de enfermedad y calidad de vida para pacientes con cáncer (condiciones).
Dos integrantes del grupo de actualización revisaron los títulos y los resúmenes de manera independiente, así como la revisión y selección de textos completos. Las diferencias fueron sometidas a una evaluación por parte de un tercer integrante del grupo. Una vez seleccionados los documentos teniendo en cuenta los criterios descritos previamente, se procedió a calificar la información de acuerdo con el tipo de evidencia; las guías de práctica clínica se evaluaron con la herramienta AGREE II3, los ensayos clínicos aleatorizados mediante la herramienta de riesgo de sesgos del grupo Cochrane4, y los ensayos no aleatorizados mediante las herramientas de evaluación de calidad de la evidencia para estudios observacionales de SIGN5. Posteriormente, se procedió a la elaboración de los resúmenes de evidencia para las condiciones de interés mediante síntesis textual narrativa. Para la elaboración de las indicaciones finales, se usó como documento de referencia el protocolo existente, para la extracción de las indicaciones preliminares y una vez compilada la actualización de la evidencia, el grupo desarrollador revisó las indicaciones existentes y concertó el nuevo listado de indicaciones a ser validadas mediante consenso formal.
La contextualización de la nueva evidencia y la generación del listado de indicaciones finales del protocolo fueron realizados mediante consenso formal tipo RAND/UCLA. En primer lugar, se envió un resumen de la evidencia y un cuestionario por correo electrónico a los médicos participantes del consenso que incluyó profesionales de los servicios de urología, seno y tejidos blandos, neurooncología, cirugía de tórax, gastroenterología, ginecología, medicina interna y oncología radioterápica. Además, se realizaron visitas para contestar cualquier duda que tuvieran. Posteriormente, se pidió a los participantes que votaran por cada una de las recomendaciones propuestas en una escala de uno a nueve (de completamente en desacuerdo a totalmente de acuerdo). Se consideró que el consenso se alcanzaba en las siguientes situaciones: cuando la mediana y su intervalo de confianza estaban en la zona de acuerdo (7 a 9) o en la zona de desacuerdo (1 a 3) y cuando al menos el 80% de los votos estaban en la zona de acuerdo o en la zona de desacuerdo. Si se logró un acuerdo durante la primera ronda de votación, no hubo discusión, de lo contrario se celebraron reuniones de toma de decisiones. La evidencia fue presentada nuevamente a los participantes, así como nueva evidencia propuesta por ellos; esto fue seguido por una discusión donde todos los miembros del panel pudieron expresar sus comentarios y opiniones, y de forma inmediata todos los asistentes votaron usando un sistema interactivo electrónico de respuesta de la audiencia. Si se lograba un acuerdo entre los participantes en el proceso de toma de decisiones no se realizaban más rondas de discusión y en caso contrario se realizaba una discusión complementaria y una tercera votación.
Finalmente, una vez consolidadas las indicaciones del protocolo se realizó un proceso de priorización considerando la factibilidad de generar un indicador de medición y la necesidad de supervisión de dicha práctica en la institución. En esta priorización se incluyeron a todos los participantes del proceso de consenso más las directivas institucionales.
Resultados
Pregunta 1. ¿Cuál es la efectividad de la técnica IMRT comparada con la técnica 3D-CRT en los pacientes con cáncer de próstata o pene que requieren radioterapia?
Indicaciones del uso de la técnica IMRT en pacientes con cáncer de próstata o pene
1.1. Se debe considerar la IMRT como primera opción en los pacientes con cáncer de próstata de riesgo intermedio y alto que requieran tratamiento con radioterapia.
1.2. En pacientes con cáncer de próstata de bajo riesgo, se puede usar la técnica IMRT o la técnica 3D-CRT conformacional de acuerdo con el criterio médico.
1.3. Para mejorar los desenlaces oncológicos y la calidad de vida es obligatorio en pacientes con cáncer de próstata de alto riesgo adicionar a la técnica IMRT la técnica IGRT.
1.4. Se debe utilizar la IMRT como primera opción de radioterapia de salvamento en pacientes con cáncer de próstata.
1.5. El uso de la técnica IMRT en pacientes con cáncer de pene debe ser discutido en la junta de casos especiales, de acuerdo con las características clínicas de cada caso.
Resumen de la actualización y contextualización de la evidencia
Entre el periodo 2014-2017 las recomendaciones sobre el uso de la técnica IMRT para cáncer de próstata se han abordado en dos guías de práctica clínica (GPC) y dos guías basadas en consenso (GBC). Tres de estos documentos6-8recomendaron la radioterapia con haz externo como una alternativa terapéutica en pacientes con cáncer de próstata de riesgo intermedio9 o alto riesgo con posibilidades de control de enfermedad a largo plazo9 o en pacientes sometidos a prostatectomía radical con márgenes quirúrgicos positivos7,9. Para pacientes con bajo riesgo, una GPC recomendó la radioterapia como alternativa en los pacientes que hayan estado bajo vigilancia activa y presenten progresión9. Dos GBC recomendaron la inclusión de la técnica de radioterapia guiada por imagen (IGRT)8,9, bien fuera en hipofraccionamiento con IMRT en pacientes seleccionadas con enfermedad localizada8 o simplemente para mejorar la exactitud del tratamiento9. En lo que respecta a la radioterapia en el manejo del cáncer de pene se encontró una GBC que recomendó el uso de radioterapia externa o braquiterapia sola o adyuvante en tumores T1-2 y la quimiorradioterapia con radioterapia externa en pacientes en estadios T3-4 o N+10. La guía no recomendó algún tipo específico de radioterapia externa.
Junto a la evidencia provista por guías, la actualización encontró un estudio observacional que evaluó la calidad de vida mediante el cuestionario EPIC-26 en 5.727 pacientes con cáncer de próstata con diferentes tipo de riesgo encontrando que los pacientes sometidos a radioterapia externa presentaban peores puntajes en los dominios relacionados con: función sexual (diferencia promedio a los 24 meses -14,31; IC95% -17,98 a -10,64); aspectos hormonales (diferencia promedio a los 24 meses: -5,17; IC95% -7,47 a -2,86); aspectos intestinales (diferencia promedio a los 24 meses: -8,62; IC95% -10,54 a -6,69); irritación urinaria (diferencia promedio a los 24 meses: -5,86; IC95% -8,14 a -3,57), y continencia urinaria (diferencia promedio a los 24 meses: -5,78; IC95% -9,27 a 2,28)11.
Como parte del proceso de contextualización de la evidencia encontrada y la validación de las indicaciones, se encontró que la nueva evidencia no ha modificado de forma significativa la dirección ni las recomendaciones realizadas por GPC publicadas antes de 2014 para el uso de la radioterapia en cáncer de próstata12 ni por el protocolo clínico desarrollado en 20141 y que aún persiste la ausencia de información sobre el uso o no uso de la técnica IMRT en pacientes con cáncer de próstata de bajo riesgo. Teniendo en cuenta esto, se deciden proponer como indicaciones el uso de la técnica IMRT en pacientes con cáncer de próstata de riesgo intermedio que requieran tratamiento con radioterapia (mediana de acuerdo primera ronda: 9; IC95% 9 a 9), la selección de la técnica IMRT o 3D-CRT en pacientes con cáncer de próstata de bajo riesgo que sean sometidos a radioterapia (mediana segunda ronda: 9; IC95% 8,68 a 9).
Además, como nuevo hallazgo del proceso de actualización, se encontró la recomendación de la adición de la técnica IGRT a la radioterapia externa, la cual desde el punto de vista clínico mejora la precisión con la que se entrega la dosis a la próstata, la cual varía su posición debido a variaciones en el volumen vesical y rectal; considerando esto se decidió indicar esta práctica en los pacientes con cáncer de próstata de alto riesgo (mediana de acuerdo primera ronda: 9; IC95% 8 a 9). De forma complementaria, en cuanto al uso de la técnica IMRT como terapia de salvamento, teniendo en cuenta la experiencia institucional, se decide indicar como técnica estándar (mediana de acuerdo primera ronda: 9; IC95% 9 a 9). Finalmente, se encontró que persiste la ausencia de evidencia que permita soportar el uso de la técnica IMRT en cáncer de pene, por lo que se indicó que esta debe evaluarse en junta médica (mediana de acuerdo primera ronda: 9; IC95% 8,71 a 9).
Pregunta 2. ¿Cuál es la efectividad de la técnica IMRT comparada con la técnica 3D-CRT en los pacientes con cáncer de cabeza y cuello que requieren radioterapia?
Indicaciones del uso de la técnica IMRT en pacientes con cáncer de cabeza y cuello
2.1. La IMRT es la técnica estándar de tratamiento con radioterapia en los pacientes con cáncer de cabeza y cuello.
2.2. Se debe usar la técnica IMRT como primera opción en el manejo de los pacientes con cáncer de cabeza y cuello que requieren reirradiación.
Resumen de la actualización y contextualización de la evidencia
Las indicaciones de IMRT en este contexto fueron soportadas por dos revisiones sistemáticas de la literatura13,14. Una de ellas incluyó un ensayo clínico y 19 series de casos en los que se evidenciaba que los pacientes sometidos a IMRT tenían una mejor y más rápida recuperación en función salivar en comparación que los pacientes que no recibían esta técnica; este hallazgo fue interpretado como un desenlace relacionado con la calidad de vida de los pacientes13. Asimismo, se evidenció que en estudios observacionales, los pacientes con cáncer de senos paranasales sometidos a IMRT presentaban menor riesgo de ceguera en comparación con los pacientes que no la recibieron13. La otra revisión sistemática reportó diferencias a favor de la IMRT en comparación con la técnicas 2D o 3D-CRT respecto a la frecuencia de xerostomía (HR 0,76; IC95% 0,66 a 0,87), sin encontrar diferencias entre los grupos en la supervivencia global o el control local en pacientes con cáncer localizado en cabeza y cuello14.
Dentro de la nueva evidencia, se encontró una GPC15, una GBC para cáncer de cabeza y cuello16 y una revisión sistemática17. Ninguna de las dos guías encontradas brindó recomendaciones específicas sobre el uso de la IMRT14, 15. Por su parte, la revisión sistemática encontró que el tratamiento con IMRT, comparado con la técnica 3D-CRT, demostraba un beneficio en algunos dominios de calidad de vida en general (cuestionario EORTC-QoL-C30 (mayor puntaje mejor): funcionamiento emocional puntaje a los 12 meses: 3D-CRT: 86, IMRT: 98, p= 0,008; funcionamiento de rol puntaje a los 12 meses: 3D-CRT: 86, IMRT: 98, p= 0,008, y funcionamiento social puntaje a los 24 meses: 3D-CRT: 85, IMRT: 95, p= 0,03). Así como en varios dominios específicos de cáncer de cabeza y cuello (cuestionario HN-35 (mayor puntaje peor): boca seca (puntaje a los 12 meses: 3D-CRT: 48, IMRT: 33, p= 0,05); rol en sexualidad (puntaje a los 42 meses: 3D-CRT: 6, IMRT: 22, p= 0,02); contacto social (puntaje a los 24 meses: 3D-CRT: 11, IMRT: 1, p=0,01) y apertura de boca (puntaje a los 24 meses: 3D-CRT: 22, IMRT: 7, p= 0,04)17).
Teniendo en cuenta la información encontrada más la experiencia clínica e institucional, se generó la indicación de utilizar la IMRT como primera opción en el manejo de los pacientes con cáncer de cabeza y cuello que requieran radioterapia, la cual logró un acuerdo unánime en la primera ronda de votación (mediana de acuerdo 9; IC95% de 9 a 9). Del mismo modo, al someter a consenso formal la indicación de utilizar la IMRT como primera opción en el manejo de los pacientes con cáncer de cabeza y cuello que requieran reirradiación, también se obtuvo acuerdo unánime en la primera ronda de votación (mediana de acuerdo 9; IC95% de 9 a 9).
Pregunta 3. ¿Cuál es la efectividad de la técnica IMRT comparada con la técnica 3D-CRT en los pacientes con cáncer de piel que requieren radioterapia?
Declaración sobre el uso de la técnica IMRT en pacientes con cáncer de piel
3.1. No hay evidencia que soporte el uso de la técnica IMRT en el manejo de los pacientes con cáncer de piel.
Resumen de la actualización y contextualización de la evidencia
Durante el periodo 2014-2017, cinco GPC18-22y seis GBC23-28generaron recomendaciones de radioterapia para pacientes con cáncer de piel sin realizar recomendaciones específicas sobre el uso de la técnica IMRT. Estos documentos refirieron que la radioterapia se reserva de manera frecuente para pacientes mayores de 60 años con carcinoma basocelular23 o escamocelular25; además, sugirieron el uso de radioterapia adyuvante en: pacientes con melanoma en estadio IIIB o IIIC20; pacientes con melanoma que presenten un alto riesgo de recurrencia en el sitio primario después de la resección curativa cuando no se logran los márgenes libres adecuados21; pacientes con melanoma desmoplástico con el fin de mejorar el control local o que tengan ganglios positivos o presentaciones que predigan un riesgo alto de recaída ganglionar26; pacientes con dermatofibrosarcoma protuberans27, y pacientes con carcinoma de células de Merkel28. Por otro lado, una GPC recomendó no ofrecer este tipo de radioterapia en pacientes con melanoma en estadio IIIB o IIIC a menos que se estime que una reducción del riesgo de recidiva local supere el riesgo de efectos adversos significativos22.
Dada la ausencia de evidencia directa sobre el uso de la técnica IMRT en cáncer de piel, la versión 2014 del protocolo clínico estableció que no era posible generar indicaciones basadas en la evidencia para el uso de la técnica IMRT en pacientes con cáncer de piel en otras localizaciones diferentes a cabeza y cuello1. La actualización de la evidencia no mostró evidencia directa acerca del uso de la técnica en pacientes con cáncer de piel y durante el proceso de revisión externa y validación se decidió realizar una declaración que reiterara la ausencia de evidencia acerca del uso de esta técnica en pacientes con esta condición.
Pregunta 4. ¿Cuál es la efectividad de la técnica IMRT comparada con la técnica 3D-CRT en los pacientes con cáncer del sistema nervioso central que requieren radioterapia?
Indicación del uso de la técnica IMRT en pacientes con tumores del sistema nervioso central
4.1. Se debe considerar la técnica IMRT en pacientes con tumores del sistema nervioso central que estén localizados muy cerca de estructuras críticas (como nervio óptico, vía óptica, quiasma, tallo cerebral, médula espinal, etc.) y que tengan especificado en su plan terapéutico el uso de radioterapia externa.
Resumen de la actualización y contextualización de la evidencia
Las indicaciones de IMRT en pacientes con tumores del sistema nervioso central (SNC) fueron soportadas por una revisión sistemática12, que identificó series comparativas de casos en pacientes con glioblastoma multiforme, astrocitoma maligno o meduloblastoma pediátrico. Solo para astrocitoma se observó que el grupo que recibió IMRT comparado con el grupo tratado con irradiación de haz externo convencional tuvo una mayor tasa de supervivencia global (71,4% vs. 54,6%, p < 0,0001) y supervivencia libre de progresión (71,4% vs. 26,4%, p = 0,046) al año. Para meduloblastoma pediátrico, la IMRT mostró reducción de ototoxicidad en el grupo de niños tratados con IMRT comparado con los que recibieron radioterapia convencional (p < 0,014, estimadores de asociación no reportados)1,13.
Además, se encontraron dos GBC para tumores del SNC29,30 que recomendaron que la dosis prescrita puede modificarse para mantener la dosis en estructuras críticas dentro de límites aceptables y que las técnicas conformacionales, como 3D-CRT o IMRT y el uso de radioterapia basada en imágenes pueden ser necesarias cuando los órganos en riesgo están cerca del objetivo29, delimitando de esta manera estructuras críticas y el tejido no comprometido30.
Teniendo en cuenta la información encontrada más la experiencia clínica e institucional, se consideró que en tumores con localizaciones críticas (cerca de órganos sanos tales como el tallo cerebral, la hipófisis, el quiasma óptico, entre otros) y con un mayor riesgo de complicaciones secundarias tardías por toxicidad ocasionada por radiación ionizante se dé preferencia a técnicas que permitan la mejor delimitación de los órganos a riesgo. De esta forma, el grupo desarrollador consideró que sigue vigente la indicación de la primera edición del protocolo y a favor del uso de la técnica IMRT en pacientes que tengan tumores del sistema nervioso central localizados cerca de estructuras críticas1 con el fin de no afectar la calidad de vida. Esta indicación fue validada por los expertos en la primera ronda de votación (mediana de acuerdo de 9; IC95% 9 a 9).
Pregunta 5. ¿Cuál es la efectividad de la técnica IMRT comparada con la técnica 3D-CRT en los pacientes con cáncer de mama que requieren radioterapia?
Indicaciones para el uso de la técnica IMRT en cáncer de mama
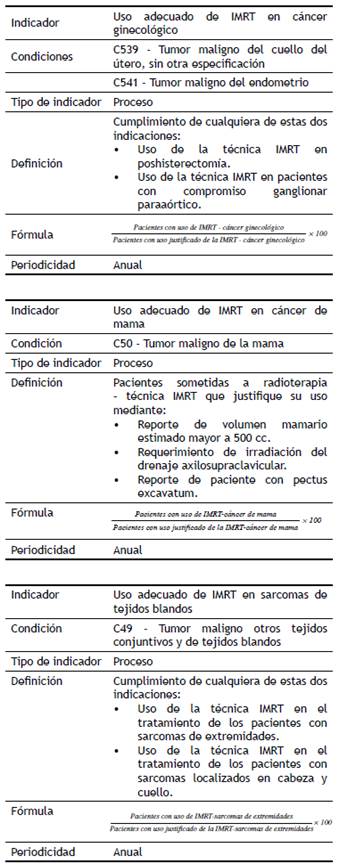
5.1. El manejo con la técnica IMRT en cáncer de mama debe ser individualizado y no debe usarse como tratamiento estándar en todas las pacientes.
5.2. Se debe preferir la técnica IMRT en pacientes con cáncer de mama que requieran radioterapia y que cumplan con una de las siguientes condiciones:
Resumen de la actualización y contextualización de la evidencia
Como resultado del proceso de actualización de la evidencia, se encontró una GBC14,31y el reporte de los datos de seguimiento de dos ensayos clínicos que compararon el uso de la IMRT frente a la radioterapia externa convencional 2D32 o 3D-CRT32,33. Mientras que la guía recomendó el uso de la IMRT en casos en donde se requiera administrar la dosis objetivo con mayor homogeneidad31, los ensayos clínicos no reportaron diferencias estadísticamente significativas a los 5 y 10 años de seguimiento entre las técnicas en desenlaces relacionados con la supervivencia global, la supervivencia libre de recurrencia, la apreciación estética33, ni en desenlaces reportados por las pacientes, tales como: alteraciones en la piel, dolor, hipersensibilidad, inflamación, contractura de la mama32 o la calidad de vida33.
Teniendo en cuenta que la radioterapia es un componente clave en el manejo de las pacientes con cáncer de mama, que las guías nacionales no han generado recomendaciones a favor de algún tipo de técnica de radioterapia en específico34, que las guías internacionales recomiendan el uso de la técnica IMRT en casos específicos31, y que la IMRT no está recomendada como la técnica estándar de tratamiento1, la primera versión del protocolo de indicaciones de IMRT de 2014 indicó el uso de esta técnica en pacientes con cáncer de mama que tuvieran mamas grandes, pectus excavatum, o en aquellas donde la dosis de tolerancia de los órganos a riesgo (OAR) o la cobertura homogénea del área blanco no pueda ser obtenida con la radioterapia externa 3D-CRT1. Al comparar estos resultados con los obtenidos en el proceso de actualización, se ratificó la vigencia de la indicación durante la primera ronda de votación sobre la individualización de la técnica IMRT en casos específicos dado que no es la técnica estándar (mediana de acuerdo de 9; IC95% 7 a 9) y la indicación del uso de la técnica en pacientes con mamas grandes (definidas como mayores a 500 cc), pacientes en quienes se requiera irradiar el drenaje supraclavicular y pacientes con pectus excavatum (mediana de acuerdo de 9; IC95% 7,11 a 9).
Pregunta 6. ¿Cuál es la efectividad de la técnica IMRT comparada con la técnica 3D-CRT en los pacientes con sarcomas de tejidos blandos que requieren radioterapia?
Indicaciones para el uso de la técnica IMRT en sarcomas de tejidos blandos
6.1. Se debe usar radioterapia externa, técnica IMRT como primera opción en pacientes con sarcomas de tejidos blandos localizados en cabeza y cuello.
6.2. Se debe preferir la técnica IMRT a la técnica 3D-CRT en el tratamiento de los pacientes con sarcomas de extremidades.
6.3. En pacientes con sarcomas recidivantes que requieran reirradiación, debe ser usada preferencialmente la técnica IMRT.
Resumen de la actualización y contextualización de la evidencia
Durante el periodo de actualización 2014-2017, una GPC35 y dos GBC36,37 generaron recomendaciones de radioterapia en pacientes con sarcomas de tejidos blandos. Estos documentos encontraron que el uso de la técnica IMRT junto con la radioterapia guiada por imagen han demostrado presentar mejoría en el control local de los sarcomas de tejidos blandos35. Se puede considerar su uso de manera pre o posoperatoria en pacientes con sarcomas de extremidades y de cabeza y cuello en los cuales se logre una resección completa, así como en pacientes con sarcomas de retroperitoneo en los que se prevé no se logre una resección completa36, o cuando la dosis óptima de fraccionamiento no puede ser alcanzada empleando las técnicas convencionales37.
Adicional a la evidencia proporcionada por las guías, se encontró un ensayo clínico fase I/II realizado en pacientes con sarcomas en retroperitoneo y que reportó los siguientes desenlaces clínicos medidos a 5 años: tasa de control local 72%, tasa de progresión libre de enfermedad 40% y tasa de supervivencia global 74%38. Además, se encontró un estudio observacional realizado en pacientes con sarcomas en extremidades y que no encontró diferencias estadísticamente significativas para la supervivencia global (68,1% vs. 75,6%), pero sí las encontró a favor de la IMRT para disminuir el riesgo de recurrencia local (Hazard Ratio ajustado = 0,46; IC95% 0,24 a 0,89)39.
Al comparar los resultados de la actualización con la evidencia disponible hasta 2014, se encontró que las indicaciones generadas en la primera edición previa del protocolo1 seguían vigentes; además, teniendo en cuenta la experiencia clínica institucional, el grupo desarrollador decidió realizar unas precisiones adicionales. En el proceso de validación se encontró que la indicación acerca del uso de la técnica IMRT en pacientes con sarcomas de tejidos blandos localizados en cabeza y cuello obtuvo un acuerdo unánime en la primera ronda de votación (mediana de acuerdo de 9; IC95% 8 a 9), al igual que la indicación sobre el uso preferencial de la IMRT en pacientes con sarcomas recidivantes que requieran reirradiación (primera ronda de consenso mediana de acuerdo de 9; IC95% 7,71 a 9); mientras que en lo referente al uso de la IMRT en el tratamiento de pacientes con sarcomas de extremidades se obtuvo el acuerdo en segunda ronda de votación, una vez se realizaron precisiones sobre los comparadores considerados (mediana de acuerdo de la segunda ronda: 9; IC95% 8 a 9).
Indicación del uso de la técnica IMRT en pacientes con cáncer de pulmón
7.1. El uso de la técnica IMRT en pacientes con cáncer de pulmón debe ser discutido en junta de casos especiales, de acuerdo al estadio, la histología y el estado funcional.
Resumen de la actualización y contextualización de la evidencia
Durante el periodo de actualización, dos GPC40,41 y cuatro GBC37,42-44generaron recomendaciones de radioterapia para pacientes con cáncer de pulmón. Estos documentos recomendaron de manera indistinta tanto la técnica 3D-CRT como la IMRT: en pacientes en estadio IA como terapia adyuvante40; en pacientes en estadios IIB a IIIB como terapia adyuvante o de manera concomitante con quimioterapia40; en pacientes con enfermedad limitada que la reciban de forma concomitante con quimioterapia basada en cisplatino, y en individuos con enfermedad limitada que tengan compromiso T1-T2 y ganglionar N0-N1 de manera concomitante a la quimioterapia40,44. Además, una GBC42 recomendó el uso de la técnica IMRT u otra tecnología avanzada cuando se necesite administrar radioterapia curativa de manera segura; de manera similar otra GBC37declaró que la IMRT no solo tiene una mejor dosimetría sino que también puede mantener las restricciones del tejido normal comparado con la radioterapia estándar cuando se usa en tumores voluminosos en ciertas regiones anatómicas, tales como el canal paravertebral.
Junto a la evidencia proporcionada por las guías, se incluyó una revisión sistemática45 que evidenció que el uso de la técnica IMRT reduce el riesgo de neumonitis por radiación grado 2 (RR: 0,74; IC95% 0,59 a 0,93; 4 estudios, 981 pacientes) y aumenta el riesgo de desarrollar esofagitis por radiación grado 3 (RR: 2,47; IC95% 1,95 a 3,14; 4 estudios, 1.339 pacientes), sin encontrar diferencias significativas para la supervivencia global al compararla con la técnica 3D-CRT (HR ajustado: 0,96; IC95% 0,90 a 1,03; 5 estudios, 12.896 pacientes). También se encontró el reporte de un análisis secundario del ensayo clínico NRG Oncology clinical trial-RTOG 061746, que tampoco encontró diferencias estadísticamente significativas en la supervivencia global (3D-CRT: 49,4%; IC95% 42,9% a 55,5%; IMRT: 53,2%; IC95%; 46,4% a 59,6%; p = 0,597) ni en la supervivencia libre de enfermedad (3D-CRT 27,0°%; IC95% 21,5°% a 32,7°%; IMRT 25,2°%; IC95% 19,7% a 31,1%; p = 0,595) a los dos años de seguimiento.
Teniendo en cuenta los resultados de la actualización de la evidencia se confirma la vigencia de la indicación generada en la versión previa del protocolo (1), el grupo de actualización decidió mantener la indicación de individualizar la técnica de radioterapia en pacientes con esta condición, lo cual fue validado por los participantes del consenso formal durante la primera ronda de votación (mediana 9; IC95% 7 a 9).
Pregunta 8. ¿Cuál es la efectividad de la técnica IMRT comparada con la técnica 3D-CRT en los pacientes con cáncer gastrointestinal que requieren radioterapia?
Indicaciones del uso de la técnica IMRT en pacientes con cáncer del tracto gastrointestinal
8.1. La IMRT debe utilizarse en pacientes con diagnóstico de cáncer de esófago y cáncer de la unión gastroesofágica y estómago cuyos planes de tratamiento de 3D-CRT conformacional no cumplan las dosis límite en órganos sanos.
8.2. Se debe usar la técnica IMRT si se requiere escalamiento de dosis en carcinoma de esófago cervical.
8.3. Se debe realizar junta multidisciplinaria para definir la técnica de radioterapia a usar en los pacientes con cáncer gastrointestinal recurrente o en situaciones anatómicas especiales.
8.4. Se debe preferir la técnica IMRT para tratar pacientes con cáncer anal.
Resumen de la actualización y contextualización de la evidencia
Como resultado del proceso de actualización de evidencia se encontraron dos GPC47,48 y ocho GBC49-57. Las dos GPC no brindaron recomendaciones explícitas ni a favor ni en contra de la técnica IMRT47,48, al igual que tres GBC51-53. En cuanto a las GBC que realizaron consideraciones especiales sobre la técnica IMRT, se encontraron dos GBC49,50que declararon que en pacientes con cáncer del tracto gastrointestinal superior la IMRT es apropiada en entornos clínicos en los que la reducción de la dosis a órganos de riesgo (por ejemplo, corazón, pulmones) no se puede lograr mediante técnicas tridimensionales en pacientes con cáncer de esófago, de la unión gastroesofágica y de estómago. Asimismo, otra GBC55 declaró que en pacientes con cáncer de recto, el uso de la IMRT debe condicionarse para situaciones clínicas tales como la reirradiación o la presencia de situaciones anatómicas únicas. Finalmente, en relación con el carcinoma anal, una GBC56 recomendó la IMRT sobre la 3D-CRT en este contexto, de acuerdo con los resultados del estudio RTOG-0529.
Al comparar la evidencia proveniente de la actualización con las indicaciones propuestas en la primera versión del protocolo donde se reportó ausencia de evidencia suficiente para recomendar la IMRT en pacientes con cáncer de origen gastrointestinal a excepción de pacientes con cáncer del canal anal y pacientes con cáncer rectal que requieran reirradicación1, se expuso que se requería individualizar las indicaciones de uso de la técnica IMRT de acuerdo al sitio anatómico. De esta forma, para el tracto gastrointestinal superior se estableció como primera indicación condicionar el uso de la IMRT a pacientes con cáncer de esófago, unión gastroesofágica y estómago, en cuyos planes de tratamiento con 3D-CRT no cumplan la dosis límite en órganos sanos; la cual fue validada en primera ronda (mediana de acuerdo de 8,5; IC95% 7,1 a 9). Por otro lado, reconociendo que el cáncer localizado en la porción cervical del esófago tiene ciertas particularidades (son pacientes no quirúrgicos cuya estructura a riesgo es la médula espinal cervical), el grupo de actualización decide proponer como indicación adicional el uso de la técnica IMRT en pacientes con carcinoma de esófago cervical que requieren escalamiento de dosis la cual fue validada en la primera ronda de consenso (mediana de acuerdo de 9; IC95% 9 a 9). Ahora bien, para el caso del tracto gastrointestinal inferior, y en particular para cáncer de colon/recto y cáncer de hígado, los hallazgos descritos ratificaron la vigencia de las indicaciones del protocolo previo1, las cuales fueron soportadas por dos GBC55,57 y una revisión sistemática13, que revelaron ausencia de estudios comparativos de la IMRT frente a otras técnicas de radioterapia en este tipo de pacientes e imposibilitando la generación de recomendaciones basadas en la evidencia sobre el uso de la IMRT en estos pacientes57. Dado esto, se generó una indicación condicionando la selección de la técnica de radioterapia a administrar a una junta multidisciplinaria; esta indicación fue validada en la primera ronda de consenso (mediana de acuerdo de 9; IC95% de 8 a 9).
Finalmente, para los pacientes con cáncer de canal anal, se confirmó la vigencia de la indicación generada en la versión previa del protocolo, además que desde la experiencia clínica institucional se ha observado que la técnica IMRT genera un menor abandono del tratamiento por menor morbilidad en los pacientes a quienes se les realiza el esquema Nigro (uso concomitante de quimioterapia con mitomicina-C y 5-fluorouracilo más radioterapia con fines curativos y para preservación del esfínter anal), por lo que se generó una indicación a favor del uso de la técnica IMRT en pacientes con cáncer del canal anal; esta indicación fue validada por los expertos participantes del consenso formal votando a su favor de forma unánime (mediana de acuerdo primera ronda 9; IC95% 9 a 9).
Pregunta 9. ¿Cuál es la efectividad de la técnica IMRT comparada con la técnica 3D-CRT en las pacientes con cáncer ginecológico que requieren radioterapia?
Indicaciones del uso de la técnica IMRT en pacientes con cáncer de origen ginecológico
9.1. Se puede usar la IMRT como escalamiento de dosis en las pacientes con cáncer ginecológico en las que no sea posible administrar técnicamente braquiterapia ginecológica.
9.2. Se debe incluir la IMRT en los planes de tratamiento que incluyan irradiación de la región paraaórtica, especialmente en las pacientes que requieren quimioterapia y radioterapia concomitante por compromiso paraaórtico.
9.3. Se debe preferir el uso de la IMRT en pacientes con cáncer de cuello uterino o cáncer de endometrio poshisterectomía.
9.4. En pacientes con cáncer de vulva, la indicación de IMRT debe ser discutida en junta.
Resumen de la actualización y contextualización de la evidencia
Durante el periodo 2014-2017, una GPC58 y una GBC59 generaron recomendaciones explicitas acerca de la técnica IMRT para el tratamiento de mujeres con cáncer de cuello uterino. Tanto la GPC58 como la GBC59 brindaron recomendaciones débiles a favor de la técnica IMRT en pacientes con cáncer de cuello uterino quienes hubieran recibido tratamiento quirúrgico previo que presentaran compromiso de los ganglios pélvicos paraaórticos por la minimización de la dosis de radiación del intestino y otras estructuras críticas59; además, este documento declaró que la IMRT no debería ser utilizada en pacientes con un cérvix intacto.
En lo referente a cáncer de endometrio, la actualización detectó una GBC disponible en dos versiones60,61. La última versión de la GBC declaró que tanto la técnica 3D-CRT como la técnica IMRT pueden ser empleadas cuando la radiación pélvica o paraaórtica está indicada61.
Respecto al uso de la técnica IMRT en pacientes con cáncer de vulva, la actualización encontró dos GBC37,62 que realizaron recomendaciones de radioterapia para pacientes con cáncer de vulva. Una de las GBC62 declaró que tanto la técnica 3D-CRT como la técnica IMRT pueden ser usadas mientras se garantice la dosis adecuada y la cobertura de los tejidos a riesgo; mientras que la otra GBC37 declaró que tanto la técnica IMRT como la braquiterapia podrían ser empleadas en pacientes con cáncer de vulva inoperable como terapia de refuerzo integrado para irradiar los ganglios primarios involucrados. Como precisiones adicionales, una de las GBC recomendó el uso de un bolus o "falsa estructura" sobre la vulva de las pacientes que vayan a ser tratadas con la técnica IMRT.
Teniendo en cuenta que la braquiterapia ginecológica, adicional a la radioterapia externa, es considerada el tratamiento de primera línea en pacientes con cáncer ginecológico1, la versión anterior del protocolo reportó que la técnica IMRT podía ser considerada como una alternativa en situaciones donde no fuese posible administrar este tipo de radioterapia o cuando se requiriera escalamiento de dosis1. La validez de estos hallazgos fue ratificada durante el proceso de actualización y se estableció que la técnica IMRT se debe usar como escalamiento de dosis en pacientes con cáncer ginecológico en quienes no sea posible administrar técnicamente la braquiterapia ginecológica; esta indicación fue validada por los participantes del consenso formal durante la segunda ronda de votación (mediana de acuerdo 9; IC95% 7,68 a 9). Como indicaciones adicionales a la propuesta por la primera versión del protocolo, el grupo de actualización, con base en una recomendación proporcionada por una GBC62, indicó que el uso de la IMRT en pacientes con cáncer de vulva debe ser discutida en junta (tercera ronda de votación, mediana de acuerdo 9; IC95% 8 a 9); además se indicó la preferencia de la técnica IMRT en pacientes con cáncer ginecológico que requieran de irradiación de la región paraaórtica (primera ronda de votación, mediana de acuerdo 9; IC95% 8,39 a 9) y en pacientes poshisterectomía (primera ronda de votación, mediana de acuerdo 9; IC95% 8 a 9).
Pregunta 10. ¿Cuál es la efectividad de la técnica IMRT comparada con la técnica 3D-CRT en los pacientes con cáncer en urgencias oncológicas que requieren radioterapia?
Indicación del uso de la técnica IMRT en urgencias oncológicas
10.1. No se debe considerar la técnica IMRT como primera opción en el manejo de urgencias oncológicas (compresión medular y síndrome de vena cava superior).
Resumen de la actualización y contextualización de la evidencia
Durante el periodo de actualización se encontró una GPC63, que formuló recomendaciones sobre el uso de la radioterapia en: obstrucción maligna de vía aérea, compresión maligna de la médula espinal y síndrome de vena cava superior (SVCS)63. Si bien las recomendaciones variaron de acuerdo con el tipo de urgencia, la guía no recomendó un tipo de radioterapia en específico y usó como fuente de evidencia un estudio publicado en 1987 que usó radioterapia externa en el manejo de estas condiciones.
Al revisar los resultados de la primera versión del protocolo no se encontró evidencia que soportara el uso de la técnica IMRT en urgencias oncológicas, como el síndrome de vena superior o compresión medular1.
La actualización de la evidencia detectó una guía de muy baja calidad63 que no brindó recomendaciones explícitas acerca del tipo de radioterapia que se debe emplear en este contexto clínico y se considera que persiste la ausencia de evidencia. Esta indicación fue validada por los participantes del consenso formal durante la primera ronda de votación (mediana de acuerdo 9; IC95% 8,1 a 9).