Introducción
El dermatofibrosarcoma protuberans (DFSP) es un sarcoma de diferenciación fibroblástica originado en la piel. Fue descrito por primera vez en 1890 por Taylor, pero fue Darier quien en 1924 lo reconoció como una entidad clínico-patológica independiente. Un año más tarde, en 1925, Hoffman acuñó el término dermatofibrosarcoma protuberans 1,2.
En el Instituto Nacional de Cancerología (INC), entre 1954 a 1987, el DFSP representó el 0,06%o de todas las neoplasias malignas y el 1,17% de todos los sarcomas 3. Según el anuario estadístico de 2016 del INC el DFSP representó el 0,6% de los tumores malignos de la piel con 9 casos nuevos 4. Por ser una enfermedad con alta tendencia a la recurrencia, la cirugía micrográfica de Mohs (CMM) es una alternativa importante de tratamiento 5. En Colombia se tiene experiencia en el uso de esta técnica en la modalidad de parafina para el tratamiento de esta enfermedad 6.
Este artículo es una revisión del DFSP con énfasis en el resultado de la CMM. Los investigadores realizaron una búsqueda de la literatura científica en la base de datos MEDLINE mediante el motor pubmed cruzando distintos términos MeSH: Dermatofibrosarcoma, Epidemiology, In situ hybridization, Pathology, Dermoscopy, Prognosis, Recurrence, Mohs surgery, Margins of excision, Therapy, Surgery, Radiotherapy e Imatinib Mesylate. Se filtraron los artículos más relevantes y se hizo una revisión crítica de los mismos. Algunas publicaciones regionales relevantes por fuera de la base de datos MEDLINE fueron incluidas.
Epidemiología
EL DFSP es una neoplasia rara que representa menos del 0,1% de todas las malignidades 5 y el 18,4% de los sarcomas de tejidos blandos 7. Su incidencia está entre 0,8 y 5 casos/1'000.000 hab/año (8,9), siendo más alta en afrodescendientes, en quienes llega a ser de 7,1 casos/1'000.000 hab/año 8. El grupo etario más afectado es el comprendido entre 20 y 39 años con el 42% al 46,8% de los casos 8,9, seguidos del grupo de 40 a 59 años con el 37,7% y el grupo de 60 a 79 años con el 12,2% 8. Los mayores de 80 años representan solo el 2,1%, los menores de 19 años el 6% (8) y solo el 3% son congénitos 10. La diferencia por sexo es controversial y algunos estudios sugieren predominio masculino 11, mientras que otros sugieren predominio femenino 8,12 y otros no muestran diferencias 13,14. Algunas variantes clínicopatológicas del tumor pueden tener particularidades en su epidemiología, como por ejemplo: el tumor de Bednar que se encuentra más comúnmente en niños y afrodescendientes12,13, el fibroblastoma de células gigantes que es un tumor de la edad pediátrica15 y la variante atrófica que es más frecuente en personas jóvenes 16.
Etiología
Hasta el momento no se han identificado factores causales suficientes o necesarios para desencadenar el DFSP. Hasta el 21% de las personas refieren haber presentado algún tipo de trauma en el sitio del tumor, pero la relación causal de estos eventos es aún cuestionable 17.
Patogénesis
En el 96% de los DFSP hay rearreglos genéticos que involucran los genes que codifican para el colágeno tipo 1 (COL1A1) y el factor de crecimiento derivado de plaquetas subunidad B (PDGFB) 18, bien sea mediante traslocaciones reciprocas t 17,22(q22;q13) o mediante anillos cromosómicos supernumerarios conteniendo el gen de fusión COL1A1/PDGFB 19. Estos rearreglos genéticos ponen el PDGFB bajo el control del promotor de COL1A1 20, lo que lleva a la expresión de la proteína de fusión COL1A1/PDGFB, que se procesa después de la traducción para producir un PDGFB funcional 21 que activa el receptor PDGFBR de manera autocrina y paracrina 22. El PDGFB es un potente mitógeno para las células mesenquimales y la activación constante de su receptor induce el desarrollo del tumor 22. Se han detectado varios subtipos del gen de fusión, sin que se haya encontrado alguna relación entre estos y las características histológicas o clínicas del tumor 23,24. También, se han descrito rearreglos con el COL1A2 y rearreglos que involucran el COL6A3 en mujeres con DFSP de la mama 25. Estos rearreglos pueden detectarse por hibridación fluorescente in situ (FISH) o por reacción en cadena de la polimerasa con transcriptasa reversa (RT PCR) 18.
Clínica
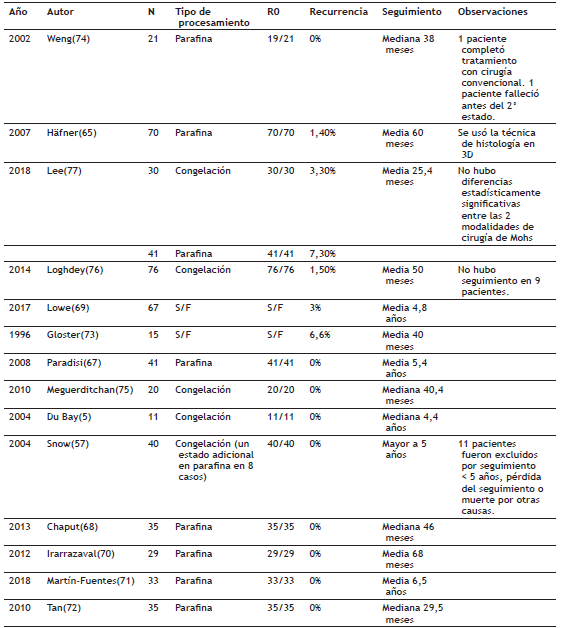
La forma clásica del DFSP consiste en un tumor de color piel, rosado, pardo o violáceo, de consistencia firme (fig. 1). No obstante, la clínica es heterogénea y el tumor puede cambiar con el tiempo de evolución 26. Cuando las lesiones inician pueden tener las características clásicas o carecer del típico crecimiento exofítico; en este último caso el 29% de ellos inician simulando una morfea, el 42% simulando un angioma y 19% simulando atrofoder-mia 10. Con el tiempo es usual que las lesiones adquieran el crecimiento exofítico evidente, esto puede tardar en promedio 7,6 años 10 y sin embargo algunas lesiones se mantienen sin protruir 16. Además del DFSP clásico existen otras formas clínicas de la enfermedad, como: la variante atrófica 27, la variante pigmentada o el tumor de Bednar, la variante fibrosarcomatosa y el fibroblastoma de células gigantes 15.
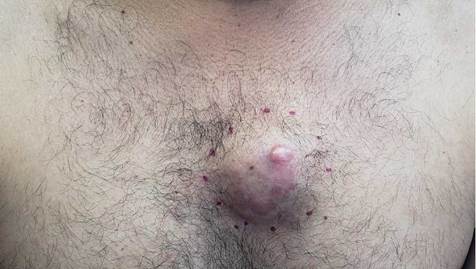
Figura 1 DFSP en el pecho de un hombre adulto. La lesión exhibe características típicas: un tumor firme con áreas eucrómicas y areas rosadas, cuyo mayor volumen está en la dermis y el tejido celular subcutáneo.
El DFSP es un tumor de lento crecimiento, lo que lleva a que en promedio el diagnóstico se haga 10 años después de que aparecieron las primeras manifestaciones 17. Puede ser tan lento el crecimiento y tan demorado el diagnóstico que algunas lesiones congénitas han sido diagnosticadas durante la edad escolar 28.
La localización más frecuente del DFSP es el tronco con el 35% al 77% de los casos 9,11,12, el segundo sitio de presentación son los miembros superiores con una frecuencia del 18% al 28,2% 9,12, seguidos de los miembros inferiores con una frecuencia del 12,5% al 28% 9,12 y la región de cabeza y cuello con el 6,1% 9. La localización en genitales se considera poco frecuente 29. Algunas variantes podrían tener una distribución diferente; el DFSP mixoide tiene predilección por las extremidades 30 y la variante atrófica puede verse más comúnmente en el dorso 16. Los niños tienen particularidades en la localización; son frecuentes en ellos las lesiones acrales, que pueden verse en el 15,3% de los casos 28. Estas son más frecuentes en las manos que en los pies 31. Se han reportado lesiones simultaneas en un mismo paciente y que pueden estar agrupadas como satélites o estar en áreas corporales distintas 32.
Diagnóstico
El diagnóstico clínico requiere un alto índice de sospecha ya que el DFSP puede ser confundido con: neurofibroma, neurilemoma, leiomioma, melanoma, carcinoma basocelular morfeiforme, queloide, sarcoma de Kaposi, fibrosarcoma, dermatofibroma, quiste, angioma, lipoma, morfea, atrofodermia, lipoatrofia, anetodermia y fibroma laxo, entre otros 2,11,27,33. Además de la sospecha clínica se requiere confirmación diagnóstica mediante el estudio histológico de una biopsia de piel. El FISH para identificar el rearreglo t 17,22 en la biopsia de piel puede ser de utilidad para aclarar el diagnóstico en casos seleccionados 34.
Dermatoscopia
Esta es una técnica reciente para el abordaje diagnóstico del DFSP. Los patrones descritos para el DFSP clásico son: la red pigmentada en el 87% de los pacientes, vasos en el 80%, áreas marrón claro sin estructura en el 73%, estrías blanco brillantes en el 67%, fondo rosado en el 67% y áreas hipopigmentadas o despigmentadas en el 60% 35. Los DFSP exhiben al menos dos de estas características al tiempo y los tumores recurrentes pueden exhibir las seis características a la vez 35. La combinación más distintiva de DFSP es la de vasos no enfocados y el retículo de pigmento 36. Algunas de las variantes clínicas del DFSP han mostrado características dermatoscópicas propias; la variante del DFSP similar a angioma muestra vasos arborescentes gruesos de distribución centrífuga sobre un fondo rosado 37, los DFSP similares a queloide se caracterizan por tener vasos polimorfos en fondo blanco azuloso con áreas blancas desestructuradas y el DFSP similar a morfea presenta un área de hipopigmentación central rodeada de una red fina pigmentada con vasos lineares 37.
Histopatología
En la actualidad el método diagnóstico más confiable es la biopsia de piel, no obstante se ha reportado que hasta en un 33% de los casos la biopsia inicial no fue diagnóstica y se requirió del espécimen quirúrgico completo 17. Es recomendable que la biopsia sea profunda y tenga representación de la dermis y el tejido celular subcutáneo 33. La imagen histológica clásica del DFSP corresponde a un tumor de células fusiformes que se disponen en un patrón estoriforme o en rueda de carreta, con alta densidad celular en el centro de la lesión y la disminución de la densidad celular en la periferia donde presenta proyecciones que infiltran el tejido graso 38. Las mitosis son poco frecuentes, usualmente menos de cinco mitosis por campo de 10X 39. La figura 2 muestra los cambios histopatológicos clásicos.
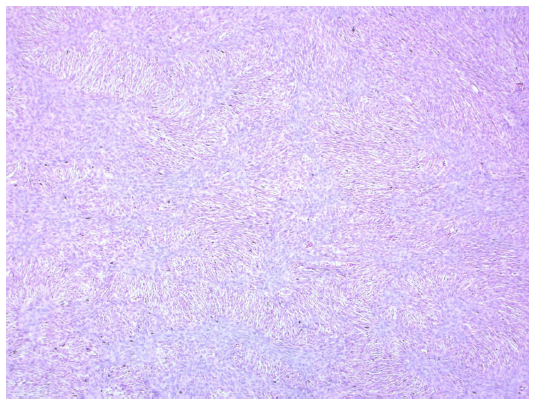
Figura 2 Biopsia de piel con tinción rutinaria de hematoxilina y eosina. Se observan células fusiformes dispuestas en fascículos con los típicos patrones estoriforme y en rueda de carreta.
Además de la forma clásica del DFSP existen variantes histológicas como: la mixoide, la pigmentada o el tumor de Bednar que representan el 1% de los DFSP 40, la forma atrófica, el fibroblastoma de células gigantes y la variante con cambio fibrosarcomatoso que representan el 7,6% de los DFSP 41. El DFSP mixoide se caracteriza por sábanas de células fusiformes de citoplasma eosinófilo con núcleos estrellados, estroma mixoide en más del 50% y vasos prominentes de pared delgada 30. El fibroblastoma de células gigantes muestra un grado variable de células fusiformes con un estroma hialino fibromixoide y hendiduras revestidas por una capa de células gigantes multinucleadas, que son un hallazgo patognomónico 42. El tumor de Bednar presenta células dendríticas cargadas de pigmento 43.
La variante fibrosarcomatosa se caracteriza por una mayor celularidad, atipia citológica, actividad mitótica alta, expresión escasa de CD34 y un patrón de entrelazamiento en espina de pescado 44. Un mismo tumor puede presentar más de una variante histológica 30.
A pesar de los rasgos distintivos del DFSP su evaluación histológica es un reto y su diagnóstico diferencial incluye: la dermatofibroma celular, el neurofibroma, el schwan-noma, el tumor maligno de la vaina neural periférica, el leiomiosarcoma, el liposarcoma mixoide, el fibrosarcoma y el melanoma desmoplásico, entre otros 39. El perfil de inmunohistoquímica del DFSP es CD34 positivo, vimenti-na positivo, nestina positivo, factor XIIIa negativo y S100 negativo 39,45. EL CD34 es el marcador más relevante, su sensibilidad es del 84% al 100% y su especificidad es del 83% (38). Es más frecuente que los DFSP negativos a CD34 correspondan a la variante fibrosarcomatosa 46, pues solamente el 77,3% tiñen con este marcador 21. Los falsos positivos pueden corresponder a otros tumores como el miofibrosarcoma, tumor fibroso solitario, sarcoma epitelioide y angiosarcoma, entre otros 46. El factor XIIIa es otra herramienta útil y usualmente es positivo en el dermatofibroma y negativo en el DFSP, aunque un 10% a 15% de los dermatofibromas pueden ser negativos y en la misma proporción los DFSP pueden ser positivos 46.
FISH
Es usado para la detección del rearreglo entre los cromosomas 17 y 22 19. El 96% de los casos claramente diagnosticados como DFSP y el 91% de los casos catalogados como probables tienen FISH positivo 38. El FISH de fusión dual tiene sensibilidad del 94,33%, especificidad del 100% y un 8,12% de pruebas fallidas 20. La técnica de FISH break apart tiene sensibilidad del 95% y pruebas fallidas del 17,69% 20. El número de señales es mayor en la variante fibrosarcomatosa; con la técnica break apart el número promedio de copias de PDGFB por célula es de 3,47 para el DFSP clásico y de 4,54 en la variante fibrosarcomatosa 21. Además la proporción de células positivas en el FISH es más alto en esta variante 21. El tamaño del tumor también se correlaciona positivamente con una alta proporción de células que presentan señal y el número de señales por célula 47.
Imágenes diagnósticas
El papel de las imágenes radiológicas como método diagnóstico del DFSP es muy limitado. En la ecografía de alta frecuencia se ha reportado una imagen similar a una medusa con un cuerpo oval hipoecoico paralelo a la epidermis, invadiendo el tejido celular subcutáneo a través de unas proyecciones similares a tentáculos 48. En la tomografía se han reportado lesiones ovales, redondas y en tira plana, isodensas o hipodensas y con bordes bien definidos 49. La tomografía puede ser de utilidad cuando se sospeche compromiso óseo 46. La resonancia magnética es la imagen de elección para la evaluación de la extensión subclínica profunda y el planeamiento de la cirugía, pero no es recomendable para evaluar los márgenes laterales 50. Thornton et al. reportaron que la resonancia cambió considerablemente el planeamiento quirúrgico en 2 de 10 niños con DFSP 51. Otra utilidad de la resonancia es el seguimiento de los pacientes tratados. Algunos autores consideran conveniente tener una resonancia de base que facilite la diferenciación entre la imagen de la cicatriz, los cambios posoperatorios y la recurrencia 2. La estadificación rutinaria con imágenes es innecesaria debido a la baja probabilidad de metástasis a distancia, sin embargo, en el DFSP con cambio fibrosarcoma-toso las imágenes del tórax son útiles 52.
Pronóstico
El riesgo de recurrencia después de cirugía convencional es variable. Las primeras publicaciones se caracterizaron por tasas de recurrencias muy altas de hasta el 60% 53, que pudieron relacionarse con márgenes quirúrgicos estrechos, a diferencia de los estudios posteriores que han publicado tasas de recurrencia más favorables. Farma et al. reportaron 1% de recurrencia en un grupo de pacientes operados con mediana de margen lateral de 2 cm y mediana de seguimiento de 64 meses 54. Chang et al. presentaron un grupo de pacientes tratados con márgenes laterales de 3,1 mm en promedio y ellos reportan 16,7% de recurrencia con una mediana de seguimiento de 59 meses 55. Heuvel et al. presentaron un grupo de pacientes que alcanzaron bordes negativos en el 95% de los casos con márgenes laterales de 2 a 3 cm y ellos reportaron una recurrencia global del 7%; sin embargo, los pacientes que alcanzaron márgenes libres confirmados histológicamente (R0) tuvieron control local de la enfermedad en el 100%, lo que sugiere que la amplitud del margen y el estado de los márgenes posquirúrgicos están relacionados con el riesgo de recurrencia 56. El estudio de Monnier et al. apoya esta hipótesis y soporta la idea de que las tasas de recurrencias de los primeros artículos se debieron a márgenes quirúrgicos estrechos; en este estudio se reportaron 50% de recurrencias en los pacientes operados con márgenes de 0,9 cm o menos, mientras que para los pacientes operados con márgenes de 1 a 2,9 cm fue de 46% y para los pacientes operados con 3 cm o más las recurrencias fueron del 7% 17. La localización del tumor también es un factor pronóstico local, se ha visto que el riesgo de recaída en el tronco es de hasta el 21%, mientras que en cabeza y cuello es del 50% al 75% 57. La variante fibrosarcomatosa también es un factor de riesgo para la recurrencia, que puede ser tan alta como 34,5% para esta variante 11.
La profundidad del tumor también es un factor pronóstico de supervivencia libre de enfermedad en los tumores primarios 58. El promedio de tiempo libre de recurrencia después de cirugía se ha reportado entre 1,3 y 2,6 años 11,17, pero han sido reportadas recurrencias hasta 39 años después de la resección 59.
Las metástasis del DFSP son infrecuentes. Las metástasis linfáticas se presentan en el 1% de los casos y las metástasis a distancia se presentan desde < 1% hasta el 7,6% de los casos 9,60. Cuando se presentan los sitios más frecuentes son el pulmón y el hueso, sin embargo también se han descrito en otros órganos 60. La variante fibrosarcomatosa es un factor de riesgo que aumenta la probabilidad de metástasis de 0,4% a 23,5% 11. El tamaño del tumor también se ha propuesto como factor de riesgo para metástasis 60.
La mortalidad del DFSP es baja y ha mejorado en las últimas décadas 13. Se ha reportado supervivencia específica a los 5 y 10 años del 99,8% y 91,1% respectivamente 8. Otras publicaciones reportan incluso supervivencia global a 15 y 30 años del 98% y 97%, respectivamente 13. Son factores de mal pronóstico para mortalidad: ser de sexo masculino y la localización en extremidades o cabeza y cuello 8. La variante fibrosarcomatosa nuevamente es un factor de mal pronóstico en la supervivencia, un estudio reportó supervivencia a 10 años de 66% vs. 98,6% para la forma clásica 11.
Respecto al pronóstico individual de las distintas variantes del DFSP, la variante fibrosarcomatosa es la de peor pronóstico; tiene mayor riesgo de recurrencia local, de metástasis y de muerte 61. El DFSP mixoide tiene el mismo pronóstico de la forma clásica 30. El tumor de Bednar es considerado menos agresivo por algunos autores, de hecho se ha reportado supervivencia a 5 años del 98,5% 12. A pesar de esto también ha reportado menor respuesta de esta variante a la neoadyuvancia con imatinib 62. La variante fibroblastoma de células gigantes tampoco confiere un peor pronóstico, tiene alta tendencia a la recaída local pero no se han reportado metástasis 42. El pronóstico de la forma atrófica es similar al de la forma clásica 63.
Tratamiento
La primera línea de manejo del DFSP ha sido la cirugía, bien sea la cirugía convencional con márgenes amplios o CMM. Los márgenes apropiados para la resección convencional han sido evaluados en múltiples estudios. Cai et al. encontraron recurrencia del 45% con los márgenes laterales de 1 cm o menos, 13,6% con el margen de 15 a 25 mm y 5,7% con los márgenes mayores a 30 mm 11. Los márgenes profundos podrían ser aún más problemáticos que los laterales y pese a esto no han sido tan estudiados 6. Algunos autores han decidido conservar la fascia si prevén que el tumor está localizado solo en la piel y el tejido celular subcutáneo es abundante, pero si la extensión profunda es desconocida y en los casos recurrentes han decidido hacer resección de la fascia con músculo subyacente 64. En nuestra opinión todos los pacientes operados con cirugía convencional deberían incluir al menos la fascia en la resección 1. La cirugía convencional va acompañada de un procesamiento histológico en "tajadas de pan" en el que se evalúa menos del 1% del margen de sección 65. Una opción más racional de abordaje histológico en la cirugía convencional es la técnica en face66 que aumenta la proporción del margen estudiado. Sin embargo, la única manera de examinar el 100% de los márgenes de sección es mediante la CMM 67,68.
La CMM es una técnica quirúrgico-patológica minuciosa que busca retirar el tumor por etapas hasta alcanzar márgenes libres al examinar el 100% de los bordes de sección, lo que llevaría a menor probabilidad de recurrencia 67,68. Algunos autores han mostrado que la CMM tiene menor recurrencia, defectos quirúrgicos más pequeños y menor necesidad de métodos reconstructivos complejos en comparación con la cirugía convencional 69. Con la CMM se han reportado tasas de recaída consistentemente bajas que oscilan entre 0% y 7,3% 5,65,67,77. Las características de algunas de las series más relevantes se encuentran resumidas en la tabla 1.
La técnica usual de la CMM usa cortes por congelación, sin embargo los desgarros de tejido y pérdidas de grasa pueden hacer difícil la interpretación 72, los cordones tumorales pueden ser confundidos con cicatrices recientes o con septos de la hipodermis 70 y pueden verse células fusiformes dispersas aún en la piel normal 78. Por estas razones algunos han usado el inmunomarcador CD34 como un método complementario y otros han variado la técnica para incluir los fragmentos en parafina 72,77. Hay reportes de que el procesamiento puede revelar el tumor que no se vio por congelación 72, sin que hasta la fecha se hayan encontrado diferencias estadísticamente significativas en la proporción de recurrencias entre las dos modalidades 77. En ausencia de estudios prospectivos y aleatorizados, la opinión de los expertos es que el método en parafina es el de elección por ser más preciso 65,68,70,71,79.
No hay un estándar del margen quirúrgico para el primer estado de la CMM. Estudios con cirugía convencional han mostrado que los márgenes menores a 1 cm resultan comprometidos por tumor el 50,2% de las veces 11. Otros autores han reportado márgenes comprometidos en el 21,4% de los tumores resecados con una mediana de margen lateral de 2 cm 75. De acuerdo con lo anterior, iniciar el primer estado de la CMM con un margen menor a 1 cm no es la mejor opción en la mayoría de los casos. En el INC, donde se usa la técnica en parafina, suele iniciarse con un margen lateral mayor a 2 cm.
En el INC se han realizado aproximadamente 70 CMM en parafina con la participación interdisciplinaria del servicio de dermatología oncológica, cirugía de seno y tejidos blandos, cirugía plástica oncológica y otros servicios. El procesamiento histológico es realizado por el mismo dermatólogo que participó en la cirugía, con el fin de asegurar la adecuada orientación y correlación espacial. El procesamiento se hace de una manera exhaustiva para que los cortes histológicos tengan representación del 100% del margen de sección y únicamente contengan tejido que correspondan al margen de sección. La incisión con inclinación de 45° aproximadamente y el decapitado de la pieza quirúrgica buscan facilitar que cada pieza se posicione adecuadamente sobre el papel de filtro que se introduce en el casete de patología para la fijación en formol e inclusión en parafina. Los márgenes de cada pieza son pintados con tintas de al menos dos colores para guardar la orientación. Las láminas son vistas en conjunto por dermatopatólogos expertos y el dermatólogo oncólogo. La figura 3 muestra las dos maneras como usualmente se procesan los DFSP por CMM en parafina en el INC.
Figura 3 Esquema del procesamiento de la pieza quirúrgica. (A) Procesamiento separado del margen lateral y la profundidad de la pieza. En el INC esta técnica es la más común en piezas de gran tamaño y, por lo tanto, es la más usada en el DFSP. Esta variante tiene similitud con la técnica de histología en 3D(65). (B) Procesamiento conjunto del margen profundo y lateral. En el INC esta técnica es más común en piezas pequeñas. Con ambas técnicas se busca incluir fragmentos de menos de 2 cm de diámetro.
El DFSP es un tumor radiosensible que puede ser manejado con radioterapia con fines de adyuvancia o como monote-rapia en casos seleccionados 80. Se han usado dosis de radiación entre 55,8 y 66 Gy con mejoría del control local y reducción del riesgo de recurrencia posoperatoria 80.
La quimioterapia convencional no es efectiva en el control de la enfermedad localmente avanzada 81,82 y solo es una opción cuando las demás terapias han fallado o en la enfermedad metastásica 81. El descubrimiento del mecanismo molecular del DFSP y el papel clave que juega el PDGFB, llevó al uso del imatinib, que es un inhibidor de tirosina quinasa 83. El imatinib a dosis de 400 mg/día o 400 mg 2v/día tiene una tasa de respuesta objetiva de aproximadamente el 50% en pacientes con DFSP metastá-sico o localmente avanzado que presentan el rearreglo t 17,22, incluyendo la variante fibrosarcomatosa 82,84. La neoadyuvancia con imatinib 600 mg/día en pacientes con DFSP primario localmente avanzado o recurrente ha demostrado ser eficaz y bien tolerada, sin embargo no permite disminuir el margen quirúrgico 62. Actualmente el imatinib es el estándar de oro de tratamiento para el DFSP metastásico independientemente del estado del rearreglo genético 46.
La criocirugía ha sido reportada como método de tratamiento del DFSP recurrente. Xu et al. reportaron su experiencia con crioablación percutánea en 19 pacientes que presentaban recurrencia local 85. La recurrencia local reportada después de una, dos y tres sesiones fue de 68%, 54% y 0%, respectivamente. Todos los pacientes tuvieron supervivencia libre de enfermedad de más de 5 años 85.
Conclusión
El DFSP es una neoplasia poco común que requiere un alto nivel de sospecha y conocimiento específico de la enfermedad. El diagnóstico es histológico, siendo de especial ayuda el inmunomarcador CD34 34. El FISH es una herramienta diagnóstica útil 38, pero su uso rutinario no está indicado. El planeamiento quirúrgico basado en imágenes de radiología es recomendable en las lesiones de mayor tamaño y en las que se sospeche compromiso profundo. El método terapéutico de elección en la actualidad es la CMM 52,68,70. Aunque hasta la fecha no hay estudios prospectivos aleatorizados que comparen la CMM con la resección local amplia, la CMM ha sido consistente mostrando tasas de recurrencia bajas 5,65,67,77 y ahorro de tejido sano 68,69. Debe usarse CMM en todos los casos donde el ahorro de tejido sea una necesidad y en quienes la cirugía convencional haya fallado, además puede considerarse su uso como primera línea en todos los DFSP resecables, siempre que se cuente con este recurso 52,68,71. La cirugía convencional es una alternativa cuando no se requiera ahorro de tejido sano y la CMM no esté disponible 52. En caso de realizarse cirugía convencional se recomiendan márgenes laterales de al menos 3 cm y evitar en lo posible los márgenes menores a 2 cm 86. Se recomienda que el margen profundo incluya la fascia 1 y que el procesamiento histológico se haga en face. Para los casos localmente avanzados o irresecables la radioterapia es una opción 80. El imatinib es la mejor opción en los DFSP metastásicos o localmente avanzados que no sean candidatos a radioterapia ni cirugía 46. La criocirugía es una alternativa para el control local de tumores recurrentes en casos seleccionados 85. La baja incidencia de la enfermedad hace difícil la realización de ensayos clínicos por lo que hay un vacío en la evidencia del tratamiento quirúrgico del DFSP. Se espera que colaboraciones multicéntricas o internacionales puedan ayudar a zanjar este inconveniente.