Introducción
En España se regula la disponibilidad de medicamentos en situaciones especiales, bajo la normativa que define el uso de medicamentos en condiciones diferentes a las autorizadas, (fármacos "off label" o fuera de ficha técnica) como el uso de medicamentos en condiciones distintas a las incluidas en su ficha técnica autorizada 1.
La prescripción off-label puede consistir tanto en la prescripción en una indicación distinta a la aprobada, como en utilizar el fármaco en una población de pacientes en la que no se encuentre autorizado, el uso con diferente dosis, y diferente duración de tratamiento o vía de administración 2-3.
Un medicamento puede no estar indicado en su ficha técnica para una condición clínica por diferentes motivos, entre los que se puede destacar 4:
Existe evidencia científica adecuada, pero no se ha autorizado todavía para esa indicación por encontrarse en trámite o porque no se ha solicitado por parte del laboratorio titular.
Existe una evidencia limitada para su utilización y es difícil obtenerla, como puede ser el caso de enfermedades raras, embarazadas o niños.
No se dispone de datos suficientes para garantizar su seguridad y eficacia, o no es eficaz en la situación clínica concreta solicitada.
La frecuencia de utilización de fármacos fuera de ficha técnica no está claramente constatada y varía según la publicación consultada. Una revisión de Saiyed et al. 5 sobre el uso de fármacos fuera de indicación concluye que el uso de fármacos sin indicación en pacientes hospitalizados varió entre el 18% y el 41%, y entre los pacientes con cáncer, de un 13% a un 71% recibe al menos un tratamiento fuera de indicación.
En oncología y hematología la causa más frecuente para usar fármacos off label suele ser la existencia de situaciones graves sin alternativas eficaces, existiendo además datos preliminares beneficiosos en fases intermedias de investiga ción. Así, en oncología y hematología se dan determinadas circunstancias que favorecen su uso, entre las que podemos destacar 4:
Subtipos de tumores que comparten sensibilidad a agentes terapéuticos.
Valoración riesgo/beneficio puede ser diferente a otras patologías.
Largo y costoso proceso de aprobación de fármacos.
Rápida difusión de resultados preliminares.
La regulación de este uso es diferente entre países. Desde la perspectiva de la Food and Drug Administration (FDA), una vez que aprueba un medicamento los proveedores de atención médica generalmente pueden prescribir el medica mento para un uso no aprobado cuando consideran que es médicamente adecuado para su paciente 6. Por otro lado, sí que existen recomendaciones de otras agencias estadou nidenses- por ejemplo, un estudio realizado con citostáticos orales encuentra que el uso fuera de indicación asciende a un 29% del total. De estos, el 88% de los tratamientos son respaldados por las recomendaciones de la guía del National Comprehensive Cancer Network (NCCN). Un total de 3,3% de todas las prescripciones no cumplen con las recomenda ciones de la guía NCCN 7.
En España, según el Real Decreto 1015/2009, la autorización de off-label debe ser de carácter excepcional y su utilización se encuentra dentro de la esfera de la práctica clínica y siendo responsabilidad del médico prescriptor.
Esta legislación no establece de forma explícita actuacio nes por parte de las comunidades autónomas ni de comisiones de farmacia. Si bien el Servicio de Farmacia y las adminis traciones públicas sanitarias deben dirigir sus actividades a favorecer el uso racional de los medicamentos, por lo que pueden definir procedimientos en off-label.
Por otro lado, se dispone de pocos datos sobre los resultados de estos tratamientos, hecho muy importante, dado que se trata de tratamientos con una evidencia científica variable y, por tanto, se está en un terreno de mayor incertidumbre respecto al balance beneficio/riesgo 8-9.
El objetivo del presente trabajo es analizar las solicitudes de medicamentos fuera de ficha técnica realizadas por los servicios de oncología y hematología, aprobadas en un hospital de segundo nivel y evaluar los resultados obtenidos tras la administración de los mismos.
Material y métodos
Se realiza un estudio observacional, retrospectivo de pacientes del Hospital General Universitario Morales Meseguer, Murcia, España. Los datos se obtienen de una base de datos disponible en el Servicio de Farmacia para el trabajo diario y, que incluye todas las peticiones de uso de fármacos off label recibidas por el Servicio de Farmacia. Se incluyen solicitudes enviadas por el Servicio de Hematología y Oncología, tramitadas y aprobadas por el Servicio de Farmacia, entre enero de 2016 y enero de 2017, según el procedimiento establecido en la Comisión Regional de Farmacia. Se realiza un seguimiento hasta julio 2017. Una vez seleccionados los pacientes, los datos de la base de datos se anonimizan asignando un número correlativo a cada paciente y desvinculando este número con el número de historia.
El Centro Información del Medicamento de hospital de área, siguiendo las instrucciones de la Comisión Regional de Farmacia, valora la solicitud del uso de medicamentos fuera de indicaciones autorizadas según el siguiente procedimiento:
Se inicia el proceso cuando el médico prescriptor envía una solicitud al Servicio de Farmacia.
El Servicio de Farmacia realiza una evaluación de las evidencias disponibles y una propuesta de autorización o denegación, que es ratificada por el director médico.
Este informe se somete a decisión por parte de una Comisión Regional de Farmacia y Terapéutica (CRFT) que emite la autorización definitiva.
Los criterios de evaluación contemplados en el informe de Farmacia son: medicamento, dosis, indicaciones autorizadas, análisis de la evidencia disponible para la indicación solicitada, análisis de la adecuación de la situación clínica del paciente a las evidencias disponibles, existencia de alternativas con indicación aprobada, existencia de alternativas con indicación no aprobada, pero con mayor peso de evidencia, y análisis de impacto económico.
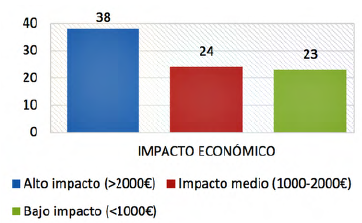
Los medicamentos se clasifican, por un lado, por su impacto económico, basándonos en una estimación del gasto mensual en función de coste/dosis, y número de dosis estándar que recibiría el paciente en base al estudio de referencia. Los costes se obtienen basándose en un programa informático del Servicio de Farmacia que refleja el precio de compra en el momento de solicitud del medicamento. Los tratamientos se consideran de alto impacto cuando suponen un coste > de 2000 €/mes, bajo impacto si su coste es < de 1000 €/mes, e impacto medio si su coste está entre 1000-2000 €/mes.
Por otro lado, con el objetivo de aclarar los motivos más frecuentes de solicitud de fármacos fuera de ficha técnica, el Servicio de Farmacia realiza una clasificación propia de todas las solicitudes aprobadas según el tipo de fármaco y motivo de petición, quedando de la siguiente forma: patologías raras y sin aprobaciones de fármacos en los últimos 10 años; de reciente comercialización que salen de un programa de acceso expandido pendientes de comercialización e indicación o nueva indicación; diana específica, son casos concretos con marcador molecular (amplificación MET en pulmón, HER2 en colon); mejoras significativas en seguridad, y últimas opciones para pacientes con múltiples líneas y generalmente con evidencia limitada.
Se analiza el grado de evidencia de estas solicitudes basándose en GRADE for practice guidelines recogida en el tema: Overview of clinical practice guidelines de UpToDate®10.
Se analizan las características basales de los pacientes, las líneas previas de tratamiento, el Perfomance Status (PS), la duración de los tratamientos y la respuesta en base al estudio que avala su utilización. Así mismo, se realiza un seguimiento de los efectos adversos y un análisis de supervivencia mediante curvas de Kaplan-Meier para el cálculo de la media de supervivencia libre de progresión y media de supervivencia global desde la fecha de inicio del tratamiento. Para el análisis estadístico se crea una base de datos en el programa SPSS versión 2.0, donde se transcriben las variables a analizar.
Resultados
De un total de 90 solicitudes de tratamiento se aprueban 85 (94,4%): 28 de pacientes hematológicos (32,9%) y 57 de pacientes oncológicos (67,1%).
La distribución de las solicitudes aprobadas según las clasificaciones realizadas por el servicio de farmacia según su impacto económico y el tipo de fármaco junto al motivo de su uso se observan en las figuras 1 y 2, respectivamente.
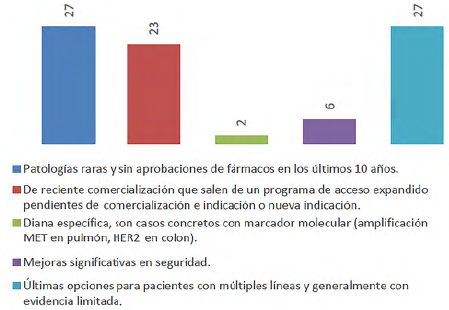
Figura 2 Número de solicitudes aprobadas en función de la clasificación realizada por tipo de fármaco y motivo de petición.
De las 85 solicitudes aprobadas, 10 tratamientos no se llegan a realizar. Son tratados 68 pacientes diferentes, ya que 7 de ellos reciben medicamentos con uso fuera de indicación en dos ocasiones. De los 75 tratamientos realizados se evalúan 73, por imposibilidad de recoger datos de los 2 restantes. La mediana de seguimiento de los pacientes es de 7,15 meses hasta el momento de su muerte o periodo final del estudio. Entre los medicamentos aprobados destacan las solicitudes de bevacizumab y fotemustina para glioblastoma, con 12 y 8 peticiones de tratamiento respectivamente, representado un 15% del total de solicitudes. En la tabla 1 aparecen los fármacos con la indicación para la que se solicitan.
Tabla 1 Fármaco solicitado e indicación (diagnóstico) para el que se solicita.
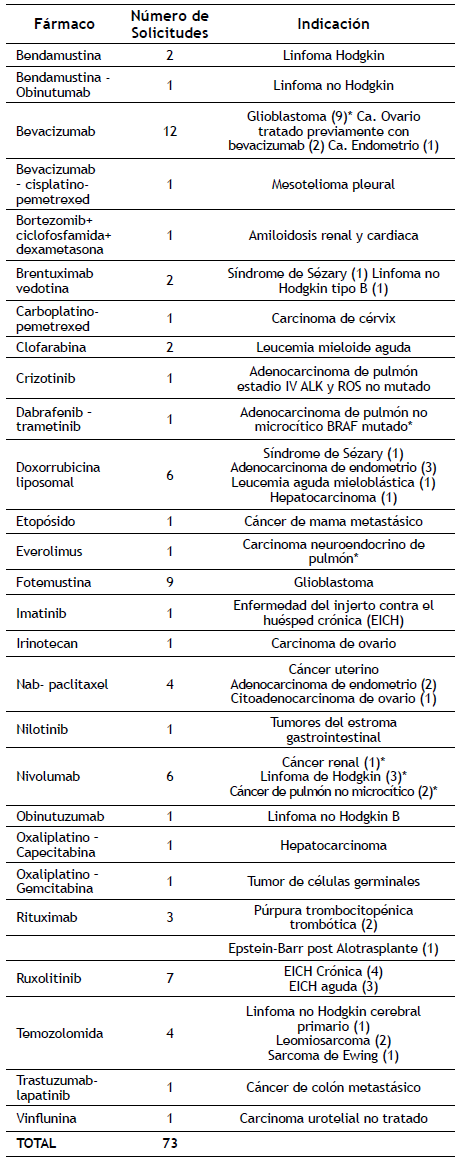
*Indicación no incluida en ficha técnica en el momento de la solicitud.
Los pacientes tienen una mediana de edad de 59 años (rango: 22-81 años) y mediana de 3 líneas de tratamiento previas (rango: 1-9). En cuanto al estado funcional: PS-0: 2 pacientes (2,74%), PS-1: 43 pacientes (58,9%), PS-2: 21 pacientes (28,77%), PS-3: 3 pacientes (4,11%) y PS desconocido: 4 pacientes (5,48%); 59 pacientes (81%) presentan síntomas al iniciar el tratamiento.
La mediana de duración de los tratamientos es de 60 días (rango 1 - 473 días), y 10 pacientes continúan recibiendo tratamiento al finalizar el periodo estudio. 36 pacientes (49,32%) habían iniciado tratamiento hace más de un año al finalizar el periodo de estudio, de los cuales un 44,4% de ellos permanecen vivos.
En el análisis de las solicitudes según su grado de evidencia, al igual que en GRADE for practice guidelines se consideran tratamientos con recomendación fuerte aquellos con un nivel de evidencia 1A, 1B y 1C. Obteniendo un total de 2, 14 y 0 respectivamente, por lo que un 22% de las solicitudes tienen una recomendación fuerte a favor del tratamiento. Por otro lado, se consideran solicitudes con recomendación débil a favor del tratamiento aquellas con un grado de evidencia 2A, 2B y 2C, con 7, 40 y 10 solicitudes respectivamente, representando un 78% del total de estas.
En cuanto a la respuesta, 2 de los tratamientos (2,74%) se utilizan como adyuvancia, en 41 pacientes la enfermedad progresa (56,2% de las solicitudes), 8 mantienen enfermedad estable (10,96%), 6 respuesta parcial (8,22%), 11 respuesta completa (15,07%) y en 5 de ellos la respuesta es no evaluable (6,85%). Por tanto, en un 34,2% de las solicitudes de los pacientes se obtiene algún tipo de respuesta. 24 pacientes (18%) reportan una mejoría sintomática tras el inicio del tratamiento. En 14 de los tratamientos (10%) aparecen efectos adversos grado 3 o 4, consistentes principalmente en diarrea por doxorrubicina y temozolamida, bicitopenia (pancitopenia y neutropenia) por clofarabina, paclitaxel-albúmina y brentuximab, trombopenia por bevacizumab o fotemustibna, cefalea, mucositis o rash cutáneo por bendamustina y nivolumab. 29 de los pacientes (21%) necesitan recibir otro tratamiento oncohematológico posterior.
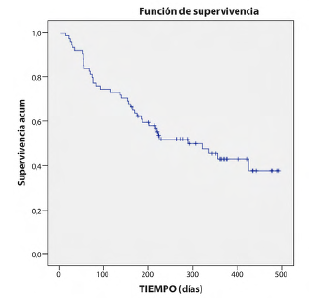
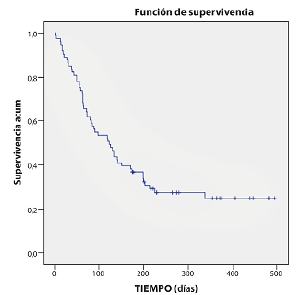
Al finalizar el tratamiento, el PS mejora en 6 de los pacientes (8,21%), empeora en 23 y se mantiene estable en los 44 restantes. La media de supervivencia libre de progresión es de 6,6 meses (IC95% 5,2-8) y de la supervivencia global es de 9,7 meses (IC95% 8,2-11,2), como se muestra en las figuras 3 y 4. La supervivencia al año de los pacientes tratados es del 64% y 40 pacientes (54%) habían fallecido al finalizar el periodo de estudio.
Se estima un coste mensual en base al precio del tratamiento y la dosis necesaria en el momento del tratamiento y un coste total basado en la duración total de los tratamientos, según la evidencia aportada para la autorización del tratamiento o de un año en aquellos en los que no se especifica. La mediana de coste mensual es de 1.736 €/mes y se estima un coste mensual total de 221.424 €. La mediana de coste total estimado, y por tanto presupuestado en el hospital, por tratamiento es de 9.771 € tratamiento y el coste total estimado de los 73 tratamientos es de 1.108.034 €. El coste real es bastante menor, ya que muchos tratamientos se suspenden antes del tiempo que se refleja en la evidencia, ya sea por fallecimiento, progresión o efectos adversos. La mediana del coste real por tratamiento es de 3.797 € y el coste real de todos es de 576.148 €.
Discusión
En los últimos años se están publicando estudios sobre el uso de medicamentos fuera de indicación 9, centrándose muchos de ellos en medicamentos antineoplásicos o usados en patologías relacionadas 11-12. Estos datos son de particular interés, ya que al no cumplir los criterios incluidos en la ficha técnica del medicamento se está en un territorio de una gran incertidumbre, tanto en términos de eficacia como de seguridad; además, hay que considerar el coste de dichas terapias para el sistema sanitario 13.
Según los resultados de este estudio, en el hospital analizado los fármacos solicitados off-label van dirigidos mayoritariamente a patologías raras y con pocas aprobaciones de fármacos (31,76%) y últimas opciones de tratamiento en otras patologías (31,76%), y en más de la mitad de los casos suponen un alto o medio impacto económico según la clasificación establecida. La mayor parte de las solicitudes presentan una recomendación débil y una evidencia de calidad débil. A pesar de estos datos, es importante reseñar que el uso de fármacos "off-label" representa un pequeño porcentaje respecto al uso de fármacos por el Servicio de Hematología y Oncología.
En el estudio comentado de Sayed et al. 5, los autores realizan una revisión para valorar el uso de medicación off-label en oncología. En esta revisión, se incluyen 23 estudios en los que la prevalencia del uso de medicamentos off-label varía del 13% al 71%. La principal razón del uso no autorizado de medicamentos es: medicamentos no aprobados para un tumor específico en cánceres metastásicos y tratamientos paliativos, algo muy similar a lo detectado en nuestro estudio, en el que se utilizan fundamentalmente como última opción o en patologías raras. Por tanto, esta práctica es habitual en muchos centros para estas patologías, por lo que son necesarios estudios que permitan determinar el beneficio/riesgo.
Por otro lado, una encuesta realizada a nivel nacional por González-Haba et al. 4 sobre la utilización de fármacos off-label en el área de oncohematología, muestra resultados sobre la evaluación de las solicitudes muy similares a los usados en nuestro centro. Al igual que en este caso, uno de los factores que se analiza y que influye en el circuito de autorización-dispensación de estos fármacos es la evidencia disponible. Por lo general también es necesaria una autorización de la dirección del hospital previo informe del servicio de farmacia. En un 55,3% de los hospitales hay criterios establecidos específicos del paciente que ayudan a la toma de decisiones, junto con los aspectos de eficacia y seguridad de los fármacos en la indicación solicitada. En la mayoría de los centros se acepta un menor nivel de evidencia en el caso de que no existan alternativas terapéuticas, así como en los tumores de baja prevalencia, coincidiendo con el tipo de solicitudes mayoritarias en nuestro centro, lo que explicaría en parte el bajo nivel de evidencia de las solicitudes presentadas. Esta encuesta concluye que existe una gran variabilidad en el procedimiento de utilización de los off-label y en los criterios que se utilizan para su aprobación, esto es así dado que el Real Decreto 1015/2009 no establece un procedimiento único. La CRFT es una oportunidad para estandarizar estos procedimientos, puesto que reciben solicitudes de toda la región. De hecho, después de la realización de este estudio se ha estandarizado mediante un protocolo regional el uso de fármacos fuera de ficha técnica para el tratamiento del glioblastoma, que es la primera indicación en nuestra serie (21%).
En un reciente estudio de Blanco et al. 14, analizan de manera transversal la magnitud y perfil de las prescripciones fuera de ficha técnica, durante el año 2010 en su centro. Se registran 190 solicitudes, para 82 indicaciones distintas. En este caso los medicamentos más solicitados son tacrolimus, micofenolato, colistimetato y everolimus, constituyéndose el grupo de inmunosupresores como el de mayor número de usos en indicaciones no aprobadas. El 52,4% de las solicitudes están basadas en algún ensayo clínico, mientras que el resto tiene un bajo nivel de evidencia (estudios observacionales y casos). Los autores concluyen, al igual que en nuestros datos, que hay un gran volumen de usos off-label en ausencia de buena evidencia, aunque el sistema de clasificación de la evidencia fue diferente en ambos estudios.
Arroyo et al. 8 estudian la efectividad y la seguridad de antineoplásicos en condiciones off-label en una cohorte de pacientes durante 10 años. Se analizan 85 hombres y 83 mujeres con una mediana de edad de 56 años y una mediana de 4 ciclos de quimioterapia, la mediana de la supervivencia libre de progresión es de 5 meses (4-21,3) y supervivencia global 11 meses (9,2-20,6). En este estudio el estado funcional y el número de líneas previas influyen en la supervivencia global (tras un análisis modelo univariante y multivariante). Como se observa en estos datos de SLP y de SG se acercan a los encontrados en este estudio, donde la supervivencia libre de progresión es de 6,6 meses (IC 95% 5,2-8) y la supervivencia global es de 9,7 meses (IC95% 8,2-11,2). Por otro lado, también es muy similar el perfil de efectos adversos, ya que, en este estudio, entre los efectos de grado 3 o 4 predominan la astenia y la neutropenia. Estos datos de SLP y SG son similares a los resultados que se obtienen con fármacos en líneas avanzadas de tratamiento.
Martín-Gónzalez et al. 15 analizan las prescripciones off-label en pacientes oncológicos en un estudio retros pectivo, en el que previamente establecen unos criterios de calidad en la prescripción. Así se define como de calidad óptima la prescripción que cumple los siguientes criterios:
Nivel de evidencia de eficacia mínimo demostrado en un ensayo fase II.
Con adecuado consentimiento informado al paciente.
Para paciente con supervivencia igual o mayor a 3 meses.
Para paciente con PS inferior a 3.
Con última dosis administrada al menos 30 días antes del fallecimiento, si acontece.
Se analizan 23 tratamientos para 22 pacientes. De ellos, 13 no cumplen alguno de los criterios de calidad previamente definidos (57%). Todos los pacientes son informados y consienten el tratamiento a recibir, aunque en ningún caso se puede constatar la calidad del consentimiento informado. En 10 de los 23 tratamientos se incumplen simultáneamente 2 o más de los criterios de calidad establecidos (43%). La mediana de SLP es de 52 días (0-357) y la respuesta se evalúa solo en 14 casos y en 7 de ellos no se constata ninguna respuesta positiva al tratamiento. Estos autores concluyen que estos tratamientos difícilmente pueden justificarse dados los resultados obtenidos. En nuestro estudio, se solicita el consentimiento informado a todos los pacientes, y al contrario que en el trabajo de Martín-González et al., sí que se evalúa la respuesta en 68 (90,6%) de los 75 pacientes tratados y se obtiene una media de SLP de 6,6 meses (IC 95% 5,2-8).
Como vemos el uso de fármacos con indicación fuera de ficha técnica, a pesar de sus resultados inciertos, está regulado y entra dentro de la práctica clínica. En la revisión de Golocorbin Kon S et al. 16, también concluyen que no hay un acuerdo general sobre su uso, pero tiene un lugar en la práctica clínica y se debe establecer un sistema de registro adecuado.
Un punto importante a considerar en los fármacos off label es la información que deben recibir los pacientes, Green AK et al. 17, analizan esto y establecen una serie de preguntas que deben contestarse a los pacientes, entre las que destacan:
¿Qué estudios científicos están disponibles para apoyar el uso de este medicamento para tratar mi enfermedad o condición médica?
¿Es probable que este medicamento funcione mejor para tratar mi enfermedad o condición médica que usar un tratamiento aprobado?
¿Cuáles son los posibles beneficios y riesgos de tratar mi enfermedad o condición médica con este medicamento?
Estas cuestiones deben reflejarse en la información que reciben los pacientes antes de dar su consentimiento informado tal como se refleja en el Real Decreto 1015/2009.
En cuanto al caso concreto de nuestro estudio, presenta como debilidad el tamaño reducido de muestra y la heterogeneidad de las patologías y pacientes. Pero a pesar de esto, los resultados obtenidos en esta serie de casos en SLP (6,6 meses) y SG (9,7 meses), y con un 34,2% de pacientes con algún tipo de respuesta, obliga a seguir avanzando en la evaluación de este tipo de tratamientos ya que la respuesta obtenida puede ser similar y comparable a la de algunos fármacos con indicación incluida en ficha técnica.
Por otro lado, hay que considerar la baja evidencia de las recomendaciones (78% de las solicitudes evidencia débil) y el coste medio-elevado de la mayoría de los tratamientos.
La bibliografía revisada muestra resultados heterogé neos, pero en general coinciden en la baja evidencia de las recomendaciones y en el tipo de patologías con nulas opciones de tratamiento. En este contexto es muy importante la información al paciente y garantizar la calidad de vida y sus prioridades y valores. En este estudio, el PS mejora solo en 6 de las solicitudes (8,21%) y se mantiene estable en más de la mitad de los casos.
Analizados los resultados obtenidos, la justificación de estos tratamientos debe evaluarse continuamente y evidencia la necesidad de un control más estricto y a una valoración de los resultados en salud que se obtengan. El valorar los niveles de evidencia científica de estos usos aporta un seguimiento de la actividad investigadora y al evaluar los resultados obtenidos se podría ampliar la evidencia disponible para estas patologías. Así mismo, se podría establecer un criterio de rechazo de estas solicitudes en base a la evidencia y otras opciones de tratamiento y grado de beneficio/riesgo para el paciente, de acuerdo con el médico solicitante.