Introducción
Los TNEsP provienen de células madre multipotenciales que dan origen a todos los tipos de células epiteliales en el páncreas y el tracto gastrointestinal 2. Tienen una incidencia de 1 a 5 por cada millón de personas-año, con una prevalencia del 0,5% a 1,5% 3 y en orden de mayor a menor frecuencia están: los TNEsP no funcionales (25-100%); la insulinoma (30-45%); la gastrinoma (16-30%); la glucagonoma (< 10%); el VIPoma (< 10%) y, otros 4. Son más frecuentes en adultos entre la cuarta y la sexta década de la vida, sin diferencias entre los géneros. La mayoría son esporádicos o hacen parte de síndromes genéticos como neoplasia endocrina múltiple tipo 1 (NEM1), von Hippel-Lindau, neurofibromatosis tipo 1 y esclerosis tuberosa 1. Se clasifican en: funcionales o no funcionales, bien diferenciados o pobremente diferenciados, por grados (1 a 3) según el índice de proliferación (índice mitótico o Ki-67), según el TNM 5 y por estadios teniendo en cuenta el TNM.
Caso clínico
Paciente de 55 años con cuadro de dos años de evolución consistente en dolor en epigastrio e hipocondrio izquierdo y pérdida de peso involuntaria (10 kg), previo al inicio del cuadro con obesidad sin otros antecedentes de importancia. Tomografía de abdomen con reporte de masa (95 x 45 mm) en cuerpo y cola de páncreas (fig. 1a) y múltiples lesiones focales diseminadas en parénquima hepático (fig. 1b). Fue llevada a biopsia hepática y se reportó un tumor neuroendocrino con inmunohistoquímica positiva para cromogranina, sinaptofisina, focalmente para CK20 y negativa para CK7, TTF1 y CDX2, el índice de proliferación Ki-67 fue del 10% (grado 2 por WHO) y no se observaron mitosis en 10 campos de alto poder (CAP). En la tomografía por emisión de positrones (PET) con Galio 68-DOTATOC (fig. 2) se evidenció una masa en cuerpo y cola de páncreas con elevada sobreexpresión de receptores de somatostatina (Krenning 4/4), y múltiples focos hipercaptantes en los ganglios paraaórticos, el hígado, el peritoneo y en la columna vertebral (T6, L4, L5, S1); en PET-FDG (fig. 3) se observó igualmente compromiso hipermetabólico en páncreas y focos metastásicos descritos. Se consideró no candidata a intervención quirúrgica por la extensión de las lesiones hepáticas. Se inició con lanreotide 120 mg subcutáneos mensuales y ácido zoledrónico 4 mg intravenosos trimestrales por el compromiso óseo. Teniendo en cuenta que hubo progresión de la enfermedad a nivel hepático al tercer mes del tratamiento, se indicó quimioterapia con capecitabina (1.500 mg/m2) desde el día 1 al 14 y temozolamida (200 mg/m2) desde el día 10 al 14, ciclos cada 28 días.
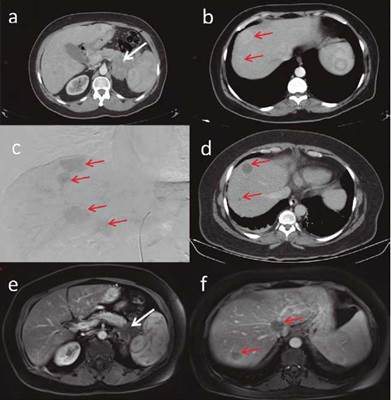
Figura 1 Escanografías abdomen con medio de contraste: (a) Masa lobulada sólida con calcificaciones en cola del páncreas, envuelve vasos esplénicos, diámetros mayores en plano axial de 95 x 45 mm. (b) Metástasis hepáticas la mayoría hipervasculares. (c) Arteriografía embolización: cateterización segmentaria hepática derecha muestra. (d) Imagen postembolización: ausencia de realce como respuesta al tratamiento compromiso metastásico multifocal predominio lóbulo hepático derecho. Resonancia magnética abdomen superior con gadolinio. (e) Masa en cola de páncreas con escaso realce, su tamaño se mantiene. (f) Lesiones focales hepáticas sin realce con gadolinio como respuesta al tratamiento.
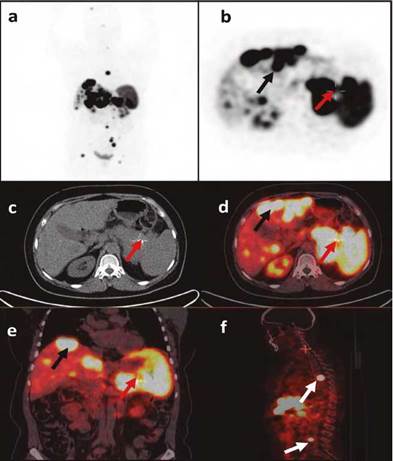
Figura 2 PET Galio 68 - DOTATOC. Representación PET (a, b), TAC (c) e imágenes fusionadas (d, e, f). Se observa masa en cuerpo y cola páncreas (flechas rojas), metástasis hepáticas (flechas negras), metástasis en columna (flechas blancas).

Figura 3 Figura 3. PET/CT 18 F-FDG. Representación PET (a, c) e imágenes fusionadas (b, d). Se observa masa en cuerpo y cola páncreas (flechas rojas) y metástasis hepáticas (flechas negras).
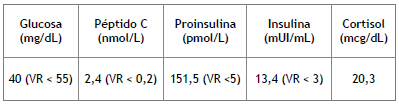
Durante el seguimiento, la paciente presentó síncope con síntomas neuroglucopénicos e hipoglucemia (glucosa sérica 40 mg/dL). Se le realizó test de ayuno que confirmó hipoglucemia hiperinsulinémica (tabla 1) con marcación negativa para insulina en inmunohistoquímica en la biopsia hepática.
Se inició diazóxido con titulación progresiva en la dosis. Por la persistencia de las hipoglucemias se le adicionó prednisolona (10 mg día) con reducción de la frecuencia de los episodios de hipoglucemia a menos de 3 a la semana. El control tomográfico en el ciclo 5 de quimioterapia demostró enfermedad estable (criterios RECIST 1.1); sin embargo, por la persistencia de hipoglucemias se realizó embolización transarterial de las metástasis hepáticas con microesferas de 100 - 300 micras. En la tomografía de control, se observaron cambios en las características de las metástasis hepáticas de una apariencia sólida a quística y ausencia del realce en la fase arterial como respuesta al tratamiento instaurado (fig. 1c y 1d). En el ciclo 7 de quimioterapia la paciente se mantuvo sin nuevos episodios de hipoglucemia, por lo cual se retiró el diazóxido y la prednisolona de manera gradual.
En el ciclo 15 de quimioterapia la paciente presenta poliuria y polidipsia, con glucemia en 329 mg/dL y HbA1c 12%, confirmando el diagnóstico de diabetes mellitus de novo y requiriendo manejo con insulina en esquema basal bolo; las imágenes de control (fig. 1e y 1f) fueron compatibles con enfermedad estable. Se consideró retirar la quimioterapia al obtener una adecuada respuesta clínica.
Discusión
Los insulinomas son los TNEsP funcionales más comunes, con una incidencia de 1 a 3 por cada millón de personas-año, se presentan generalmente en la quinta década de la vida, entre 4% a 14% son malignos, 10% son múltiples y 5% son asociados a NEM1 1,6,7. La mayoría son menores de 2 cm y se distribuyen en igual frecuencia en cualquier parte del páncreas, aunque el 3% son ectópicos y se ubican generalmente en la mucosa duodenal 8. El diagnóstico se basa en el hallazgo clínico de la tríada de Whipple con la confirmación bioquímica de hipoglucemia hiperinsulinémica y el hallazgo por imágenes de una lesión tumoral pancreática; la tinción para insulina en inmunohistoquímica puede ser negativa en las biopsias de las lesiones metastásicas, como en este caso que presentamos.
El 97% de los insulinomas malignos son esporádicos, gene ralmente son bien diferenciados, invaden ganglios linfáticos regionales, presentan compromiso locorregional (bazo, estó mago, vía biliar) y hacen metástasis a distancia especialmente al hígado, dado que los síntomas son más severos debido a la mayor secreción de insulina 7,9. La supervivencia a 5 años en insulinomas malignos con metástasis hepáticas es del 15-25% 9. Los siguientes son predictores de enfermedad metastásica: tamaño > 2 cm, Ki-67 > 2%, inestabilidad cromosómica, pérdida de cromosomas 3p o 6q y ganancia cromosómica en 7q, 12q o 14q 4,6.
En cuanto a la tumorigénesis de los TNEsP, se han descrito múltiples vías de señalización intracelular que se encuentran alteradas, dentro de las principales tenemos PI3K-Akt, Notch-1, Ras/Raf/mitogen-activated protein kinase [MEK]/extracellular signal-regulated kinase [ERK], RET, mTOR; 10 por lo cual se han propuesto varias posibilidades terapéuticas dirigidas tales como los inhibidores mTOR. El panorama es aún más complejo, ya que se han descrito diferentes aberraciones genéticas, hasta en el 65% de los TNEsP pueden estar sobreexpresados los niveles de ciclina D1, además de otras aberraciones tales como p16, alteraciones en el gen de la ciclooxigenasa 2, o inactivación (mutaciones o metilación) del gen de la trombospondina 1, que tiene una notable actividad antiangiogénica 11.
Una de las características especiales de este tipo de tumores es la importante vascularización tumoral, relacionada con una alta expresión de moléculas y factores proangiogénicos, tales como: factor de crecimiento del endotelio vascular (VEGF) y angiopoyetina 2, además una mayor expresión de receptores (tirosina quinasa, factor de crecimiento derivado de plaquetas (PDGFR), factor de crecimiento similar a la insulina (IGFR1) y factor de crecimiento epidérmico (EGFR)) 12.
Dentro de las dificultades terapéuticas adicionales a las moleculares y genéticas previamente expuestas, se suma el estroma tumoral como una barrera que protege a las células tumorales de los tratamientos oncológicos, y que podrían estar directamente implicadas en la trasformación maligna de células no tumorales. El estroma tumoral está compuesto por Los fibroblastos, las células vasculares, las células inmunológicas y la matriz extracelular 13.
El manejo quirúrgico es el tratamiento de elección en insulinomas, sin embargo, las lesiones localmente avanzadas con compromiso de la arteria mesentérica superior y/o tronco celíaco y/o arteria hepática común son consideradas irresecables 14. La cirugía de las metástasis hepáticas mejora la sobrevida y el control de síntomas y se recomienda realizarla en lesiones tipo I (unilobares) o tipo II (bilobares, con lesión dominante en un lóbulo hepático) (ENETS 2016). En lesiones tipo III (enfermedad metastásica diseminada) no debe realizarse cirugía (como en el caso de la paciente del estudio) y tampoco está indicado realizar pancreatoduodonectomía paliativa 14 dado que solo es útil cuando se reseca un 90% a 95% de la masa tumoral 7.
El tratamiento sintomático se basa en el control de la secreción excesiva de insulina. El diazóxido inhibe la liberación de insulina, por medio de la apertura de los canales de potasio dependientes de ATP 8, promueve la glicogenolisis 4 y aumenta la producción hepática de glucosa 15 para disminuir entre un 50-60% la frecuencia y la severidad de los episodios de hipoglucemia, por lo que es considerado el medicamento de elección en el tratamiento sintomático de los insulinomas 8,16. Los análogos de somatostatina (ASST) pueden inhibir los efectos del diazóxido, por lo que no se recomienda el uso concomitante de estos medicamentos 7 y por esta razón el lanreotide fue retirado en la paciente.
Los ASST inhiben la secreción de insulina por su efecto principalmente sobre los receptores SST2, aunque podrían tener un efecto paradójico inhibiendo la producción de glucagón. Se recomienda tener una imagen positiva para receptores de somatostatina (gammagrafía o PET-Galio 68) para iniciar los ASST 8 y realizar un test corto con ASST para evaluar respuesta. Los ASST controlan los síntomas de hipoglucemia en el 35-50% de los pacientes 6 y puede considerarse de primera línea en insulinomas malignos dado su efecto antiproliferativo 9, aunque para TNEsP solo el lanreotide ha sido probado para este fin en estudios de fase 3 17. Con el tiempo, los ASST se asocian a taquifilaxis, lo que genera pérdida de efectividad en la mayoría de los pacientes 18. Una opción que requiere más estudios podría ser el uso de pasireotide dado su efecto multirreceptor, principalmente sobre el receptor SSTR5 y que implica disminución en la producción de insulina. Hasta el momento solo hay dos reportes de caso en pacientes con insulinoma maligno e hipoglucemia refractaria 19,20 y que documentan la disminución de los episodios de hipoglucemia, sin impacto en tamaño tumoral.
Los glucocorticoides incrementan la resistencia a la insulina, estimulan la gluconeogénesis y disminuyen la producción de insulina. El más utilizado es la prednisolona, con una rápida acción, pero resultados a largo plazo diversos 7. Estos podrían considerarse como terapias de segunda o tercera línea en el manejo de la hipoglucemia. Como se observó en el presente caso, el uso de lanreotide y la terapia combinada de diazóxido y prednisolona no fueron efectivos para controlar la hipogluce-mia; en estos casos, tratamientos de tercera línea como terapia ablativa, terapias con radionucléidos de receptores peptídicos (TRRP) o everolimus, pueden ser considerados.
En pacientes con metástasis hepáticas no operables la embolización arterial hepática parece ser un enfoque de tratamiento óptimo y varios reportes han demostrado que la embolización arterial hepática puede reducir el tamaño del tumor y la producción hormonal mejorando los síntomas en el 70% al 100% de los pacientes y la supervivencia libre de progresión en TNEsP 21-25.
Las TRRP, como 177Lu-Dotatate, han demostrado una disminución del 69% en el riesgo de progresión de la enfermedad o la muerte en pacientes con tumores neuroendocrinos de intestino delgado (HR 0,21; IC95%: 0,13 - 0,33; P < 0,001) 26, pero hasta el momento la evidencia en el tratamiento de pacientes con TNEsP proviene de reportes de casos y estudios retrospectivos 27,28. Reportes de casos 27,29 y una serie de casos reciente 30 de manejo con 177Lu-Dotatate en insulinoma maligno con hipoglucemia refractaria, reportaron disminución de los episodios de hipoglucemia y el control del tamaño tumoral, por lo que esta sería una terapia de tercera línea en TNEsP que expresen receptores de somatostatina.
El everolimus puede reducir la producción y la secreción de insulina e incrementar la resistencia a la insulina (disminución GLUT1) 7,8. Teniendo en cuenta que uno de los efectos secundarios reportados en los estudios RADIANT fue la hiperglucemia (13 %) y según reportes de casos 18 y estudios retrospectivos 31 que observaron mejoría de la hipoglucemia, podría considerarse como tratamiento de tercera línea en hipoglucemia refractaria y como primera línea en insulinomas malignos en progresión, dada la mejoría en la supervivencia libre de progresión (11,4 meses vs. 4,6 meses con placebo) demostrada en el estudio RADIANT-3, que incluyó 98/410 pacientes con TNEsP funcionales 32.
En cuanto a la quimioterapia, la mejor evidencia disponible proviene de estudios fase II empleando agentes alquilantes como la estreptozocina, la temozolamida, la dacarbazina, los fluorinados (5 flurouracilo-5FU), la capecitabina, y la doxo-rrubicina 33-38. Teniendo en cuenta la alta vascularización peritumoral también se ha intentado el tratamiento con beva-cizumab 39. A continuación, se comentarán los resultados de los estudios considerados más importantes.
El primer agente alquilante utilizado para TNEsP fue la estreptozocina, hacia los años setenta y ochenta, con una tasa de respuesta del 63% en combinación con 5 FU 33 y del 69% en combinación con doxorrubicina 34. Estos estudios han sido criticados ya que la evaluación de la respuesta fue realizada basada en mediciones por examen clínico y no por criterios de respuesta imagenológica.
En el 2004 se publicó un estudio retrospectivo cuyo objetivo era evaluar la eficacia de estreptozocina/5FU/doxorrubicina en 84 pacientes con carcinoma pancreático neuroendocrino, en el que se demostró una tasa de respuesta del 39% evaluada con TAC o RMN mediante criterios RECIST, una mediana de duración de respuesta de 9,3 meses, una supervivencia libre de progresión (SLP) a 2 años del 41% y una tasa de supervivencia global (SG) a 2 años del 74%, con importante toxicidad principalmente neutropenia grado 3-4 36.
En Colombia no se dispone de estreptozocina, por lo que se utilizan otros agentes alquilantes. La dacarbazina fue evaluada en un estudio fase II con una tasa de respuesta del 33% 35. La temozolamida (TMZ), un agente alquilante del grupo de los triazenos, fue evaluada en un estudio fase II con 11 pacientes y demostró que la combinación con talidomida generaba una tasa de respuesta del 45% 37.
En el 2011, teniendo en cuenta los datos in vitro de un efecto sinergístico antitumoral con la combinación de capecitabina y temozolamida (CAPTEM) se evaluó esta dupleta en un análisis retrospectivo en 30 pacientes con carcinomas neuroendocrinos pancreáticos bien o moderadamente diferenciados, con el fin de evaluar la tasa de respuesta imagenológica (criterios RECIST), SLP y SG. En este estudio se utilizó la capecitabina a dosis de 750 mg/m2 dos veces al día desde el día 1 al 14 y temozolamida 200 mg/m2 diariamente durante los días 10 al 14 de un ciclo de 28 días. La tasa de respuesta fue del 70%, 21 pacientes (70%) con respuesta parcial, 8 pacientes (27%) enfermedad estable y 1 paciente con enfermedad en progresión. La SG a 2 años se estimó en 92% y la mediana de SLP a 18 meses. En este estudio se encontró un perfil de toxicidad mejor que en los estudios anteriores con eventos adversos grado 3 y 4 en 3 pacientes 38.
En nuestro caso, teniendo en cuenta que se trataba de un TNEsP bien diferenciado grado 2, se decidió tratar con CAPTEM, tras 15 ciclos de tratamiento se alcanzó enfermedad estable, en cambio, en el estudio referido anteriormente la mediana de duración de tratamiento fue de 8 ciclos con una máxima de 23 ciclos. En el momento la paciente tiene estabilidad de la enfermedad, sin toxicidad limitante, se consideró máxima respuesta, teniendo en cuenta la poca información y falta de consenso a nivel internacional se decidió suspender la quimioterapia y continuar en vigilancia clínica.
También se ha estudiado la combinación de temozolamida y bevacizumab en un estudio fase II, con una tasa de respuesta del 33% 39. El estudio xelbevoct (bevacizumab/octreotide/ capecitabina metronósmica) demostró un beneficio en tumores neuroendocrinos bien y moderadamente diferenciados, tasa de respuesta global (TRG) del 83%, respuesta parcial de 17,8% y enfermedad estable de 64,4%, SLP de 14,9 meses y SG no alcanzada 40. Más recientemente se publicó un estudio fase II evaluando la combinación de 177 Lu-Octreotate/capecitabina/ temozolamida, demostrando una TRG de 80%, con una tasa de remisión completa del 13%, con una impresionante SLP de 48 meses y SG no alcanzada en un periodo de seguimiento de 33 meses, siendo hasta el momento la mejor respuesta observada en los estudios 41. Al revisar los estudios y los efectos adversos referidos, no se han descrito casos de hiperglucemia o diabetes con relación a CAPTEM y tampoco a otros agentes de quimioterapia o combinaciones.
El 90% de los pacientes presentan hiperglucemia transito ria (duración aproximada 9 días) tras la resección quirúrgica del insulinoma 42,43, el 33% la presentan en las primeras 24 horas 44 y el 41,6% en las primeras 48 horas 45. Esta hiperglucemia podría ser secundaria a supresión crónica de las células 6 normofuncionantes o efectos locales (edema o necrosis) del tejido cercano al área quirúrgica 46,47. Tres casos reportados de hiperglucemia persistente posterior a cirugía de insulinoma con criterios diagnósticos de diabetes están descritos; una mujer de 44 años con NEM1 manejada con insulina 46; una mujer de 74 años con obesidad manejada con metformina y sitagliptina 43, y una mujer de 45 años manejada con metformina 47. Dos series de casos han repor tado diabetes mellitus posterior cirugía de insulinoma que han requerido manejo con insulina: Akca et al. (1 de 77 pacientes) 45 y Nockel et al. (4 de 33 pacientes) 44. Existe un caso previamente reportado tratado en esta misma institución 25 de un paciente con insulinoma maligno no manejado quirúrgi camente, que presentó hiperglucemia posterior a embolización de metástasis hepáticas.
Este es el segundo caso descrito de diabetes posterior a manejo no quirúrgico de un insulinoma. Posiblemente la necro sis del tumor primario secundaria a la quimioterapia y de las metástasis hepáticas secundarias a la embolización, en con texto de una paciente previamente obesa, desenmascaró una diabetes mellitus tipo 2. Otra hipótesis es la coexistencia de secreción de glucagón, menos probable es que la quimioterapia originara necrosis tumoral y de las células 6 normofuncionantes desencadenando diabetes secundaria.
Conclusiones
El insulinoma maligno es una patología poco frecuente, pero con un reto terapéutico grande dada la frecuencia mayor de hipoglucemia refractaria y el compromiso metastásico. Cuando no es posible la intervención quirúrgica, el tratamiento médico de la hipoglucemia y el control tumoral con quimioterapia y/o embolización de metástasis hepáticas son fundamentales. Este es el segundo caso descrito de diabetes posterior a tratamiento no quirúrgico de un insulinoma y es importante tener en cuenta los antecedentes del paciente y factores de riesgo dada la posibilidad de desenmascarar con el tratamiento una diabetes mellitus de base.