Introducción
La calidad de vida relacionada con la salud (CVRS) se considera un constructo subjetivo y multidimensional, y uno de los desenlaces más utilizados en la investigación en oncología 1. Dentro de la propuesta de medidas de desenlaces reportados por pacientes (PROMs por sus siglas en inglés), ocupa un lugar central y se reconoce su importancia como desenlace de primera línea en ensayos clínicos en pacientes con cáncer 2-5. Se han definido los PROMs como la medición de cualquier aspecto del estado de salud del paciente que está realizada por él mismo 6 y se ha reportado que su utilización permite recopilar datos que son útiles para estandarizar prácticas clínicas y mejorar el cuidado del paciente 7, ya que los resultados de estas mediciones son útiles para tomar decisiones en diferentes áreas relacionadas con el cuidado del paciente (área clínica, en investigación, vigilancia y a nivel administrativo) 8,9. También se ha evidenciado que la utilización de PROMs repercute favorablemente en la comunicación médico-paciente y que mejora la percepción que tiene el clínico sobre los problemas del paciente 10. Si bien los nuevos tratamientos para el cáncer han permitido mejorar en algunos casos la supervivencia, la toxicidad asociada a los mismos, junto con las características de los síntomas de la enfermedad, comprometen la calidad de vida del paciente y esto se ha relacionado con pobre adherencia a los tratamientos y con peor supervivencia 11,12.
Para la medición de la calidad de vida se han diseñado diferentes instrumentos que buscan hacer una cuantificación objetiva, válida y confiable del constructo; dentro de los más utilizados en investigación clínica a nivel mundial, se encuentran el FACIT-G (Functional Assessment of Cancer Therapy - General) 13 y el EORTC QLQ C-30 (European Organisation for Research and Treatment of Cancer, Quality of Life Questionnaire) 4. La escala FACIT-G ya ha sido validada en Colombia y ha demostrado tener adecuadas propiedades psicométricas: su estructura factorial representa cuatro dominios: bienestar físico, familiar-social, emocional y funcional 14. La escala EORTC QLQ C-30 es un instrumento que ha sido traducido a diferentes idiomas, se ha utilizado en distintos contextos culturales y ha sido validado tomando pacientes con diferentes tipos de cáncer; en los diferentes estudios el instrumento ha mostrado adecuadas propiedades clinimétricas 15-22. Hasta donde se tiene conocimiento no existen validaciones en Colombia de este instrumento, a pesar de ser considerada el PROMs más ampliamente utilizado en oncología 4. El instrumento EORTC QLQ C-30, versión 3, está conformado por 30 ítems calificados en formato Likert; este formato tiene cuatro niveles para todos los ítems, excepto para los dos de la subescala global que tienen siete niveles. La escala utiliza un marco temporal de una semana para la evaluación de los ítems. Los 30 ítems de la escala se distribuyen en cinco subescalas funcionales (cinco ítems relacionados con aspecto físico, dos relacionados con rol asumido, dos con el aspecto cognoscitivo, cuatro con el aspecto emocional y dos con el social), en tres subescalas de síntomas (conformada por tres ítems relacionados con fatiga, dos con náusea/vómito y dos con dolor), una subescala de evaluación global (integrada por dos ítems) y seis ítems individuales adicionales; esta estructura mide un total de 15 dominios relacionados con la calidad de vida. Los puntajes del instrumento se transforman linealmente en una escala de 0 a 100.
El objetivo que se planteó para el presente estudio fue realizar la evaluación de las propiedades clinimétricas de la escala EORTC QLQ C-30 al aplicarse en pacientes de la población colombiana con diagnóstico de cáncer teniendo en cuenta que es el PROMs más utilizado en cáncer, que no está aún validado en este país y que dicha escala ya había sido sometida previamente a una adaptación transcultural en pacientes colombianos 23.
Material y métodos
Se efectuó un estudio de validación de escala desde la perspectiva de la teoría clásica de medición. Los pacientes fueron ubicados en el Instituto Nacional de Cancerología entre 2009 y 2015. Como criterios de elegibilidad se consideraron: i) tener nacionalidad colombiana; ii) tener 18 años o más; iii) ser hispanoparlante; iv) tener diagnóstico histopatológico confirmado de cáncer en cualquier localización. A cada paciente que aceptó participar en el estudio, le fue aplicada la escala por un profesional en salud con experiencia en la utilización clínica de estos instrumentos. El primer contacto con los pacientes se realizó por parte de una asistente de investigación, quien verificó los criterios de elegibilidad y solicitó al paciente tramitar un consentimiento informado para participar en el estudio. Los pacientes fueron inicialmente contactados en los servicios de consulta del Instituto Nacional de Cancerología. En un subgrupo de pacientes que asistirían nuevamente a consulta, se les volvió a contactar para aplicar nuevamente la escala EORTC QLQ C-30 con miras a efectuar las mediciones relacionadas con la evaluación de confiabilidad. La puntuación de la escala se efectuó siguiendo lo recomendado en el manual de calificación del instrumento 24. Para el cálculo del tamaño de muestra para cada componente del estudio de validación se consideró la siguiente información: se recomienda un número de al menos 250 observaciones para análisis factoriales en los cuales se utilicen matrices de correlación con estructura derivada de mediciones ordinales 25. Para los análisis de validez de criterio concurrente y confiabilidad test re-test se tuvo en cuenta que las muestras utilizadas (473 y 105 pacientes respectivamente) permiten detectar diferencias significativas (valor de significación del 5%) entre coeficientes de correlación de 0,7 para la hipótesis nula y 0,8 para la alterna y alcanzar poderes mayores que 80%. Para la consistencia interna se tuvo en cuenta que muestras de al menos 96 pacientes, cada uno respondiendo un instrumento de 30 ítems, alcanzan un poder del 80% para detectar diferencias entre coeficientes alfa de 0,7 (hipótesis nula) y 0,8 (hipótesis alterna), usando una prueba F a dos colas y un nivel de significación del 5%. Los cálculos del tamaño de muestra se realizaron con el programa PASS®.
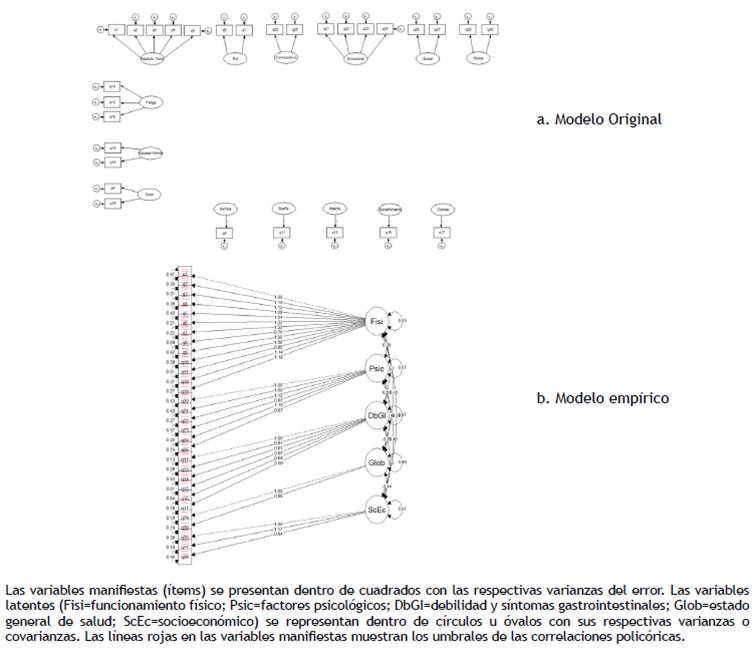
Para establecer la validez de contenido, dada la estructura ordinal en la medición de cada uno de los ítems, se realizó un análisis factorial exploratorio en una muestra de 486 pacientes usando un método de factores principales en una matriz de correlación policórica. Previamente se verificó que la matriz de correlación fuera adecuada para realizar análisis factoriales usando la prueba de esfericidad de Bartlett y la de Kaiser-Meier-Olkin. La solución ortogonal inicial fue rotada, primero de forma ortogonal y luego usando rotaciones oblicuas (promax y oblimin) para seleccionar la de mejor interpretabilidad. El número de dominios a analizar se determinó utilizando métodos de análisis paralelo y coordenadas óptimas.
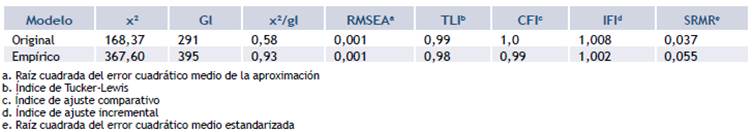
Posteriormente, utilizando la misma muestra de 486 pacientes, se efectuó un análisis factorial confirmatorio sobre dos modelos: el modelo original de 15 factores y el modelo generado en el análisis factorial exploratorio. La bondad de ajuste de cada uno de estos modelos se midió con los siguientes coeficientes: razón x2 /grados de libertad (valores <3 indican buen ajuste), raíz cuadrada del error cuadrático medio de la aproximación (RMSEA por sus siglas en inglés; valores <0,08 sugieren buen ajuste), raíz cuadrada del error cuadrático medio estandarizada (SRMR por sus siglas en inglés; valores < 0,05 indican buen ajuste), índice de ajuste comparativo (CFI por sus siglas en inglés), índice de ajuste incremental (IFI por sus siglas en inglés) e índice de Tucker-Lewis (TLI por sus siglas en inglés) (para los dos últimos índices valores >0,9 son indicio de buen ajuste del modelo) 26,27. En los análisis de ecuaciones estructurales se tuvo en cuenta la estructura ordinal de los puntajes de cada uno de los ítems utilizando métodos de mínimos cuadrados ponderados.
La validez de criterio concurrente se evaluó en 473 pacientes estimando los coeficientes de correlación entre los puntajes de la EORTC QLQ-C30 y los cuatro dominios de la escala FACIT-G. Esta última escala también está diseñada para medir la calidad de vida, consta de 27 ítems medidos en una dimensión ordinal agrupados en cuatro dominios (bienestar físico, bienestar social-familiar, bienestar emocional y bienestar funcional); en esta escala mayores puntuaciones reflejan un mayor grado de calidad de vida. Como se mencionó previamente, la escala FACIT-G ya se ha validado para su uso en Colombia 14.
La consistencia interna (indicador de confiabilidad entre ítems) fue evaluada en 486 pacientes mediante los coeficientes Alfa de Cronbach, ω de McDonald y GLB (Greatest Lower Bound); la confiabilidad test re-test se midió en 105 pacientes utilizando una estrategia de medidas repetidas con una diferencia media de 10,3 días (DE=6,9 días) y calculando el coeficiente de correlación concordancia de Lin para cada uno de los 15 dominios; adicionalmente se evaluó la dispersión de la correlación y la concordancia encontrada con respecto a la perfecta, mediante los gráficos de bondad de ajuste de Bland y Altman.
Los análisis del componente estadístico descriptivo y de validación con el programa R utilizando las librerías psych, paran, polycor, semPlot y lavaan 28-32.
El estudio fue aprobado por el comité de ética del Instituto Nacional de Cancerología.
Resultados
La escala EORTC QOL C-30 fue aplicada a 486 pacientes con una media de edad de 60,8 años (DE=11,6 años). El 49,8% de los pacientes fueron mujeres (N=242). La mayoría de pacientes presentó cáncer de próstata (46,9%, N=228 pacientes, representando el 93% de los cánceres en la muestra de hombres) y de mama (43,8%, N=213 pacientes, dando cuenta del 87,2% de los cánceres en la muestra de mujeres); 13 pacientes presentaron cáncer ginecológico (2,7% de la muestra total y 5,4% de la muestra de mujeres) y seis pacientes tuvieron diagnóstico de cáncer de cabeza y cuello (1,2%); hubo 4 pacientes (0,82% por categoría) en cada uno de los siguientes tipos de cáncer: colon, piel, recto y de tejidos blandos; tres pacientes presentaron cáncer de tipo hematopoyético (0,62%); para los diagnósticos de cáncer de pulmón y riñón hubo dos pacientes en cada categoría (0,41% por categoría); para los diagnósticos de cáncer cerebral, gástrico y de vías urinarias hubo un paciente respectivamente (0,21% por categoría).
Los puntajes de los ítems estuvieron en un rango entre 1 y 4, excepto para los ítems q29 y q30 que se calificaron entre 1 y 7. Los puntajes en cada uno de los dominios se muestran en la figura 1.
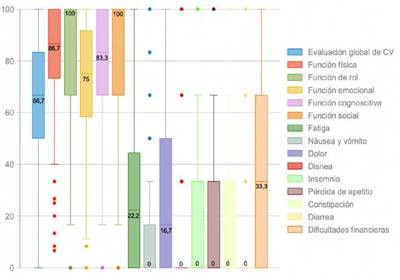
* Mayores puntajes indican mejor calidad de vida
Figura 1 Diagrama de cajas con las puntuaciones global y en cada una de las variables latentes de la escala EORTC QLQ C-30 en 486 pacientes colombianos con cáncer en el Instituto Nacional de Cancerología*
Análisis factorial exploratorio
La estructura de la matriz de correlación resultó adecuada para efectuar análisis factoriales (prueba de esfericidad de Bartlett (X2=7007,2 (435), p=0,000) y prueba de Kaiser-Meyer-Olkin (KMO=0,93)). De acuerdo con el método de análisis paralelo y de coordenadas óptimas, el número de factores a analizar fue de seis y cinco respectivamente); sobre estas dos opciones se efectuaron análisis de factores principales y se practicaron rotaciones ortogonales y oblicuas; la solución que mostró una mejor interpretabilidad fue la de cinco factores rotada oblicua (promax); la estructura de dicha solución se presenta en la tabla 1. Los cinco factores explican un 60% de la varianza distribuida así: D1: 22%, D2: 11%, D3: 10%, D4: 9%, D5: 8%. Los valores de correlación más altos se dieron entre los dominios 1-2 y 2-5 (0,58 y -0,50 respectivamente); los valores más bajos fueron entre los dominios 3-4 y 5-4 (0,28 y -0,21 respectivamente). El valor de unicidad más alto que se alcanzó fue de 0,74. La estructura de cada dominio puede resumirse de la siguiente manera:
Dominio uno: está conformado por 13 de los 30 ítems de la escala. El factor agrupa aspectos relacionados especialmente con funcionamiento físico y síntomas relacionados.
Dominio dos: está conformado por seis de los 30 ítems de la escala y agrupa aspectos relacionados con factores psicológicos y cognoscitivos.
Dominio tres: constituido por los ítems 12 a 17. Es un factor relacionado con la presencia de debilidad y síntomas gastrointestinales.
Dominio cuatro: constituido por los dos últimos ítems de la escala. Es un factor relacionado con la exploración del estado general de salud.
Dominio cinco: constituido por tres ítems. Es un factor relacionado con aspectos sociales y económicos.
Análisis factorial confirmatorio
Para este componente de la validación se evaluaron dos modelos (fig. 2): el original reportado por la organización EORTC (fig. 2a) y el empírico, resultante del análisis factorial exploratorio efectuado en la fase anterior (fig. 2b) se encontraron adecuados valores en los indicadores de bondad de ajuste: Razón x2 /grados de libertad <3; RMSEA <0,08; SRMR < 0,05; CFI; IFI, e índice de Tucker-Lewis (TLI) >0,9. En general los indicadores de bondad de ajuste para los dos modelos son muy similares (tabla 2).
Consistencia interna
La consistencia interna de la escala, medida con el Alfa de Cronbach, fue de 0,94. Ninguno de los ítems, al ser retirado, incrementó de manera importante el nivel de consistencia global de la escala. El omega de McDonald dio un valor de 0,96 y el coeficiente GLB 0,93. Los valores del coeficiente alfa y omega para cada factor fueron respectivamente: Factor 1 (0,92-0,93); Factor 2 (0,90-0,81); Factor 3 (0,79-0,79); Factor 4 (0,77-0,74), y Factor 5 (0,74-0,88).
Validez de criterio concurrente
Se evaluó en 473 pacientes. Para tal efecto se seleccionaron las subescalas del EORTC QLQ C-30 que tuvieran correspondencia teórica con las de la escala FACIT: funcionamiento físico (5 ítems), funcionamiento social/familiar (2 ítems), funcionamiento emocional (4 ítems) y papel funcional (2 ítems). Los valores de las correlaciones entre las parejas de subescalas contrastadas oscilaron entre 0,1 y 0,7 (tabla 3).
Confiabilidad test re-test
La confiabilidad en mediciones repetidas se evaluó en 105 pacientes examinados con una diferencia media de tiempo entre las dos mediciones de 10,3 días (de=6,9 días), encontrándose un rango entre 2 y 47 días. Para evaluar dicha confiabilidad se utilizó el coeficiente de correlación-concordancia de Lin que reportó valores entre 0,32 y 0,84. En general se advirtieron coeficientes de correlación-concordancia más altos en los dominios relacionados con funcionalidad que en los de síntomas (tabla 4).
Discusión
La escala EORTC QLQ C-30 es uno de los instrumentos para medir PROMs que se utiliza más ampliamente (está traducida a más de 80 idiomas) y cuenta con diversas validaciones en el mundo 15-22) (33-47. Hasta donde tenemos conocimiento no existen validaciones de la escala completa para ser utilizada en pacientes con cáncer en Colombia. En el presente estudio de validación se encontró que la estructura factorial original reportada para el instrumento (también llamado modelo estándar) tiene una adecuada representación en una muestra de pacientes colombianos con cáncer. La estructura factorial de esta escala ha sido probada en diferentes estudios y se han evaluado diferentes alternativas de organización de los ítems 48,49. Aunque la estructura del modelo estándar se ha mostrado consistente en varios estudios de validación 50,51, también se han propuesto otros modelos que plantean un menor número de variables latentes; por ejemplo, se ha encontrado que un modelo de segundo orden con solo dos dominios centrales (salud mental y salud física) tiene buena calidad de ajuste 49 y puede resultar más eficiente a la hora de ser usado en investigación clínica, teniendo en cuenta que un menor número de factores permite análisis estadísticos más parsimoniosos al reducir el número de pruebas estadísticas que pueden derivarse de una estructura factorial compleja (el modelo estándar de la escala EORTC QLQ C-30 tiene 14 variables latentes).
En este sentido, la solución factorial derivada del análisis factorial exploratorio realizado en el presente estudio de validación puede resultar eficiente ya que: refleja una estructura teóricamente plausible, muestra una adecuada representación de ítems en cada dominio (todos los ítems presentaron adecuadas cargas factoriales), muestra buenos indicadores de bondad de ajuste y solo está compuesta por cinco variables latentes (nueve menos que los del modelo estándar); sin embargo, la aplicación de la estructura factorial empírica en escenarios clínicos y de investigación implica desarrollar algoritmos de calificación particulares que no fueron efectuados en la presente validación.
Para evaluar la validez concurrente del instrumento se midió la correlación de un grupo de dominios (físico, social, emocional, funcional) que fueran similares a los de otro instrumento para medir el mismo constructo, validado en pacientes colombianos (FACT-G). Los valores de correlación entre las dos escalas mostraron valores aceptables, excepto para el dominio relacionado con aspectos sociales; sin embargo, este dominio es medido por solo dos ítems en la escala EORTC QLQ C-30 (q7: ¿Ha tenido alguna dificultad para realizar sus aficiones o pasatiempos? y q6: ¿Ha tenido alguna dificultad para hacer su trabajo u otras actividades cotidianas?) mientras que la escala FACT-G dispone de 7 ítems para medir tal constructo; esta diferencia en la estructura y el número de ítems puede afectar el resultado de las mediciones de correlación entre los dominios de los dos instrumentos. Cabe resaltar que el estudio de validación de la escala FACT-G en Colombia reportó un resultado similar al evaluar la validez concurrente 14.
La confiabilidad del instrumento resultó adecuada al ser medida con estimaciones de la consistencia interna y mediante comparación de medidas repetidas; en el primer caso se utilizaron, además de los coeficientes Alfa de Cronbach, coeficientes omega de McDonald y GLB; la utilización de estos dos últimos estimadores de consistencia se efectuó teniendo en cuenta las limitaciones que se han reportado en relación con el coeficiente Alfa de Cronbach (en ausencia de equivalencia tau y en presencia de ítems con valores sesgados, el Alfa de Cronbach presenta más sesgo que los otros dos coeficientes) 52. En relación con el componente de medidas repetidas se encontraron mejores medidas de estabilidad en los dominios relacionados con funcionalidad que en los de síntomas: esto podría explicarse por la mayor cantidad de ítems incorporados dentro de los dominios de funcionalidad.
Como limitaciones del presente estudio consideramos las siguientes:
La muestra tiene una representación muy alta de solo dos localizaciones del cáncer: próstata y mama. No puede descartarse que otros tipos de cáncer puedan mostrar funcionamientos diferenciales al efectuar la medición con la escala EORTC QLQ C-30 ni tampoco puede descartarse la presencia de funcionamiento diferencial de los ítems del instrumento si se incorporan variables adicionales como estadio clínico o tipo y fase del tratamiento.
No se registró de manera sistemática la procedencia de los pacientes: si bien, se confirmó como criterio de inclusión que todos los pacientes tuvieran nacionalidad colombiana, no se especificó dentro del protocolo el lugar de procedencia; Colombia es un país con una gran diversidad cultural y este es un factor que puede afectar el funcionamiento de un instrumento de medición como son las escalas.
No se evaluó cuál fue la sensibilidad al cambio del instrumento, aspecto que es de gran importancia a la hora de poder verificar el efecto de intervenciones clínicas sobre la calidad de vida de los pacientes.
Para estudios posteriores con este instrumento de medición se plantea la importancia de evaluar aspectos adicionales recomendados dentro de una validación de un instrumento, como son las medidas de ajuste de los ítems, la evaluación de la escala de medición de cada ítem y el análisis del cubrimiento del espectro del constructo con los ítems de la escala; dichos aspectos pueden ser cubiertos utilizando técnicas relacionadas con la teoría de respuesta al ítem.
Se concluye que la escala EORTC QLQ C-30 es un instrumento válido y confiable para medir calidad de vida en pacientes con cáncer en Colombia. Esto supone disponer de una herramienta de utilidad para medir PROMs en pacientes, lo cual puede redundar en beneficios clínicos, investigativos y en el cuidado de la salud del paciente con cáncer.