Introducción
En el mundo, el cáncer de mama es un problema de salud pública, sin embargo, el riesgo de desarrollar cáncer de mama no es similar en todas las regiones. La incidencia de cáncer se concentra en aquellas zonas de mayor desarrollo humano caracterizadas por una mayor expectativa de vida, un mayor nivel de educación y un mayor ingreso bruto per cápita, por lo que las mujeres residentes en países de muy alto índice de desarrollo humano (MAIDH) tienen el mayor riesgo de padecer esta enfermedad 1.
En los países de MAIDH como en Europa, Estados Unidos y Canadá la mortalidad por cáncer de mama se ha podido reducir entre un 25-30% gracias a la implementación de estrategias de tamización, así como de tratamiento oportuno e integral 1,2. En la actualidad existe controversia sobre el peso que tiene la tamización frente al tratamiento y respecto al porcentaje de reducción de la mortalidad por cáncer de mama 3,4,5. El Instituto Nacional de Cáncer de Estados Unidos encontró que, en ese país, entre 2000 y 2012, los avances en el tratamiento se asociaron con una mayor contribución que la tamización, respecto a la disminución general de la moralidad por cáncer de mama para todos los subtipos moleculares, excepto un subtipo agresivo (ER- / ERBB2-) 6.
En Colombia, el cáncer de mama constituye la primera causa de incidencia por cáncer en las mujeres. En 2018, la tasa estimada de incidencia fue 44,1 por 100.000, es decir cerca de 13.380 casos nuevos al año 3. Esta cifra se considera de riesgo intermedio si se compara con la de Estados Unidos con 263.347 casos al año y una tasa de incidencia estandarizada por edad de 84,8 por 100.000 mujeres. En Colombia, el mayor riesgo de cáncer de mama se concentra en las ciudades capitales y esto se explica porque los procesos de urbanización determinan, además de lo mencionado, una mayor prevalencia de factores de riesgo (dietas ricas en grasa, obesidad, tabaquismo, edad tardía al primer embarazo, baja paridad) 7. Existe controversia en la evidencia sobre la práctica de lactancia materna y el uso de anticonceptivos orales por largos periodos de tiempo 8,9. El principal problema que se observa en el país es que la mortalidad por esta causa no se ha disminuido y, por el contrario, va en aumento 10.
Entre los países de América Latina, tanto Argentina como Chile han logrado disminuir la mortalidad por cáncer de mama, pues en ambos la mamografía de tamización se realiza a partir de los 50 años. De Chile se resalta el hecho de que además se implementó una ley denominada Ley AUGE que hace énfasis en garantizar la oportunidad diagnóstica para las mujeres con sospecha de cáncer de mama, así como la oportunidad de inicio de tratamiento y la estandarización del tratamiento 11,12.
El Plan Decenal para el control del cáncer en Colombia 2012-2022 propuso como meta implementar un Programa Nacional de Detección Temprana del Cáncer que incluya el cáncer de mama, a fin de incrementar el diagnóstico de la enfermedad en estadios tempranos (meta 60% con línea de Base 31% 2008), mediante: el incremento en la cobertura de mamografía de tamización bienal al 70% en mujeres de 50 a 69 años y la garantía del acceso oportuno a confirmación diagnóstica y tratamiento en el 100% de las mujeres con mamografías reportadas como BIRADS 4 o más 13.
La Guía de atención integral para la detección temprana, atención integral, seguimiento y rehabilitación de pacientes con diagnóstico de cáncer de mama, luego de una exhaustiva revisión de la evidencia científica y de los análisis económicos, de impacto presupuestal y de factibilidad, recomienda realizar tamización de base poblacional organizada mediante mamografía de dos proyecciones, cada dos años en mujeres de 50 a 69 años de edad adicional al examen clínico de la mama anual realizado por personal entrenado. Esta práctica debe ser complementada con detección temprana en mujeres sintomáticas independientemente de su edad, utilizando las estrategias diagnósticas adecuadas que pueden incluir la mamografía o la ecografía. La guía no recomienda realizar tamización de rutina con mamografía en mujeres menores de 50 años. Se considera que la tamización en mujeres de 40 a 49 años debe ser individual y debe tener en cuenta el contexto del paciente incluyendo sus valores en relación con beneficios y daños 14.
Al tener en cuenta estas recomendaciones, el 3 de octubre fue aprobado en primer debate el proyecto de ley 259 de 2019 Cámara - Proyecto de Ley "Por medio de la cual se establecen medidas para la prevención, diagnóstico, tratamiento oportuno, rehabilitación, y cuidados paliativos del cáncer de mama y se dictan otras disposiciones". El proyecto de ley tiene por objeto lo establecido en el título. En sus artículos plantea definir el día nacional de la detección temprana de cáncer de mama e implementar un programa nacional de detección temprana a cargo de las entidades administradoras de planes de beneficios, los regímenes de excepción, las instituciones públicas y privadas y los entes territoriales. Dentro de este programa propuesto se resalta el hecho que, a diferencia de las recomendaciones previamente definidas en el país, se propone la tamización con mamografía a partir de los 40 años cada dos años hasta cumplir los 50 años y en mujeres mayores de 50 años cada año. El proyecto resalta la importancia de realizar el control de calidad de la tamización de cáncer de mama, así como la obligatoriedad en el cumplimiento de la atención en salud para el diagnóstico y el tratamiento de cáncer de mama. Igualmente, el proyecto hace énfasis en disponer de una red integral de servicios oncológicos para el tratamiento oportuno de cáncer de mama, así como la necesidad de fortalecer de las funciones de inspección, vigilancia y control por parte de la Superintendencia Nacional de Salud en el seguimiento de la ley. El proyecto de ley finaliza con la mención sobre las sanciones previstas en la Ley por el incumplimiento a las ordenes adoptadas, así como la función que tiene la Procuraduría General de la Nación respecto de los informes de vigilancia sobre el estado de cumplimiento de lo ordenado en la mencionada ley 15.
A fin de revisar el soporte científico del contenido del proyecto de ley y aportar a su adecuada discusión, el Instituto Nacional de Cancerología (INC) realizó un foro el 9 de diciembre de 2019. El propósito de este artículo es presentar el análisis de los puntos de mayor controversia desde una perspectiva científica, como base para la adecuada toma de decisiones en materia de políticas de salud pública.
1. La incidencia de cáncer antes y después de los 50 años
El INC estima el riesgo de cáncer para todo el país con la metodología propuesta por la Agencia Internacional de Investigación en Cáncer (IARC, por su sigla en inglés), con base en la información recolectada por los registros de base poblacional de Cali, Pasto, Manizales y Bucaramanga, el Censo Poblacional, y las cifras oficiales de mortalidad divulgadas por el Departamento Nacional de Estadística de Colombia (DANE) 11,16.
En el marco del Foro, la Sociedad Colombiana de Radiología citó los datos relativos al comportamiento del cáncer de mama notificados al Instituto Nacional de Salud (INS), quien publica boletines del Sistema de Vigilancia Epidemiológica Nacional (SIVIGILA). Para 2018, se notificaron al INS 2.278 casos nuevos de cáncer de mama y esta institución reporta una tasa de incidencia de 4,5 por 100.000 mujeres 17. El SIVIGILA se basa en un modelo de notificación diseñado para la vigilancia de las enfermedades transmisibles, el cual no coincide con los métodos utilizados para la vigilancia de las enfermedades crónicas que requieren una revisión exhaustiva de todas las posibles fuentes de información (búsqueda activa) sobre la ocurrencia de la enfermedad en un espacio de población dado 18. Esta discusión hizo imperativa la necesidad de revisar en el marco de este foro el uso de las cifras publicadas por el SIVIGILA para cáncer de mama, así como sus objetivos.
De otra parte, la Cuenta de Alto Costo (CAC), entidad encargada de generar mecanismos de compensación económica para las aseguradoras de salud (ajuste de la prima básica), a fin de evitar la selección adversa en torno a las enfermedades de alto costo reportó en su publicación de 2018 que le fueron notificados 6.348 casos nuevos de cáncer de mama 19. Las cifras generadas por los dos sistemas de notificación que tiene el país (SIVIGILA y CAC) no coinciden entre sí y tampoco coinciden con las estimaciones de incidencia realizadas a partir de sistemas de vigilancia (RCBP) con las metodologías de cálculo validadas internacionalmente 20. Estas diferencias se explican por las diferencias metodológicas utilizadas las cuales deben revisarse con detenimiento, particularmente frente a la toma de decisiones en materia de salud pública y la decisión de utilizar una u otra fuente de información para dicho propósito.
El sistema de vigilancia global del cáncer de la Organización Mundial de la Salud (OMS), liderado por la IARC, muestra un incremento en la incidencia de cáncer a nivel mundial con una distribución por edad que varía dependiendo del nivel de ingreso de los países, variación que se encuentra en estrecha relación con la estructura de la pirámide poblacional. Los países de mayores ingresos tienen más casos de cáncer con una menor proporción de casos por debajo de los 50 años (edad media de la menopausia) debido al envejecimiento poblacional. En contraste, los países de bajos ingresos tienen una población más joven, menos casos de cáncer con una mayor proporción de casos por debajo de los 50 años 5.
Una proporción mayor de casos por debajo de los 50 años no significa mayor riesgo a esta edad sino como se anotó, un efecto simple de la pirámide poblacional: las tasas de incidencia que expresan el número de casos por habitante son invariablemente menores por debajo de los 50 años. El Registro Poblacional de Cáncer de Cali (único de 4 registros validados en el país que tiene información recolectada de forma continua durante más de 20 años) reporta la distribución del riesgo en mujeres menores y mayores de 50 años 5. En la Figura 1 se presenta la tendencia temporal en las tasas de incidencia de cáncer de mama por grupos de edad desde 1962. La Figura 2 muestra las tendencias en las tasas de mortalidad de cáncer de mama por grupos de edad, entre 1984-2018. Como se puede observar en esta figura las tasas de mortalidad en mujeres menores de 50 años se ha mantenido constante mientras que entre las mayores de 70 años se han incrementado.
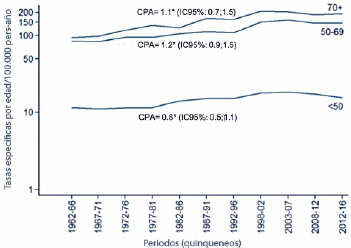
Figura 1 Cali, Colombia. Tendencia temporal en las tasas de incidencia de cáncer de mama por grupos de edad, 1962-2016.
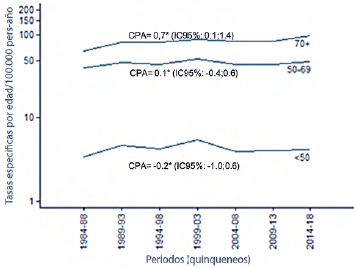
Figura 2. Cali, Colombia. Tendencia temporal en las tasas de mortalidad de cáncer de mama por grupos de edad, 1984-2018.
En este mismo sentido, para 2018, las estimaciones de incidencia del Sistema de Vigilancia de la IARC/OMS para Colombia indican que el 33,1% de los casos nuevos de cáncer de mama ocurren en menores de 50 años y el 18,6% en mujeres de 70 años o más 3, edades no cubiertas por las actuales recomendaciones de tamizaje ni en Colombia ni en la inmensa mayoría de países en el mundo como se discutirá más adelante.
2. La mamografía de tamización
La evaluación global de los beneficios y eventos adversos ocasionados por el tamizaje de cáncer de mama en la población muestran evidencia sobre la reducción de la mortalidad en mujeres de 50-69 años, así como entre 70 y 74 años 6,21,22,23.
La evidencia es limitada para el grupo de mujeres de 40-49 años y no hay evidencia por fuera de estos rangos de edad (menores de 40 o mayores de 75). Una de las razones por las que la reducción de mortalidad en menores de 50 años no es clara, se relaciona con el menor desempeño o la menor capacidad de detección de la mamografía por debajo de esta edad, posiblemente asociado a la mayor densidad mamaria antes de la edad de menopausia. Por otro lado, las tasas de falsos positivos son más altas en esta población que en mujeres de 50 a 69 años, lo que aumenta el sobretratamiento y genera ansiedad y angustia por el cáncer de mama, así como consecuencias psicológicas negativas 22.
Por otra parte, los estudios muestran que por debajo de los 50 años la proporción de resultados de falsos positivos de la mamografía es mayor (355 por 100.000 en menores de 50 años versus 242 por 100.000 en mayores de 50 años), lo que induce una mayor proporción de biopsias y procedimientos innecesarios (1 de cada 2,5 versus 1 de cada 7, respectivamente) 5.
Un efecto potencial adicional de la tamización con mamografía es el sobrediagnóstico (estimado en 12,4%) 22 por la detección de tumores indolentes con crecimiento tan lento que si no se hubiese hecho el tamizaje nunca se habrían detectado durante la vida de la mujer, y por tanto nunca habrían afectado su salud, ya que habrían muerto a edad avanzada por causas no relacionadas con el cáncer de mama.
Este riesgo se asocia de manera importante con el diagnóstico de una variedad tumoral, la cual es el carcinoma ductal in situ (CDIS), entidad que solo se incrementó después de la introducción de la tamización mamográfica y que actualmente representa más del 25% de los cánceres de mama 15. La mayoría de CDIS tiene una tasa de progresión lenta y no llega a cáncer invasivo, sin embargo, las pacientes con este diagnóstico son llevadas a tumorectomía con radioterapia adyuvante y una importante proporción serán llevadas a mastectomía 5,21,24
Algunos estudios basados en datos poblacionales provenientes principalmente de los programas de tamizaje del norte de Europa muestran que el aporte a la reducción de la mortalidad de la mamografía es menor, mientras que la introducción de nuevas alternativas de tratamiento sistémico representa la intervención con mayor impacto independiente del tamizaje, es decir, puede ser la detección de la enfermedad en etapas tempranas a partir de síntomas 25. Este tipo de información llevó a Suiza a suspender su programa de tamización por considerarlo ineficiente; no obstante, debe tenerse en cuenta la cobertura y capacidad de respuesta de los sistemas de salud para tomar decisiones en dicho sentido, condiciones que difieren sustancialmente entre países de altos y bajos ingresos 25. En ausencia de tales condiciones, lo ideal es tener un programa de tamizaje con suficiente cobertura de la población objeto, calidad en las pruebas en la rutina de los servicios, y que garantice el acceso oportuno y apropiado a la confirmación diagnóstica y el tratamiento de la enfermedad.
La Encuesta Nacional de Demografía y Salud se realiza quinquenalmente y permite hacer vigilancia de las acciones de tamización. Esta reportó una cobertura de mamografía cercana a 48% en la población objeto del tamizaje (50 a 69 años), entendida como el antecedente de mamografía de tamizaje en los dos años anteriores a la encuesta; con solo 4 departamentos llegando a coberturas de 50% 26. Pocas mujeres entre 50 a 69 años lo hacen regularmente cada dos años: 30,4% en 2005 27, 54,8°% en 2010 26 y 52,5°% en 2015 26. Es decir que las metas planteadas en el plan decenal para el control del cáncer no se han cumplido.
En resumen, la evidencia científica acerca de la eficacia de la tamización con mamografía para la reducción de la mortalidad por debajo de los 50 años o por encima de los 75 años es controversial, tal como lo reconocieron todos los participantes en el foro organizado por el INC, incluyendo las sociedades de Radiología, Mastología y Onco-Hematología.
Adicionalmente, los datos disponibles sobre tamización de cáncer de mama en el país indican fuertes deficiencias en el cumplimiento de las recomendaciones existentes. En este escenario, donde la mortalidad por la enfermedad sigue en aumento a expensas principalmente del grupo de edad cubierto por las recomendaciones, el aporte de extender la edad de tamización no es solamente nulo sino potencialmente dañino debido a la carga adicional que impone sobre un programa que no funciona adecuadamente. Ya que a la edad de 40 años, la tamización implica un 63,9% adicional de mujeres para buscar un 20% adicional de tumores, sin la certeza de poder detectarlos debido al menor desempeño de la tamización a esta edad, y también sin la certeza de reducir la mortalidad, además de un incremento de efectos indeseables del tamizaje (falsos positivos y sobre diagnóstico), como ya se anotó.
Son estas las razones por las que muy pocos países en el mundo han adoptado la tamización con mamografía por debajo de los 50 años, sin que se observe diferencia en reducción de la mortalidad frente a quienes no han incorporado dicha recomendación 4.
La calidad de las mamografías de tamización
El INC realizó una evaluación de calidad mamográfica en 39 centros en seis ciudades de Colombia que aceptaron participar. En cada centro visitado se evaluó la infraestructura, los sistemas de adquisición, el procesamiento, la lectura, la protección radiológica y la calidad de las imágenes. Además, se compararon las medidas de todos los parámetros físicos con los estándares nacionales e internacionales. Con base en esta evaluación se encontraron deficiencias significativas en los parámetros de la evaluación, particularmente en las condiciones de almacenamiento de las películas, el cuarto oscuro, el equipo radiológico, el control automático de exposición, los negatoscopios y la calidad de la imagen. Este estudio encontró un 60-100% de no conformidad en estándares nacionales e internacionales, lo cual puso en evidencia la necesidad de programas de aseguramiento para que la calidad mejore 29.
Luego de estos hallazgos, el INC realizó las recomendaciones específicas a cada centro para iniciar un plan de mejora y un año después midió el avance de seguimiento a las recomendaciones realizadas. Es así como en las seis ciudades de Colombia se realizó una evaluación del control de calidad de las mamografías en una muestra de 28 centros de radiología que prestaban el servicio y que participaron de forma voluntaria. El INC comparó los resultados de la visita inicial con lo registrado un año después en los 28 centros. Los resultados mostraron una mejora significativa en: la calidad de la imagen mamográfica, la adecuación de la infraestructura, la calibración de los equipos de mamografía y las condiciones de visualización de las imágenes. Sin embargo, se observaron deficiencias significativas en algunos de los parámetros de la evaluación particularmente en la calidad de la imagen 30.
En relación con ello, y teniendo en consideración que el tejido glandular es el más sensible a la radiación ionizante, el INC estimó la dosis glandular media (MGD) para estimar el riesgo de exposición en el tejido glandular. Este estudio se realizó en 60 equipos mamográficos localizados en 10 ciudades de Colombia y de manera complementaria, se hizo énfasis en la evaluación de la calidad de la imagen. De acuerdo con los estándares internacionales la MGD debe ser inferior a 2 mGy, que es lo recomendado en una sola proyección. La distribución de la dosis glandular media (MGD) en los mamógrafos evaluados fue de 2,07 mGy para el valor promedio, 2,01 mGy para la mediana (segundo cuartil) y 2,29 mGy para el tercer cuartil. Para la evaluación de la imagen del maniquí, un 62% de todos los equipos no cumplieron con los requerimientos de calidad. Se evidenció que solo en el 50% de los mimógrafos evaluados cumplían con el estándar de seguridad y en un 62% de todos los equipos se evidenció una inconformidad en la calidad de imagen 31.
Dado que la lectura de la mamográfica es observador dependiente y en la mayoría de los países de Europa el radiólogo debe realizar una doble lectura, se hizo un estudio en 11 centros mamográficos de Bogotá, con una muestra de 323 exámenes mamográficos de mujeres asintomáticas de 50 a 69 años, seleccionadas de forma aleatoria y estratificada según su categorización BI-RADS. Se determinó la concordancia de la categorización diagnóstica del sistema BI-RADS en los informes mamográficos entre los radiólogos de los centros mamográficos y el consenso de dos médicos radiólogos expertos del INC. Se encontró una tasa de acuerdo del 54,9% y una índice kappa (k) de 0,21 (IC 95%: 0,14-0,28) en la categorización BI-RADS. El estudio resalta la alta variabilidad para la interpretación de las imágenes mamográficas por parte de los radiólogos 32.
Todos estos estudios resaltan la necesidad de hacer énfasis en la implementación de un sistema de garantía de calidad para la mamografía de tamización que mejoran la seguridad para las mujeres, la calidad de la imagen, así como la precisión de los resultados de la interpretación. Los países europeos tienen sistemas de control de calidad de las imágenes que, además de realizar una doble lectura por parte de radiólogos, tienen un sistema de auditorías externas. Un ejemplo muy importante de estos sistemas de garantía es el de Holanda, que se considera uno de los más completos 33,34.
Los retos del tratamiento
El tratamiento del cáncer requiere unos mínimos en calidad y tiempo para el diagnóstico, tratamiento, rehabilitación, seguimiento, para lograr una mejor supervivencia. El análisis de supervivencia para los últimos 20 años mostró que en Cali hubo una mejoría significativa (p= 0,001) en la supervivencia neta a 5 años hasta 2000-2004, en comparación con el período 1995-1999, aunque en la década 2005-2016 se observó un estancamiento 35.
Para mejorar la supervivencia de las pacientes diagnosticada es necesario realizar un trabajo interdisciplinario entre el cirujano especialista en cáncer de mama, el oncólogo clínico y el radioterapeuta, además con los equipos de soporte. La oportunidad es esencial y el tiempo óptimo para inicio de tratamiento adyuvante con quimioterapia después de la cirugía debe ser inferior a 90 días, quienes sobrepasan este tiempo tienen un 34% más de riesgo observado de morir (HR 1,34; IC95% 1,15-1,57) y 27% más riesgo de morir por cáncer de mama (HR 1,27; IC95% 1,051,53); por demora aumenta el riesgo de muerte en 4%, los resultados son peores para el subgrupo triple negativo con menor supervivencia global (HR 1,53 IC95% 1,05-1,53) y supervivencia específica (HR 1,53 IC95% 1,17-2 36. También afecta la supervivencia la reducción de la dosis y los tratamientos irregulares que no cumplen con los tiempos establecidos en los protocolos. Esto se evalúa con la denominada intensidad de dosis relativa total IDRT que es la relación entre la dosis real administrada en el tiempo y la dosis planeada en el tiempo multiplicado por 100. Los pacientes con IDRT menor a 85% tienen menor supervivencia (p=0,0086) 37.
La European Society of Breast Cancer Specialists (EUSOMA) ha establecido unas guías de calidad entre sus afiliados en los diferentes aspectos del abordaje, tratamiento y rehabilitación del cáncer de mama y recomienda que el tiempo entre el primer examen diagnóstico en el centro y el primer tratamiento sea menor a 6 semanas 38.
Estudios previos realizados en 2006 en Bogotá, donde se encuentra la mejor oferta de servicios, mostraron que el tiempo promedio para inicio del tratamiento fue mayor a seis meses (193 días con desviación estándar 210 días) y el 37% de las mujeres presentaron demoras mayores a los seis meses 39. Datos más recientes publicados CAC en 2018, muestran una mediana 55 días entre la sospecha médica al diagnóstico y de 68,6 días entre el diagnóstico al tratamiento para un total de 123 días, lo cual muestra que en Colombia no se tiene la oportunidad necesaria para reducir el riesgo de muerte 20. Es importante anotar, además, que los registros no cubren la totalidad de las mujeres con cáncer de mujeres y el subregistro parece estar a favor del régimen contributivo; esto significa que muy probablemente la oportunidad es menor para las mujeres del régimen contributivo como ya se ha encontrado en otros estudios 24.
Además, para alcanzar los objetivos de supervivencia y lograr el éxito en el tratamiento la quimioterapia se debe aplicar en los tiempos establecidos para garantizar la regularidad del tratamiento, con el fin de alcanzar una intensidad de dosis mayor o igual 85%. En Colombia no hay datos sobre la intensidad de dosis.
Es importante para el adecuado tratamiento de las mujeres con cáncer de mama seguir las recomendaciones establecidas por las Guías de Atención Integral (GAI), que en su última versión hizo énfasis en varios puntos que generaban controversias 15. Estos puntos son: la omisión de vaciamiento axilar en pacientes con cáncer de mama temprano y ganglio centinela positivo, las estrategias de manejo hormonal adyuvante de la paciente premenopáusica, omisión de radioterapia adyuvante postcirugía conservadora en pacientes seleccionados con cáncer de mama temprano, la terapia antiHER2 en pacientes con cáncer de mama HER2 positivo metastásico o en progresión, la combinación de carboplatino más taxanos en el tratamiento neoadyuvante de pacientes con cáncer de mama triple negativo y, por último, indicaciones para la solicitud de perfiles de expresión genómica en cáncer de mama infiltrante 13. Es conveniente para el país hacer seguimiento de la adherencia a las guías de tratamiento como sistema de evaluación de la calidad de los tratamientos y una fuente importante para ello podrían ser los registros administrativos.
En la tabla 1 se presentan algunas de los Indicadores calidad de la Sociedad Europea de especialistas en cáncer de mama (EUSOMA).
Tabla 1 Indicadores calidad de la Sociedad Europea de especialistas en cáncer de mama (EUSOMA)
| Indicador | Nivel de recomendación |
|---|---|
| Pacientes remitidos a consejería genética | Nivel IV, Recomendado, mínimo 10%, objetivo: NO |
| Proporción de pacientes discutidos en junta multidisciplinaria | Nivel III, Mandatario, mínimo 90%, objetivo 99% |
| Pacientes con cáncer invasivo y una sola cirugía (sin reconstrucción) | Nivel II, Mandatorio, mínimo 80%, objetivo 90% |
| Pacientes con cáncer invasivo y una sola cirugía (sin reconstrucción) | Nivel II, Mandatorio, mínimo 80%, objetivo 90% |
| Paciente con T > 1 cm invasivo, G+ que reciben QT adyuvante | Nivel I, Mandatorio, mínimo 85%, objetivo 95% |
| Pacientes con Her2 +, T>1cm o G+ tratado con QT y trastuzumab adyuvante | Nivel I, Mandatorio, mínimo 85%, objetivo 95%) |
| Pacientes con Her2+ tratado con QT neoadyuvante y trastuzumab | Nivel I, Mandatorio, mínimo 90%, objetivo 95% |
Recomendaciones finales
Este artículo presentó un análisis y una descripción de los puntos más críticos que se realizaron frente la Ley 259 de 2019 Cámara - Proyecto de Ley "Por medio de la cual se establecen medidas para la prevención, diagnóstico, tratamiento oportuno, rehabilitación, y cuidados paliativos del cáncer de mama y se dictan otras disposiciones" como fueron lo relacionado con la incidencia de cáncer en menores de 50 años, la tamización con mamografía por debajo de los 50 años de edad, así como el acceso y la oportunidad al tratamiento integral en pacientes con diagnóstico de cáncer.
A la reunión académica realizada en el Instituto Nacional de Cancerología el 9 de diciembre de 20 asistieron miembros de la Asociación Colombiana de Mastología, la Asociación Colombiana de Radiología, la Asociación Colombiana de Hemato y Oncología, la Asociación Colombiana de Radioterapia Oncológica, la Asociación de Exalumnos; y, aunque no fue una reunión de consenso, las asociaciones estuvieron de acuerdo en firmar unas recomendaciones sustentadas en el análisis realizado en el marco de la Guía de Atención Integral para cáncer de mama que fue publicado en 2014, el cual recogía la evidencia hasta ese momento 13. En ese sentido, se hizo énfasis en que el principal punto relacionado con el cáncer de mama en Colombia es el hecho que a pesar de haber introducido la mamografía de tamización a la población de mujeres entre 50 a 69 años, el país no ha podido registrar una reducción de la mortalidad. Este punto debería estar claro en el objeto del proyecto y se recalcó que la no reducción de la mortalidad en Colombia está relacionada con la baja cobertura de tamización en el grupo de población objeto, los problemas de calidad de la mamografía, así como el bajo acceso al diagnóstico y el tratamiento oportuno, y en ese sentido deberían enfocarse las estrategias definidas.
Al finalizar el foro, se recomendó no proponer la tamización a mujeres entre 40 a 49 años en Colombia sino mejorar la cobertura y la calidad de la tamización en mujeres mayores de 50 años e incluso ampliar la edad de finalización de tamización de los 69 años hasta los 75 años, teniendo en consideración la expectativa de vida actual de las mujeres. Sin duda, la elevada proporción de casos por fuera de la edad de tamizaje (51,7%) genera preocupación; sin embargo, resulta necesario analizar con detenimiento las razones por las cuales no se cubren dichas edades, las eventuales alternativas para su cobertura y el efecto potencial sobre el sistema de salud de su potencial inclusión, lo que requiere de la revisión de evidencia científica sobre la eficacia y efectividad de la tamización a esas edades, así como de los análisis económicos pertinentes, tal como se hizo para la construcción de la guía nacional previamente descrita y como se discute más adelante. De ninguna forma la toma de decisiones debería basarse en una mirada simplista y sin fundamentación científica en torno a la problemática, como puede ser la tendencia en las propuestas de organizaciones sin capacidad técnica, pero como no debería ocurrir en las propuestas provenientes de profesionales con elevado nivel de formación y de organizaciones responsables del desarrollo científico de la comunidad médica.
Fue evidente durante el foro que se debe hacer claridad sobre la diferencia que hay entre la mamografía de tamización y la mamografía diagnóstica, por cuanto no hay duda de que toda mujer con síntomas mamarios o, sin importar la edad, debe tener acceso a todas las pruebas diagnósticas que requiera. Precisamente por la falta de claridad en estos conceptos los auditores y los aseguradores pueden incurrir en el error de no autorizar la mamografía diagnóstica en mujeres menores de 50 años con signos clínicos de enfermedad mamaria.
El proyecto de ley en el artículo de las definiciones no incluye la relacionada con el examen clínico como técnica de tamización: por ello se resaltó la utilidad e importancia que tiene el examen clínico de la mama (ECM) anual, incluso para las mujeres mayores de 50 años. Igualmente se recomendó, como lo dice la GAI de mama, promover el ECM anual a partir de los 40 años para toda mujer asintomática y para las sintomáticas sin importar la edad. A los médicos generales no se les autoriza con frecuencia solicitar exámenes a una mujer con signos mamográficos o clínicos de enfermedad mamaria (ecografía mamaria, proyecciones adicionales, biopsias, etc.), lo que resulta en retrasos en el diagnóstico y en el tratamiento. Para mejorar las habilidades clínicas de los médicos generales y especialistas no oncólogos, el INC puso a disposición el curso virtual sobre detección temprana para cáncer de mama para que pueda ser impartido en todas las facultades de medicina y enfermería dentro de una cátedra de oncología, al igual que para los profesionales que trabajan en la red pública.
Un cuello de botella lo constituye la toma de la biopsia para mujeres que tienen indicación, por lo cual se hace necesario promover la toma de biopsia por personal entrenado. Asimismo, se hizo énfasis en promover el adecuado procesamiento de la anatomía por patólogos entrenados e igualmente la adecuada realización de inmunohistoquímica completa, pues estos dos aspectos son fundamentales a la hora de definir el tratamiento. También se recomendó mejorar los sistemas de referencia y el acceso a los especialistas de los casos sospechosos.
No hubo discusión frente a los retos que tienen los programas de tamización con mamografía respecto al control de calidad. Por ello y con base en los estudios presentados por el INC se recomendó iniciar un programa de control de calidad de mamografías liderado por el INC, la Asociación Colombiana de Radiología y la Asociación Colombiana de Mastología. Dicho programa debe incluir: un programa de educación continua a radiólogos en interpretación y clasificación de los signos mamográficos, sistemas de autoevaluación y certificación, auditorías internas y externas, y la definición y monitoreo de indicadores de calidad. Igualmente, se recomienda que la tamización para cáncer de mama sea considerada como un servicio y no como un procedimiento, pues así ha quedado definido en la normatividad pasada y la reciente.
En relación al tratamiento del cáncer de mama se expuso la importancia de garantizar la multidisciplinariedad del tratamiento para que las conductas sean tomadas en consultas bidisciplinarias, establecer tiempos óptimos para la estadificación e inicio del primer tratamiento, remisiones a genética y otras especialidades según el caso, verificar y asegurar que el tratamiento sistémico y quirúrgico sea realizado por personal entrenado y por ultimo establecer mecanismos de control que le garanticen a la paciente la continuidad de sus tratamientos.
Las profundas deliberaciones que se realizaron en el foro, antes y después del mismo no tienen otro objetivo que construir entre todos, la salud de todos. Por eso, el INC y las asociaciones científicas no solo aplauden la iniciativa de incidir en el control del cáncer de mama en Colombia, sino que ofrecen todos sus respaldos para fortalecerla pues esta, sin duda, es una prioridad para el país. Así fue definido en el Plan Nacional de Desarrollo 2018-2022 y se espera que sea la oportunidad para hacer visible la problemática que se constituye en una preocupación permanente, particularmente para las mujeres colombianas














