Introducción
El tumor desmoplásico de célula redonda y pequeña (TDCRP) es una neoplasia maligna muy poco frecuente, de alta agresividad y de origen histológico desconocido 1. Fue descrita por primera vez por Gerald et al. en 1989 2 y posteriormente se reportó para su diagnóstico la alta especificidad que tiene la detección del gen de fusión EWSR1- WT1 3. Afecta predominantemente a hombres adolescentes o adultos jóvenes, a menudo tiene un comportamiento indolente u oligosintomático y se diagnostica frecuentemente en etapas avanzadas, lo que les confiere a los pacientes un pronóstico pobre 4. Se ha descrito una tasa de supervivencia a 5 años entre un 15% a 30% 5. La mayoría se presenta como una masa en la cavidad abdominal y la pelvis, a menudo multifocal y con diseminación a lo largo de las superficies serosas 6. El peritoneo, el retroperitoneo, el omento y el mesenterio están frecuentemente comprometidos al momento del diagnóstico. También puede haber compromiso a distancia en hígado, pulmón y hueso 7,8.
Los sitios de presentación del primario menos frecuentes son: el sistema nervioso central, los senos paranasales, el pulmón, la pleura, los huesos, los tejidos blandos, el riñón y las glándulas salivales 9. El compromiso primario por este tumor a nivel paratesticular es muy raro y para su tratamiento se recomienda un enfoque multimodal que incluye tratamiento quirúrgico para el control local junto con radioterapia y/o quimioterapia multiagente 6,10-13.
A continuación, se presenta el caso de un paciente de 40 años con TDCRP paratesticular con compromiso ganglionar retroperitoneal atendido en el Instituto Nacional de Cancerologia (INC) de Bogotá, Colombia; al cual se le brindó tratamiento quirúrgico con citorreducción completa y quimioterapia adyuvante con esquema VAC IE. Se discute el caso, los diagnósticos diferenciales, los potenciales tratamientos y la literatura concerniente a esta poca frecuente localización del tumor.
Presentación del caso
Paciente masculino de 40 años, portador de marcapaso desde los 33 años por por bloqueo AV de tercer grado, sin historia familiar de cáncer. En 2007 presentó dolor inguinoescrotal izquierdo, por lo que fue sometido a resección de una lesión en el epidídimo en otra ciudad, sin estudio anatomopatológico. Permaneció asintomático hasta principios de 2016, cuando notó crecimiento del testículo izquierdo asociado a dolor. Acudió a una institución de salud en su ciudad de origen, donde le realizaron una ecografía testicular y encontraron un tumor en la cola del epidídimo de 23 mm de diámetro. En agosto de 2018 se realizó una tomografía axial computarizada (TAC) abdominopélvica y se evidenció una lesión ocupante de espacio en la bolsa escrotal izquierda, con marcadores oncofetales alfafetoproteína y BHCG negativos (α-fetoproteína: 6,1 ng/ml, BHCG: <0,1 mUI/ml).
Se realizó epididimectomía y resección de un nódulo en la cola de este. La anatomía patológica revisada en el Instituto Nacional de Cancerología (INC) reportó un TDCRP, con estudios de inmunohistoquímica positivos para citoqueratina AE1/AE3, CK7 y CD57, positividad focal para EMA, desmina y enolasa y un índice de proliferación Ki67 del 20%; las tinciones con calretinina, CK5/6, miogenina, cromogranina, CD56, sinaptofisina, CEA, CD117, CD30, CK20, WT1, p63, glipican, CD99, OCT 3/4, CD34 y Sall4 fueron negativas (fig. 1). Se realizó FISH con una sonda que detecta todos los rearreglos que involucran el gen EWSR1 (22q12) con otros cromosomas, incluida la t(11;22), que resultó positiva (fig. 2).
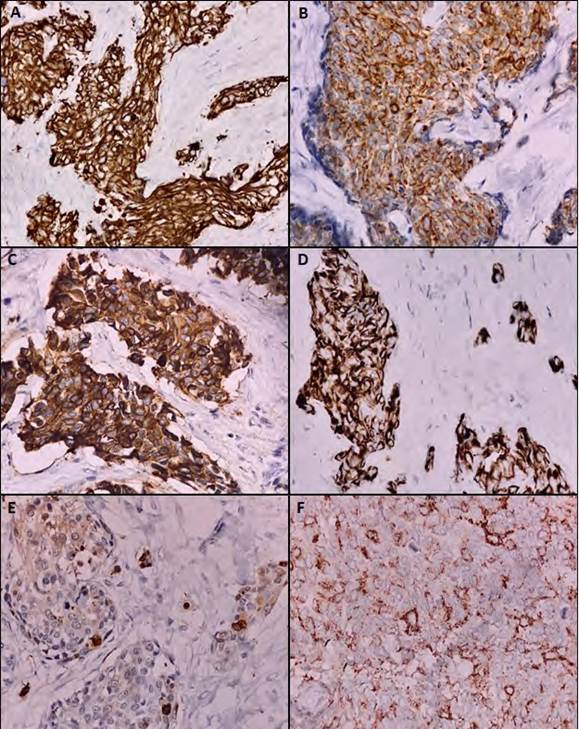
Figura 1 Inmunoperfíl del TDCRP del paciente. Inmunotinción fuerte para CK AE1/AE3 (A) y CK7 (B); focal para EMA (C), desmina (D), enonlasa (E); y débil para CD57 (F); 40x.
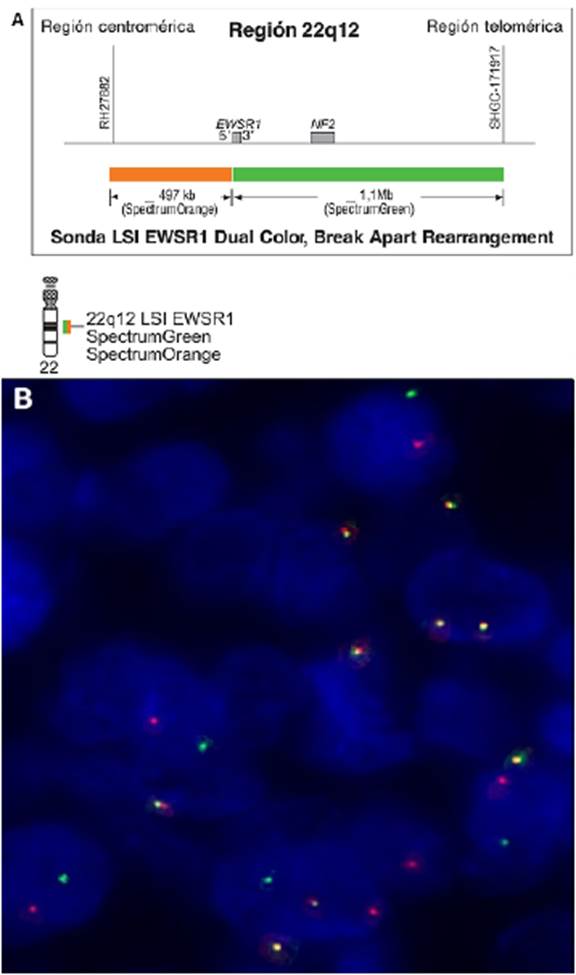
Figuro 2 Rearreglo del gen EWSR1 por FISH. (A). Descripción de la sonda utilizada: Vysis EWSR1 Break Apart FISH Probe (Ref. 03N59-020 - Abbott Molecular). La prueba consiste de una mezcla de 2 sondas FISH de ADN. La primera tiene una longitud de 497 kb, está marcada con SpectrumOrange y cubre el extremo 5' del gen EWSR1, extendiéndose e incluyendo el intrón 4. La segunda, con una longitud de 1 100 kb, está marcada con SpectrumGreen y cubre el extremo 3' del gen EWSR1. Los puntos de ruptura del gen EWSR1 se encuentran desde los intrones 7 al 10. Esta sonda detecta todos los rearreglos que involucra este gen con otros cromosomas incluidos la t(11;22). (B). FISH para el gen EWSR1 del paciente. Se ilustran dos señales independientes (roja, correspondiente a la sonda marcada con SpectrumOrange; y verde, correspondiente a la sonda marcada con SpectrumGreen) dentro del núcleo de las células tumorales, correspondientes a los rearreglos del gen EWSR1 en la región 22q12. La señal del alelo no translocado se ilustra de color amarillo. Nomenclatura según ISCN 2016: nuc ish (EWSR1x2)(5'EWSR1 sep 3'EWSR1)x2 [200]. Imagen (A) tomada y modificada de: https://www.molecular.abbott/ int/en/chromosome/22.html. (B). Proporcionada con permiso del Laboratorio de Biología Molecular del Instituto Nacional de Cancerología, Bogotá, Colombia.iste de una mezcla de 2 sondas FISH de ADN. La primera tiene una longitud de 497 kb, está marcada con SpectrumOrange y cubre el extremo 5' del gen EWSR1, extendiéndose e incluyendo el intrón 4. La segunda, con una longitud de 1 100 kb, está marcada con SpectrumGreen y cubre el extremo 3' del gen EWSR1. Los puntos de ruptura del gen EWSR1 se encuentran desde los intrones 7 al 10. Esta sonda detecta todos los rearreglos que involucra este gen con otros cromosomas incluidos la t(11;22). (B). FISH para el gen EWSR1 del paciente. Se ilustran dos señales independientes (roja, correspondiente a la sonda marcada con SpectrumOrange; y verde, correspondiente a la sonda marcada con SpectrumGreen) dentro del núcleo de las células tumorales, correspondientes a los rearreglos del gen EWSR1 en la región 22q12. La señal del alelo no translocado se ilustra de color amarillo. Nomenclatura según ISCN 2016: nuc ish (EWSR1x2)(5'EWSR1 sep 3'EWSR1)x2 [200]. Imagen (A) tomada y modificada de: https://www.molecular.abbott/ int/en/chromosome/22.html. (B). Proporcionada con permiso del Laboratorio de Biología Molecular del Instituto Nacional de Cancerología, Bogotá, Colombia.
Fue valorado por el grupo de Urología Oncológica del INC, con una TAC abdominopélvica que reveló dos adenomegalias paraaórticas inferiores a la arteria renal izquierda con ejes cortos de 16 y 11 mm y ganglios ilíacos bilaterales de tamaño y morfología normal. Asimismo, se realizó una tomografía de tórax que evidenció cuatro nódulos subcentimétricos, la mayoría de localización subpleural (fig. 3).
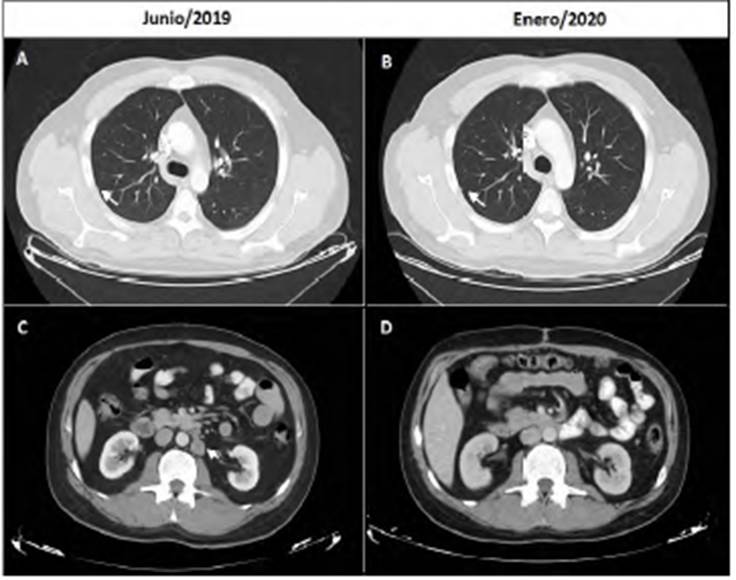
Figura 3 Seguimiento tomográfico del paciente. (A) Tomografìa de tórax del paciente cercano al inicio de tratamiento. Se ilustra uno de los nódulos pulmonares subcentimétricos, de 2,6 mm (flecha). (B) Tomografía de tórax siete meses después del procedimiento quirúrgico, con nódulos subcentimétricos estables (flecha). (C) TAC abdominopélvico del paciente antes del último procedimiento quirúrgico. Se ilustran dos adenomegalias localizadas paraaórticas inferiores a nivel de la arteria renal izquierda con ejes cortos de 16 y 11 mm (flecha). (D) Seguimiento tomográfico de abdomen, sin signos de recaída retroperitoneal.
Fue llevado a orquiectomía radical izquierda, escrotectomía y linfadenectomía retroperitoneal, encontrando el testículo izquierdo de apariencia normal, fuertemente adherido al escroto y con fibrosis, el epididimo engrosado, un conglomerado ganglionar paraaórtico infrarrenal de 3 cm de diámetro, ganglios interaortocavos y paracavos de apariencia macroscópica normal y vasos gonadales bilaterales de apariencia normal. No se encontraron otros hallazgos positivos. Fue dado de alta a los pocos días con adecuada evolución postoperatoria.
El reporte de la patología indicó un testículo izquierdo comprometido por TDCRP de 2 cm de diámetro mayor, grado histológico 3 de la clasificación FNCLCC (Federation Nationale des Centres de Lutte le Cancer), con hasta 20 mitosis atípicas por 10 campos de gran aumento, 10% de necrosis tumoral, invasión linfovascular presente e infiltración de la túnica albugínea y de los tejidos blandos peritesticulares. No se identificó el epididimo y los bordes de sección estaban libres de tumor. Se encontraron siete de nueve ganglios paraaórticos comprometidos por metástasis, con extensión extraganglionar y dieciséis ganglios interaortocavos y cinco paracavos libres de metástasis.
Con estos hallazgos se decidió brindar quimioterapia adyuvante con esquema VAC-IE, que inició a las 12 semanas del procedimiento quirúrgico. Fue valorado por el grupo de oncología radioterápica de la institución, considerando que no se beneficiaba de radioterapia. En el último control de marzo de 2020 completó 10 ciclos de quimioterapia, sin toxicidad limitante y sin signos de recaída por tomografias (fig. 3). A la fecha de publicación de este manuscrito, el paciente se encuentra en buen estado general y libre de enfermedad.
Discusión
El TDCRP paratesticular es una presentación poco común de esta neoplasia, con poco más 20 casos reportados en la literatura 13. Al igual que su contraparte abdominal, afecta predominantemente a hombres entre la segunda y la tercera década de la vida. El paciente más joven reportado en la literatura tenía 14 años y el de mayor edad tenía 64 años 13,14. Nuestro paciente tenía 40 años al momento del diagnóstico. De los 20 casos descritos por Sedig et al. en su reporte, el dolor y la sensación de masa testicular fueron los síntomas predominantes de presentación, al igual que en el paciente relacionado en este trabajo 13. Los síntomas descritos en primarios de otras localizaciones incluyen pérdida de peso, dolor y distensión abdominal, constipación, dolor lumbar y anorexia, que el paciente analizado no tenía 15.
La histogénesis del TDCRP se desconoce, no obstante, dadas sus características inmunofenotipicas y la alta prevalencia en cavidades serosas se cree que pueden tener origen en la célula mesotelial 10. Otros autores han propuesto su desarrollo a partir de una célula progenitora con potencial de diferenciación multifenotípica 16. Sin embargo, este caso originado en el testículo no apoya la primera teoría.
Microscópicamente el TDCRP se caracteriza por nidos y cordones de células pequeñas redondas y azules en un estroma celular desmoplásico, ocasionalmente con pseudorosetas; las células tienden a presentar escaso citoplasma eosinófilo con bordes celulares poco definidos y núcleos redondos, ovalados o alargados, con cromatina finamente dispersa y uno o dos pequeños nucleolos; las figuras mitóticas son frecuentes y ocasionalmente anormales 17. Puede haber necrosis o comedonecrosis y cambios metaplásicos. El diagnóstico diferencial incluye: sarcoma de Ewing, neuroblastoma, tumor de Wilms, rabdomiosarcoma, carcinoma de células pequeñas, linfoma y neuroblastoma 18. La presencia de diferenciación y coexpresión de marcadores epiteliales, mesenquimales y neurales (citokeratinas, vimentina, desmina, y enolasa neuronal específica) en la misma célula, y ocasionalmente la presencia de un patrón punteado perinuclear en la inmunotinción con desmina sugiere fuertemente el diagnóstico de TDCRP 17,19,20. La biopsia de este caso analizado tenía positividad para marcadores epiteliales (CK 7, CK AE1/AE3 y EMA), mesenquimales (desmina) y de diferenciación neuronal (CD57). (fig. 1).
La presencia del gen de fusión EWSR1-WT1, producto de la translocación cromosómica recíproca t(11;22) (p13;q12), tiene una especificidad que supera el 90% y por tanto es considerada por muchos autores como patognomónica del TDCRP 3,17. Su producto es una proteína quimérica de 59 kDa que tiene una fuerte propiedad de activación transcripcional para alrededor de 35 genes que codifican factores de crecimiento, reguladores transcripcionales y proteínas transmembrana responsables de regular la adhesión celular, la migración y la metástasis 8,21. Los rearreglos del gen EWSR1 pueden detectarse por técnica FISH, aunque idealmente se debe realizar RT-PCR para detectar el transcripto de fusión EWSR1-WT1, ya que es más específica y ayuda en el diagnóstico diferencial, aunque la sensibilidad parece ser similar para ambos estudios y puede alcanzar un 92% 17,22. Nuestro paciente en particular tenía rearreglos del gen EWSR1 detectados por FISH. No obstante, a pesar de que no fue posible realizar la secuenciación completa del gen de fusión EWSR1-WT1 por RT-PCR, los hallazgos histopatológicos en conjunto con los resultados del FISH soportan fuertemente el diagnóstico de un TDCRP.
Los estudios de imagen de elección sugeridos para el abordaje diagnóstico, la estadificación y el seguimiento del TDCRP incluyen un TAC de tórax y abdominopélvico 8,23, que pueden revelar nódulos o masas de tejidos blandos lobuladas intraabdominales con reforzamiento homogéneo o heterogéneo del medio de contraste 8,24. Asimismo, la TAC de tórax es más confiable que el PET en la representación de metástasis pulmonares 8. Los estudios tomográficos también pueden revelar compromiso ganglionar hasta en la mitad de los pacientes y, ocasionalmente, ascitis 8. Otros órganos como el pulmón, la pleura y los ganglios linfáticos mediastinales también pueden estar comprometidos y se ha descrito la presencia de enfermedad metastásica multifocal hasta en el 90% de los pacientes, siendo el hígado el órgano visceral más frecuentemente afectado 25. Otros estudios como la resonancia magnética nuclear de abdomen pueden revelar siembras metastásicas en la cavidad peritoneal y presencia de necrosis hemorrágica intralesional, que sin embargo no ayuda a diferenciar el TDCRP de otros tumores 1,24. El PET/CT tiene una exactitud diagnóstica del 97,4%, con sensibilidad, especificidad, valores predictivos positivos y negativos de 96,1%, 98,6%, 98% y 97%, respectivamente, por lo que algunos grupos sugieren que debe ser parte de la estadificación inicial 26,27. Puede ser de utilidad tanto en el diagnóstico como en el seguimiento, e igualmente se ha demostrado que tiene un impacto en el cambio de tratamiento cuando se utiliza en conjunto con la TAC 8,27.
La presencia de enfermedad metastásica ganglionar retroperitoneal, mediastinal y cervical, así como lesiones metastásicas hepáticas, peritoneales, en páncreas, pulmonares y óseas se han descrito en los pacientes con TDCRP paratesticular 1,10,13,25,28-35. El paciente analizado, en contraste, tenía enfermedad ganglionar retroperitoneal en las tomografías iniciales, que posteriormente se confirmó histopatológicamente (fig. 3); esto refleja que, a pesar de la gran agresividad del tumor, algunos casos pueden diagnosticarse de manera temprana, con enfermedad regional.
Dado que es un tumor poco usual, la 8° edición del Manual de Estadificación del AJCC (American Joint Committee on Cancer) no incluye estadificación para esta histología, a excepción de algunas recomendaciones para los primarios peritoneales, especialmente el reporte del diámetro de la masa tumoral más grande, propuesta también por el grupo del MD Anderson Cancer Center (MDACC) 26,36. Por otra parte, Hayes-Jordan et al. han propuesto un sistema aún no validado de cuatro estadios para esta neoplasia: estadio 1, pacientes con enfermedad limitada, localizada en uno o dos sitios en el abdomen o en un solo sitio en cualquier otra localización; estadio 2, pacientes con cualquier cantidad de enfermedad peritoneal extensa; estadio 3, pacientes con metástasis hepáticas y enfermedad peritoneal, y estadio 4, pacientes con enfermedad peritoneal, hepática y por fuera de la cavidad abdominal, incluyendo nodos linfáticos 37,38.
Debido a su rareza y datos prospectivos limitados, el tratamiento del TDCRP es un reto 39. No hay una sola estrategia de tratamiento óptima e independientemente del abordaje, no se han logrado tasas de supervivencia importantes a largo plazo, siendo el pronóstico en general pobre, especialmente para los que tienen compromiso metastásico 18,20. Las tasas de supervivencia pueden ser incluso inferiores a los de los pacientes con sarcoma de Ewing. No obstante, algunos autores aducen que los TDCRP paratesticulares pueden diagnosticarse en una etapa más temprana de la enfermedad debido a su localización, y por tanto tener un mejor pronóstico que los de otras zonas 32,34. Las series de caso han encontrado tasas de supervivencia del 40% entre 2,5 a 3 años para esta localización 34.
Hoy en día se recomienda una estrategia de tratamiento multimodal que incluye: quimioterapia intensiva multiagente, cirugía citorreductora agresiva con objetivo de llevar a resección R0 y terapia de radiación abdominal total, así como quimioterapia de consolidación 37,40. Esta estrategia ha demostrado mejorar los desenlaces de los pacientes, logrando tasas de supervivencia global alrededor de 25% a 5 años 26,41,42. El objetivo del manejo quirúrgico es remover > 90% del tumor 6. Series de caso han evidenciado que este abordaje se lleva a cabo en el 47% al 67% de los pacientes 26,37,43,44. En otro análisis retrospectivo, la supervivencia global a 3 años fue del 58% para los que recibieron cirugía de debulking 11.
La mayoría de estos pacientes reciben regímenes de quimioterapia multiagente que incluyen diversas combinaciones de platino, antraciclinas, actinomicina D, ciclofosfamida, vincristina, ifosfamida y etopósido, entre otros, y pueden ser utilizados en un contexto neoadyuvante, adyuvante, o como parte del manejo paliativo de enfermedad metastásica 6,26,44,45. Un reporte de 10 casos de TDCRP no pretratados en los que se utilizó quimioterapia a altas dosis con esquemas alternantes de ciclofosfamida, doxorrubicina y vincristina (VAC) en los ciclos 1,2,3 y 6 e ifosfamida y etopósido (IE) los ciclos 4,5 y 7, un esquema conocido como P6, encontró actividad en nueve pacientes, con tasas de remisión completa de hasta 38 meses en siete de ellos 46.
En una serie retrospectiva de 187 pacientes atendidos en el MDACC en un transcurso de dos décadas, el esquema VAC/IE, con conocido beneficio en sarcoma de Ewing, fue el más comúnmente utilizado en el tratamiento multimodal, y en conjunto con otros como VAI (vincristina, actinomicina D, ifosfamida), VIDE (vincristina, ifosfamida, doxorrubicina y etopósido), demostró tasas de supervivencia a cinco años que aumentaron de un 5% a un 25% 26. El 90% de los pacientes recibió quimioterapia y un porcentaje similar logró un beneficio clínico, con tasas de respuestas prequirúrgicas de hasta 52% 26. Regímenes de quimioterapia de inducción a base de ifosfamida y adriamicina con o sin agentes de platino han demostrado tasas de respuesta objetiva y de control de enfermedad de 71% y 91%, respectivamente 44.
La actividad de la trabectedina ha sido limitada en estos pacientes 47. Regímenes de segunda línea como temozolomide/irinotecan, ciclofosfamida/topotecan, ciclofosfamida/vinorelbine y gemcitabina/docetaxel se han utilizado como quimioterapia de segunda línea o de rescate 26. Pazopanib, sunitinib y afatinib demostraron tener actividad clínica en algunas series de caso (48-50). Otras terapias target como ganitumab, un anticuerpo monoclonal dirigido contra el receptor 1 del factor de crecimiento insulínico (IGF-1R), también demostró actividad a expensas de respuestas parciales (con tasas de respuesta global del 6%) y enfermedad estable (47%) en un estudio fase 2 51. Inhibidores de mTOR como temsirolimus poseen actividad limitada en monoterapia, sin embargo se demostró actividad en pacientes con tumores de la familia Ewing y TDCRP altamente pretratados en combinación con cixutumumab, un anticuerpo monoclonal de tipo IgG1 dirigido contra IGF-1R 52,53.
Otros receptores potencialmente susceptibles de terapia target son Her-2/neu, c-kit, PDGFR, GD3, VEGFR-2 y el receptor de andrógenos, algunos de ellos con resultados favorables en ensayos preclínicos 54-56. La inmunoterapia con terapias anti CTLA-4 y anti PD-1 ha sido muy poco estudiada en pacientes con TDCRP, y a pesar que ha sido descrita como una potencial estrategia terapéutica, a la fecha de realización de este manuscrito no se han reportado pacientes tratados con estas moléculas 57. Algunos hallazgos de estudios preclínicos indican que a pesar de la alta expresión de PD-1 en las células tumorales, la expresión de PD-L1 es muy limitada y disminuye aún más en el momento de la recurrencia 58. Actualmente, no hay ensayos clínicos con inmunoterapia en curso para pacientes con este tipo de tumor (consultado en www.clinicaltrials.gov).
La radioterapia adyuvante abdominal total (WART) en pacientes con TDCRP se ha utilizado de manera muy variable en un 15% a 50% en las diferentes series, sin embargo a través del tiempo su uso ha aumentado de manera importante 26,37,41. Se ha asociado con mejores desenlaces, especialmente una mayor tasa de control local, aunque con resultados discordantes entre las series y sin mejoría consistente en la supervivencia global en análisis multivariados 6,26,37,59-61. Puede también ser útil en el control de síntomas y mejoría de la calidad de vida 62. Debe utilizarse en pacientes cuidadosamente seleccionados, y en lo posible en el marco de un ensayo clínico, dadas las preocupaciones concernientes a la toxicidad que podría incluso sobrepasar el potencial beneficio de esta 26,61.
La quimioterapia hipertérmica intraoperatoria (HIPEC) se ha utilizado en algunas instituciones, puede proveer beneficio en el control de la enfermedad microscópica residual y cuando se añade a la cirugía de debulking mejora las tasas de supervivencia global en comparación con únicamente manejo quirúrgico para enfermedad abdominal, con medianas de supervivencia que pueden alcanzar los entre 19 y 63 meses 38,40,41,63. Hayes-Jordan et al. reportaron dos casos de niños exitosamente tratados con cirugía citorreductora luego de haber recibido seis ciclos de quimioterapia a base de irinotecan y temozolomide, alcanzando resección R0. Durante la misma los pacientes recibieron perfusión peritoneal hipertérmica continua (CHPP) a 40 °C con cisplatino 100 mg/m2, adicionalmente WART y seis ciclos de quimioterapia adyuvante con el mismo esquema; ambos se encontraban vivos y libres de recaída a los seis y diez meses de seguimiento 64,65. En un ensayo fase 2 reciente, el grupo del MDACC estudió la cirugía citorreductora con HIPEC con cisplatino en pacientes pediátricos con sarcomas abdominales, de los cuales catorce tenían TDCRP. Se encontraron tasas de supervivencia global superiores para los pacientes con este tipo de tumor en comparación con otras histologías (44,3 vs. 12,5 meses, p = 0,0013), con una tasa de supervivencia a tres meses de 79% y medianas de supervivencia libres de recaída también superiores en comparación con otros tumores (14,9 vs. 4,5 meses, p = 0,0012) (66). Sin embargo, el 35% de los pacientes presentaron complicaciones serias incluyendo infecciones de herida quirúrgica, infecciones urinarias y fístulas enterocutáneas 66.
Un grupo francés también reportó su experiencia en 38 pacientes, de los cuales cinco de 23 intervenidos quirúrgicamente recibieron HIPEC con oxaliplatino e irinotecan intraperitoneal en conjunto con 5-fluorouracilo endovenoso, sin que esta haya tenido impacto en la supervivencia global 60. Ensayos fase 1 y análisis retrospectivos han encontrado también actividad de HIPEC en estos pacientes, con hallazgos similares en los desenlaces 26,38. Su beneficio parece ser limitado en pacientes con enfermedad extraperitoneal 37,39. En una serie retrospectiva de 100 pacientes de los cuales 27 tenía compromiso metastásico, 51 de 80 pacientes que recibieron quimioterapia upfront fueron intervenidos quirúrgicamente y 17 de ellos recibieron quimioterapia intraperitoneal. La supervivencia a 3 y 5 años fue del 35% y 4%, respectivamente y 7 pacientes se consideraron curados; los factores asociados a cura fueron sexo femenino, PCI <12, estadio I de la clasificación MD Anderson, citorreducción completa, y terapia de radiación abdominal total. Ni la HIPEC ni la quimioterapia intraperitoneal postoperatoria aumentaron las tasas de curación 59.
La mayoría de los casos reportados en la literatura de TDCR paratesticular o testicular recibieron tratamiento quirúrgico, tanto en el escenario de enfermedad localizada como en el metastásico, acompañados por quimioterapia multiagente 13,34. Ninguno de los pacientes encontrados en esta revisión recibió radioterapia adyuvante. Nuestro caso en particular recibió tratamiento quirúrgico citorreductor completo R0, sin complicaciones postquirúrgicas. Asimismo, actualmente se encuentra recibiendo ciclos alternantes de quimioterapia adyuvante con esquema VAC/IE, del cual completa diez ciclos, sin signos de recaída en las últimas imágenes tomográficas de enero de 2020 (fig. 3). Teniendo en cuenta que no se trataba de un primario abdominal y que el compromiso metastásico en abdomen estaba representado por adenopatías retroperitoneales, se consideró que no había beneficiode ofrecer HIPEC ni WART.
Otras terapias multimodales que incluyen ablación de médula ósea con tiotepa y carboplatino, etopósido y trasplante autólogo o rescate de células madre periféricas pueden tener un papel en el manejo de esta patología. Se han reportado a la fecha un solo paciente con TCRD paratesticular en el que se utilizó esta estrategia, sin evidencia de enfermedad durante el seguimiento 10. Sin embargo, los resultados han sido controversiales en primarios de otras localizaciones, alcanzando excelentes tasas de supervivencia a largo plazo en algunos estudios, pero éxito limitado en otros, por lo que por ahora se considera tiene un beneficio limitado para estos pacientes 10,46,67,68.
En conclusión, el TDCRP es una neoplasia maligna muy poco frecuente y más aún en la región testicular/ paratesticular. La correlación histopatológica, en conjunto con el hallazgo citogenético patognomónico de la t(11;22) (p13; q12) detectando rearreglos del gen EWSR1 por FISH y el transcripto de fusión EWSR1-WT1 por RT-PCR, soportan el diagnóstico. Su tratamiento debe ser multimodal, con cirugía y, por lo menos, quimioterapia pre y/o postoperatoria con esquemas que en general incluyen vincristina, doxorrubicina, ciclofosfamida, ifosfamida y etopósido. La WART y la HIPEC solo se han utilizado luego de la cirugía de debulking abdominal, pero no tiene indicación en los primarios testiculares/paratesticulares. El trasplante de médula ósea o de células madre periféricas tiene beneficio limitado en estos pacientes. Terapias target como pazopanib y sunitinib han demostrado actividad y la evidencia de inmunoterapia aún se encuentra limitada a ensayos preclínicos














