Introducción
La citología convencional (CCU) fue por años la única prueba para el tamizaje del cáncer de cuello uterino (CaCu) y permite determinar si hay algún tipo de lesión en el cuello uterino. Sin embargo, presenta algunas limitaciones dado que es operador dependiente y para la lectura influyen: la calidad de la muestra, las características del extendido, la fijación de la lámina, la presencia de células inflamatorias o detritus celulares que afectan la sensibilidad de la prueba, entre otros 1,2.
Teniendo en cuenta las limitaciones de la CCU y gracias a los avances tecnológicos se logró la implementación de pruebas moleculares para la detección del ADN del virus del papiloma humano (VPH), que es el principal agente causal para el desarrollo de CaCu; estas permiten saber si una mujer presenta infección por VPH, incluso antes de observar alguna lesión.
Las pruebas de VPH son analizadas a través de equipos semiautomatizados o automatizados que evitan los sesgos que dependen del observador y además tienen una mayor sensibilidad. Actualmente, las pruebas moleculares para la detección del VPH se han implementado en diferentes centros de diagnóstico e investigación; entre las técnicas que sobresalen se encuentran: Captura de híbridos II (Qiagen), Cobas 4800 (Roche), Cervista (Hologic), Aptima (Hologic), CareHPV (Qiagen), Onclarity (BD), entre otras 1,3-5.
En 2012, el Grupo de Prevención e Implementación, Sección de Detección Temprana y Prevención (PRI/ EDP) de la Agencia Internacional para el Control del Cáncer (IARC) planteó un estudio multicéntrico de tamizaje y triage para cáncer de cuello uterino con pruebas del virus de papiloma humano (ESTAMPA), cuya finalidad fue reclutar 50.000 mujeres de diferentes países para estimar las características de desempeño de múltiples técnicas, solas o en combinación, para la detección de lesiones intraepiteliales escamosas de alto grado (LIEAG) histológicamente confirmadas en mujeres entre 30 y 64 años que resulten positivas en la prueba del VPH 6.
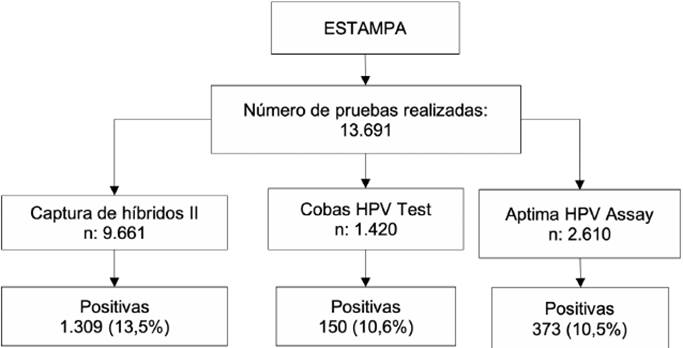
En Colombia, el proyecto se desarrolló en dos instituciones, el Instituto Nacional de Cancerología (INC) de Bogotá y la Universidad de Antioquia. El reclutamiento inició en 2012 y hasta 2018 se reclutaron 11.000 mujeres en Soacha-Cundinamarca (a través del INC). A todas las participantes se les realizó la detección del VPH por una o dos tecnologías, en total, se emplearon 3 tecnologías durante el desarrollo del estudio y se realizaron 13.691 procesamientos. Se detectaron 1.714 mujeres con prueba positiva (15,6 %), siendo CHII la de mayor positividad (fig. 1).
Fuente. Fuente: Elaboración propia
Figura 1. Pruebas moleculares para detección de virus del papiloma humano realizadas durante el proyecto: ESTAMPA.
El objetivo de esta nota técnica es describir la experiencia operativa de la implementación de técnicas moleculares en el laboratorio de ADN-VPH del INC para el desarrollo de un estudio multicéntrico de tamizaje y de triage de cáncer de cuello uterino (Estampa) en Soacha-Cundinamarca.
2. Experiencia en el Laboratorio
2.1 Obtención y conservación
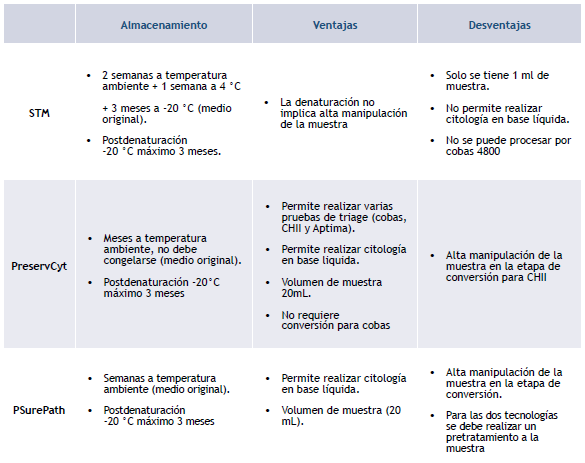
La muestra se toma con un cepillo que recolecta células exocervicales y endocervicales; esta muestra es tomada por personal capacitado (principalmente enfermeras) y en algunos sitios por auxiliares de enfermería con capacitación en toma de muestras del VPH. La muestra debe ser recogida en medios con solución conservante como: STM, PreservCyt o SurePath (tabla 1)
STM es el medio recomendado por Qiagen (casa comercial) para la realización de la prueba de CHII, sin embargo, como el proyecto requería la realización de otras pruebas de triage se decidió tomar las pruebas en el medio PreservCyt que permite procesar CHII, Aptima, Cobas 4800 y obtener un mayor volumen de muestra. El medio PreservCyt contiene componentes que interfieren con la técnica de CHII por lo que se debe realizar una conversión previa al montaje, esta permite sedimentar, resuspender y desnaturalizar células cervicales que luego serán procesadas para determinar la presencia o la ausencia del VPH 7.
2.2 Técnicas empleadas Captura de híbridos II
Es una técnica in vitro donde se realiza la hibridación de ácidos nucleicos con amplificación de la señal y utiliza la quimioluminiscencia para la detección cualitativa de ADN de 13 tipos de VPH de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68) en muestras cervicouterinas 7. El procesamiento de la muestra incluye: desnaturalización, hibridación del ADN-ARN viral, conjugación de anticuerpos y degradación del sustrato quimioluminiscente para determinar la presencia o la ausencia del ADN viral 3,7-9.
Al seguir el protocolo se evidenció que la técnica es estable, sin embargo, involucra un gran número de pasos que requieren la intervención del operador, así como diferentes equipos que pueden ser una limitante para laboratorios pequeños, proyectos con poco número de muestras y personal poco capacitado. Adicionalmente, al emplear varios equipos, estos pueden ser sensibles a la contaminación. Por ejemplo, el lavador de placas se puede contaminar y hacer que se pierdan los reactivos empleados o durante la desnaturalización se pueden perder células que contengan copias del virus, lo que puede disminuir la posibilidad de detectar quimioluminiscencia.
2.3 Cobas® HPV Test
Es una prueba cualitativa, automatizada y cerrada que emplea extracción del ADN viral y celular, para luego realizar una amplificación por PCR de las secuencias de ADN diana y utiliza pares de cebadores complementarios específicos del VPH. La técnica identifica 14 genotipos de alto riesgo (31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 y 68) y reporta individualmente los genotipos 16 y 18; dependiendo el genotipo se requiere entre 300 y 1.000 copias/mL para la detección del virus 10.
En el estudio fue importante que la técnica contara con un control de ß- globina para evaluar la integridad de la muestra y verificar los procesos de extracción, amplificación y detección 3,10; esto descartó la posibilidad de un volumen insuficiente de células cervicales en la muestra. Durante los montajes se presentaron inconvenientes relacionados con: el equipo (puntas cerradas que no dispensaron el reactivo), el personal (mal sellado de la placa durante el cambio de equipo) y la infraestructura (cambios de voltaje o caídas parciales del servicio eléctrico que cancelaban los montajes).
2.4 Aptima HPV Assay
Es una técnica cualitativa in vitro, semiautomatizada que permite detectar la expresión del ARN mensajero (mRNA) de las oncoproteínas E6 y E7 presentes en los 14 tipos de VPH de alto riesgo (16,18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 y 68) y no discrimina los genotipos 11.
Esta técnica fue desarrollada por un laboratorio extrainstitucional que presentó inconvenientes logísticos y operacionales relacionados con: puntualidad en la entrega de resultados, falta de reactivos y posibilidad del cierre de la oferta del servicio por parte de la casa comercial, debido a la actualización de la tecnología (tabla 2).
| Características | Captura de Híbridos II (Qiagen) | Cobas® HPV Test (Roche) | Aptima HPV Assay (Hologic) |
| Plataforma | Rapid Capture System (automatizado) | Cobas 4800 System | Panther System |
| Genotipos detectados | 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68. | 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 y 68. | 16,18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 y 68. |
| Tecnología de detección | Amplificación de la señal y su posterior visualización por medio de quimioluminiscencia (una reacción química que produce luz). | PCR cualitativa en multiplex, todas las reacciones en un solo tubo. | Detección de la expresión del ARN mensajero de las oncoproteínas E6 y E7 y su posterior visualización por medio de quimioluminiscencia (una reacción química que produce luz). |
| Identificación de genotipos en grupos | No aplica | Identifica 14 genotipos de alto y reporta individualmente los genotipos 16 y 18. | No aplica |
| Segmento del genoma viral identificado | Utiliza una sonda complementaria para el genoma completo. | Amplifica un fragmento de gen viral L1. | Utiliza una sonda de ADN complementaria al ARN mensajero de las oncoproteínas E6/E7. |
| Control interno de la muestra | No tiene | Gen de beta-globina humana | Cinética diferencial de emisión de la luz. |
| Vol. de la muestra requerido | 500 μl | 400 μl | 1000 μl |
| # de muestras requerido por procesamiento | 88 muestras. | 22 a 94 muestras. | Desde 1 muestra en adelante. |
| Ventajas | Bajo riesgo de contaminación. Da un resultado cuantitativo, el cual tiene una correlación relativa con el número de partículas virales presentes en la lesión. Excelente reproducibilidad inter e intra laboratorio. | La contaminación debido a fallas en el lavador empleado. Falsos negativos cuando hay escaso número de células con copias del virus (límite de detección). No genotípica los tipos virales presentes en las muestras, por lo que para efectos del proyecto, no se puede evidenciar si la paciente en seguimiento tiene una infección persistente, una coinfección o una nueva infección. | Permite detectar la expresión de las oncoproteínas E6 y E7 identificando a las pacientes con riesgo elevado de presentar transformaciones malignas de las células del epitelio cervical. No hay límite mínimo o máximo de muestras para poder realizar el procesamiento de las mismas. |
| Desventajas | La contaminación debido a fallas en el lavador empleado. Falsos negativos cuando hay escaso número de células con copias del virus (límite de detección). No genotípica los tipos virales presentes en las muestras, por lo que para efectos del proyecto, no se puede evidenciar si la paciente en seguimiento tiene una infección persistente, una coinfección o una nueva infección. | Al ser un equipo cerrado no se evidencian problemas en el procesamiento de las muestras sino hasta el final. El equipo no requiere mucha intervención por parte del personal, sin embargo, cuando se requiere cambiar la placa de PCR al termociclador se debe sellar muy bien placa para evitar que se evaporen los controles o las muestras. Si hay fallas de voltaje en la corriente o el equipo se apaga por alguna razón y no es posible recuperar el procesamiento. | El control interno supervisa el procesamiento, pero, no es idóneo para evaluar la calidad de las muestras de cuello uterino. Requiere muchas intervenciones del operador y diferentes procedimientos que pueden generar contaminación de las muestras. |
3. Conclusión
La experiencia con las técnicas de CHII y Cobas HPV Test en el estudio multicéntrico de tamizaje y triage para cáncer de cuello uterino en Soacha (Cundinamarca) evidenció que son útiles para tamizaje del VPH debido a su alto valor predictivo negativo, sensibilidad y reproducibilidad; además son operativamente fáciles de realizar gracias a los equipos y al software empleado. Aptima HPV Assay, por el contrario, presentó varios inconvenientes al ser operativamente compleja de realizar. Adicionalmente, CHII y Aptima HPV exigen mayor manipulación de la muestra, lo que aumenta las probabilidades de contaminación de las mismas, mientras que Cobas HPV Test requiere una menor manipulación.
Por lo anterior, se sugiere que para el planteamiento de proyectos de investigación o para la implementación de pruebas de tamizaje de VPH se analicen las ventajas y las desventajas de las pruebas moleculares del mercado, como: el personal con el que se cuenta, el espacio del laboratorio, el volumen de muestras esperado, el objetivo del diagnóstico, entre otros aspectos. Esto con el fin de lograr que la técnica seleccionada cumpla con las expectativas del personal clínico o de los investigadores.
Adicionalmente, es importante en el desarrollo de proyectos de investigación y selección de pruebas para programas de tamización tener la certeza que al contratar con un laboratorio se cuente con las garantías necesarias durante todo el proceso