Introducción
En Diciembre de 2019, un brote de casos de neumonía grave de etiología no conocida fue reportado por la entidad sanitaria de Wuhan en la provincia de Hubei, China; el 7 de enero, fue documentado el agente etiológico: el nuevo Coronavirus del Síndrome Respiratorio Agudo Severo o Grave 2 (Severe Acute Respiratory Syndrome 2, SARS-CoV-2) como causante de la enfermedad denominada COVID-19 (Coronavirus Disease 2019) 1. El SARS-CoV-2 se caracteriza por la rápida trasmisión humano-humano a través de gotas y contacto con secreciones respiratorias 1,2. En menos de tres meses, la Organización Mundial de la Salud (OMS) (11 de marzo de 2020) declaró la pandemia. A diferencia de pandemias previas, reportes chinos iniciales estimaron una frecuencia de coinfección virus-bacteria y virus-virus menor al 1% 1,3.
Hasta 41,3% de los casos podrían corresponder a adquisición intrahospitalaria 1,4, colocando en gran riesgo a aquellos pacientes con factores de vulnerabilidad que requieren atención y monitoria intrahospitalaria frecuente, entre ellos, los pacientes con neoplasias malignas (NM) 5.
La mayoría de los pacientes cursan con un síndrome clínico similar a la influenza (cuadro clínico que abarca diversos agentes etiológicos) 6, cuyos síntomas pueden incluir fiebre, tos, astenia, adinamia y dificultad para respirar 1,6,7. El abanico de presentación clínica es extenso, con recientes descripciones de manifestaciones a nivel cutáneo, gastrointestinal, hematológico y en sistema nervioso (central y periférico) 1, presentándose con mayor heterogeneidad clínica en pacientes con NM 4.
Colombia inicia el registro de casos el 6 de marzo de 2020; a la fecha (mayo 09 de 2020), se han confirmado 14.216 casos con resultado positivo para SARS-CoV2-2 en 33 departamentos y 546 muertes; 79,5% de los casos se presentan en Bogotá, Cali, Cartagena, Leticia, Villavicencio, Barranquilla, Soledad, Medellín, Santa Marta, Tumaco y Pereira 8. Los pacientes con cáncer tienen factores de riesgo propios de la enfermedad y de los tratamientos que reciben, por lo cual consideramos de gran interés describir los dos primeros casos de pacientes con NM y COVID-19 atendidos en un centro de referencia de patología oncológica. El primero, un caso de coinfección virus-virus en una paciente con cáncer de mama; el segundo, infección por COVID-19 en un paciente con cáncer de próstata.
Caso 1
Mujer de 40 años de edad, natural y procedente de Bogotá, quién consulta en el mes de abril por cuadro clínico de cuatro días de evolución consistente en fiebre, tos, disnea, astenia y adinamia; el día previo a la consulta, presentó temperatura axilar de 38,5°C con nexo epidemiológico por contacto estrecho por más de 8 horas con familiar asintomático procedente de Estados Unidos. Como antecedente médico presenta cáncer ductal de mama derecha invasivo, moderadamente diferenciado, estado IIIA (T1N2M0) con receptores hormonales positivos, Her2 negativo, Ki67 20% diagnosticado en 2014, para lo cual recibió cuadrantectomía y vaciamiento ganglionar ese mismo año. En 2015, recibió quimioterapia adyuvante con 10 ciclos de AC-T (doxorrubicina y ciclofosfamida, seguido por paclitaxel) y 6 sesiones de radioterapia adyuvante que finalizó en mayo de 2016. Desde junio de 2016 hasta enero de 2017 recibió terapia hormonal con tamoxifeno, el cual suspende por embarazo y lactancia. Reinicia tamoxifeno en junio de 2019, desde que se encuentra en seguimiento y con control del cáncer. Al examen físico: paciente en aceptable estado general, consciente, alerta, orientada en las tres esferas, TA: 122/95 mm Hg FC: 72 lpm FR: 20 rpm T: 37,2°C, IK/ECOG 100/0, IMC: 26,56. Tórax simétrico, normo expansible, mama derecha con leve dolor a la palpación. Cardiopulmonar: murmullo vesicular conservado, ruidos cardiacos rítmicos sin sobreagregados. Abdomen blando depresible. Extremidades: no signos de trombosis venosa profunda. Neurológico: sin signos de irritación meníngea ni de focalización. No se solicitó imagen radiográfica de tórax. Se obtuvo el diagnóstico de infección respiratoria aguda sin repercusión sistêmica ni hemodinámica. Dada su noción de contacto estrecho por nexo epidemiológico se solicitó prueba de PCR-TR de hisopado nasofaríngeo para SARS-CoV-2 el día de la consulta, con resultado positivo (se encontraba en el cuarto día del inicio de los síntomas) y también se realizó prueba de PCR múltiple para virus respiratorios con positividad para virus sincitial respiratorio. Se realiza notificación del caso al Instituto Nacional de Salud (INS) y se da egreso para seguimiento ambulatorio con manejo sintomático. Con el control telefónico se pudo verificar que tuvo evolución satisfactoria hacia la mejoría.
Caso 2
Hombre de 63 años de edad que consulta en el mes de mayo por cuadro clínico de seis días de evolución, consistente en deposiciones líquidas con moco, sin sangre, asociadas a emesis no relacionadas con ingesta de alimentos, pirosis y epigastralgia. Refiere asociada una disminución de la clase funcional con disnea de pequeños esfuerzos, NYHA III-IV/IV, ortopnea y edema de miembros inferiores. Nexo epidemiológico de contacto estrecho con persona positiva para Covid-19. Como antecedentes médicos presenta: enfermedad pulmonar obstructiva crónica, obesidad, síndrome de apnea/hipopnea obstructiva del sueño (SAHOS), insuficiencia cardiaca congestiva, hipertensión arterial, e hipotiroidismo posquirúrgico. En 2012 se diagnostica con carcinoma de próstata CT2ANXMX, IPSA 6.4, Gleason3+4 GG:2, de riesgo intermedio. Se inició tratamiento con leuprolide entre 2012 y 2015, año éste último en el que se realizó orquiectomía bilateral. A la fecha, presenta control bioquímico de la NM. En tratamiento farmacológico con levotiroxina, enalapril, calcitriol, metformina, salbutamol e ipratropio. Antecedentes quirúrgicos adicionales de colecistectomía y apendicectomía. Al examen físico: el paciente se encontraba en regulares condiciones generales, alerta, consciente y orientado en las tres esferas. Signos vitales de TA: 127/85 mmHg, FC: 96 lpm FR: 16 rpm T: 37°C; IK/ECOG: 80/1 SaO2 92% FIO2:28% con oxígeno suplementario por cánula nasal. Cavidad oral sin lesiones; Cardiopulmonar: sin sobreagregados pulmonares ni cardiacos. Abdomen: cicatrices por procedimientos quirúrgicos previos, blando, no doloroso. Extremidades inferiores con edema simétrico grado 2. Neurológico: sin déficit sensitivo ni motor observable.
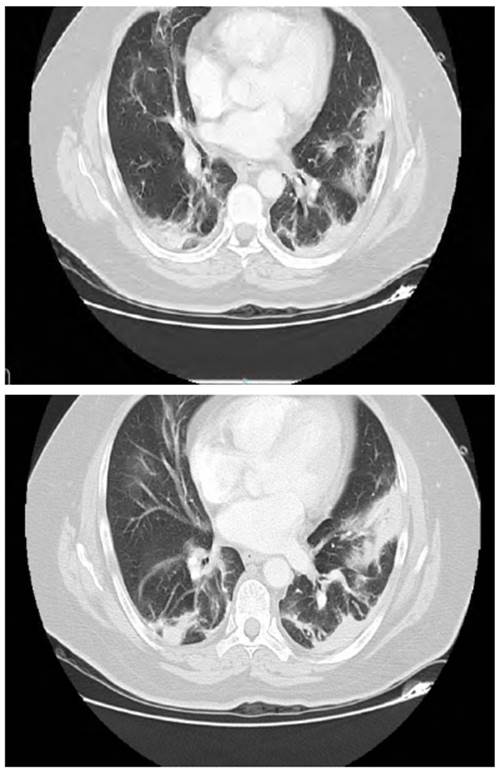
Los paraclínicos de ingreso evidenciaron leucocitos: 11.820 cel/mcl, neutrófilos 6.300 cel/mcl, hemoglobina en 13,8 g/dl, plaquetas 225.000 cel/mcl; creatinina 0,85 mg/dl; el resto de la química sanguínea estaba dentro de parámetros normativos. Los gases arteriales evidenciaron PAFI de 220 con PaO2 de 60, lactato de 1,26. La radiografía de tórax muestra infiltrados intersticiales bilaterales de predominio derecho y signos indirectos de hipertensión pulmonar (figura 1). Hallazgos que se confirman en la TAC de tórax por la presencia de múltiples lesiones en vidrio esmerilado, periféricas y consolidación en la língula con broncograma aéreo (figura 2). La ecocardiografía transtorácica reveló una FEVI en 56% y predijo una baja probabilidad de hipertensión pulmonar con PSAP en 30 mm Hg. Con diagnóstico de neumonía adquirida en la comunidad, en paciente con múltiples comorbilidades, se hospitaliza. Requirió oxígeno a bajo flujo por cánula nasal, ampicilina/sulbactam 12 g/día y claritromicina 1 g/ día, adicionales a los medicamentos de uso crónico que no se suspendieron. Por sospecha de infección por SARS-CoV2, el día del ingreso se realiza hisopado nasofaríngeo que es positivo, mientras que la PCR múltiple para otros virus es negativa. Se notifica el caso al INS. El paciente permanece en hospitalización en sala general, sin complicaciones agudas. No recibió tratamiento específico para Covid-19. El paciente evolucionó satisfactoriamente hacia la mejoría con el tratamiento instaurado.
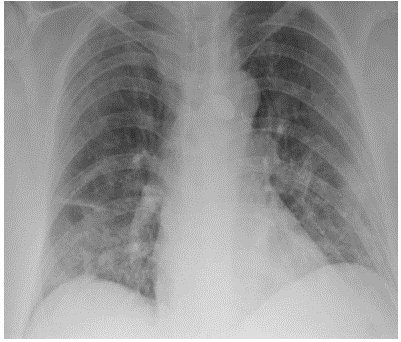
Figura 1 Caso 2. Radiografía de tórax Infiltrados pulmonares intersticiales difusos bilaterales, de aspecto inflamatorio, con acentuación en las bases.
Discusión
El SARS-CoV-2 se caracteriza por la rápida trasmisión humano-humano a través de gotas y contacto con secreciones respiratorias 1,2. La mayoría de los pacientes cursan con un síndrome clínico similar a la influenza, cuyos síntomas pueden incluir fiebre, tos, astenia, adinamia y dificultad para respirar 1,6,7.
En Colombia -con objeto de vigilancia en Salud Publica-, el síndrome clínico similar a la influenza se ha definido previamente bajo el evento: Infección Respiratoria Aguda 9 (IRA (leve, moderada, grave (IRAG). Aquí presentamos el primer caso de coinfección virus-virus en paciente con cáncer durante la pandemia por Covid-19 en Colombia, ejemplificando que la definición actual por el INS de caso sospechoso de infección por SARS-CoV-2 abarca gran número de agentes etiológicos y que éstos varían según la región geográfica y época del año.
La mortalidad estimada en pacientes hospitalizados con enfermedad similar a la influenza es significativamente mayor en la presencia de comorbilidades, principalmente, neoplasia de órgano sólido con metástasis (OR: 3,49), malignidad hematológica (OR: 3,04) y neoplasia oncológica sin metástasis (OR: 1,72) para todos los grupos de edad 10. Datos similares han sido descritos para pacientes con diferentes tipos de cáncer, difiriendo según el agente etiológico y la presencia o no de coinfección virus-bacteria o virus-virus 5,6,11.
Los pacientes con NM requieren diagnóstico, evaluación y tratamiento oportuno 12. Su atención en medio de la pandemia se ha convertido en un reto clínico y administrativo 12. Con el sistema de salud enfocado en el control del virus, los tratamientos quimioterapéuticos intrahospitalarios y la cirugía oncológica han sido reducidos a nivel mundial 13. En el caso de infección en cáncer de mama, los reportes de IRA por Covid-19 hasta la fecha sugieren un curso clínico benigno tanto en fase de remisión como en tratamiento activo con quimioterapia 4,14,15; en el primer caso descrito, la paciente presenta control del cáncer de mama en tratamiento hormonal oral con tamoxifeno, presentando curso clínico benigno, sin requerir admisión hospitalaria.
El abanico de presentación clínica es extenso, con recientes descripciones de infección por SARS-CoV-2, incluyendo manifestaciones a nivel cutáneo, gastrointestinal, hematológico y en sistema nervioso (central y periférico) 1. El paciente descrito en el caso 2 inicia su cuadro clínico con manifestaciones gastrointestinales y posteriormente desarrolla sintomatología respiratoria, principalmente disnea, con documentación radiográfica de neumonía, lo que conlleva a clasificarlo como caso probable y finalmente confirmado para Covid-19. Dados los factores de riesgo propios de la enfermedad y de la terapia, se prevé que en pacientes con NM la presentación clínica sea más heterogénea 4, sugiriendo la necesidad de disminuir el umbral diagnóstico en ésta población.
En el caso de cáncer de próstata, evidencia observacional de estudios analíticos sugiere un menor riesgo de infección en aquellos pacientes con terapia antiandrogénica 16,17; sin embargo, dado el pequeño porcentaje de pacientes incluidos y el no control de covariables, se requieren estudios adicionales para sugerir conclusiones definitivas.
Resultados divergentes en cohortes de pacientes con COVID-19, realizados en centros oncológicos han descrito, de un lado, mayor frecuencia de coinfección bacteriana, mayor requerimiento de ventilación mecánica y mayor mortalidad 4,18,19,20; sin embargo, en otros centros no se han observado éstas diferencias 21,22. Muchos factores adicionales determinan la gravedad de la infección respiratoria aguda, como la neoplasia maligna subyacente 4,15,23, el agente etiológico, el grado de inmunosupresión, el retraso en el diagnóstico y el momento de la presentación 18,21,24, sustentando la heterogeneidad de los resultados 4.
En la pandemia actual por COVID 19, los pacientes hospitalizados que reciben tratamiento antibiótico oscilan entre el 54% 3 al 100% de los casos 1,25. Reportes iniciales en población asiática describieron una frecuencia de coinfección bacteriana menor al 1% 1,3 (menor para coinfección viral 26,27,28), sugiriendo que la positividad para otro microorganismo haría improbable la infección por SARS-CoV2 28.
Debido a esta baja frecuencia de coinfección, los CDCs (The Centers for Disease Control and Prevention) aconsejan realizar pruebas de detección para otros patógenos en pacientes con IRA, sugiriendo que la evidencia de otra infección podría ayudar en la evaluación de pacientes con potencial COVID-19 en las locaciones donde los resultados de las pruebas para SARS-CoV2 no estén inmediatamente disponibles 7,9,28. Descripciones más recientes, sin embargo, han detectado tasas de coinfección SARS-Cov2 con otros patógenos respiratorios virales en hasta el 20% de los casos, haciendo imperativo el manejo de todos los pacientes sospechosos como casos positivos para SARS-CoV2 hasta tener la prueba negativa 28.
Durante la pandemia actual, el virus sincitial respiratorio se presenta como la segunda causa de coinfección y la principal en aquellos casos negativos para SAR-CoV2 28,29. La detección de coinfección no se ha asociado a diferencias en morbimortalidad 28,30; sin embargo, el uso extendido de pruebas para detección de patógenos respiratorios ha tenido impacto clínico (casos documentados de influenza donde la adición de terapia específica modifica el pronóstico), y logístico significativo (no requerimiento de aislamiento) 31.
Ninguno de los estudios descritos en casos de coinfección describe pacientes con NM, limitando la extrapolación de resultados.
El tratamiento del COVID-19 aún es experimental, sin demostrarse hasta la fecha evidencia suficiente para sugerir un esquema de tratamiento sobre otro. A la fecha, el estudio europeo IMMUNOCOVID está reclutando pacientes con cáncer avanzado y metastásico, con el objetivo de evaluar la eficacia de cloroquina, nivolumab (anti-PD-1) y tocilizumab (anti-IL6) en éste grupo poblacional específico 12. Se requieren estudios adicionales para orientar terapias específicas en éste grupo poblacional de alta vulnerabilidad.
Los pacientes descritos presentaron evolución clínica satisfactoria; en la mujer con cáncer de mama gracias a las medidas generales y cuarentena, y en el paciente con cáncer de próstata, mediante el tratamiento de las comorbilidades de base y sin tratamiento específico para COVID-19 recomendados por el consenso colombiano ACIN-IETS.
El paciente con NM presenta mayor susceptibilidad a procesos infecciosos dada la inmunosupresión sistémica causada por la neoplasia maligna y los tratamientos contra el cáncer, como la quimioterapia o la cirugía 15.
La pandemia por COVID-19 representa la mayor crisis en salud pública de los últimos 100 años. No hay tratamiento específico, con un único estudio a la fecha específicamente dirigido a población con NM. Las descripciones realizadas carecen de rigor metodológico para sustentar intervenciones diferenciales. En Colombia, la población oncológica sigue siendo considerada de alto riesgo y se prioriza su atención ante la plausibilidad de peores desenlaces.