Introducción
De acuerdo con la clasificación de la Organización Mundial de la Salud (OMS) de 2017, los feocromocitomas y paragangliomas son tumores neuroendocrinos derivados de las células cromafines que se diferencian entre sí por su localización anatómica. El feocromocitoma es un tumor originado en la médula de la glándula adrenal y el paraganglioma es un tumor extra-adrenal 1. La incidencia de feocromocitoma y paraganglioma es 0.6 casos por 100.000 personas-años 2.
Estos tumores presentan alta variabilidad en su presentación clínica de acuerdo con su localización, potencial de metástasis, fenotipo bioquímico y predisposición genética. En los casos de hipersecreción de catecolaminas, pueden aumentar el riesgo de enfermedades cardiovasculares e incluso la muerte 3.
Ante la sospecha clínica se requiere la realización de estudios bioquímicos e imagenológicos para confirmar y localizar la enfermedad. La cirugía es el tratamiento de elección. Un adecuado manejo perioperatorio y abordaje quirúrgico disminuyen la morbimortalidad asociada al procedimiento 4. La enfermedad metastásica no puede ser curada; estudios han evaluado la eficacia de quimioterapia sistémica, radiofármacos e inhibidores de la tirosina quinasa 5.
El conocimiento sobre feocromocitomas y paragangliomas ha avanzado en los últimos años. En esta revisión se discutirá sobre genética, manifestaciones clínicas, diagnóstico y tratamiento.
Métodos
Se realizó una búsqueda de la literatura en las bases de datos de MedLine, Embase, Scopus, LILACS y SciELO utlizando los términos MeSH: "Feocromocitoma" o "Pheochromocytoma" o "Paraganglioma", enlazados con: "Cirugia" o "Surgery" o "Drug Therapy" o "Metanefrinas" o "Metanephrine". Se limitó la búsqueda a literatura de los últimos 20 años. Se incluyeron artículos generales, todos los diseños de estudios clínicos, cohortes y revisiones de la literatura, en idiomas inglés y español.
Todos los estudios obtenidos a partir de la búsqueda se examinaron por títulos y resumen. Los artículos con datos potencialmente relevantes se incluyeron para una revisión detallada.
Genética
Hasta el 40% de los pacientes con feocromocitomas y paragangliomas tienen una mutación germinal en un gen de susceptibilidad 6,7. Ha sido relacionada con su tumorigénesis, mutaciones en más de 20 genes 8 9. Describimos los fenotipos (características clínicas, número de tumores, riesgo de metástasis) y patrón de herencia de los síndromes más relevantes (Tabla 1) 10,11 12.
Tabla 1 Características de síndromes genéticos asociados a feocromocitoma y paraganglioma. Se muestran las características clínicas, número de tumores, riesgo de metástasis y patrón de herencia de los síndromes más relevantes asociados a feocromocitoma y paraganglioma.
| CARACTERÍSTICAS DE SÍNDROMES GENÉTICOS ASOCIADOS A FEOCROMOCITOMA/PARAGANGLIOMA | ||||
| Síndrome | Gen | Clínica | Patrón de herencia | Comentarios |
| Von Hippel Lindau | VHL | Hemangioblastomas en Sistema Nervioso Central, carcinoma de células renales, tumores neuroendocrines | Autosómico dominante. | Alto porcentaje de tumores bilaterales. |
| Neurofibromatosis tipo 1. | NF1 | Neurofibromas cutáneos, cáncer de seno, manchas café con leche, gliomas ópticos, tumores adrenales. | Autosómico dominante. | Alto porcentaje de tumores bilaterales (50%). |
| Neoplasia endocrina múltiple tipo 2 | RET. | Cáncer medular de tiroides, feocromocitoma, hiperparatiroidismo | Autosómico dominante | Alto porcentaje de tumores bilaterales (50%). |
| Síndrome feocromocitoma/ paraganglioma tipo 1 | SDHD | Tumores estromales gastrointestinales, paragangliomas, cáncer de células renales, adenomas hipofisarios. | Autosómico dominante, impronta genética materna. | Alto porcentaje de tumores en cabeza y cuello (50%), común encontrar múltiples tumores. |
| Síndrome feocromocitoma/ paraganglioma tipo 2 | SDHAF2 | Paragangliomas de cabeza y cuello. | Autosómico dominante | Alto porcentaje de tumores en cabeza y cuello (50%), común encontrar múltiples tumores. |
| Síndrome feocromocitoma / paraganglioma tipo 3 | SDHC | Tumores estromales gastrointestinales, paragangliomas, cáncer de células renales. | Autosómico dominante. | Alto porcentaje de tumores en cabeza y cuello (50%) |
| Síndrome feocromocitoma / paraganglioma tipo 4 | SDHB | Tumores estromales gastrointestinales, feocromocitomas, cáncer de células renales, adenomas hipofisarios. | Autosómico dominante. | Alto porcentaje de compromiso metastásico (25 - 50%). |
| Síndrome feocromocitoma / paraganglioma tipo 5 | SDHA | Tumores estromales gastrointestinales, feocromocitomas, cáncer de células renales, adenomas hipofisarios. | Autosómico dominante. | Frecuencia similar de feocromocitomas y paragangliomas (entre 25 - 50%). |
Según los hallazgos del proyecto The Cancer Genome Atlas (TCGA), los genes SDHB (9%), RET (6%), VHL (4%) y NF1 (3%) exhibieron las tasas más altas de mutaciones germinales. La clasificación molecular basada en perfiles de expresión génica ha dividido estos tumores en tres grupos principales: señalización de quinasa, pseudohipoxia y vía Wnt alterada (Ver figura 1) 13.
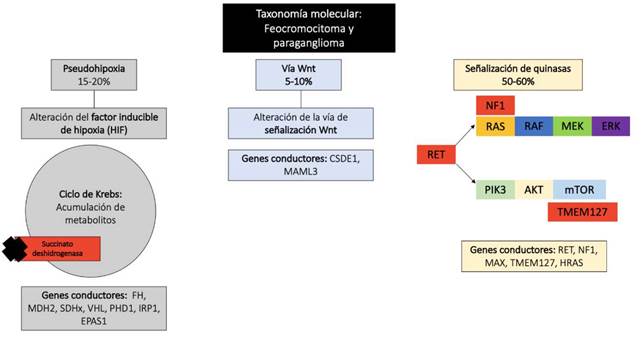
A: Pseudohipoxia: Respuesta hipóxica patológica de los factores HIFs debido a acumulación de metabolitos relacionados con el ciclo de Krebs y perturbación directa en el recambio de los HIFs. B: Vía Wnt: mutaciones somáticas en CSDE1 o fusión de genes UBTF-MAML3. C: Señalización vía quinasa: Mutación con ganancia de función en RET o NF1.
Figura 1 Clasificación molecular
El grupo señalización de quinasa consiste en mutaciones somáticas o germinales en RET, NF1, TMEM127, MAX y HRAS13. El síndrome hereditario más común de este grupo es la neoplasia endocrina múltiple tipo 2 (MEN2), que ocurre como resultado de mutaciones de ganancia de función en RET14. Una minoría de los casos tiene neurofibromatosis tipo 1 (NF1) 15.
El grupo pseudohipoxia se caracteriza por una respuesta hipóxica patológica debido a la estabilización de los factores inducibles de hipoxia (HIFs). Contiene 2 subgrupos: uno relacionado con mutaciones germinales en genes del ciclo de Krebs -Complejo succinate deshidrogenasa mitocondrial (SDHx: SDHA, SDHB, SDHC, SDHD), así como succinato deshidrogenasa factor de montaje 2 (SDHAF2), fumarato hidratasa (FH), malato deshidrogenasa 2 (MDH2) e isocitrato deshidrogenasa (IDH)-; y otro relacionado con alteraciones en el recambio de los HIFs (factores inducibles por la hipoxia) a través mutaciones somáticas y germinales del gen supresor de tumores Von Hippel-Lindau y la proteína del dominio endotelial PAS 1 (VHL/EPAS1)16. El HIF activado altera la transcripción génica, lo que resulta en un aumento de la angiogénesis, así como en la proliferación celular y una reducción de la apoptosis 17.
El grupo vía Wnt alterada presenta genes sobreexpresados en las vías de señalización de Wnt y Hedgehog, como WNT4 y DVL3. Además, presenta la mayor sobreexpresión de CHGA, un gen importante para la función celular, cuyo producto es la cromogranina A, un marcador clínico de tumores neuroendocrinos. Este grupo contiene los tumores que expresan mutaciones somáticas en genes de fusión MAML3 y CSDE113,18. Clínicamente, los pacientes muestran casos esporádicos y agresivos porque algunos de ellos presentan recurrencia y metástasis 16.
La mayoría de los feocromocitomas y paragangliomas tienen baja tasa de mutación somática en relación con otros tipos de cáncer, con un promedio de 0.67 mutaciones por megabase. La carga de mutación somática se asocia con mayor agresividad 13.
Manifestaciones clínicas
La amplia variedad de manifestaciones clínicas está relacionada con el exceso de catecolaminas, incluida la triada clásica de cefalea, palpitaciones y sudoración profusa4. Sin embargo, algunos síntomas pueden ser causados por compresión local o metástasis 19. En la tabla 2 se muestran las manifestaciones más frecuentes 20-22.
Tabla 2 Manifestaciones clínicas feocromocitoma y paraganglioma. Es el porcentaje de presentación de las manifestaciones clínicas de los feocromocitoma y paraganglioma
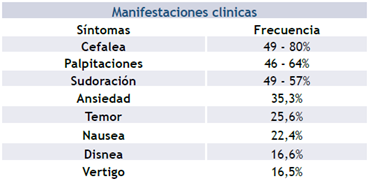
En la tabla 2 se muestran las manifestaciones clínicas de los feocromocitoma y paraganglioma 20,21,22
La secreción de catecolaminas suele ser episódica y causar hipertensión arterial en un 50-60% de los casos. La triada clásica solo está presente en un 1530% de los casos con una sensibilidad del 58% 23-25. No hay un hallazgo clínico con un valor significativo para el diagnóstico o exclusión de feocromocitoma y paraganglioma. La combinación de síntomas, signos y exámenes paraclínicos es la herramienta más provechosa 25.
Algunos casos son asintomáticos y se descubren como incidentalomas adrenales26. Los feocromocitomas son hallazgos incidentales en imágenes de sección transversal (61%), sintomáticos (27%) o por pruebas de detección de casos basadas en mutaciones (12%) 27.
La descarga catecolaminérgica recurrente puede llevar en algunos casos a inflamación y necrosis de los miocitos cardiacos, produciendo falla cardiaca reversible similar al Síndrome de Takotsubo 28. Adicionalmente, el estímulo de receptores 6-2 aumenta la glucogenólisis y disminuye la secreción de insulina a través de receptores alfa-2, causando hiperglicemia 29.
Diagnóstico
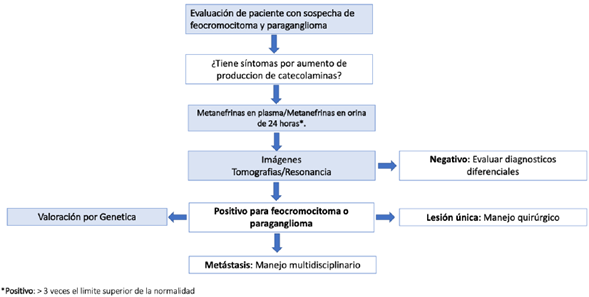
El diagnóstico de feocromocitoma y paraganglioma requiere documentar la liberación excesiva de catecolaminas y ubicación anatómica del tumor (Ver figura 2).
La síntesis y liberación de catecolaminas está inherentemente relacionada con la diferenciación celular y la regulación génica. Los paragangliomas y feocromocitomas del subgrupo de alteración de genes del ciclo de Krebs, presentan disminución o ausencia de enzimas claves en el metabolismo de la catecolamina con fenotipos puramente noradrenérgicos o dopaminérgicos; el subgrupo VHL/ EPAS1 tiene un fenotipo de síntesis de catecolaminas intermedio y es estrictamente noradrenérgico. No obstante, los grupos de señalización de quinasas y vía alterada Wnt muestran una mayor diferenciación neuronal con una mayor expresión de feniletanolamina N-metiltransferasa (PNMT) que facilita la síntesis de epinefrina a partir de norepinefrina 30.
La medición de metanefrinas totales y fraccionadas libres en plasma tiene una sensibilidad media del 97% y una especificidad del 93%, considerándose la primera prueba de elección para el diagnóstico de estos tumores 31. Elevaciones leves en las metanefrinas en plasma son comunes en pacientes sin feocromocitoma. Se requieren valores tres veces por encima del límite superior de la normalidad para considerar como probable el diagnóstico 32. La posición supina al momento de la toma del examen y el uso de cromatografía líquida de alta resolución con métodos de espectrometría de masas o electroquímica proporcionan mayor precisión33. Medicaciones como antidepresivos tricíclicos, antipsicóticos, inhibidores de la recaptación de serotonina o noradrenalina y levodopa pueden causar elevaciones de catecolaminas y algunas enfermedades agudas pueden causar falsos positivos 34. Igualmente, ciertos medicamentos antihipertensivos, como bloqueadores de canales de calcio, bloqueadores selectivos y no selectivos de los receptores alfa-adrenérgicos, deben cambiarse para la medición debido a que alteran los resultados elevándolas o disminuyéndolas 35.
Se debe considerar realizar estudio bioquímico con metanefrinas en las siguientes situaciones 36:
Hipertensión arterial resistente.
Incidentaloma adrenal.
Crisis hipertensivas durante inducción anestésica.
Historia familiar de feocromocitoma o de enfermedades genéticas predisponentes como Von Hippel Lindau, NF1, MEN2, síndrome de feocromocitoma/paraganglioma.
Historia personal de las enfermedades mencionadas previamente.
Cuando la sospecha es alta y los resultados de medición de metanefrinas no son concluyentes, se aconseja realizar la prueba de supresión con clonidina. La clonidina suprime la secreción normal de catecolaminas sin afectar la producción tumoral. Se administran 300 microgramos y se miden metanefrinas en plasma al momento 0 y 3 horas. Se descarta el diagnóstico si las metanefrinas son normales a las 3 horas o tienen un descenso mayor al 40% 37.
La médula de la glándula adrenal o cualquier sitio que contenga paraganglios puede ser afectado. Aproximadamente el 90% de los tumores son adrenales y el 10% restante son extraadrenales. Las localizaciones más frecuentes de los extraadrenales son: región paraaórtica abdominal (75%), vejiga (10%), tórax (10%), cabeza y cuello (5%) 38.
En los casos con clínica compatible y confirmación bioquímica de exceso de catecolaminas se utiliza la tomografía axial computarizada con contraste (TAC) o resonancia magnética (RM) , ambas con sensibilidad superior al 90% y especificidad alrededor del 75% 39.
Es común encontrar masas adrenales ≥ 1cm como hallazgo incidental en estudios tomográficos abdominales, este hallazgo se conoce con el término de incidentaloma adrenal. En estos casos, se prefiere la realización de estudios tomográficos no contrastados con el fin de evaluar la radiodensidad de la masa por medio de la escala de Unidades Hounsfield (UH). Si la atenuación de la masa es ≤10 UH significará que se trata de un componente con alto contenido lipídico y se excluye el diagnóstico de feocromocitoma. En caso contrario, si la masa tiene 10-30 UH se debe realizar el estudio bioquímico para excluir feocromocitoma. En caso de lesiones >30 UH existe indicación de cirugía, aunque no se documente producción hormonal. La resonancia contrastada muestra gran contenido lipídico intracelular en casos de lesiones benignas (adenomas) 26.
Dentro de los estudios funcionales tenemos la gammagrafía con metayodobencilguanidina marcada con I-131 (131I-MIBG), la gammagrafía con metayodobencilguanidina marcada con I-123 (123I-MIBG), el PET con 18 fluorodeoxyglucosa (PET - FDG), el PET con 18F-3,4-dihidroxifenilalanina (PET - DOPA) (no disponible en Colombia), el PET con 18F-fluorodopamina (PET-18F-FDA) (no disponible en Colombia), el PET con Gadolinio, 4, 7, 10-tetraazaciclododecano-1, 4, 7, 10-ácido tetracético-octreotide (PET-DOTATATE). Sin embargo, la realización y el rol actual de los estudios funcionales en pacientes con feocromocitoma y paraganglioma ha sido pobremente estudiado, principalmente por la rareza de estos tumores, la poca disponibilidad y el alto costo que tienen los estudios funcionales 40. La evidencia actual sugiere que las imágenes funcionales solo detectan aproximadamente un 1.5% más de los tumores primarios y un 3.5% más de compromiso metastásico, comparados con la TAC y la RM, por lo que su utilidad se reserva para pacientes con predictores de compromiso metastásico y de mal pronóstico como son un tamaño tumoral > 5 cm y la presencia de una mutación germinal en la SDHB 41.
En caso de considerarse su realización se prefiere la gammagrafía con 123I-MIBG, dada su mejor sensibilidad y menor riesgo de irradiación a tejido tiroideo, comparada con la gammagrafía 131I-MIBG. Los estudios con PET, dado su alto costo y baja disponibilidad, se reservan en caso de que exista muy alta sospecha de compromiso metastásico asociado a mutación en SDHB y que los estudios de gammagrafía sean inconclusos o negativos 42.
Tratamiento
La resección total es la primera línea de tratamiento para el feocromocitoma y paraganglioma no metastásico 43, con una supervivencia libre de tumor del 76% 44. La reducción quirúrgica, aunque no es curativa, es útil para el control sintomático de las metástasis 45,46. Las áreas de incertidumbre son el momento de la cirugía y el enfoque quirúrgico.
En caso de tumores productores de catecolaminas, previamente al procedimiento quirúrgico, se requiere hacer inicialmente bloqueo a y luego 6. Está contraindicado el uso inicial de bloqueadores 6 como monoterapia porque la estimulación sin oposición de los receptores a puede llevar a vasoconstricción arterial severa. La fenoxibenzamina es un a bloqueador no selectivo de larga acción y es el medicamento de elección; sin embargo, no está disponible en Colombia, por lo que se usan bloqueadores selectivos a1 de corta acción como doxazosina y prazosin 47. En caso de no lograr el control de cifras tensionales y de frecuencias cardiacas con el bloqueo a y 6, se pueden adicionar calcio antagonistas o inhibidores de la enzima convertidora de angiotensina. En el postoperatorio se deben vigilar estrictamente las cifras de tensión arterial y ajustar los medicamentos antihipertensivos para evitar hipotensión 48.
Desde 1996, la adrenalectomía laparoscópica es una práctica estándar debido al menor tiempo quirúrgico, menores complicaciones y menor tiempo de estancia hospitalaria, con excepción de los tumores muy grandes (5-8 cm) 49,50. Actualmente, hay mejores resultados debido a una adecuada preparación preoperatoria, estudios de localización y un abordaje quirúrgico laparoscópico mínimamente invasivo 51. En los casos de feocromocitoma bilateral, se utiliza medulectomía para evitar un requerimiento postoperatorio de glucocorticoides y mineralocorticoides 52.
Los feocromocitomas y paragangliomas metastásicos se propagan con frecuencia a los ganglios linfáticos regionales y distantes, huesos, hígado y pulmones 53,54. Como cabría esperar, los pacientes con metástasis tienen una supervivencia general más corta 54. Las metástasis ocurren en menos del 10% de los paragangliomas parasimpáticos, hasta el 25% de los feocromocitomas, y en el 40-70% de los paragangliomas simpáticos 55.
Los feocromocitomas y paragangliomas con compromiso metastásico pueden ser tratados con quimioterapia sistémica y agentes radiofarmacéuticos como 131I-MIBG. Los resultados de estos tratamientos se derivan de pequeños estudios retrospectivos y sin adecuado seguimiento sistemático dada la rareza de la enfermedad 56,57.
La quimioterapia disminuye la capacidad del tumor de mantener señalización proliferativa, disminuyendo la división celular anormal. Sin embargo, a pesar de mejorar el control de la presión arterial y síntomas del exceso de catecolaminas por la reducción del tamaño tumoral, no inducen respuestas completas 58. No hay claridad sobre el momento en el cual los pacientes se benefician de terapia sistémica; la evidencia favorece la vigilancia clínica hasta progresión de la enfermedad; el esquema de quimioterapia más utilizado es CVD (Ciclofosfamida, Vincristina, Dacarbazina) 59. En una cohorte francesa de pacientes con paragangliomas y feocromocitomas metastásicos, la mitad permanecieron con enfermedad estable en el primer año sin recibir tratamiento 60.
El 131I-MIBG es absorbido por el transportador de noradrenalina; una vez en la célula tumoral, libera radiación letal que causa daño severo al ADN, inhibe la proliferación y causa muerte celular. Hasta el 80% de los pacientes con feocromocitomas y paragangliomas metastásicos expresan el transportador de noradrenalina en la membrana celular 61. 131I-MIBG puede ser clasificado de dos maneras: 131I-MIBG de baja actividad especifica (LSA-131I-MIBG) o de alta actividad (HSA-131I-MIBG); son estructuralmente similares. Sin embargo, sus procesos de fabricación difieren notablemente, confiriéndole al HSA-131I-MIBG una alta especificidad para el tejido diana, con bajo riesgo de efectos adversos cardiovasculares. No existen ensayos clínicos que comparen terapia con LSA-131I-MIBG contra HSA-131I-MIBG. La terapia con HSA-131I-MIBG es la única actualmente aprobada en Estados Unidos por la Administración de Medicamentos y Alimentos (FDA por sus siglas en inglés) para tratamientos de feocromocitoma y paraganglioma; esto se basa en un ensayo clínico que demostró control de la enfermedad a 12 meses del 92.2% comparado con tasas de respuesta de LSA-131I-MIBG, que están alrededor del 50% 62,63. Adicionalmente, el HSA-131I-MIBG tiene perfil de seguridad aceptable, siendo el evento adverso grave más comúnmente reportado la presencia de mielosupresión con trombocitopenia en un66% de los casos, leucopenia en un 55%, y anemia en un 54%. El 23% requirió transfusión de plaquetas, glóbulos rojos o uso de factor estimulante de colonias de granulocitos; todos se recuperaron de la aplasia medular y ninguno requirió trasplante de médula ósea 63,64.
El Axitinib, cabozantinib, lenvatinib, pazopanib y sunitinib son medicamentos antiangiogénicos que se están evaluando en ensayos clínicos para pacientes con feocromocitomas y paraganglios metastásicos. La plausibilidad biológica de esta terapia radica en el agotamiento del suministro de oxígeno y nutrientes a las células cancerosas, lo que conlleva a la muerte 55.
Conclusiones
Los feocromocitomas y paragangliomas son entidades poco frecuentes con alta variabilidad de presentación clínica. Su diagnóstico requiere la documentación de la liberación excesiva de catecolaminas y ubicación anatómica del tumor, a través de la medición de catecolaminas o sus derivados, las metanefrinas e imágenes como tomografía axial computarizada o imagen por resonancia magnética.
En el caso de enfermedad metastásica las opciones de tratamiento actuales son limitadas. Se están llevando a cabo estudios con antiangiogénicos que esperan ampliar el abanico de opciones terapéuticas para estos pacientes y mejorar su calidad de vida.