Introducción
El melanoma maligno que se identifica en el tracto genital inferior ocurre entre el 2% al 3% de todos los cánceres ginecológicos y su localización en mucosas solo se presenta en el 0,03% de los casos 1. Los originados en cuello uterino son extremadamente raros y desde 1950 hasta 2016 se han reportado 96 casos en la literatura 2, lo que lo hace una entidad poco estudiada y con mal pronóstico a corto plazo, con tasas de supervivencia a 5 años de 10% 3.
A pesar de los esfuerzos que se han realizado desde hace 30 años en la identificación de las causas y los factores de riesgo que predisponen para el desarrollo del melanoma de mucosas estos no se han logrado establecer claramente. Se han atribuido como factores de riesgo: la infección por virus del papiloma humano, la exposición a terapia hormonal o los antecedentes de radioterapia; sin embargo, esta asociación no ha sido conclusiva del todo debido a la baja incidencia de casos y de síntomas inespecíficos que contribuye con el retraso en el diagnóstico por su difícil localización y su rica vascularización linfática y hematógena que presentan estas lesiones, lo que genera una rápida progresión que empeora su pronóstico 4,5. El objetivo de este estudio es hacer el primer reporte de caso en Colombia de una paciente con un melanoma primario de cuello uterino que fue remitida y recibió manejo en el Instituto Nacional de Cancerología.
Reporte de caso
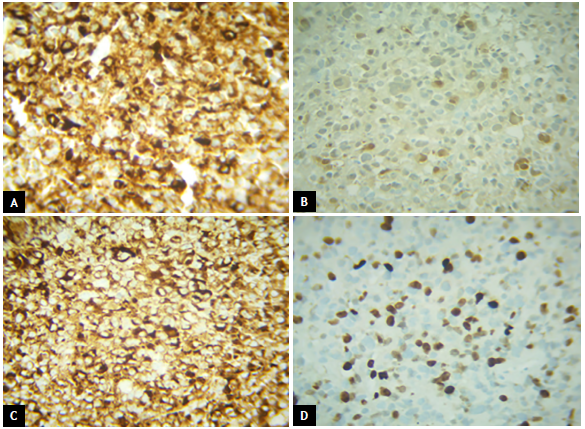
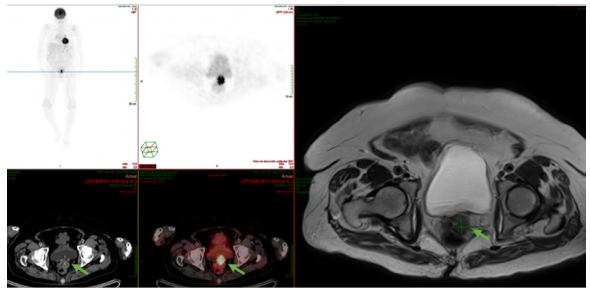
Paciente de 82 años con cuadro clínico de 1 año de evolución de sangrado vaginal postmenopáusico que consultó a una institución de primer nivel donde enfocaron el caso como un posible carcinoma de cuello uterino. Se le realizó citología cérvico vaginal que fue reportada con alteración de células escamosas de significado indeterminado (ASC-US) y con este resultado le realizaron una colposcopia donde se evidenció lesión melanocítica de bordes sobreelevados en cuello uterino de 2 cm (Fig. 1). Se hizo biopsia de la lesión (no se cuenta con los hallazgos colposcópicos extrainstitucionales) y se remitió al INC donde se procesa la muestra que reportó: compromiso por tumor maligno pobremente diferenciado, pigmentado, (Fig. 2 A y B) con marcadores de inmunohistoquímica HMB45, S100 y MELAN A positivos con Ki67 del 60% (Fig. 3 A, B, C y D), lo que confirmó inmunofenotipo para melanoma maligno. En la valoración de la paciente en la consulta del servicio de Ginecología Oncológica se estableció que presenta comorbilidades importantes dadas por artrosis, hipertensión arterial y enfermedad pulmonar obstructiva crónica (EPOC) y una cuantificación de la escala Eastern Cooperative Oncology Group (ECOG) de 3. En el examen físico se identificó lesión pigmentada con bordes regulares sobreelevados de 2 cm que comprometía el labio anterior de cuello uterino (de donde se había tomado la muestra para representación histológica). Los estudios imagenológicos de extensión resonancia nuclear magnética de pelvis reportaban masa de aspecto neoplásico de 25 x 21 x 22 mm en exocérvix sin compromiso de parametrios ni linfadenopatías metastásicas (Fig. 4 A y B). La tomografía por emisión de positrones (PET/CT) mostró engrosamiento concéntrico intensamente hipermetabólico con epicentro en el cuello uterino con valor estandarizado de captación (SUV) de 25 (Fig. 5) sin otras lesiones hipermetabólicas; se realizaron estudios endoscópicos para descartar compromiso de mucosa rectal y vesical, y estos fueron negativos. Con estos hallazgos y después de realizar una inspección rigurosa, en búsqueda de otros sitios de compromiso melanótico, se hizo un diagnóstico de melanoma maligno primario de cuello uterino estadio IB2 y se presentó el caso en junta multidisciplinaria, donde se conceptuó que por la edad avanzada, el estado funcional y la comorbilidades asociadas de la paciente no era candidata a manejo quirúrgico (histerectomía radical con salpingooforectomía bilateral y vaginectomía), que es el manejo que generalmente se ofrece para esta patología. En este caso se dio manejo con radioterapia pélvica externa exclusiva con intención paliativa para control de síntoma de sangrado; recibió tratamiento con radioterapia externa dosis de 600 cGy en 5 fracciones hasta 3000 cGy bisemanal con adecuada respuesta, logrando control sintomático y después de 10 meses de seguimiento la paciente falleció.
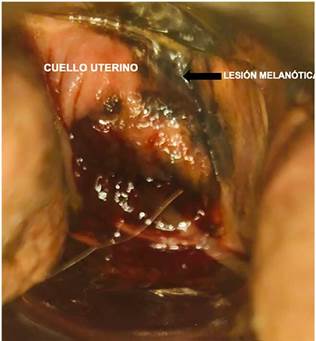
Figura 1 Imagen colposcópica de lesión melanótica de 22 x 20 mm que compromete labio anterior de cuello uterino.
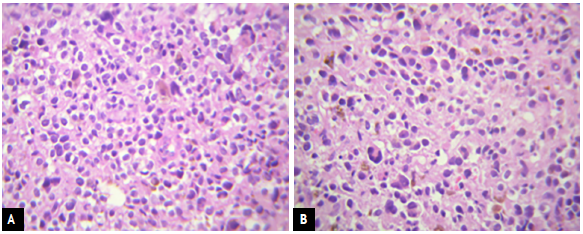
Figura 2 A-B Tinción de hematoxilina eosina de biopsia de la lesión con núcleos y citoplasma prominentes compuestos por células melanocíticas atípicas.
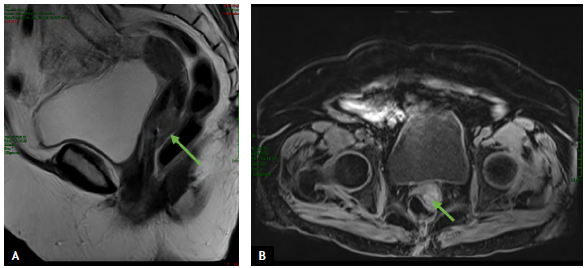
Figura 4 Imágenes de resonancia nuclear magnética de pelvis (flechas). A. Corte sagital flecha indica lesión exofítica en canal vaginal. B. Corte transversal flecha indica lesión cervical.
Discusión
Los melanomas malignos, que comprometen las mucosas, se presentan de manera más frecuente en las personas de edad avanzada y mujeres posmenopáusicas. En el 73% de los casos afectan a mujeres mayores de 60 años. La incidencia de los melanomas malignos de mucosas del tracto genital se ha estimado en 1,6 casos por cada millón de mujeres 4.
La etiología de los melanomas originados en cuello uterino se desconoce, solo en 1959 cuando se identificaron los primeros melanocitos basales en biopsias de cuello uterino fue que se empezó a evaluar la posible migración de los melanocitos desde la cresta neural o la diferenciación melanocítica del epitelio endocervical, como teorías que explicarían la presencia de estas células en esa localización 5. Algunos factores de riesgo como la infección del virus del papiloma humano genotipo 16, el antecedente de radioterapia pélvica o la suplencia hormonal se han propuesto en los pocos reportes de casos que se encuentran en la literatura 6. También se han sugerido mecanismos etiológico hipotéticos como la predisposición genética, los factores ambientales, entre otros, pero ninguno es suficientemente claro para llegar a precisar el origen de causalidad de esta entidad. Es así que el melanoma maligno primario de cuello uterino es una patología de presentación poco frecuente y en la que no se ha podido establecer claramente los factores predisponentes ni los mecanismos en torno a su origen 3.
Las principales manifestaciones clínicas son flujo vaginal, sinusorragia, dispareunia y hemorragia uterina en el periodo postmenopáusico. En el caso que reportamos la paciente presentó inicialmente sangrado anormal y una anormalidad citológica inespecífica, pues no existen hallazgos citológicos característicos. Los hallazgos colposcópicos y de inspección visual orientaron el diagnóstico ante la presencia de una lesión melanocítica que se caracteriza por ser una masa polipoide o exofítica originada en el cuello uterino. El volumen tumoral puede variar y la pigmentación generalmente es oscura, negra, azul o rojiza y en un 6% de los casos, también se puede presentar como tumores amelanóticos, pálidos o blancos 7,8.
Hoy en día la inmunohistoquímica es la herramienta que ayuda a precisar su diagnóstico y el realizar inmunotinción con marcadores S100, vimentina, melanina A, MART1 y HMB45 con frecuencia positivos para esta entidad. La proteína S100 se considera más sensible y la proteína HMB45 es una tinción más específica para establecer el diagnóstico de melanoma maligno, especialmente cuando se combinan los dos marcadores 3. Los criterios para el diagnóstico de un melanoma maligno primario de cuello uterino incluyen: la presencia de melanina en el epitelio cervical normal; la ausencia de melanoma en otras áreas del cuerpo; la evidencia de cambios en la unión en el cuello uterino, y la metástasis, según el patrón de cáncer cervical 2.
En la tabla 1 se enumeran los parámetros histopatológicos a tener en cuenta frente a una sospecha diagnóstica de un melanoma maligno primario de cuello uterino.
El diagnóstico histológico se realiza mediante una biopsia exocervical frente al hallazgo de un tumor polipoide sospechoso asociado a síntomas mencionados anteriormente o incidentalmente después de la evaluación del cuello uterino al colocar el espéculo durante el examen ginecológico de rutina 9. En la revisión de los frotis cervicales y las biopsias que presentan células pigmentadas con melanina, lesiones intraepiteliales escamosas de alto grado o células poco diferenciadas, se debe tener en cuenta esta patología poco frecuente y aplicar la tinción adecuada en los casos donde se evidencien estas células tumorales 10.
Es importante aclarar que para realizar el diagnóstico de melanoma que se origina en el cuello del útero, que es una patología con una muy baja incidencia, se debe realizar una inspección exhaustiva de la paciente en busca de lesiones pigmentadas que puedan ser las lesiones primarias. Complementario a esto, se deben realizar estudios de extensión como: tomografías, resonancia nuclear magnética o tomografía por emisión de positrones (PET/CT); estos estudios se hacen con el propósito de estadificación, identificación de lesiones metastásicas, verificación de extensión de enfermedad o para ubicación de lesiones tumorales primarias en localizaciones más frecuentes que el cuello uterino. Además, estas imágenes diagnósticas tienen un buen rendimiento alcanzando sensibilidad hasta del 83% con tasas de especificidad hasta de un 100%, obteniendo su mayor rendimiento en estadios avanzados de la enfermedad 11.
Aunque la estadificación de los melanomas cutáneos primarios se basa en el grosor de la lesión, la clasificación para el melanoma maligno del cuello uterino se clasifica de acuerdo con el sistema FIGO para el cáncer cervical 3. El tratamiento de elección para el melanoma maligno de cuello uterino es quirúrgico con la extirpación del tumor teniendo en cuenta que se deben garantizar márgenes amplios mayores a 2 cm 12. Este manejo también aplica para otros melanomas malignos como el de localización anorrectal, que es igualmente raro, pero mejor estudiado en la literatura 13. Aunque no existe consenso para un abordaje quirúrgico estandarizado para el melanoma maligno de cuello uterino, en general se realiza una histerectomía radical combinada con linfadenectomía pélvica y/o vaginectomía 12.
Otros enfoques terapéuticos van dirigidos al papel de la radioterapia, aunque se sabe que este tipo de tumor es resistente a la acción de la radiación, por lo tanto, esta estrategia de tratamiento se ha reservado para: escenarios de manejo paliativo de las recurrencias, enfermedad en progresión, márgenes quirúrgicos positivos, compromiso parametrial, tumores residuales o compromiso ganglionar pélvicos 14; los resultados que han obtenido son aun variables. En cuanto a la aplicación de la quimioterapia, en esta patología se aplican los mismos protocolos utilizados para el melanoma de la piel, en casos de melanoma maligno de cuello uterino en estadios avanzados o en enfermedad recurrente y han observado una respuesta medible al tratamiento, pero sin mayor impacto en la supervivencia global 15.
El papel de la inmunoterapia en el tratamiento de esta entidad ha tenido varios cambios a través del tiempo. La interleucina-2 (IL-2), que es un factor de crecimiento estimulante de proliferación de células T y de la actividad citotóxica, fue la primera inmunoterapia que recibió aprobación regulatoria en 1998 para el tratamiento del melanoma 16. Entre 1985 y 1993 se realizó un análisis en 270 pacientes con dosis altas de IL-2 y se observó que la tasa de respuesta global fue del 16%, con respuesta completa del 6% y respuesta parcial del 10%, sin progresión a los 30 meses de seguimiento. Las toxicidades significativas observadas fueron causadas por el síndrome de fuga capilar y la infiltración linfoide, sin embargo, las toxicidades se resolvieron después de la interrupción del tratamiento 17. Posterior a esto, se evaluó la utilidad de los inhibidores de punto de control inmune que actúan utilizando mecanismos de transducción de señales de células T. La CTLA-4 o la proteína asociada a los linfocitos T citotóxicos se descubrió en 1987 y esta compite con CD28 para unirse a CD80 y CD86, mediante esta unión se realiza una regulación inhibitoria de las vías de activación de las células T. El anticuerpo programado de la proteína de muerte celular 1 (PD-1) conduce a la expansión de subgrupos de células CD8 T similares a la que se presentan en la infiltración de tumores específicos. De manera, CTLA-4 y PD-1 regulan negativamente la respuesta antitumoral. Hasta la fecha, un anticuerpo CTLA-4 (ipilimumab) y dos anticuerpos anti-PD-1 han recibido aprobación regulatoria para el tratamiento del melanoma 18. El ipilimumab es un anticuerpo IgG1 monoclonal completamente humano que inhibe a CTLA-4 y en 2011 fue aprobado por la FDA para el tratamiento del melanoma metastásico no resecable 19. Desde 2012 en Colombia se cuenta con aprobación por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) para el uso de este agente en paciente con diagnóstico de melanoma.
Los inhibidores de PD-1 que son reguladores negativos de la actividad de las células T, que se expresa con exposición excesiva a los antígenos, son medicamentos empleados en el tratamiento del melanoma. Su ligando primario, PD-L1, se expresa con frecuencia en células tumorales. El otro ligando, PD-L2, se expresa principalmente en las células presentadoras de antígeno. Ambos ligandos son miembros de la familia de proteínas B7. Han observado una asociación entre la sobreexpresión de PD-1 y PD-L1 en células tumorales. Lo que busca este agente es bloquear esta sobreexpresión 20.
El nivolumab es un anticuerpo monoclonal IgG4 de inmunoglobulina completamente humano dirigido contra PD-1 que logró aprobación regulatoria por la FDA en 2014 para el tratamiento del melanoma. El ipilimumab y el nivolumab en combinación ha mostrado tasas de respuesta del 57% con impacto en el periodo libre de enfermedad de hasta 11,5 meses, aunque con efectos tóxicos grado 3 y 4 en pacientes sometidos a este régimen 21. Estos dos agentes se encuentran disponibles en Colombia y cuentan con aprobación por el INVIMA para su uso.
El pembrolizumab es el segundo anticuerpo IgG4 completamente humanizado dirigido contra el receptor PD-1 que tiene aprobación regulatoria. Está aprobado por la FDA para múltiples tipos de tumores, incluyendo melanoma. El pembrolizumab ha mostrado mejores resultados objetivos en comparación con ipilimumab. En estudios realizados han mostrado una tasa de respuesta más alta (33,7%) en comparación con el ipilimumab (11,9%). El periodo libre de enfermedad a los 6 meses fue de casi 47% versus 26,5%, la supervivencia global a 12 meses fue de 74,1% para el pembrolizumab en comparación al 58,2% para el ipilimumab 22. Este agente también cuenta con registro INVIMA y se encuentra disponible en el país.
También se han empleado terapia dirigidas con inhibidores de mutaciones BRAF y MEK en el tratamiento del melanoma metastásico 16. El vemurafenib, el dabrafenib y el trametinib son medicamentos aprobados por la FDA para melanomas no resecable o metastásico que presentan mutaciones específicas en el dominio BRAF 23. Sin embargo, dada la baja prevalencia de las mutaciones de BRAF en melanoma de mucosas, es probable que la utilidad de estos nuevos tratamientos se limite a un pequeño subconjunto de pacientes. Estos agentes cuentan con registro INVIMA para su uso en el país desde 2016. Los inhibidores de 80 c-KIT incluyen: el imatinib, el sunitinib, el dasatinib, el nilotinib y el masitinib. Estos últimos se encuentran en ensayos clínicos para pacientes con melanomas avanzados que tienen mutaciones asociadas a 98 c-KIT. De los inhibidores de C-KIT, el imatinib ha sido el más investigado en melanoma. En dos ensayos fase II de terapia con el imatinib la mediana de tiempo hasta la progresión fue 2,8 a 3,7 meses, y la mediana de supervivencia global fue de 10,7 a 12,5 meses 24,25. El imatinib está regulado por el INVIMA para su uso en Colombia.
Se espera que esta publicación sirva de incentivo a los grupos de especialistas que manejan este tipo de diagnóstico para realizar estudios y ensayos clínicos que logren aportar información para la comprensión etiológica y el mejoramiento de estrategias de manejo que impacten en resultados oncológicos. Además, esta publicación cobra valor adicional por ser un caso de una patología infrecuente, que debe ser tenida en cuenta dentro del diagnóstico diferencial. Es importante reconocer que no se pudo profundizar la información sobre el abordaje inicial que se realizó a la paciente en su primer sitio de atención médica y que el tratamiento quirúrgico estuvo limitado por el estado general de la paciente y sus comorbilidades, lo que impactó en su supervivencia.
Se puede concluir que el melanoma maligno del cuello uterino es muy agresivo, ya que la recurrencia local y las metástasis de gran extensión generalmente ocurren dentro de un periodo corto de pocos meses desde el diagnóstico inicial 26. La presentación más frecuente de la recaída es local en vagina, vulva o de forma paralela a la línea de sutura, en contraste con las metástasis a distancia que son poco habituales, con esto se destaca el valor del examen clínico ginecológico como parte del seguimiento de rutina 26.
Independientemente del estadio y el tratamiento que se ofrezca, el pronóstico del melanoma maligno de cuello uterino es muy malo, ya que el 87,5% de los pacientes reportados en la literatura mueren dentro de los 36 meses posteriores al diagnóstico (22,9 meses de media de supervivencia global). Esto a pesar que el 41% de los casos se diagnostican en estadio I de FIGO 3. Las cifras de supervivencia a 5 años a nivel mundial se estiman en un 18,8% para el estadio I, de 11,1% para el estadio II y de 0% para los estadios III-IV 3,26. Aún no se ha logrado estandarizar el enfoque del tratamiento de esta entidad, esto probablemente debido al desconocimiento que se tiene en cuanto a su etiología y a su infrecuente presentación, por lo que no se pueden hacer conclusiones al respecto.
Aunque el tamaño del tumor primario, el estado negativo de los ganglios linfáticos y la ausencia de invasión del espacio linfovascular son factores que impactan en la supervivencia de esta entidad, el manejo de estos tumores poco frecuentes deben ser discutidos por un equipo multidisciplinario especializado y el enfoque inicial debe ser el manejo quirúrgico con intención curativa. La quimioterapia y la radioterapia adyuvantes, con o sin escisión quirúrgica, se reserva para controlar los síntomas locales y como tratamiento paliativo en estadios avanzados y recidivas de la enfermedad. La inmunoterapia y las terapias dirigidas son la herramienta terapéutica más prometedora en el manejo de esta entidad.
El objetivo más importante es diagnosticar el melanoma maligno del cuello uterino y ofrecer tratamiento en estadios tempranos. El examen pélvico de rutina y la inspección en cuello uterino deben formar parte de la evaluación clínica, especialmente en pacientes que presentan sangrado o flujo vaginal, pues es una herramienta valiosa para el diagnóstico precoz de esta patología.