Introducción
Los tumores de células germinales (TCG) de testículo constituyen la mayoría (95%) de los cánceres testiculares a nivel mundial, junto con otras neoplasias raras como los linfomas y los tumores del estroma gonadal 1. En las últimas 5 décadas se han logrado cifras de supervivencia muy elevadas en pacientes con TCG. La quimioterapia, la cirugía y la radioterapia, cuidadosamente aplicadas mediante estudios aleatorizados, han demostrado resultados curativos muy elevados en pacientes con TCG 1. Sin embargo, 30% de los pacientes con enfermedad metastásica recae después del primer tratamiento y, hasta ahora, las decisiones con relación al tratamiento de estos pacientes son sumamente complejas 2.
Los pacientes con enfermedad anatómicamente confinada con marcadores normales y dependiendo del sitio de recaída después de recibir quimioterapia inicial, pueden lograr su curación con una cirugía de rescate 3. Sin embargo, la mayoría de estos pacientes recaen con enfermedad metastásica diseminada y deben ser tratados con una quimioterapia de rescate, incluyendo quimioterapia a dosis convencionales o quimioterapia en altas dosis. La elección del tratamiento inicial para el cáncer testicular recidivante es controversial y uno de los mayores retos clínicos es determinar cuáles pacientes deben ser tratados con dosis convencionales de rescate vs quimioterapia a altas dosis 1. Los pacientes en estadios 2 y 3 que recaen ofrecen un gran reto en el tratamiento. Antes de iniciar el tratamiento, el médico oncólogo debe evaluar la histología inicial, los marcadores tumorales, la extensión y sitios de la enfermedad, el esquema de tratamiento previo y luego escoger un tratamiento óptimo 4.
Hay 2 grupos de pacientes con recaídas que requieren tratamientos especiales: a) los pacientes con teratoma creciente, condición que aparece durante o al finalizar la quimioterapia y b) los pacientes con recaídas tardías, con marcadores negativos Estos pacientes se benefician de la cirugía inmediata, que debe ser realizada por cirujanos oncólogos expertos en este tipo de procedimiento, sobre todo, con dominio del área retroperitoneal, tórax y por supuesto con experiencia en cirugía vascular 4.
Elementos malignos pueden encontrarse en los especímenes de patología, y el manejo clínico de estos pacientes constituye un reto para el grupo de trabajo 5.
En el escenario de pacientes con progresión durante una administración adecuada de quimioterapia, o lo que llamamos enfermedad refractaria, en lo posible deben ser tratados con protocolos que utilizan altas dosis de quimioterapia seguidos de la cirugía de rescate si presentan masas residuales.
En este artículo se realiza una revisión sobre el manejo de los TCG en primera recaída, ya que es importante tener una amplia experiencia clínica en la toma de decisiones para así aumentar la supervivencia de estos pacientes.
Métodos
La búsqueda de información se llevó a cabo en el periodo comprendido entre febrero y diciembre de 2019. Se consultaron bases de datos de Pubmed y Cochrane utilizando los términos MeSH y DeCS requeridos en idioma inglés (testicular cancer, germ cell tumor, non-seminomatous, relapse, treatment) y español (cáncer testicular, tumor de células germinales, no seminomatoso, recaída, tratamiento). Como criterios de inclusión se abordaron estudios con un número de por lo menos 15 pacientes con un seguimiento no menor de 2 años para los pacientes en primera recaída. Se revisaron 100 artículos -entre 1986 y 2019- de forma manual, seleccionándose 55 artículos de revisión, serie de casos y ensayos clínicos a través de un comité de 5 evaluadores expertos. Adicionalmente, se hizo una revisión de los tratamientos que se utilizan en pacientes con dos o más recaídas.
Evaluación del paciente antes del tratamiento de rescate
Los pacientes que recaen después de su manejo inicial deben ser claramente evaluados con la historia clínica, marcadores tumorales y estudios radiológicos.
Hay que ser lo más precisos para determinar la presencia de una recaída y debe establecerse con la determinación de la a-fetoproteína (AFP), la gonadotrofina coriónica humana (HCG) así como la LDH, con los estudios radiológicos 4. En nuestra opinión, es importante tener en cuenta que para el diagnóstico, manejo, pronóstico, tratamiento y seguimiento adecuados de los pacientes con TCG en recaída se debe hacer un uso racional de la tomografía axial computarizada y de los marcadores tumorales.
Se han observado elevaciones transitorias de los mismos con normalización espontánea. La evaluación cuidadosa y repetida por un profesional con experiencia determinará si dichos marcadores aumentan o se mantienen sin cambios, luego de los estudios apropiados para excluir el diagnóstico de enfermedad activa y así vigilar estos casos para evitar la quimioterapia innecesaria 6. Las alteraciones pulmonares, por la toxicidad debido al uso de bleomicina o manifestaciones de la sarcoidosis, pueden confundirse con enfermedad progresiva, mientras que el uso de la marihuana, la infección por mononucleosis infecciosa reciente y sustancias que causan reacciones cruzadas con la hormona luteinizante (LH) pueden elevar la HCG (2,7). Altos niveles de AFP pueden ser observados en alcoholismo, hepatitis, cirrosis y obstrucción biliar (8,9). En algunas familias se puede observar una elevación discreta de la AFP en el rango de 15 a 20 ng/ml (normal 0 a 8 ng/ ml) 10.
En algunas ocasiones, sobre todo cuando hay niveles muy elevados de la HCG antes del inicio de la quimioterapia, ésta puede descender marcadamente durante los primeros ciclos, luego hacer un plateau, para finalmente descender lentamente a niveles normales. Esta situación no debe confundirse con una respuesta incompleta al tratamiento, por lo que se debe esperar hasta que haya un claro incremento de la HCG para considerar que el paciente presenta una recaída 11. Por otra parte, la LDH no es específica para enfermedad y usualmente su valor refleja volumen tumoral 2.
La recaída en sitios santuarios, como el cerebro o la presencia de un segundo primario en el testículo contralateral, deben descartarse cuando se elevan los marcadores en ausencia de enfermedad radiológica progresiva 2.
Factores pronósticos en la primera recaída
En 1996, Beyer y colaboradores fueron los primeros en establecer los factores pronósticos para la respuesta y supervivencia de pacientes con tumores germinales recidivantes tratados con altas dosis de quimioterapia, logrando desarrollar un modelo de pronóstico en un estudio retrospectivo de 310 pacientes tratados con varios regímenes de altas dosis de quimioterapia en cuatro centros de tratamiento en Europa y Estados Unidos 12. Se observó que los factores asociados con resultados adversos fueron: tumores de células germinales no seminomatosos y primario mediastinal, HCG mayor o igual a 1000 UI/L, enfermedad progresiva antes del tratamiento con altas dosis de quimioterapia y enfermedad refractaria al cisplatino. Con estos factores se asignaron a tres grupos: buen pronóstico, intermedio o malo, con tasas de supervivencia libre de recaída del 51%, 27% y 5% respectivamente 12.
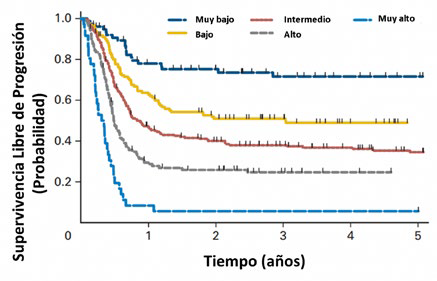
En 2010, el Grupo Internacional de Estudio de Factores Pronósticos 13, en un estudio multicéntrico en 38 centros de tratamiento europeos y americanos, desarrolló un modelo actualizado de los factores pronósticos adversos (Tabla 1) y de acuerdo con un análisis multifactorial y la jerarquía de cada uno de estos factores, permitió agruparlos de la siguiente manera: 1) tumores extragonadales; 2) respuesta completa e incompleta con normalización de los marcadores; 3) respuesta incompleta sin normalización los marcadores y enfermedad estable; 4) enfermedad progresiva; 5) intervalo libre de enfermedad menor de 3 meses; 6) elevación de la alfafetoproteina a más de 1000 ng/ml; 7) elevación de la HCG a más de 1000 U/lt y 8) presencia de metástasis hepáticas, óseas o cerebrales en la terapia de rescate. En este estudio, los pacientes con TCG en recaída se agruparon en diferentes categorías (0) = 0; (1 o 2 factores) = 1; (3 o 4) = 2 y (5 o más factores) = 3 (Tabla 1) De acuerdo con las posibilidades de recaída, estos grupos se clasifican en: muy bajo riesgo (-1), bajo riesgo (0), riesgo intermedio (1), alto riesgo (2) y muy alto riesgo (3).
Tabla 1 Score pronóstico para pacientes con Tumores de células germinales (seminoma y no seminoma)
| Parámetro | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Tu primario | Gonadal | Extragonadal | Mediastinal No seminoma | |
| Respuesta previa | RC/RP (-) | RP (+) / EE | EP | - |
| ILP (meses) | >3 meses | < 3 meses | - | |
| AFP | Normal | < 1000 | > 1000 | - |
| HCG | < 1000 | > 1000 | - | |
| HOC | No | Si | - |
Sumatoria del Score (Validación de 0 a 10 puntos)
Categoría de acuerdo a la sumatoria del Score: 0 = 0 puntos, Categoría 1 = 1-2 puntos, Categoría 2 = 3-4 puntos, Categoría 3 = 5 o más puntos.
Añadir puntuación al Score: Seminoma puro = - 1 punto; No seminoma o Tu Mixto = 0 puntos.
Score Pronóstico final: (-1 punto = Muy Bajo Riesgo; 0 puntos = Bajo Riesgo
1 punto = Riesgo Intermedio; 2 puntos = Alto Riesgo; 3 puntos = Muy alto riesgo
Abrevaturas: ILP: intervalo libre de progresión; RC: respuesta completa; RP (-): respuesta parcial con normalización de los marcadores; RP (+): respuesta parcial sin normalización de los marcadores; EP: enfermedad progresiva; HOC: metástasis hepáticas, óseas, y/o cerebrales
Tomado de Prognostic factors in Patients with Metastatic Germ Cell Tumors who Experience Failure w'th first Line Chemotherapy Cisplatin based chemotherapy: The International prognostic factors Study Group J Clin Oncol 28:4906-4911; 2010. Traducción propia.
Se ha establecido que los pacientes con seminoma puro tienen mejor pronóstico, por lo tanto son considerados de muy bajo riesgo (-1).
Los factores pronósticos adversos más importantes fueron la presencia de tumor mediastinal en pacientes con tumores no seminomatosos y luego la elevación de la alfa fetoproteina >1000 ng/ml, así como enfermedad progresiva antes del tratamiento de rescate (Tabla 1) 13. La Tabla 2 muestra la supervivencia libre de progresión y la superviviencia global de acuerdo con las categorías pronósticas.
Lo importante de ese análisis fueron los criterios estrictos de elegibilidad y la utlización de quimioterapia moderna de primera línea, así como el uso de quimioterapia eficaz de rescate. Se excluyeron pacientes que recibieron quimioterapia de intensificación en primera línea y se eligieron solo pacientes que presentaron documentación inequívoca de enfermedad progresiva antes del tratamiento de rescate.
Aunque se trató de un estudio retrospectivo, y se utilizaron diferentes tipos de tratamientos de acuerdo al centro de referencia, este análisis de sobrevida libre de enfermedad y sobrevida global permitió establecer diferentes categorías pronósticas.
Se llevó a cabo en múltiples centros de diferentes países con experiencia en el tratamiento de pacientes con TCG, lo cual hizo posible que la parcialización por un determinado tratamiento fuera menos probable.
Los pacientes con las categorías pronósticas intermedio, alto y muy alto presentaron una supervivencia libre de enfermedad y supervivencia global igual o menor de 40,1% y 58,3% respectivamente (ver Tabla 2).
Tabla 2 Tasas de Supervivencia de acuerdo a Categorías pronósticas
| Tasas de Supervivencia de acuerdo a Categorías Pronosticas | |||||||
|---|---|---|---|---|---|---|---|
| Categoría Pronostica | Score | N° Pacientes | % | HR | 95% IC | SLP 2 años | SG 3 años |
| Muy bajo | -1 | 76 | 13,0 | 1 | 75,1 | 77,0 | |
| Bajo | 0 | 132 | 22,6 | 2,17 | 1,32 a 3,58 | 51,0 | 65,9 |
| Intermedio | 1 | 219 | 37,4 | 3,20 | 2,00 a 5,11 | 40,1 | 58,3 |
| Alto | 2 | 122 | 20,9 | 4,85 | 2,98 a 7,89 | 25,9 | 27,1 |
| Muy Alto | 3 | 36 | 6,1 | 11,70 | 6,70 a 20,45 | 5,6 | 6,1 |
| Sin clasificación | 69 | ||||||
Abreviaturas: SLP: supervivencia libre de progresión; SG: Supervivencia global; HR: hazard ratio.
Tomado de "Prognostic factors in patients with metastatic germ cell tumors who experience failure with first line chemotherapy cisplatin based chemotherapy: The International prognostic factors Study Group J Clin Oncol 28:4906-4911; 2010." Traducción propia. Abreviaciones: SLP 2 sobrev'da libre de progresión a los 2 años.El hazard rate fue calculado para la sobrevida libre de progresión a los 2 años, SG 3 sobrevida Global a los 3 años.
La Figura 1 mostró la curva de sobrevida libre de progresión de acuerdo al método de Kaplan y Meier.
Quimioterapia a dosis convencionales
Dependiendo de los factores pronósticos, la quimioterapia a dosis convencionales puede rescatar del 13 al 68 % de los pacientes en recaída. Los esquemas de tratamiento que combinan cisplatino e ifosfamida con etopósido (VIP), vinblastina (VelP) o paclitaxel (TIP) tienen la misma eficacia.(14,15,16). Hasta ahora, cuatro ciclos de cisplatino/ifosfamida/ paclitaxel,cisplatino/ifosfamida/etopósido, o cisplatino/ifosfamida/vinblastina deben considerarse como la primera opción para la quimioterapia a dosis convencionales dependiendo del tratamiento previo (Tabla 3) 4.
Tabla 3 Regímenes de Quimioterapia más utilizados
| Régimen | Dosis | Aplicación | Número de ciclos |
|---|---|---|---|
| VIP | |||
| Cisplatino | 20mg/m2 | IV Día 1 al día 5 | 4 cada 21 días |
| Ifosfamida+Mesna | 1.2 g/m | IV Día 1 al día 5 | |
| Etoposido | 80 mg/m2 | IV Día 1 al día 5 | |
| VelP | |||
| Cisplatino | 20mg/m2 | IV Día 1 al día 5 | 4 cada 21 días |
| Ifosfamida +Mesna | 1.2 gm/m2 | IV Día 1 al día 5 | |
| Vinblastina | 0.11mg/kg | IV Día 1 y día 2 | |
| TIP | |||
| Cisplatino | 20mg/m2 | IV Día 1 al día 5 | 4 cada 21 días |
| Ifosfamida +Mesna | 1.2 gm/m2 | IV Día 1 al día 5 | |
| Paclitaxel | 200/m2 | IV 24 H día 1 | |
Mesna 240 mg/m2-300mg/m2 IV en 15 minutos antes de la administración de la Ifosfamida,hora 4 y hora 8.
Dependiendo de los factores pronósticos, los regímenes empleados a dosis convencionales no son claramente superiores entre si (14,18,19,20).
Se destaca la experiencia del Hospital Memorial de Nueva York, en 43 pacientes con primario gonadal, que habían obtenido una respuesta completa con la primera línea de tratamiento; fueron tratados con 4 ciclos con el esquema TIP (paclitaxel, ifosfamida y cisplatino) y se logró un 63% de remisiones con un segimiento medio de 69 meses. El elevado número de respuestas completas (70%) enfatiza la selección de los pacientes de acuerdo con los factores pronósticos antes del tratamiento para obtener resultados favorables utilizando dosis convencionales de quimioterapia 14.
En un ensayo clínico en fase II, donde se estudió el uso de la quimioterapia TIP por cuatro ciclos como quimioterapia de rescate en pacientes con TCG metastásico con recaída al tratamiento inicial BEP (bleomicina, etopósido y cisplatino), se observó una respuesta favorable del 60% con una tasa de supervivencia al año del 70% en 43 pacientes evaluables para respuesta. El 38 % de los pacientes se encontraba libre de enfermedad al año. El grupo de pacientes de buen pronóstico de este estudio obtuvo resultados similares a los obtenidos por el Grupo del MSKCC 14 a pesar de que se utilizó una dosis menos intensa de quimioterapia y no se utilizó factor estimulante de colonias de granulocitos de rutina.16
Recientemente, se publicó un estudio en fase I/II con el objetivo de mejorar la tasa de respuesta y duración del régimen TIP agregando gemcitabina (Gem-TIP) en 20 pacientes con TGC en recaída luego de recibir cisplatino. La dosis máxima tolerada de gemcitabina fue 1200 mg/m2 con una tasa de respuesta completa global del 50% y una supervivencia del 68%. Se concluyó que la gemcitabina se puede agregar a la quimioterapia TIP, con una tolerancia aceptable y sin comprometer la intensidad de la dosis de los otros medicamentos 17. Estos resultados deben comprobarse en un número mayor de pacientes.
No hay ningún estudio prospectivo que haya comparado TIP con VeIP. En nuestra opinión, cualquiera de estos dos regímenes de quimioterapia puede ser utilizado en segunda línea cuando se utilizan dosis convencionales de quimioterapia. En la Tabla 4 se describen diferentes Instituciones con experiencia en el tratamiento de pacientes con fallas al tratamiento de primera línea. En nuestra opinión, cuando se utilizó quimioterapia a dosis convencionales se obtuvo una supervivencia libre de enfermedad similar con los esquemas utilizados y probablemente las diferencias se debieron a los factores de riesgo antes del tratamiento de segunda línea.
Tabla 4 Resultados de los distintos protocolos de rescate en segunda línea en tumores germinales recurrentes
| Resultados de los distintos Protocolos de Rescate en Seguridad Línea, en Tumores Germinales Recurrentes | |||
|---|---|---|---|
| Protocolo QT | Institución | N° Pacientes | Tasa de Remisión Durable |
| VeIP | IU | 135 | 23.7% |
| VeIP/VIP | MSKCC | 56 | 23% |
| VeIP/VIP | EBMT | 128 | 35% |
| Paclitaxel | AASKCC | 31 | 13% |
| TIP | MSKCC | 46 | *63% |
| TIP | MRC | 43 | 36% |
| TIP | Esloveno | 17 | 47% |
| VIP.VeIP->ADQT | EBMT | 135 | 42% |
| IVIP.VeIP->ADQT | IU | 136 | 68% |
| TIP->ADQT | Aleman | 62 | 25% |
| TIP + Gem | UHS | 20 | 68% |
*Grupo de pronóstico favorable, de primario testicular que tuv'eron respuesta completa previo a recaída.
Abreviaturas: ADQT: altas dosis de quimioterapia; VeIP: vnblastina, ifosfamida y cisplatino; VIP: etopósido, ifosfamida y cisplastino; TIP: paclitaxel, ifosfamida y cisplastino. Gem: gemcitabina
Tomado de Sonpavde G, Hutson T and Roth B. Management of Recurrent Testicular Germ Cell Tumors. The Oncologist 12:51-61;2007. Modificación y traducción propia.
La experiencia de la Universidad de Indiana se destaca con un 68% de sobrevida global con la aplicación de altas dosis de quimioterapia.
Altas dosis de quimioterapia
En la Universidad de Indiana, altas dosis de quimioterapia con el uso de células precursoras han sido utilizadas desde 1986. La sustitución de las células precursoras de la médula ósea por la utilización de células precursoras periféricas logró que el procedimiento fuera menos costoso y menos complicado 19. Sin embargo, el uso de altas dosis de quimioterapia en primera línea de rescate es controversial. En un estudio retrospectivo llevado a cabo desde febrero de 1996 a diciembre de 2004 en la Universidad de Indiana se usaron células precursoras de la médula ósea para rescatar el sistema hematopoyético luego de altas dosis de quimioterapia 19. Se observó que de 135 pacientes que recibieron el tratamiento de segunda línea, 94 (70%) tuvieron probabilidades de supervivencia a largo plazo en los diferentes grupos pronósticos. Este régimen puede usarse en tercera línea y en líneas sucesivas de tratamiento en pacientes con enfermedad refractaria al platino 19.
En 2005, un ensayo clínico en fase III (IT94) comparó dosis convencionales de quimioterapia con altas dosis de quimioterapia entre febrero de 1994 y septiembre de 2001 en 280 pacientes de 43 instituciones de 11 países, siendo asignados de forma aleatoria para recibir cuatro ciclos de cisplatino, ifosfamida y etopósido (o vinblastina) o tres ciclos con la misma combinación seguidos de un ciclo de altas dosis de carboplatino, etopósido y ciclofosfamida (CarboPEC) con soporte de células madre hematopoyéticas. Este estudio concluyó que no se encontró una mejoría en la supervivencia global con la utilización de un solo ciclo de altas dosis de quimioterapia con carboplatino, etopósido y ciclofosfamida. Las tasas de remisión duraderas fueron similares en ambos grupos. Las muertes por toxicidad representaron el 3% en el grupo que recibió el VIP o VeIP, y 7% en el grupo de pacientes que recibieron altas dosis de quimioterapia. La supervivencia global fue de 53% en ambos grupos 20.
En un estudio de 2007, que tuvo como objetivo evaluar la dosis óptima de carboplatino, así como la eficacia y la tolerancia de la quimioterapia secuencial utilizando dosis convencionales de paclitaxel e ifosfamida seguida de 3 ciclos de tratamiento con altas dosis de carboplatino y etopósido en 48 pacientes con factores pronósticos adversos, se confirmó una buena tolerancia y eficacia del tratamiento con una supervivencia a los 5 años del 51% 21.
Posteriormente en el año 2011, un grupo internacional de investigadores comparó retrospectivamente dosis convencionales de quimioterapia con altas dosis de quimioterapia en pacientes en primera recaída.
Concluyeron que las altas dosis de quimioterapia fueron superiores en todos los grupos pronósticos excepto en los pacientes de bajo riesgo con respecto a supervivencia global 22. El tratamiento con altas dosis de quimioterapia logró mejores resultados.
La Universidad de Indiana realizó un análisis actualizado donde se trataron 364 pacientes con TCG recidivantes con altas dosis de quimioterapia y trasplante autólogo de células madre de sangre periférica entre 2004-2014. Se observó que existió una supervivencia libre de progresión del 60% y una supervivencia global del 66% a los dos años. La tasa de mortalidad relacionada con este tratamiento fue del 2,5°% 23.
En 2014 se publicó un estudio australiano con el objetivo de evaluar el tratamiento TI-CE que consistió en una combinación de taxol e ifosfamida seguido de altas dosis de quimioterapia con carboplatino y etopósido seguido de trasplante de células madre en 17 pacientes con TCG recidivante. Este estudio demostró resultados alentadores con una sobrevida libre de progresión y una sobrevida global de 59% y 71% respectivamente a los dos años. Se logró una sobrevida del 90% para quienes recibieron este tratamiento durante la primera recaída 24.
El uso de un solo ciclo de VIP seguido de 3 ciclos de altas dosis de quimioterapia provee un beneficio similar a tres ciclos de VIP seguido de 1 ciclo de altas dosis de quimioterapia; sin embargo, la metodología del estudio y las muertes tóxicas pueden ser responsables por los resultados 25. Añadir otro medicamento como la ifosfamida o la ciclofosfamida al régimen de altas dosis de quimioterapia ha resultado en una toxicidad importante específicamente a nivel del riñón 20.
No se han realizado ensayos clínicos aleatorizados en fase III que demuestren que altas dosis de quimioterapia en ciclos sucesivos o más, deban ser utilizadas como tratamiento de rescate de segunda línea; sin embargo, un estudio multicéntrico retrospectivo de 1594 pacientes que progresaron después de un tratamiento inicial basado en Cisplatino, clasificó los pacientes de acuerdo a factores de riesgo en: muy bajo riesgo, bajo riesgo, riesgo intermedio, alto riesgo y muy alto riesgo. Las tasas de curación fueron comparadas entre los pacientes que recibieron altas dosis de quimioterapia o dosis convencionales. El tratamiento con altas dosis fue superior en todos los grupos exceptuando los pacientes de bajo riesgo 25.
El estudio TIGER 26 es una colaboración internacional que agrupa muchos centros de América del Norte, Europa y Australia con el objetivo de determinar cuál sería el enfoque óptimo de la quimioterapia de rescate inicial en pacientes con TCG avanzado. Está investigando si el uso de quimioterapia TI-CE con paclitaxel e ifosfamida por 2 ciclos seguido de 3 ciclos de una alta dosis de carboplatino y etopósido es superior a las dosis convencionales de quimioterapia. Estos pacientes tratados con dosis convencionales reciben 4 ciclos de quimioterapia con el régimen TIP (26,27). Este estudio ya se encontraba en curso con un avance del 16% para principios de 2017 y se espera que los resultados puedan establecer definitivamente si las dosis convencionales o las altas dosis de quimioterapia deben utilizarse en pacientes con una primera recaída 27. Sin embargo, este estudio no va a definir el número óptimo de ciclos a utilizar con altas dosis de quimioterapia ni el subgrupo de pacientes que se van a beneficiar de un número determinado de ciclos como lo han afirmado investigadores del grupo suizo 28. En la Tabla 5 se observan diferentes experiencias con la utilización de altas dosis de quimoterapia.
Tabla 5 Resultados de los distintos protocolos de quimioterapia a altas dosis en tumores germinales recurrentes
| Autor | Año | Institución | N | QT | Dosis | Ciclos | Tasa de remisión con duración de más de 2 años % |
|---|---|---|---|---|---|---|---|
| Einhorn 18 | 2007 | IUMC | 184 | Carboplatino Etopósido | 700 mg/m2 750 mg/m2 | 2 | 41 |
| Pico 21 | 2005 | IGR | 280 | PEI or VeIP vs PEI o VeIP seguido de CarboPEC |
Carboplatino EV día 1, Etopósido 450 mg/m2/día, EV, Ciclofosfamida 1600 mg/m2/día, EV) y mesna (3600 mg/m2/día. mg/m2/day día1-día 4 |
4 | 53 |
| Kondagunta GV 22 | 2007 | MSKCC | 48 | TI-CE |
Paclitaxel 200 mg/m2 EV por 24 h. Día 2-4: Ifosfamida 2 g/m2/d con protección mesna, Carboplatino según AUC Etopósido 400 mg/m2 EV x3 |
2 Paclitaxel e Ifosfamida 3 Carboplanitno y Etopósido. |
51 |
| Adra 24 | 2017 | IUMC | 364 | Carboplatino + Etopósido | Carboplatino 700 mg/m2 y Etopósido 750 mg/m2 x 3days | 2 | SLP 66% A los dos años |
| Lewin 25 | 2014 | PMCC | 17 | TI-CE | Paclitaxel 200 mg/m2 día 1 / ifosfamida 2 g/m2/ día 2-4 seguida de carboplatino (AUC dividida en 3. dosis/etopósido (400 mg/m2/día 1-3 |
2 Paclitaxel e Ifosfamida 3 Carboplanitno y Etopósido. |
59 % SLP 71 % SG |
TICE: Paclitaxel e Ifosfamida seguido de Carboplatino y Etopósido. MSKCC Memorial Sloan-Kettering Cancer CentEV: endovenoso, ABC: área bajo la curva. IGR: Institute Gustave Roussy. SGH: Southampton General Hospital
PMCC: Peter MacCallum Cancer Centre. IUMC: Indiana University Medical Center, MBSCC: Melvin and Bren Simon Cancer Center, UHS: University Hospital Southampton NHS Foundation Trust. NR: No reportado.
En Venezuela, actualmente se utilizan dosis convencionales de quimioterapia con VeIP, VIP o TIP en primera recaída.
Segundas y posteriores recaídas
En los pacientes que presentan enfermedad refractaria o recidivante a los dos primeros esquemas de tratamiento a dosis convencionales y cuando no se disponga de tratamiento con altas dosis de quimioterapia hemos utilizado el esquema EP/OMB, que consiste en la administración de etopósido 200 mg/m2 IV y cisplatino 100mg /m2 con metotrexate intratecal alternando cada 8 a 10 días con vincristina 1 mg/m2, metotrexate 1 gm/m2 día 1 seguido de leucovorin 32 horas del inicio del metotrexate y bleomicina 10 mg/m2 IV en 24 horas día 2. Este tratamiento ha sido utilizado en pacientes con metástasis cerebrales con resultados aceptables 29. Sin embargo, se recomienda que en los casos de múltiples recaídas cada paciente sea individualizado según sus características y el tratamiento previo recibido. Aunque se pueden lograr remisiones a largo plazo y curaciones, las probabilidades de curación son bajas en pacientes que presentan recaídas múltiples (30,31). Varias combinaciones dobles de agentes activos como gemcitabina, oxaliplatino, paclitaxel e irinotecan han sido probados en ensayos clínicos recientes (32-36) (ver Tabla 6).
Tabla 6 Resultados de los distintos protocolos de quimioterapia en segundas y posteriores recaídas
| Autor | Año | Institución | N | QT | Dosis | Ciclos | Tasa de remisión durable % |
|---|---|---|---|---|---|---|---|
| Pectasides (32) | 2004 | AUH | 18 | Oxaliplatino Irinotecan | 85 mg/m2 día 1-15 80 mg/m2 | 6 | 17 |
| Pectasides (33) | 2004 | AUH | 26 | Gemcitabina Oxaliplatino (GEMOX) | 1000mg/m2 días 1-8 130mg/m2 1 día c/3sem | 6 | 14 |
| Theodore (34) | 2004 | IGR | 26 | Oxaliplatino (Ox) combinado con paclitaxel | 130 mg/m2 85mg/m2 | 3 | 8 |
| Miki (35) | 2002 | KUMS y OMCC | 18 | Irinotecan Cisplatino Nedaplatino | 100-200 mg/m2 20mg/m2x5 | 5-4 | 53 a los 5 años |
| De Giordi (36) | 2006 | IOR | 18 | Gemcitabina Oxaliplatino | 1250mg/m2 días 1-8 130mg/m2 1 día c/3sem | 3 | 17 |
| Lorch (37) | 2010 | UGM | 49 | Cisplatin Etopósido Ifosfamida Paclitaxel | 20 mg/m2 x 5 75 mg/m2 x5 1.2 g/m2 x 5 (VIP) (TIP) 175 mg/m2 | 3 | 17 |
| Mulherin (38) | 2015 | IUSCC | 32 | Paclitaxel Gemcitabina | 100 mg/m2 1000 mg/m2 Días 1,8 y 15 c/4sem | 6 | 12,5 |
| Kollmansberger (39) | 2004 | UMTC | 35 | Gemcitabina Oxaliplatino | 1000 mg/m2 (día 1, 8) 30 mg/m2 (día 1)c/21 d | 2 | 46 |
| Hinton (40) | 2002 | IUMC | 10 | Paclitaxel Gemcitabina | 110 mg/m2 1000 mg/m2 (días 1, 8, 15; c/28 d) | 6 | 30 |
| Nicolai (41) | 2009 | IRCCS | 22 | Paclitaxel Cisplatin Gemcitabina | 80 mg/m2, 50 mg/m 2 800 mg/m2 Los días 1 y 8, cada 3 sem | 4 | 18 |
| Bokemeyer (42) | 2007 | UMCE | 41 | Paclitaxel Gemcitabina Cisplatin | 80 mg/m2 800mg/m2 800mg/m2 (ambos días 1-8) 130mg/m2 (c/21d) | 2 | 17 |
| Einhorn (43) | 2007 | IUMC | 32 | Paclitaxel Gemcitabine | 100 mg/m2 1,000 mg/m2 | 6 | 5 |
| Bedano (44) | 2006 | IUMC | 30 | Cisplatino Epirubicin | 20 mg/m2 días 1-5 c/3 sem. 90 mg/m2 día 1 c/3 sem. | 4 | 59 % |
| Miller (45) | 1990 | IUMC | 22 | Etopósido | 50mg/m2 Vo | 3 | - |
| Maroto (46) | 2011 | UGM | 20 | Temozolomida | 130mg/m2 por 5 días c/4 sem | 4 | 10 |
| Jain (47) | 2014 | IUMC y MBSCC | 29 | Oxaliplatino y Bevacizumab Bevacizumab | 85 mg/m2 al inicio reajustado a 65 mg/m2 10 mg/kg c/2sem | Hasta 14 ciclos | Duración media de la respuesta 5 meses |
| Oechsle (48) | 2010 | UMCE | 4 | Lenalidomida | 25 mg en los días 1-21 | Día 1-21 de un ciclo de 28 días | - |
| Adra (51) | 2018 | IUMC | 12 | Pembrolizumab | 200 mg c/3sem | 3 | - |
AUH: Attikon University Hospital, KUMS: Kyoto University Medical School, OMCC: Osaka Medical Center for Cancer, IOR: Instituto Oncológico Romagnolo, IGR: Institute Gustave Roussy, UTMC: University of Tuebingen Medical Center, IUMC: Indiana University Medical Center, Fondazione IRCCS Istituto Nazionale di Tumori, UMCE: University Medical Centre Eppendorf, UGM: University of Giessen and Marburg, IUSCC: Indiana University Simon Cancer Center
Un estudio con altas dosis de quimioterapia que se realizó en pacientes con segundas recaídas o más, demostró que las probabilidades de curación eran menores al 20%. Las altas dosis de quimioterapia se recomiendan en pacientes que han fallado al tratamiento con dosis convencionales 37. En los últimos años, se ha utilizado el tratamiento basado en la combinación de gemcitabina y oxaliplatino con o sin paclitaxel en pacientes con múltiples recaídas, logrando de 7 a 18% de remisiones duraderas +/-cirugía de las masas residuales 38,39,40, con una toxicidad aceptable; sin embargo, estos resultados deberían mejorarse.
Se ha utilizado la combinación de paclitaxel, cisplatino y gemcitabina que ha logrado remisiones prolongadas mayores de 2 años en el 18% de los pacientes 41. Bokemeyer y colaboradores utilizaron la combinación de gemcitabina, oxaliplatino y paclitaxel después de un seguimiento medio de 5 meses (rango 0-20) y 15% de los pacientes se mantuvieron en remisión completa con una duración media de 8 meses (1 a 17+). Las toxicidades más importantes grado 3 / 4 fueron anemia (7%), leucopenia (15%) y trombocitopenia (49%) 42. En el año 2016, el grupo de Indiana publicó un régimen de quimioterapia curativa (sin platino) utilizando paclitaxel y gemcitabina en 32 pacientes con TCG recidivantes luego de recibir quimioterapia de altas dosis, observándose un 12,5% de tasa de supervivencia a largo plazo 43.
En un estudio de 30 pacientes, tratados previamente con quimioterapia de rescate, el uso de epirubicina y cisplatino logró respuestas mayores en el 23 % de los pacientes con epirubicina y cispaltino +/-resección de las masas residuales 44. El etopósido como agente único en pacientes con tumores de células germinales refractarios ha logrado un 14% de respuestas duraderas 45. La temozolomida también se ha utilizado en pacientes con tumores de células germinales. En un estudio de 20 pacientes intensamente tratados con esquemas múltiples a base de cisplatino, se administró temozolomida a la dosis de 150 mg/m2 x 5 días pudiendo escalarse a 200mg/ m2 x 5 días si no hubiese toxicidad grado 2. Dos pacientes presentaron respuestas de 3,5 y 9 meses (10% de respuestas globales) con una supervivencia libre de progresión y una supervivencia global de 1,5 y 3,1 meses respectivamente 46. Se ha utilizado la combinación de oxaliplatino y bevacizumab en pacientes previamente tratados con altas dosis de quimioterapia obteniéndose un 27,6 % de respuestas incluyendo una respuesta completa 47.
El inmunomodulador y anti angiogénico lenalidomida también se ha utilizado en pacientes con tumores de células germinales y múltiples recaídas. En el año 2009 se publicó una serie de casos sin ninguna otra opción de tratamiento, donde se administró 25 mg VO días 1-21, en ciclos de 28 días a cuatro pacientes con múltiples recaídas después de quimioterapia basada en platino. Luego de 4 semanas todos los pacientes presentaron enfermedad progresiva con un incremento de los marcadores séricos y progresión en la tomografía axial computarizada. Concluyeron que es un tratamiento que se tolera bien pero carece de eficacia en aquellos pacientes con TCG recidivantes que han sido tratados anteriormente con cisplatino 48.
El papel de los tratamientos dirigidos a objetivos moleculares ha sido evaluado en pacientes que no han respondido o han recaído después de la utilización de los esquemas que se han utilizado en primera o recaídas posteriores. Sunitinib fue utilizado en pacientes previamente tratados y solo se logró estabilización de la enfermedad en 5 de 10 pacientes tratados. El resto de los pacientes presentó enfermedad progresiva 49. Everolimus fue utilizado en 26 pacientes de 6 centros alemanes a la dosis de 10 mg diarios y después de 12 semanas no se observó ninguna respuesta, la supervivencia libre de progresión fue de 0% y solo un paciente presentó enfermedad estable. Se concluyó que el everolimus no era activo en pacientes con tumores de células germinales intensamente tratados o con enfermedad refractaria 50. Los primeros resultados de un estudio fase II que utilizó el pembrolizumab, un anticuerpo Anti-PD1, no demostró actividad importante de este medicamento como agente único 51.
Brentuximab vedotin es un anticuerpo conjugado que combina un agente antitubular con un anticuerpo monoclonal anti CD-30 específico, que ha sido evaluado en tumores de células germinales refractarios CD-30 positivos. Un estudio publicado en el año 2017, que incluyó siete pacientes con TCG o tumores de los cordones sexuales logró dos respuestas: una respuesta completa duradera y otra parcial. Los pacientes que respondieron satisfactoriamente fueron aquellos con TCG con un perfil de toxicidad muy bajo, siendo una opción para el manejo de esta patología de difícil manejo 52. Sin embargo, se recomienda que en los casos de múltiples recaídas cada paciente debe ser individualizado según sus características y el tratamiento previo 4.
Discusión
El tratamiento de los pacientes con tumores de células germinales de primera línea depende de la histología, estadio clínico y marcadores tumorales. Generalmente, se requiere una combinación de medicamentos como el etopósido y cisplatino con o sin bleomicina y la cirugía para resecar las masas residuales. Esta estrategia permite la curación de la mayoría de los pacientes con tumores de células germinales 1.
30% de los pacientes con enfermedad metastásica recaen y representan un reto para el grupo multidisciplinario que se encarga de manejar estos pacientes 2.
Los factores pronósticos más importantes antes del tratamiento de rescate son la presencia de tumores mediastinales extragonadales, respuesta al tratamiento inicial, intervalo libre de enfermedad, niveles elevados de Alfa fetoproteina y HCG, así como la presencia de metástasis cerebrales, hepáticas y óseas 13.
El debate que se presenta hoy en día es si los pacientes en recaída deben recibir dosis convencionales o altas dosis de quimioterapia con apoyo de células madre, tomando en cuenta los factores de riesgo y si hay algún subgrupo de pacientes que pueda recibir dosis convencionales de quimioterapia y así poder prescindir de estos tratamientos con altas dosis que tienen una morbilidad y mortalidad importantes, así como un costo muy elevado.
Al existir pocos estudios aleatorios 20,25 de pacientes que presentan una recaída después del tratamiento inicial o con enfermedad refractaria, la utilización de quimioterapia en altas dosis en este momento se basa fundamentalmente en estudios retrospectivos.
La utilización de un tercer antineoplásico, como la ciclofosfamida adicional al carboplatino y al etopósido utilizados en el tratamiento de altas dosis después de tres ciclos de VeIP/VIP, pudo ser responsable de la toxicidad y de haber logrado resultados similares a 4 ciclos de VeIP/VIP 20.
La metodología del estudio y la utilización de varios ciclos de inducción antes del tratamiento con altas dosis puede ocasionar mayor toxicidad y resultados inferiores 25.
Un estudio retrospectivo que comparó dosis convencionales de quimioterapia con altas dosis de quimioterapia en pacientes en primera recaída concluyó que la supervivencia global fue superior con las altas dosis de quimioterapia en todos los grupos pronósticos, excepto en los pacientes de bajo riesgo 22. Sin embargo, las cifras bajas de supervivencia libre de enfermedad y supervivencia global en pacientes con riesgo intermedio, alto y muy alto requiere de nuevos tratamientos capaces de mejorar la supervivencia de este grupo de pacientes.
Es importante reconocer la labor del grupo de Indiana comandado por el Doctor Einhorn, quienes han realizado un esfuerzo sostenido durante muchos años en el estudio de esta enfermedad (19, 23). Ellos realizaron un análisis actualizado donde trataron 364 pacientes con TCG recidivantes o refractarios con 2 ciclos de altas dosis de carboplatino/etopósido y trasplante autólogo de células madre de sangre periférica entre 2004-2014. Se observó que existió una supervivencia libre de progresión del 60% y de supervivencia global del 66% a los dos años. La tasa de mortalidad relacionada con este tratamiento fue del 2,5% 23. En un análisis de multivarianza, los factores pronósticos fueron: tratamiento con altas dosis de quimoterapia en la segunda recaída vs tercera recaída o más; sensiblidad al cisplatino, situación del primario, histología, riesgo de acuerdo a la clasificación internacional (IGCCCG) antes del tratamiento inicial y hCG mayor de 1000 MIU/ml 23.
Sin embargo, no hay suficiente evidencia basada en estudios prospectivos de que altas dosis de quimioterapia son superiores a dosis convencionales. El estudio TIGER va a permitir conocer si el uso de quimioterapia con paclitaxel e ifosfamida por 2 ciclos, seguido por 3 ciclos de alta dosis de carboplatino y etopósido es superior a las dosis convencionales de quimioterapia con el régimen TIP por 4 ciclos 26. Sin embargo, este estudio no va a definir el número óptimo de ciclos a utilizar con altas dosis de quimioterapia.
Se piensa que estos pacientes con tumores de células germinales en primera recaída deben ser tratados por grupos multidisciplinarios con experiencia en el manejo de pacientes en recaída y enfermedad refractaria; deben ser manejados por centros de excelencia en el manejo de tumores de células germinales.
En nuestra opinión, los pacientes con riesgo intermedio, alto y muy alto de recaída de acuerdo a Lorch y colaboradores 22, deben ser tratados con protocolos de altas dosis de quimioterapia hasta que se disponga de mejor evidencia de acuerdo con nuevos estudios prospectivos y aleatorios.
Es muy importante no solo conocer los factores pronósticos antes del tratamiento sino considerar la situación temporal, anatómica y bioquímica en el momento de la recaída.
En nuestro país, sin embargo, no se dispone de recursos para tratar a nuestros pacientes con factores adversos con altas dosis de quimioterapia y deben ser tratados con dosis convencionales de quimioterapia con VeIP, VIP o TIP que son los regímenes de quimioterapia que han logrado mejores resultados. El grupo de la Universidad de Indiana logró un porcentaje de 23,7% de pacientes libres de enfermedad con un mínimo de seguimiento de 6 años y con la utilización del régimen VeIP (vimblastina, ifosfamida y etoposido) en pacientes tratados previamente con esquemas de tratamiento basados en etopósido y cisplatino. Ninguno de los pacientes con tumores extragonadales seminomatosos obtuvo una respuesta completa 53.
No hay estudios prospectivos que hayan comparado el régimen TIP con el régimen VeIP en pacientes en primera recaída que hayan recibido tratamiento de primera línea basado en Etopósido y Cisplatino. Un estudio prospectivo podría aclarar cuál de estos dos tipos de tratamiento es superior.
TIP o VeIP podrían ser alternativas cuando se utlizan dosis convencionales de quimioterapia.
Se necesita investigar acerca de nuevos tratamientos en pacientes con segundas y posteriores recaídas. Los análisis contemporáneos han definido las principales características moleculares de los tumores de células germinales, donde se incluyen altas tasas de inestabilidad cromosómica del isocromosoma 12p asociado con mutaciones somáticas recurrentes de los genes KIT y KRAS 54.
Objetivos moleculares concretos, que incluyen las vías de señalización de TP53- MDM2 y PI3K que están presentes en una proporción significativa de pacientes con enfermedad resistente al cisplatino, pueden ser tomados en cuenta como opciones terapéuticas futuras 55.
Conclusiones
El manejo de los pacientes con tumores de células germinales en primera recaída sigue siendo un problema para los oncólogos. En Venezuela, los pacientes que presentan recaídas deben recibir tratamiento con cualquiera de los regímenes establecidos que utilizan dosis convencionales en segunda línea. En algunas ocasiones, es necesario referir a los pacientes a centros de oncología con un manejo multidisciplinario que permita el acceso a cirujanos oncólogos expertos y a especialistas con experiencia en altas dosis de quimioterapia. Los resultados en segundas y terceras recaídas son poco prometedores; sin embargo, se pueden lograr respuestas que pueden prolongar la vida de nuestros pacientes